Книга: Биология для тех, кто хочет понять и простить самку богомола
Назад: Глава пятая. Биосистемы
Дальше: Глава седьмая. Обмен веществ и энергии
Глава шестая. Каталог строительных материалов или молекулярно-генетический уровень организации
Мы с вами нарушили иерархический порядок, начав знакомство с уровнями организации жизни с клетки, а не с молекул. Но так было удобнее, потому что именно с клетки начинается жизнь, та самая настоящая полноценная жизнь, а не вирусное или прионное существование.
А теперь вас ждет увлекательное знакомство со строительными материалами, из которых сделаны клетки.
Молекулярно-генетический уровень организации – это базовая основа жизни. Все, что происходит в живом организме, все биологические процессы, все эмоции и все мысли являются результатами реакций между различными молекулами и каждый организм состоит из молекул органических и неорганических веществ. Жизнь на молекулярно-генетическом уровне изучает наука, которая называется молекулярной биологией. Молекулярная биология тесно связана с биохимией и генетикой.
Главная особенность молекулярно-генетического уровня организации жизни заключается в том, что на этом уровне осуществляется важнейший жизненный процесс – превращение энергии солнечных лучей в энергию химическую, которая сохраняется в химических связях органических веществ и в таком виде может использоваться живыми организмами. Большинство живых организмов на нашей планете прямо или опосредованно питают солнечные лучи. Солнечная энергия усваивается растениями. Растения поедают травоядные животные, которыми, в свою очередь, питаются хищники. А после смерти все живое становится пищей для сапрофитов – растений, грибов и бактерий, питающиеся органическим веществом умерших организмов.
Обратите внимание на слово «большинство». Большинство живых организмов питают солнечные лучи, но есть на нашей планете организмы, для которых источником энергии служат химические реакции с участием неорганических соединений. Такой способ питания, называемый хемосинтезом, доступен некоторым одноклеточным организмам (только одноклеточным, все многоклеточное питается Солнцем). Хемосинтезирующие организмы или хемотрофы могут жить в океанских глубинах и в земной коре. Им не нужны ни солнечный свет, ни останки других организмов. Был бы сероводород, или углекислый газ, или аммиак, или еще что-то неорганическое, неживое.
На первом месте в нашем каталоге строительных материалов стоит вода, которую заслуженно называют «основой жизни». Биологическое значение воды трудно переоценить, настолько оно огромно.
В первую очередь вода служит основой внутренней среды организмов и внутриклеточной среды. Вода обеспечивает транспорт веществ в клетках и организмах. Вода служит средой для химических реакций и участвует во многих реакциях, протекающих в живых организмах. А еще вода является средой обитания для многих организмов и вообще жизнь на нашей планете зародилась в воде.
Организм человека примерно на 60 % состоит из воды, то есть ее содержание больше, чем содержание всех других веществ вместе взятых. Нередко можно встретить другие цифры – 70 % или 80 %. Дело в том, что большинство клеток живых организмов содержат 70-80 % воды, но в костных клетках ее около 20 %, а в зубной эмали, самой твердой ткани организма – примерно 10 %. Поэтому в целом наш организм содержит именно 60 % воды, а не 70 % и не 80 %.
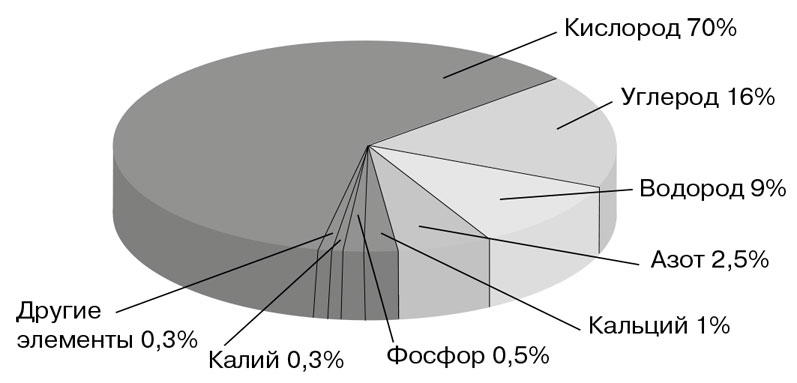
Содержание химических элементов в клетке
Кроме воды, в клетках содержатся различные минеральные соли, которые так же, как и вода, относятся к неорганическим веществам. Большинство этих минеральных солей (за исключением тех, что содержатся в костях и зубной эмали), растворены в воде.
По отношению к кислороду все живые организмы делятся на аэробов, которым для жизнедеятельности нужен свободный молекулярный кислород, и анаэробов, которые в кислороде не нуждаются. Подавляющее большинство животных, все растения, а также значительная часть микроорганизмов – аэробы. Но с эволюционной точки зрения более древними являются анаэробы. Первые жители нашей планеты «дышали» водородом и серой, кислорода тогда в атмосфере не было.
Органические вещества клетки представлены нуклеиновыми кислотами, белками, липидами и углеводами.
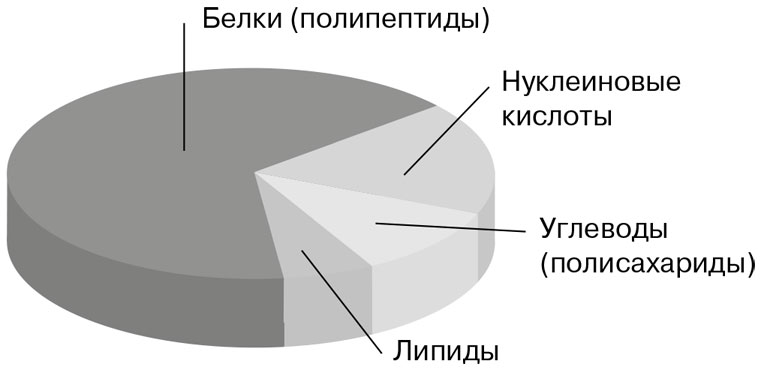
Органические вещества клетки
Углеводы содержатся в каждой живой клетке. Вот просто – в каждой без исключения. Особенно богаты углеводами клетки растений, в которых углеводы могут составлять до 90 % сухого остатка. В животных клетках углеводов содержится значительно меньше – около 1 % сухого остатка, и только в мышечных клетках и клетках печени их содержится в 5 раз больше.
Огромный мир углеводов делится на три основных класса – моносахариды, олигосахариды и полисахариды.
Моносахариды или простые углеводы содержат в своих молекулах до семи атомов углерода. Моносахариды хорошо растворимы в воде и имеют сладкий вкус. Одним из самых распространенных моносахаридов и важнейшим источником энергии в живых клетках, является глюкоза, или виноградный сахар (С6Н12О6).
При расщеплении молекулы глюкозы на две молекулы пировиноградной кислоты выделяется энергия. Этот процесс называется гликолизом, что переводится с греческого как «расщепление сахара».
Но глюкоза не только источник энергии. Она является мономером многих полимерных углеводов, которые называются олигосахаридами («малосахаридами») и полисахаридами («многосахаридами»). Если кто забыл, то полимером называют высокомолекулярное соединение, состоящее из большого числа повторяющихся групп атомов, которые называются мономерами. Мономеры – это «кирпичики» из которых собираются огромные молекулы полимеров. Олигосахариды состоят из 2-10 моносахаридных «кирпичиков», а с 11 «кирпичиков» начинаются полисахариды.
Другим широко распространенным в природе моносахаридом является фруктоза или фруктовый сахар (C6H12O6), содержащаяся в меде и фруктах. Фруктоза более сладкая на вкус, чем глюкоза.
Обычная химическая формула у глюкозы и фруктозы одинаковая – C6H12O6. Но обычными формулами органическая химия оперирует редко, только в тех случаях, когда речь идет о простейших соединениях, потому что значение имеет не только общее количество тех или иных атомов в молекуле, но и то, как именно они связаны друг с другом, а также их пространственное расположение. Эти нюансы отражают структурные формулы веществ.
Фруктоза и глюкоза – изомеры. Изомерами называются вещества, молекулы которых имеют одинаковые состав и молекулярную массу, но различаются строением или расположением атомов в пространстве.
Глюкоза может существовать в виде α-глюкозы или β-глюкозы. Отличие между этими пространственными изомерами заключается в том, что при первом атоме углерода у α-глюкозы гидроксильная группа (–ОН) расположена под плоскостью углеродного кольца, а у β-глюкозы – над плоскостью.
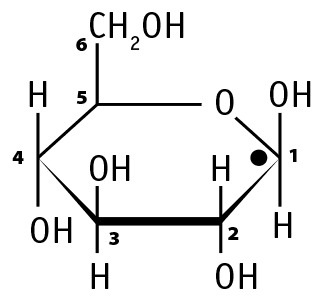
ß-глюкоза
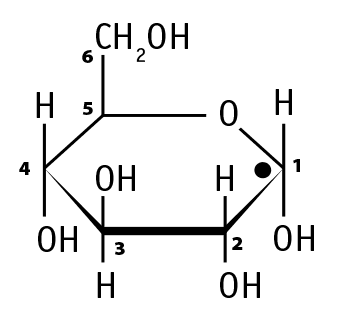
α-глюкоза
А фруктоза может существовать не только в двух циклических формах – α или β, но и в цепной.
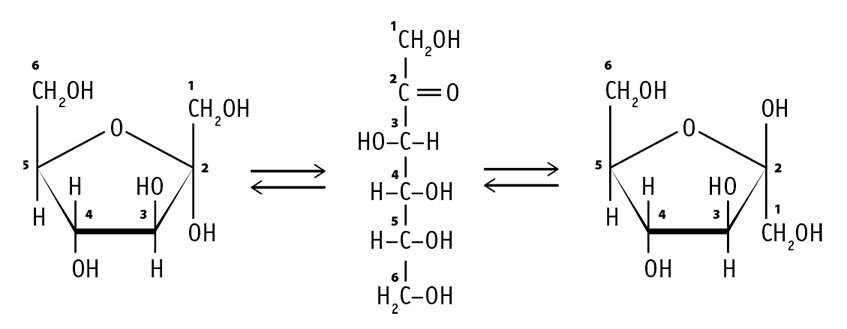
Подобно глюкозе, фруктоза также является мономером многих олигосахаридов и полисахаридов.
Наиболее распространенными олигосахаридами являются дисахариды, содержащие 2 мономерных «кирпичика». Кстати говоря, сладкий вкус олигосахаридов уменьшается по мере увеличения числа моносахаридных остатков, а полисахариды вообще не сладкие.
То, что мы в быту называем «сахаром» – это сахароза, дисахарид, состоящий из остатков глюкозы и фруктозы. Сахароза содержится в тканях растений. В промышленности сахарозу получают из сахарного тростника стебли которого содержат 10–18 % сахарозы или из сахарной свеклы, корнеплоды которой содержат до 20 % сахарозы.
В прорастающих семенах злаков содержится дисахарид мальтоза, она же – солодовый сахар. Молекула мальтозы состоит из двух остатков глюкозы. А в молоке и молочных продуктах содержится дисахарид лактоза или молочный сахар, молекула которого образована остатками глюкозы и галактозы. Галактоза – это еще один изомер глюкозы, которая отличается от глюкозы пространственным расположением водородной и гидроксильной групп у 4-го углеродного атома. Подобно фруктозе, галактоза может существовать не только в циклических, но и в цепной форме.
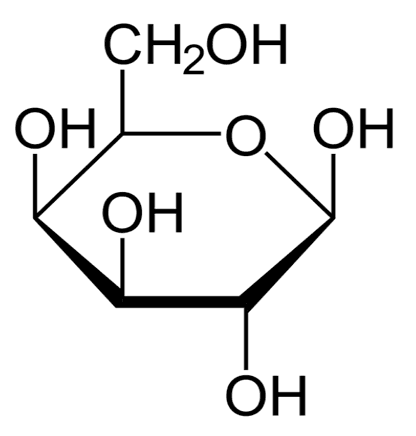
Галактоза
Все олигосахариды растворяются в воде, и чем меньше «кирпичиков» содержит молекула олигосахарида, тем выше его растворимость. А вот полисахариды плохо растворяются в воде или вообще не обладают такой способностью.
Известный всем крахмал (С6Н10О5)n представляет собой полисахарид, мономером которого является α-глюкоза. Крахмал – основной углевод нашей пищи и основной резервный углевод растений, который накапливается в семенах, клубнях, корневищах, луковицах. Растения образуют крахмал в результате фотосинтеза – так процесс образования органических веществ из неорганических с помощью солнечной энергии. Фотосинтез свойственен не только растениям и некоторым бактериям, клетки которых содержат пигмент хлорофилл, обладающий способностью поглощения солнечная энергии.
Содержание крахмала в зернах риса достигает до 86 %, пшеницы – до 75 %, кукурузы – до 72 %, в клубнях картофеля – до 25 %. В том, что молекула крахмала состоит из глюкозы, можно убедиться путем простого опыта. Если в течение нескольких минут методично и целеустремленно жевать какой-либо крахмалосодержащий продукт, например – кусочек хлеба или картофеля, то во рту появится сладкий вкус. Содержащийся в слюне пищеварительный фермент амилаза расщепляет несладкую молекулу крахмала на составные части – сладкие молекулы глюкозы. Полимерные цепочки крахмала ветвятся, но не сильно.
Полисахарид, мономером которого является β-глюкоза, называется целлюлозой (С6Н10О5)n. В отличие от крахмала полимерные цепочки целлюлозы не ветвятся. Целлюлоза – это основной структурный полисахарид клеточных стенок растений, защита и опора растительных клеток. Содержание целлюлозы в древесине доходит до 50 %, а в волокнах семян хлопчатника аж до 98 %. Хлопок – это «чистая» целлюлоза.
Если крахмалом мы можем питаться, то целлюлозой – нет. Вроде бы и разница между двумя этими полимерами небольшая (и там глюкоза, и здесь глюкоза), но в организме человека отсутствует фермент целлюлаза, разрывающий связи между молекулами β-глюкозы.
Основным резервным углеводом, образующимся в организмах грибов и животных (в том числе и человека) является третий «глюкозный» полисахарид, который называется гликогеном (С6Н10О5)n. Мономером гликогена является α-глюкоза, но полимерные цепочки гликогена ветвятся гораздо сильнее, чем цепочки крахмала. Гликоген накапливается в печени, где его содержание доходит до 20 %, а также в мышцах (до 4 %). Клетки печени – главные производители гликогена в организме животных. Но и другие клетки могут вырабатывать и накапливать гликоген. Печень далеко, долго ждать, когда оттуда поступит глюкоза, нужно иметь небольшой запас под рукой.
При расщеплении 1 грамма углеводов выделяется 17,6 кДж энергии, что соответствует 4,2 килокалориям. Столько же энергии выделяется при расщеплении 1 грамма белка. Но вот «парадокс» – углеводные овощи, в том числе и суперкалорийный картофель, считаются менее калорийными продуктами, чем белковое мясо, даже нежирное. Для сравнения – в 100 граммах сырого картофеля в среднем содержится 77 килокалорий, а калорийность сырой телятины составляет 105 килокалорий. Про калорийность огурцов вообще говорить нечего – 15 килокалорий на 100 грамм продукта.
В чем причина такой разницы в калорийности?
В различном содержании воды в растительных и животных продуктах!
Никакого парадокса на самом деле нет (потому и слово это взято в кавычки). Просто в сырых растительных продуктах содержится больше воды, чем в мясе, а у воды калорийность нулевая. Живые организмы не могут получать энергию, разлагая молекулу воды на кислород и водород. В пересчете же на сухой остаток калорийность телятины, картофеля и огурцов будет одинаковой.
С углеводами мы разобрались. На очереди – белки.
Белки или протеины это сложные высокомолекулярные вещества, состоящие из мономерных остатков аминокислот. Белки обладают большой молекулярной массой: у яичного альбумина (это то, что в быту называют «яичным белком») она равна 36 000, у гемоглобина – 152 000, у мышечного белка миозина – 500 000. Для сравнения – молекулярная масса уксусной кислоты составляет всего 60.
По содержанию в клетке белки стоят на втором месте после воды. Примерно 50 % от сухого остатка клеточных веществ приходится на долю белков.
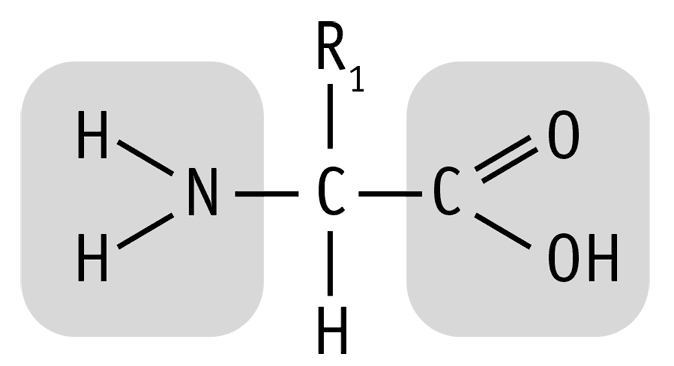
Общая структура молекулы аминокислоты
Давайте вспомним из курса химии, что аминокислотами называются органические вещества, которые содержат карбоксильную группу (–СООН), аминогруппу (–NH2) и радикал или R-группу (это остальная часть молекулы). Особенности физических и химических свойств аминокислот обусловлены присутствием в их молекулах двух противоположных по свойствам функциональных групп: кислотной карбоксильной группы и основной аминогруппы.
В зависимости от того, могут ли аминокислоты вырабатываться в организме человека или животных, их разделяют на заменимые аминокислоты, которые могут вырабатываться, и незаменимые аминокислоты, которые вырабатываться не могут. Условием нормальной жизнедеятельности организма является поступление незаменимых аминокислот вместе с пищей. А вот растения вырабатывают все виды аминокислот.
Не надо путать незаменимые аминокислоты с витаминами – веществами, которые ускоряют или делают возможными определенные обменные реакции. Витамины – это катализаторы, а аминокислоты – строительный материал и источник энергии.
Аминокислот известно с полтысячи, но в образовании большинства белков задействовано только 20.
Белки состоящие только из аминокислот, называются простыми белками. Если белок помимо аминокислот содержит еще и какой-то не аминокислотный компонент – металл, углевод, липид, нуклеиновую кислоту, – то такой белок называют сложным. Примерами сложных белков являются металлопротеины, гликопротеины, липопротеины, нуклеопротеины. Обратите внимание на то, что название неаминокислотного компонента всегда ставится первым. «Протеинолипид» – неграмотное название.
Химики называют белки «пептидами» или «полипептидами».
Пептиды – это вещества, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными связями – C(O)NH–.
Пептид, молекула которого содержит до 20 остатков аминокислот, называется олигопептидом, а от 21 остатка начинаются полипептиды. Для того, чтобы полипептид считался белком, в составе его молекулы должно присутствовать более 50 аминокислотных остатков.
Клетке энергетически невыгодно (можно сказать – неудобно) держать белки в развернутой форме, в виде длинной-предлинной полипептидной цепочки. Поэтому полипептидные цепи подвергаются пространственной организации – укладке с приобретением определенной трехмерной структуры.
Различают четыре уровня пространственной организации белков.
Первичная структура белка – полипептидная цепь.
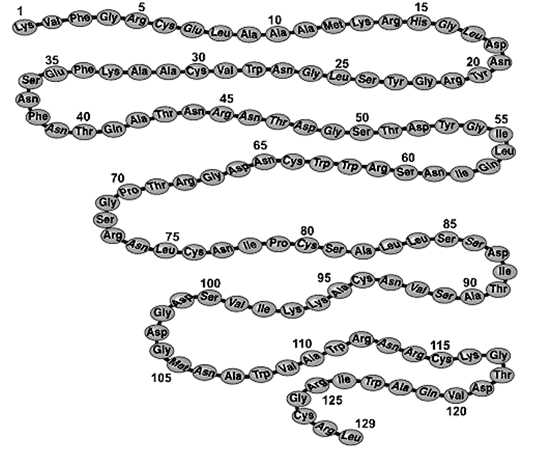
Первичная структура белка
Первичная структура белковой молекулы – самая «главная». Именно первичная структура – расположение атомов в молекуле белка – определяет свойства молекулы и ее пространственную конфигурацию.
Вторичная структура белка представляет собой упорядоченное свертывание полипептидной цепи в спираль, которая имеет вид растянутой пружины. Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами (СО-) и аминогруппами (NH-).
Водородные связи слабые, но, многократно повторяясь, они придают спирали белковой молекулы устойчивость и жесткость. На уровне вторичной структуры существуют такие белки, как, например, коллаген (сухожилия) или кератин (волосы, ногти).
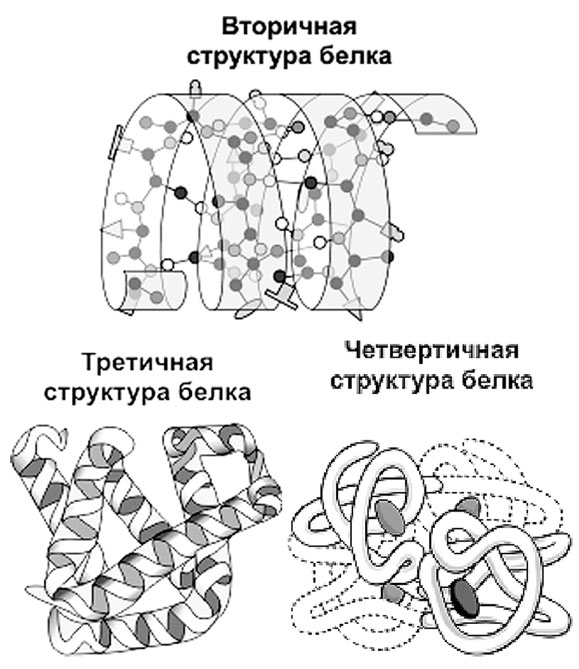
Третичная структура белка представляет собой укладку полипептидных цепей в «клубки» – глобулы, возникающая в результате возникновения различных химических связей.
На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами, соединенными какими-то химическими связями. Наиболее известным белком, имеющим четвертичную структуру, является белок крови гемоглобин, молекула которого образована четырьмя «клубками». Клубки связывает вместе общее для всех железосодержащее «ядро», называемое гемом. «Гема» в переводе с греческого означает «кровь», «глобус» – это «шар» на латыни. Гемоглобин – кровяной шар.
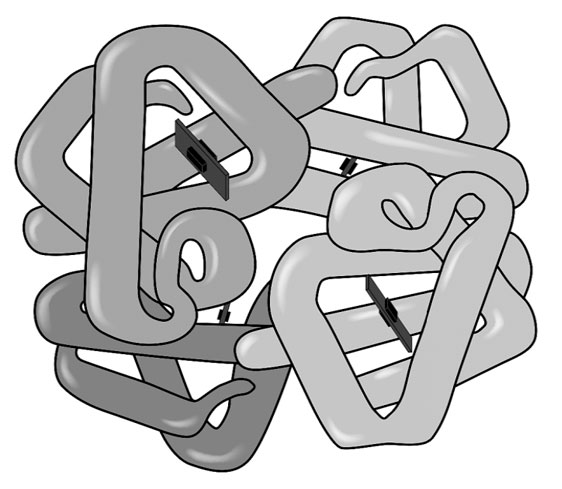
Молекула гемоглобина
Что случается с белком куриного или какого-то другого птичьего яйца при нагревании? Он сначала начинает загустевать, а затем твердеет, потому что тепловая энергия вызывает разрыв связей, удерживающих молекулу белка в свернутом виде. Молекула «расправляет плечи». Сначала утрачивается четвертичная структура, затем – третичная, затем – вторичная и молекула белка становится нитевидной. Нитевидной молекуле расправляться больше некуда, но она может распасться на несколько составных частей.
Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией (денатурация – потеря природной структуры). Изменение пространственной конфигурации молекулы приводит к изменению ее свойств и делает невозможным выполнение присущих ей биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой – ниточка снова свернется в клубочек и займется своим делом. Процесс восстановления структуры белка после денатурации называется ренатурацией.
Белки участвуют во всех процессах жизнедеятельности клетки и выполняют в организме различные функции. Биологические функции белков более разнообразны, чем функции других полимеров – полисахаридов и ДНК. Всех функций белков мы касаться не будем, отметим только самые важные.
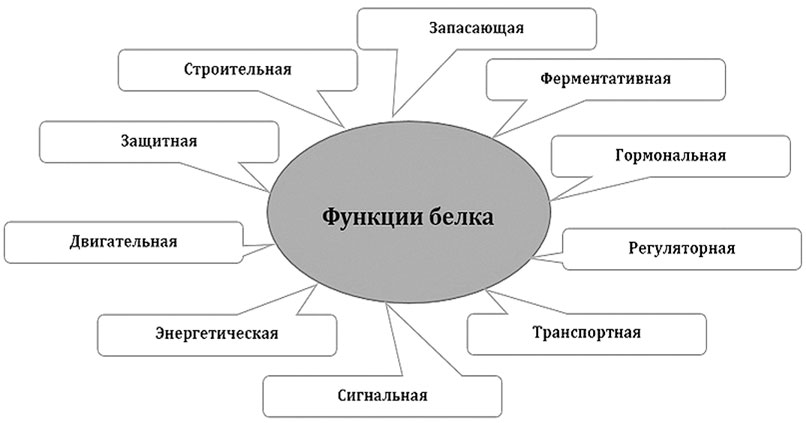
Функции белков
Строительная функция белков заключается в том, что они участвуют в образовании клеточных и внеклеточных структур.
Белки, входящие в состав клеточных мембран выполняют транспортную и рецепторную функции. Они обеспечивают избирательный перенос веществ и ионов через белковые каналы и воспринимают идущие извне сигналы, а также играют роль «визитных карточек», то есть служат для распознавания клеток. Важнейшую роль в организме играет белок гемоглобин, который занимается транспортировкой веществ в глобальном масштабе – в легких присоединяет кислород и доставляет его ко всем тканям и органам, а обратно в легкие переносит углекислый газ.
Особые белки, называемые ферментами, активизируют химические реакции, которые происходят в клетках.
Белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
В регуляции обменных процессов принимают участие белки-гормоны. Так, например, белок инсулин регулирует содержание глюкозы в крови и не только.
В ответ на проникновение в организм чужеродных агентов, образуются особые белки, называемые антителами, которые связываются с этими агентами и тем самым обезвреживают их.
Белок фибрин, образующийся из белка фибриногена, способствует прекращению кровотечений. В месте повреждения кровеносного сосуда образуется фибриновая сеть. В этой сети застревают кровяные клетки о образуется пробка, закупоривающая поврежденное место.
Белки могут служить запасом питательных веществ. Чаще всего это происходит в структурах, связанных с размножением, например – в семенах многих растений, в яйцах животных, в икре рыб. Расщепляя белки из запаса, растущий организм получает аминокислоты, необходимые для синтеза собственных белков, а также получает энергию, расщепляя аминокислоты до конечных продуктов – воды, углекислого газа и аммиака. Но вообще-то расщеплять аминокислоты для получения энергии – это расточительство. Выгоднее использовать аминокислоты в качестве строительного материала для выработки белков. Поэтому в организмах животных белки используются в качестве источника энергии только после того, как будут израсходованы другие источники – углеводы (гликоген, глюкоза) и жиры.
О липидах мы уже говорили, когда знакомились со строением клеточных мембран. Давайте повторим, что к этой группе органических соединений относятся жиры и жироподобные вещества.
Липиды подразделяют на простые и сложные.
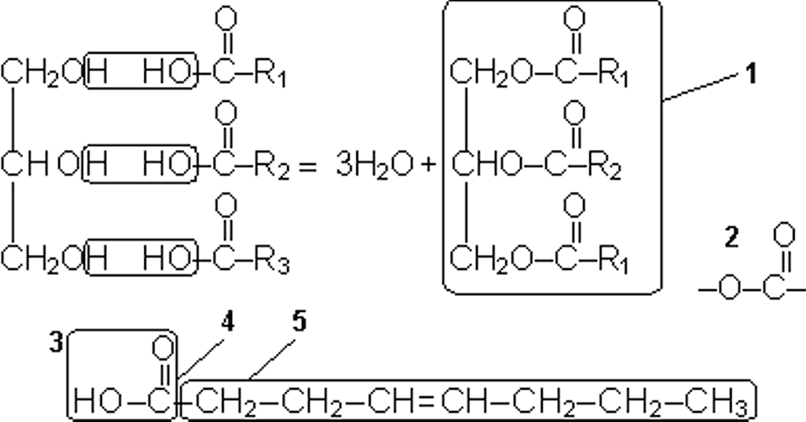
Простые липиды в большинстве своем представлены триглицеридами – сложными эфирами высших жирных кислот и трехатомного спирта глицерина.
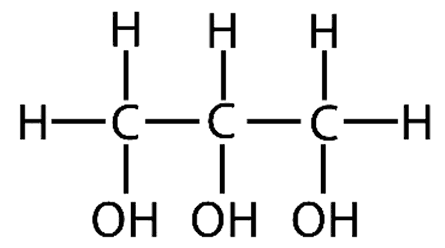
Глицерин
Вы могли подумать, что глицерин называют «трехатомным спиртом» потому что его молекула образована тремя атомами углерода. Нет! На самом деле речь идет от трех гидроксильных группах (-ОН), такие вот химические тонкости.
Жирные кислоты имеют одинаковую для всех кислот группировку – карбоксильную группу (–СООН) и радикал, которым они отличаются друг от друга. Этот радикал представляет собой цепочку из различного количества (от 14 до 22) углеводородных группировок – СН2–. Если радикал жирной кислоты содержит одну или несколько двойных связей (–СН=СН–), такую жирную кислоту называют ненасыщенной, а если жирная кислота не имеет двойных связей, ее называют насыщенной. Смысл названия ясен? Наличие двойной связи между атомами углерода позволяет каждому из атомов дополнительно присоединить по одному атому водорода. Жирная кислота с двойными связями еще не насытилась атомами водорода, потому-то ее и называют «ненасыщенной». А если все связи между атомами углерода одинарные, то присоединение атомов водорода невозможно (без разрыва углеродной цепочки), молекула жирной кислоты насытилась ими «под завязку».
При образовании триглицерида каждая из трех гидроксильных групп глицерина вступает в реакцию конденсации с жирной кислотой с образованием трех сложноэфирных связей.
Если в триглицеридах преобладают насыщенные жирные кислоты, то их называют жирами. Жиры характерны для животных клеток. Если в триглицеридах преобладают ненасыщенные жирные кислоты, то их называют маслами. Масла характерны для растительных клеток. Одним из выраженных отличий между маслами и жирами является их разное агрегатное состояние при нормальных условиях (температуре в 20°С). Жиры твердые, а масла жидкие.
Липиды. 1 – триглицерид; 2 – сложноэфирная связь; 3 – ненасыщенная жирная кислота; 4 – гидрофильная головка; 5 – гидрофобный хвост.
Обратите внимание на то, что сливочное масло на самом деле является молочным жиром.
К простым липидам также относят воски – сложные эфиры высших жирных кислот и высокомолекулярных спиртов. Воски делятся на животные и растительные. Все воски устойчивы (иначе говоря – обладают малой химической активностью), нерастворимы в воде, но хорошо растворимы в органических растворителях – бензине, хлороформе, эфире. Примерами животных восков могут служить пчелиный воск, выделяемый специальными железами медоносных пчел, или же ланолин, предохраняющий шерсть животных от посторонней влаги, а кожу – от высыхания. Растительные воски, покрывающие тонким слоем листья, стебли и плоды, защищают их от размачивания водой, высыхания и вредных микроорганизмов. У некоторых растений воски могут входить в состав семян в качестве резервных липидов (например у симмондсии китайской, более известной под названием «жожоба»).
Мир сложных липидов многообразен и сложен. Углубляться в него мы не станем, вспомним только то, что было сказано выше о фосфолипидах, которые входят в состав клеточных мембран. Помимо них в образовании клеточных мембран принимают участие гликолипиды (соединения липидов с углеводами) и липопротеины (соединения липидов с белками).
Главная задача липидов – давать организму энергию и запасать ее. При расщеплении 1 грамма липидов выделяется 38,9 кДж энергии, что соответствует 9,4 килокалорий. Жиры и масла являются резервными пищевыми веществами у животных и растений. Особенно важны эти запасы для животных, впадающих в холодное время года в спячку (бурый медведь) или совершающих, подобно верблюдам, длительные переходы через местность, в которой нет источников пищи и воды. Да – и воды тоже. Жиры можно рассматривать и как водный запас, потому что в результате реакции окислительного распада (то есть распада, в котором принимает участие кислород) жиры распадаются на углекислый газ и воду. Вот пример уравнения такой реакции:
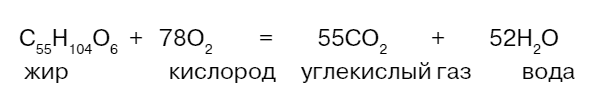
При окислении 1 кг жира выделяется около 1,1 кг воды. Способность жиров превращаться в воду очень важна для обитателей пустынь.
На втором по значению месте стоит структурная или мембранообразующая функция липидов. Впрочем, ее можно поставить и на первое место, ведь для того, чтобы иметь возможность использовать жиры в качестве источника энергии, сначала нужно создать клетку, так что мембраны главнее энергетических запасов.
Прослойки жировой ткани и жировые капсулы обеспечивают защиту внутренних органов, а слои воска используются в качестве защитного водоотталкивающего покрытия. Об руку с защитной функцией липидов идет теплоизоляционная – подкожная жировая клетчатка препятствует отдаче тепла в окружающее пространство. Это очень важно для всех водных млекопитающих, поскольку температура воды ниже температуры воздуха и, вдобавок, вода более активно «отбирает» тепло, а также для млекопитающих, обитающих в холодном климате.
К липидам относятся некоторые гормоны, например, половые гормоны тестостерон и эстроген, альдостерон, который регулирует водно-солевой обмен, кортизол, принимающий участие в регуляции углеводного и белкового обменов. Жирорастворимые витамины A, D, E, K являются кофакторами различных ферментов.
Форма жизни у нас белковая, а вот хранение информации об организме и передачу ее по наследству обеспечивают нуклеиновые кислоты. Нуклеиновыми эти кислоты были названы по той причине, что их обнаружили в клеточном ядре («нуклеус» переводится с латыни как «ядро»). С кислотами в привычно-бытовом понимании нуклеиновые кислоты ничего общего не имеют. Они представляют собой не едкие жидкости, а биологические полимеры, в которых «кирпичики» – мономеры связаны между собой при помощи остатков молекул фосфорной кислоты (фосфатных групп). Отсюда и почетное звание кислоты.
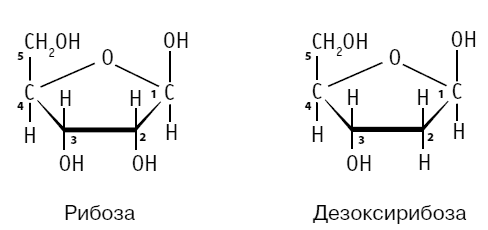
Мономерами нуклеиновых кислот служат нуклеотиды – соединения, в состав которых входят моносахарид дезоксирибоза или рибоза и азотсодержащее (азотистое) основание. Разница между двумя моносахаридами небольшая – всего в один атом кислорода. «Дезокси-» переводится с латыни как «отсутствие атома кислорода», то есть дезоксирибоза – это рибоза без одного атома кислорода.
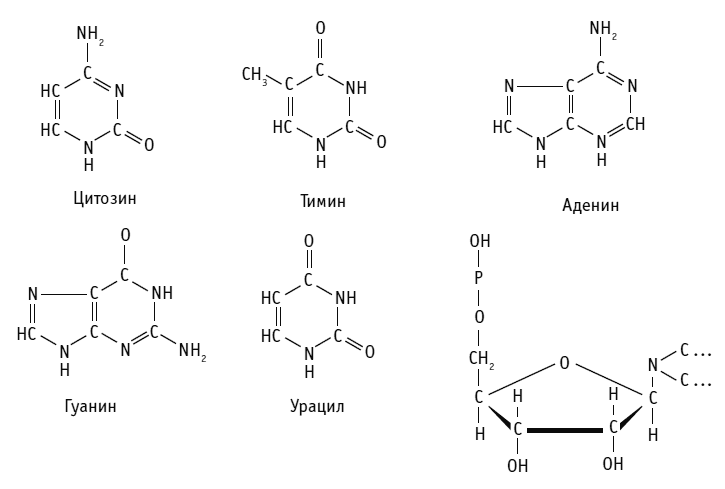
ДНК включает в себя четыре вида азотистых оснований – аденин (A), гуанин (G), тимин (T) и цитозин (C). Всего четыре, но их комбинация дает невообразимое количество вариантов.
Азотистые основания в составе ДНК
Вся информация о любом организме закодирована при помощи четырех «букв», четырех азотистых оснований – A, G, T и C. Лишь у некоторых организмов, в виде исключения, в составе ДНК может встречаться пятый тип азотистого основания – урацил (U). В человеческой ДНК урацила нет, но он содержится в нашей РНК вместо тимина, которого в РНК нет.
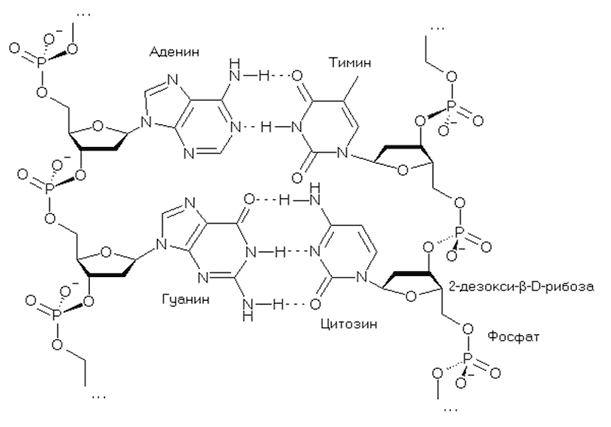
Фрагмент молекулы ДНК. Крупными латинскими буквами обозначены азотистые основания. Т – тимин, С – цитозин, А – аденин и G – гуанин.
У клеток-эукариот, которые имеют ядро, ДНК линейная и находится в ядре, а у безъядерных прокариот ДНК кольцевая и находится в цитоплазме.
Молекула ДНК образована двумя полинуклеотидными цепями, спирально закрученными друг около друга и вместе вокруг воображаемой оси, т. е. она представляет собой двойную спираль. Исключение составляют одинарные ДНК некоторых ДНК-содержащих вирусов. Вирусы имеют крайне простое строение и наследственной информации у них мало, потому и ДНК у вирусов небольшая, не нуждающаяся в сложной двухцепочечной упаковке. А многие вирусы вообще обходятся без ДНК, их наследственная информация заключена в более мелких молекулах РНК.
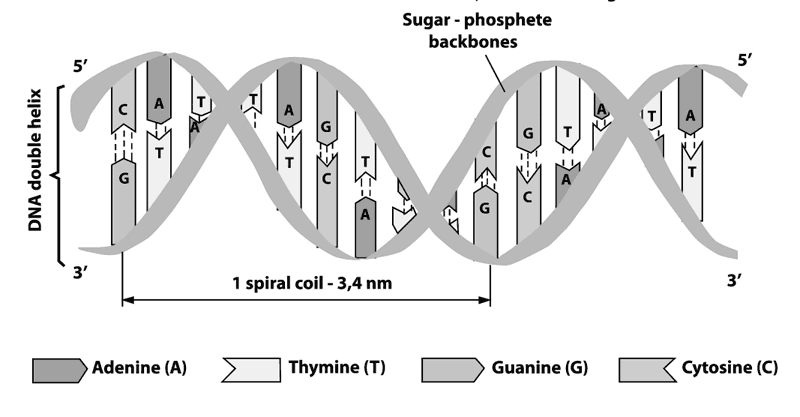
Схематическое изображение фрагмента молекулы ДНК
Диаметр двойной спирали ДНК составляет 2 нанометра, расстояние между соседними нуклеотидами – 0,34 нанометра, на один оборот спирали приходится 10 пар нуклеотидов. Длина молекулы может достигать нескольких сантиметров и иметь молекулярный вес, исчисляемый десятками и сотнями миллионов единиц. Суммарная длина ДНК ядра одной клетки человека составляет около 2 метров! Молекулы ДНК – самые крупные из органических молекул.
Расположение нуклеотидов в двух парных цепях молекулы ДНК строго определенное: против аденина одной цепи в другой цепи всегда располагается тимин, а против гуанина – всегда цитозин. Между аденином и тимином возникают две водородные связи, между гуанином и цитозином – три водородные связи. Закономерность, согласно которой нуклеотиды разных цепей ДНК строго упорядоченно располагаются (аденин – тимин, гуанин – цитозин) и избирательно соединяются друг с другом, называется принципом комплементарности.
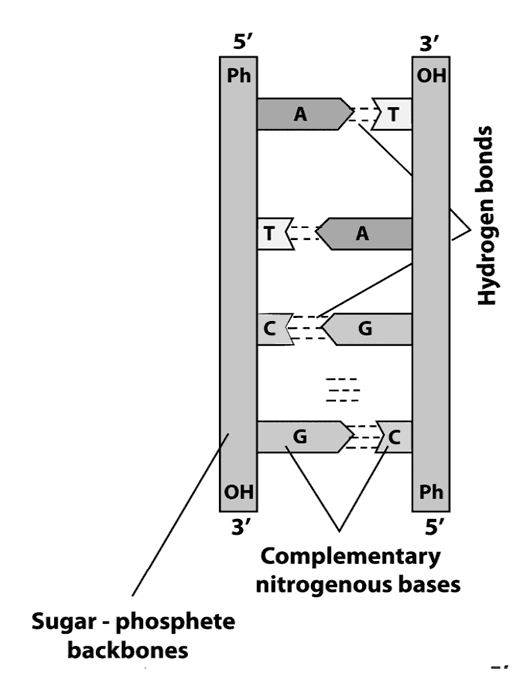
Фрагмент молекулы ДНК: Т – тимин, А – аденин, Г – гуанин, Ц – цитозин, точками показаны водородные связи.
Из принципа комплементарности следует, что последовательность нуклеотидов одной цепи определяет последовательность нуклеотидов другой.
Функцией ДНК является хранение и передача наследственной информации. Все организмы на нашей планете разные (за исключением клонов) и ДНК у всех тоже разные. Двух полностью схожих молекул ДНК в природе не существует (за исключением ДНК тех же клонов). На этой индивидуальности и основана генетическая криминалистика и судебно-медицинская генетика – любого человека можно со стопроцентной точностью идентифицировать по его ДНК. Точно так же, как и по отпечаткам пальцев, но с отпечатками еще возможны оплошности, а вот с ДНК никаких оплошностей быть не может, это личный уникальный единственный и неповторимый код организма.
Молекулы ДНК обладают способностью к репликации, то есть – к самовоспроизведению, самокопированию. Клетки размножаются делением и каждая из двух дочерних клеток непременно должна получить от материнской полную копию наследственной информации.
Репликация – это главное свойство молекулы ДНК. Новая цепь синтезируется по матрице, в роли которой выступает старая цепь. Процесс проходит с участием ряда ферментов. Одни ферменты «расплетают» двойные цепи ДНК на две одинарные, другие разрезают ДНК на фрагменты, делая процесс копирования более удобным, третьи сшивают эти фрагменты, а самые главные ферменты, называемые ДНК-полимеразами, собирают мономеры в новые цепи.
Мы уже говорили о том, что участок молекулы ДНК (а также некоторых РНК), содержащий информацию об одном отдельном белке, то есть – об одном признаке организма, называют геном. Система записи наследственной информации в виде последовательности нуклеотидов в молекулах нуклеиновых кислот, называют генетическим кодом.
Дискретной единицей генетического кода, кодирующей включение в полипептидную цепь одной аминокислоты, является кодон. Кодоны состоят из трех соседних нуклеотидов.
Каждый кодон соответствует определенной аминокислоте, входящей в состав белков. Каждой аминокислоте соответствует не один, а несколько кодонов, ведь аминокислот 20, а 4 разновидности нуклеотидов дают 64 тройных комбинации. Поскольку нуклеотиды на схемах обозначают буквами, кодоны выглядят как сочетания трех букв.
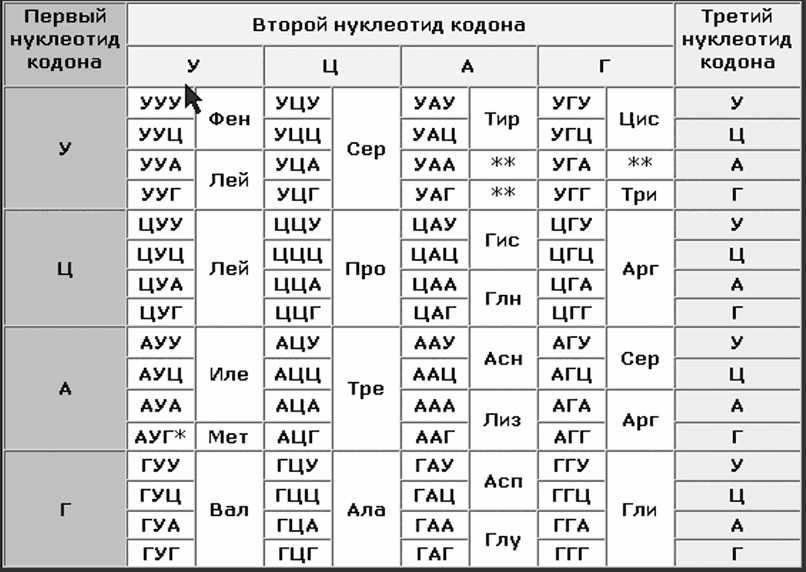
Фрагмент таблицы кодонов
Посмотрите на фрагмент молекулы матричной РНК, изображенный в буквенном виде.
АУГГУУГЦУААУЦУУАУГАГААГГУГЦГЦАГГГГГГАААГАУАААААААУАЦУГАУГГЦАГГГАААГАУАААААААУАЦУГАУГГЦАГГГГГГАУГГУУГЦУААУЦУУАУГАГААГГУГЦГЦАГГГГГГАААГАУАААААААУАЦУГАУГГЦАГГГ…
Глаза разбегаются в разные стороны, верно? А это же всего лишь небольшой фрагментик.
Если начать читать кодоны с буквы А, то первой аминокислотой будет метионин, второй – валин, третьей – аланин… И так далее. Если же пропустить букву А и начать читать кодоны с буквы У, второй по счету, то первой аминокислотой будет триптофан, второй – лейцин, и третьей – тоже лейцин… Замена всего одной аминокислоты на другую в молекуле гемоглобина приводит к развитию тяжелого заболевания. Страшно представить последствия синтеза совершенно другого белка вместо заданного. А если такое будет повторяться на разных матрицах… Ужас-ужас-ужас!
Чтобы ужаса не случилось, природа предусмотрела старт-кодон АУГ (аденин – урацил – гуанин), соответствующий аминокислоте метионину, и стоп-кодоны УГА (урацил – гуанин – аденин), УАГ (урацил – аденин – гуанин), УАА (урацил – аденин – аденин) никаким аминокислотам не соответствующие.
Таким образом, синтез любого белка начинается с метионина. Но ведь метионин может быть закодирован в разных местах на молекуле нуклеиновой кислоты. Что будет, если синтез белка начнется не с того старт-кодона? Ничего хорошего!
К счастью, природа подстраховалась и здесь – обвела стартовый кодон жирным красным маркером. Захочешь – не спутаешь! На самом деле, как вы понимаете, никакого красного маркера нет, а есть несколько нуклеотидов, располагающихся до старт-кодона и после него. Такое окружение сигнализирует о том, что начинать синтез белковой молекулы нужно с этого места, с этого метионинового кода.
В отличие от молекулы ДНК, молекула РНК образована одной полинуклеотидной цепочкой. Исключение составляют некоторые РНК-содержащие вирусы-оригиналы, которые имеют двухцепочечную РНК.
Цепи РНК значительно короче цепей ДНК.
РНК бывает четырех видов: информационная или матричная РНК, транспортная РНК, осуществляющая транспортировку аминокислот к месту синтеза белка, рибосомная РНК и РНК-ферменты, называемые рибозимами.
Все виды РНК принимают участие в процессах синтеза белков, который называется трансляцией. Трансляцию следует отличать от транскрипции, так называется процесс синтеза РНК на матрице ДНК.
Сначала происходит трансКрипция – изготавливается РНК-матрица, а уже на ней происходит трансЛяция – «штамповка» белковых молекул. Буквы «л» следует за буквой «к» точно так же, как трансляция следует за транскрипцией – этот простой прием поможет вам правильно все запомнить.
Транспортные РНК, на долю которых приходится около 10 % от общего содержания РНК в клетке, не только транспортируют аминокислоты к месту синтеза белка, но и выполняют посредническую функцию в синтезе. Каждая аминокислота имеет своего персонального «шофера с машиной» – соответствующую ей и только ей транспортную РНК. Некоторым аминокислотам соответствуют несколько транспортных РНК, но никогда одна транспортная РНК не будет переносить разные аминокислоты.
Рибосомные РНК составляют 80–85 % от общего содержания РНК в клетке. В комплексе с рибосомными белками они образуют органоиды-рибосомы, осуществляющие синтез белка.
Рибозим (от «рибонуклеиновая кислота» и «энзим») представляет собой РНК, обладающую ферментативным действием. Рибозимы «разрезают» другие молекулы РНК или, напротив, «сшивают» их фрагменты.
Рибозимы применяются в медицине для борьбы с вирусами. Они разрезают вирусную РНК, лишая тем самым вирусы способности к воспроизводству.
Из правила «один ген кодирует один белок, который определяет один признак» есть два исключения. И если первое можно понять, то второе выходит за рамки допустимого.
Но давайте начнем с понятного, так как-то спокойнее.
Некоторые гены обладают множественным действием – они способны влиять не на один, а на несколько признаков. Такая «многогранность» называется плейотропией, что переводится с греческого как «бо́льшее количество превращений».
Плейотропия может быть первичной или вторичной. При первичной плейотропии один ген на самом деле влияет на несколько признаков. Например, у человека ген, определяющий рыжую окраску волос, одновременно обуславливает более светлую окраску кожи и наличие на ней веснушек. При вторичной плейотропии ген по сути дела влияет на один признак, от которого напрямую зависит несколько других признаков. Классическим примером вторичной плейотропии является нарушение синтеза белка крови гемоглобина, приводящее к развитию заболевания, называемого серповидноклеточной анемией. Ген вызывает нарушение синтеза белка, а дальше «нарушенный» гемоглобин приводит к вторичным проявлениям – невосприимчивости к малярии, анемии, увеличению печени и селезенки, поражению сердца и головного мозга.
Но как же быть с концепцией: «один ген – один белок – один признак»? Получается, что плейотропия ей противоречит…
Нет, не противоречит. Просто один белок, образующийся в результате считывания информации с гена, может принимать участие в нескольких процессах, происходящих в организме. Давайте скажем так: «один ген – один белок» и эта концепция будет верной для любого гена.
А будет ли?
Приготовьтесь, сейчас начнется самое интересное. Мы переходим ко второму исключению.
Как, по-вашему, можно объяснить вот такой «парадокс» – мы с вами имеем около двадцати тысяч генов, но при этом в нашем организме синтезируется более ста тысяч белков?
Двадцать тысяч генов и сто тысяч белков! По пять белков на один ген!
По пять разных белков с одного и того же кода?
Как такое вообще возможно?
Это все равно, что отлить пять разных фигур, используя одну и ту же форму для литья, или же построить несколько разных зданий по одному и тому же проекту.
Можно понять, что один белок участвует в различных процессах в организме и, соответственно, влияет на несколько признаков.
Но как может быть нарушено правило «один ген – один белок»?
Такое даже представить не получается. Ген – это код, определенная последовательность четырех видов азотистых оснований. Код задает аминокислотную последовательность (состав и структуру) белковой молекулы. Как можно по одному и тому же коду «построить» две разные белковые молекулы? Или не две, а пять!
Такого просто не может быть!
Один код – одно вещество.
Но при этом двадцать тысяч генов отвечают за синтез более ста тысяч белков.
Где логика?
Логика в явлении, которое называется альтернативным сплайсингом.
Звучное название, интересный, можно сказать – уникальный процесс.
Сплайсинг представляет собой процесс вырезания определенных нуклеотидных последовательностей (проще говоря – сегментов) из молекулы РНК в ходе процесса ее созревания. Да, не удивляйтесь, РНК, особенно матричные, «созревают» подобно винограду или яблокам.
На самом деле про виноград и яблоки мы вспомнили просто так, для красного словца. Ничего общего с созреванием плодов и ягод созревание РНК не имеет и заключается оно в том, что из молекул РНК удаляются (вырезаются) лишние, ненужные участки, не отвечающие за синтез белка. Эти лишние участки образуются в ходе синтеза молекулы РНК как вспомогательные. Для синтеза РНК они нужны, а для функционирования – нет.
Вообще-то, правильнее было бы назвать этот процесс не «созреванием», а «избавлением от балласта». Но уж как назвали, так и прилепилось. Не в названии суть, а в том, что иногда после вырезания балласта разрезанная молекула РНК может быть «сшита» с пропуском какого-либо нужного, активного фрагмента. Такие «ошибки» приводят к тому, что на матрице «сшитой» РНК синтезируется другой белок, не такой, для синтеза которого матрица изначально предназначалась.
Один ген – один код – разные белки.
Спасибо альтернативному сплайсингу!
Но ген-то ни в чем не виноват. Он честно служит основой для синтеза той РНК, на которую его запрограммировала природа и не стремится нарушать. А что уж там с РНК происходит в процессе созревания – не генное дело. Но в результате мы имеем то, что имеем – пятикратное превышение количества синтезируемых в организме белков над количеством имеющихся генов.
И при этом правило «один ген – один белок» по сути не нарушается! Первоначальная «несозревшая» матрица РНК никаких отклонений от заданного кодом стандарта не имеет.
Нет, вы оцените красоту этой генетической игры!
И не спешите пугаться – что, мол, за беспредел творится в наших организмах? Вместо правильных белков образуется черт знает что!
На самом деле никакого беспредела в сплайсинге не существует. Все находится под неусыпным наблюдением системы белков, называемых факторами сплайсинга. Эти факторы контролируют образование альтернативно сплайсированных РНК-матриц. «Ошибки» сплайсинга на деле таковыми не являются, поскольку они заранее запрограммированы и позволяют синтезировать несколько белков на основе одного генетического кода. Несколько нужных организму белков, а не каких попало, обратите особое внимание на это обстоятельство.
Допустим, что вы инженер-строитель и застраиваете целую улицу однотипными домами по одному-единственному проекту. Но всякий раз перед началом строительства ваши помощники вносят в проект определенные изменения, благодаря которым дома получаются не однотипными, а индивидуальными. Вы контролируете своих помощников и приступаете к строительству только после того, как убедитесь, что изменения не повредят делу. То есть – ваш сплайсинг безопасен и полезен, потому что в результате улица получается не уныло-однотипной, а красивой. Это же совсем не то, если нерадивые строители сделают что-то не по технологии и в результате постройка обрушится.
А знаете ли вы, что в нашем организме существует так называемая «мусорная ДНК»? Так называют участки молекул ДНК, не выполняющие никакой функции, то есть – не хранящие никакой информации о синтезе белков. С учетом того, что к «мусору» относится более 90 % молекулы ДНК, можно предположить, что нам просто не известны функции этих участков, ведь у природы ничего лишнего и ненужного не бывает. У нее все продумано до мельчайших деталей и ради нескольких «работающих» процентов не будут синтезироваться гигантские молекулы ДНК. По мере развития генетики, количество «мусорной» ДНК будет сокращаться, а количество полезной – расти.
Гены могут иметь различные специальности…
Нет, это не ошибка – действительно могут. По выполняемым функциям все гены подразделяются на структурные и функциональные (проще говоря – на работяг и начальников).
Простые работяги – структурные гены, содержат информацию о белках и РНК и добросовестно передают эту информацию по назначению. Функциональные гены руководят структурными генами, регулируют их работу. В зависимости от вида регуляции, функциональные гены подразделяются на модуляторы (ингибиторы и интенсификаторы), регуляторы и операторы.
Гены-модуляторы усиливают или ослабляют действие структурных генов. Ингибиторы – ослабляют, а интенсификаторы – усиливают.
Ген-оператор «включает» и «выключает» структурные гены для считывания с них информации. Гены, да будет вам известно, включаются при необходимости, а не работают постоянно.
Ген-регулятор руководит работой гена-оператора. Он содержит информацию, на основе которой синтезируется особый белок-репрессор, блокирующий ген-оператор.
Задумывались ли вы когда-нибудь о том, как именно происходит блокировка или нейтрализация действия химических веществ в живых организмах? Путем связывания молекул белков с их молекулами. Можно сказать, что белковая молекула обхватывает молекулу блокируемого вещества «руками и ногами» и, таким образом, не дает ему выполнять свои функции.
В общих чертах транскрипция происходит так.
Ген-оператор объединяет несколько структурных генов в своеобразную «бригаду», которая работает на «стройплощадке» – участке молекулы ДНК, называемом опероном. Ген-оператор выступает в роли бригадира, который руководит рабочими и периодически покрикивает: «Давай-давай, шевелись быстрей!». Бригаде генов помогает в работе высококвалифицированный мастер – фермент РНК-полимераза, запускающий процесс синтеза РНК. Главным же руководителем строительных работ (прорабом) является ген-регулятор, который решает, когда и сколько бригаде-оперону следует работать. Если нужно остановить работу на опероне, ген-регулятор отправляет к гену-оператору посыльного – белок-репрессор. «Шабаш! – командует этот белок гену-оператору. – Хватит работать! Давай расслабляться!». А для возобновления работы ген-регулятор отправляет к оперону другой белок – индуктор, который уводит прочь белок-репрессор. Освободившийся от навязчивого гостя белок-оператор командует своей бригаде: «Начинаем работу!»…
Вот так плавно, сами того не заметив, мы с вами перешли к выработке белков, которая является частью обмена веществ в живых организмах. Но обмен – это отдельная и очень глубокая тема, которая заслуживает отдельной главы.
Назад: Глава пятая. Биосистемы
Дальше: Глава седьмая. Обмен веществ и энергии

