Хронический стресс и риск заболеваний
В этой книге мы уже много раз говорили о том, что определенная физиологическая реакция на обычные для млекопитающих стрессоры – если она длится слишком долго или возникает слишком часто – приводит к серьезным проблемам. Способность сильных стрессоров подавлять иммунитет ниже базовой линии – одна из таких проблем. Насколько опасно стрессогенное подавление иммунитета, если оно уже возникло? Как научил нас вирус СПИДа, если иммунная система серьезно подавлена, то 30-летний человек будет медленно умирать от рака и пневмонии, которые раньше врачи, за 50 лет своей карьеры, наблюдали только у пожилых пациентов. Но может ли хронический стресс подавлять иммунную систему до такой степени, чтобы вызывать болезни, которые иначе не возникли бы? А если мы уже заболели, то насколько труднее нам будет выздороветь?
Данные из множества источников свидетельствуют о том, что стресс действительно способен ослаблять иммунную систему и увеличивать риск заболеваний. Но, несмотря на это поразительное открытие, остается совершенно неясным, в какой степени хронический стресс делает нас уязвимыми к болезням, которые иммунная система обычно уничтожает в зародыше. Чтобы не запутаться в хаосе, который царит в этой сфере исследований, попробуем разложить их результаты на составные части.
По сути, все эти исследования подтверждают связь между чем-то, что увеличивает или уменьшает стресс, и теми или иными болезнями или причинами смертности. Подход многих психонейроиммунологов основан на предположении о том, что эта связь возникает посредством следующих стадий:
1. Человек переживает стресс.
2. Это заставляет его включить реакцию на стресс (выработка глюкокортикоидов, адреналина и т. д.).
3. Длительность и сила реакции на стресс увеличиваются настолько, что это подавляет иммунную функцию.
4. Это повышает вероятность инфекционных заболеваний и ослабляет способность защищаться от болезни, если она уже возникла.
Предположим, мы видим, что определенное заболевание, связанное с иммунитетом, чаще возникает в ситуации стресса. Здесь нужно задать два важных вопроса. Во-первых, можете ли вы доказать, что человек, переживший стресс и заболевший, прошел через шаги 1–4? Во-вторых, можно ли по-другому объяснить, как стресс привел к болезни? Другими словами, существует ли альтернативный маршрут?
Начнем с анализа этих четырех шагов и посмотрим, можно ли доказать, что все они имели место.
Шаг 1. Человек переживает стресс. В исследованиях на животных общее мнение заключается в том, что при достаточно сильном стрессе организм проходит шаги со 2-го по 4-й. Но перенести этот вывод на людей достаточно сложно, ведь экспериментальные стрессоры, используемые в исследованиях на животных, обычно гораздо ужаснее, чем то, что мы с вами переживаем в обычной жизни. Более того, у каждого из нас есть свои «сильные стрессы» – между людьми лежит безбрежное море индивидуальных различий, о чем мы поговорим в последней главе этой книги. Поэтому, если мы пытаемся изучать влияние стрессоров на иммунную систему человека, нам нужно как-то определить, является ли тот или иной стрессор «сильным» для данного испытуемого или нет. Это значит, что шаг 1, вероятно, можно признать достоверным в тех исследованиях взаимоотношений между стрессом и заболеваниями, связанными с иммунитетом, где фигурируют события, которые считают «ужасными» большинство людей, – смерть близких, развод, потеря работы с угрозой финансовых проблем. Но если окружающая реальность такова, что большинство людей не считают ее стрессовой, мы не можем автоматически признать, что находимся на шаге 1.
С шагом 1 есть еще одна проблема: часто неясно, действительно ли человек подвергается воздействию стрессора или он только говорит об этом. Как известно, мы не умеем объективно описывать то, что происходит в нашей жизни. Проведем воображаемый эксперимент: возьмите 100 везучих людей и подсуньте им препарат, который вызовет у них боли в желудке в течение нескольких дней. Потом отправьте их к доктору, тайно участвующему в этом эксперименте. Он скажет, что они заболели язвой желудка. Затем доктор невинно спросит: «В последнее время вы испытывали какие-нибудь стрессы?» Возможно, 90 из 100 испытуемых расскажут о каком-то стрессовом событии и припишут ему свою «язву». В ретроспективных исследованиях часто оказывается, что, узнав о своей болезни, люди часто говорят, что она возникла в результате какого-то стрессового события.
Если вы решите положиться на ретроспективные исследования с участием людей, то, скорее всего, обнаружите тесную связь между стрессом и болезнью, хотя на самом деле ее не было. Проблема в том, что почти все исследования в этой области являются ретроспективными (мы уже говорили об этом, когда обсуждали заболевания желудочно-кишечного тракта). Дорогие и длительные проспективные исследования стали массово проводиться лишь недавно – возьмите группу здоровых людей и отслеживайте их состояние в течение многих десятилетий, объективно описывая ситуации, когда они подвергаются воздействию стрессоров, и наблюдайте, заболеют они или нет.
Перейдем к следующему шагу: от стрессора к реакции на стресс (от шага 1 к шагу 2). Напоминаю, что если подвергнуть организм действию сильного стрессора, у него почти наверняка возникнет сильная реакция на стресс. Если действуют более слабые стрессоры, реакция на стресс также будет слабее.
То же самое касается перехода от шага 2 к шагу 3. В экспериментальных исследованиях на животных выяснилось, что высокий уровень глюкокортикоидов подавляет иммунную систему. То же самое происходит, если у человека есть опухоль, которая приводит к выработке больших количеств глюкокортикоидов (синдром Кушинга), или если человек принимает огромные дозы синтетических глюкокортикоидов для лечения какой-то другой болезни. Но, как мы теперь знаем, умеренное повышение уровня глюкокортикоидов в ответ на воздействие многих типичных стрессоров не подавляет иммунную систему, а стимулирует ее. Кроме того, при некоторых типах онкологических заболеваний повышенный уровень глюкокортикоидов выполняет защитную функцию. Как мы видели в предыдущей главе, очень высокий уровень глюкокортикоидов снижает количество эстрогенов у женщин и тестостерона у мужчин, а эти гормоны стимулируют рост определенных типов злокачественных опухолей (самые известные из них – «чувствительные к эстрогену» формы рака молочной железы и «чувствительные к андрогену» виды рака простаты). В этих случаях много стресса означает больше глюкокортикоидов и меньше эстрогена или тестостерона, что замедляет рост опухоли.
Переходим от шага 3 к шагу 4. Насколько изменение профиля иммунной функции меняет паттерны болезни? Весьма странно, но иммунологи этого не знают. Если иммунная система сильно подавлена, то вероятность болезни, вне всякого сомнения, растет. У людей, принимающих большие дозы глюкокортикоидов для лечения тех или иных расстройств, очень ослаблен иммунитет, и они уязвимы для инфекционных заболеваний, так же как пациенты с синдромом Кушинга или СПИДом.
Однако последствия более тонких колебаний иммунитета не так понятны. Некоторые иммунологи, возможно, сказали бы, что «для каждого минимального уменьшения какого-то параметра иммунной функции всегда есть минимальное увеличение риска заболевания». Их сомнения вызваны тем, что взаимосвязи между иммунной компетентностью и болезнью могут быть нелинейными. Другими словами, как только вы переходите определенный порог подавления иммунитета, вы оказываетесь в очень затруднительном положении; но если порог не перейден, иммунные колебания, возможно, не имеют большого значения. Иммунная система настолько сложна, что изменения в одном ее фрагменте в ответ на стресс ничего не говорят о системе в целом. Таким образом, взаимосвязь между относительно незначительными колебаниями иммунной функции и паттернами заболеваний у людей до сих пор считается относительно слабой.
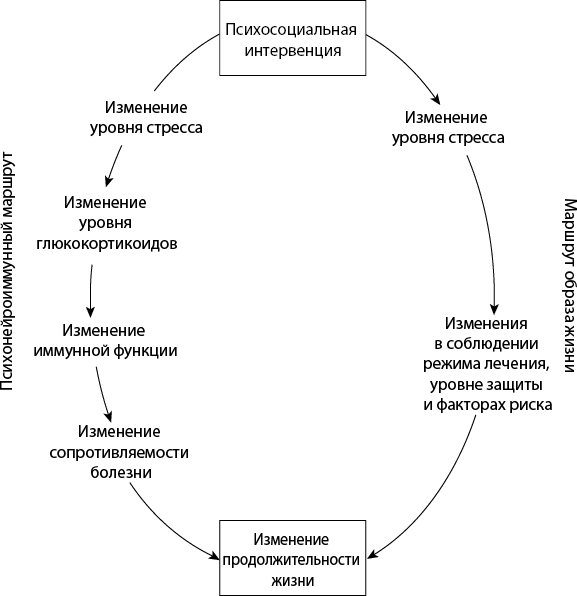
Рис. 31
Есть еще одна причина, по которой трудно делать выводы о реальном мире на основании результатов, полученных в лаборатории. В лаборатории можно изучать влияние шагов 1–3 на течение болезни, возникающей на шаге 4. Ученым редко удается изменить уровень стресса, глюкокортикоидов или иммунитета у крысы, а потом наблюдать за этой крысой всю ее оставшуюся жизнь, чтобы выяснить, насколько чаще она будет болеть, чем крыса из контрольной группы. Это долго и дорого. Как правило, ученые изучают болезни, вызванные искусственно. Возьмите крысу, подвергните ее воздействию какого-нибудь вируса, а затем проведите через шаги 1–3 и наблюдайте, что происходит. Таким образом, изучая тяжелые, искусственно вызванные болезни, вы получите информацию о шагах 1–3, которые связаны с шагом 4. Но должно быть очевидно, что этот подход никак не учитывает того факта, что мы болеем не потому, что какой-то ученый сознательно решил нас заразить. Мы просто живем в мире, полном невидимых канцерогенов, случайных эпидемий и людей, чихающих рядом с нами в метро. Лишь в нескольких экспериментальных исследованиях на животных рассматривались спонтанно возникающие, а не искусственно вызванные болезни.
Здесь есть несколько оговорок. Давайте рассмотрим несколько областей, где установлена связь между стрессом и болезнями, вызванными иммунной дисфункцией. Это позволит нам оценить, в какой степени эта связь возникает в процессе перехода от шага 1 к шагу 4. Этот путь мы назовем «психонейроиммунным маршрутом» (рис. 31). Он соединяет стресс и болезнь. В каждом случае мы постараемся выяснить, существует ли альтернативный путь. Его мы назовем «маршрутом образа жизни». Возможно, он соединяет стресс и болезни, вызванные иммунной дисфункцией, минуя при этом последовательность шагов 1–4.

