4. ЧЕЛОВЕК ПОДОПЫТНЫЙ: КАК ИСКАТЬ ТАБЛЕТКУ ОТ СТАРОСТИ
Большинство моих коллег по кафедре биологии развития избегали работы с млекопитающими. С лягушками все гораздо проще: много икринок развиваются отдельно от матери, геометрия простая, будто специально создана для микрохирургических операций. То ли дело зародыш человека или даже мыши: вне матки проживет максимум две недели, ткани расположены затейливо, оперировать неудобно, чуть что — умирает. "Рискованное занятие", — решали мы и отправлялись работать с милыми сердцу амфибиями.
Такого рода истории можно услышать от биологов самых разных направлений, от генетиков до физиологов. Человек — самый неудобный объект исследования из всех возможных, самый громоздкий и сложно устроенный. Никто так сильно не мешает поиску таблеток от старения людей, как сам человек, который отказывается примерять на себя роль лабораторного животного. В этой главе мы поговорим о том, что мешает человеку поставить эксперимент на себе самом и какие уловки приходится придумывать, чтобы получить хоть какие-то результаты и двигаться дальше.
Против времени
Наиболее неприятное для геронтолога свойство человека состоит в том, что он (человек) очень долго живет. И чем выше продолжительность жизни, тем сложнее становится спланировать эксперимент по ее увеличению. Цель оказывается главным препятствием на пути к самой себе.
Представим себе, что мы придумали средство борьбы со старением — пусть, для простоты, это будет таблетка. Скорее всего, ее нужно принимать не на смертном одре, а заранее, когда человек еще не обзавелся возрастными болезнями и не нуждается в постоянном лечении. Пусть это будет — по оптимистичным оценкам — 60 лет. Чтобы выяснить, продлевает она жизнь или нет, нужно проверить, достигнут ли испытуемые возраста хотя бы 100 лет, а лучше больше, например 120. Тогда мы сможем исключить вероятность того, что в нашу выборку случайно попали одни долгожители-рекордсмены (заранее мы это проверить не можем, потому что гены, которые определяют продолжительность жизни, до сих пор неизвестны, подробнее об этом поговорим в главе "Виноваты гены").
Таким образом, наш эксперимент займет 60 лет. Даже если нам повезло и таблетка сработала, а участники исследования не разбежались и не пали жертвой какого-нибудь стихийного бедствия, препарат не сразу появится в аптечке каждого человека на Земле. Потребуется еще сколько-то лет, чтобы успеть обработать результаты, опубликовать их в журнале и проверить, насколько препарат токсичен для разных категорий людей. В общем, редкие исследователи доживут до выхода такой таблетки на рынок — если только они не начали эксперимент, будучи совсем молодыми, и сами принимали свой препарат наравне с испытуемыми.
Но пока это всего лишь выдумка, и такие долгие эксперименты никто не начинает. Те ученые, которых интересует человеческая жизнь в динамике, пользуются лонгитюдными исследованиями. Это наблюдения за людьми, которые длятся десятки лет и в ходе которых экспериментаторы собирают множество разных данных, от семейного статуса и уровня образования до анализов крови. Одно из самых долгих — Балтиморское лонгитюдное исследование старения в США, которое ведется с 1958 года. И подобные проекты продолжают запускаться, например в 1997 году очередной (NILS-LSA) стартовал в Японии. Как правило, лонгитюдные исследования потом становятся базой для научных работ в самых разных областях — каждый ученый берет ту часть данных, которая ему необходима. В том числе их могут использовать и геронтологи — для того, например, чтобы попробовать предсказать риск смерти от естественных причин в зависимости от тех или иных особенностей образа жизни.
Редкий пример действительно долгого наблюдения — Миннесотский эксперимент, который начался в 40-е годы XX века. Американский физиолог Ансель Кейс отобрал 36 молодых и стройных мужчин, чтобы на них воспроизвести условия голодных лет Второй мировой войны. В течение полугода испытуемые жили в лаборатории, ходили на занятия в университет, выполняли свои повседневные обязанности и ходили по 5 километров в день, но ели при этом в два раза меньше, чем обычно. За это время здоровье их всерьез ухудшилось — появились слабость, отеки и психические отклонения, — и эксперимент прекратили.
Много лет спустя оказалось, что те из участников эксперимента, кому удалось достигнуть 80 лет, прожили дольше, чем их среднестатистические сверстники. Это первое и единственное на сегодняшний день эмпирическое свидетельство того, что ограничение в еде может продлевать жизнь человека (подробнее к этой теме мы вернемся в главе "Виновата молодость"). Тем не менее это исследование сложно считать доказательным (хотя бы из-за малой выборки и отсутствия контрольной группы), а других радикальных экспериментов по продлению жизни, чьи отдаленные последствия мы могли бы измерить, история для нас, к сожалению (или к счастью), не припасла.
Альтернативный подход — не дожидаться, пока кто-то из выбранной группы людей проживет больше или меньше, а работать с теми, кто уже достиг определенных успехов в борьбе со старением. Некоторые ученые, например, собирают "коллекцию" долгожителей и опрашивают их о событиях далекой молодости — как жили, что ели, чем болели — и ищут закономерности, которые могли бы объяснить их выдающиеся результаты. Так устроены ретроспективные исследования. У них есть важное преимущество по сравнению с лонгитюдными: коль скоро эти люди прожили больше среднего, у них заведомо должны быть какие-то особенности, которые им это позволили. Но есть и минус: данные получаются недостоверными, а проверить их проблематично.
Тренируемся на кошках
Можно проверять предполагаемые лекарства от старости на короткоживущих модельных организмах. Поставить на них эксперимент гораздо проще. Во-первых, не возникает этических проблем такого масштаба, как с людьми: исследователь не обязан доказывать этическому комитету, что старение — это болезнь, а также гарантировать испытуемым крысам и кроликам полную безопасность. Во-вторых, жизнь модельных объектов легко стандартизировать: держать в одинаковых клетках, кормить одной и той же едой, даже лампочки установить с одной и той же стороны — и не бояться, что они не выдержат однообразия и выйдут из эксперимента досрочно. Наконец, такие исследования обходятся гораздо дешевле, а результаты дают быстрее, чем если бы мы работали с людьми.
Но как только мы, получив какой-то эффект на животных — чаще всего на мышах, — пытаемся перенести его на людей, то сталкиваемся с "трудностями перевода". По оценкам Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), лишь 8% всех препаратов, которые прошли испытания на мышах, имеют шанс оказаться полезными и для людей и выйти в конечном счете на рынок. Поэтому ученые не склонны особенно доверять "мышиным пробам": среди наиболее цитируемых статей, где на мышах получены многообещающие результаты, половину методик даже не пытаются повторить на человеке.
Беда в том, что человек не мышь, и даже не огромная мышь. Уже хотя бы потому, что мы живем в десятки раз дольше: срок жизни среднестатистической мыши — 2–3 года в лаборатории. Это мешает напрямую соотнести результат, который мы получили на мышах, с возможными последствиями для человека. Допустим, наши подопытные мыши прожили 3 года вместо 2,5, то есть на 20% дольше. Стоит ли рассчитывать, что человек, принимая тот же препарат, вместо 100 лет проживет 120? Или всего лишь 100 с половиной?
Отличаемся мы от мышей и на молекулярном уровне. Например, наши тела используют разные стратегии борьбы с опухолями. Почти во всех клетках мыши активна теломераза — фермент, который надстраивает концы хромосом и позволяет клеткам неограниченно делиться (подробнее об этом мы поговорим в главе "Виноват рак"). Поэтому мыши чаще болеют раком: к 2–3 годам, по разным данным, от 30 до 50%, животных страдают опухолями. Правда, треть людей тоже болеет раком к концу своей жизни; но и жизнь эта в 30–40 раз длиннее мышиной. В этом смысле продление жизни мышам и людям — две разные задачи. И мы уже продвинулись в эту сторону гораздо дальше, чем мыши, увеличив свою "естественную" продолжительность жизни на несколько десятков лет, поэтому большинство спасительных для мышей методик нам едва ли помогут.
Набор возрастных заболеваний у мышей тоже не во всем совпадает с человеческим. Например, у них не встречается болезнь Альцгеймера. Поэтому, чтобы проверять лекарства против этого заболевания, приходится использовать генетически-модифицированные линии мышей, у которых развивается похожее поражение нервной ткани, — но полностью воспроизвести у них симптомы болезни вроде деменции невозможно. Из-за этого, кстати, некоторые ученые не переносят испытания препаратов, которые хорошо себя показали в преклинических исследованиях, на людей — они просто не доверяют результатам, которые получены на мышах.
Наконец, еще одно немаловажное отличие состоит в том, что люди гораздо сильнее отличаются друг от друга, чем лабораторные мыши. Каждая группа исследователей работает, как правило, с одной или несколькими линиями мышей. Линия — это фактически одна семья, генетически однородная группа. И если какой-то препарат работает на одной линии мышей, он необязательно подойдет для другой линии и тем более для человека — может оказаться, что он просто удачно компенсирует какой-нибудь дефект в физиологии этой конкретной "семьи".
Можно было бы решить, что мыши — действительно далекий от человека организм, и поэкспериментировать с кем-нибудь, кто ближе к нам. Например, с приматами. Но как только мы выбираем более близкий объект, многие плюсы от работы с мышами теряются. Приматы в среднем гораздо дольше живут, то есть исследование опять растягивается на десятки лет. Содержать их становится дороже, а в случае с большими человекообразными обезьянами, например гориллами и шимпанзе, снова появляются этические ограничения.
Приходится искать промежуточные решения. Недавно в США запустили исследование Dog Aging Project. Участники этих испытаний — обычные домашние собаки, чьи хозяева помогают следить за их здоровьем и условиями жизни. Собаки живут, конечно, не так долго, как люди, но все же дольше, чем мыши. Поэтому на них постепенно начинают тестировать препараты, которые, возможно, однажды помогут их хозяевам. Например, рапамицин — один из кандидатов в таблетки от старости. В первых испытаниях Dog Aging Project он уже улучшил работу сердца у испытуемых собак и снизил их артериальное давление (к старости у собак оно растет, как и у людей).
Но если отдельные заболевания еще можно изучить на животных, то человеческую старость в широком смысле слова — со всем набором характерных симптомов, от морщин до деменции, — у них воспроизвести невозможно. И даже если мы научимся продлевать жизнь модельных организмов, то для того, чтобы выяснить, не превращается ли новоиспеченный долгожитель в вечно больного Тифона, потребуются эксперименты на людях — тем более долгие, чем успешнее окажется наш метод продления жизни.
Модель поневоле
Среди людей изредка тоже встречаются те, кто может послужить моделью для исследований старения. В таких случаях, по крайней мере, никто не сомневается в том, что это болезнь и что ее надо лечить. Синдром преждевременного старения называют прогерией, хотя на самом деле под этим названием скрывается целая группа непохожих друг на друга заболеваний. Их объединяют не столько симптомы, сколько общий принцип: они ускоряют старение организма или отдельных его частей.
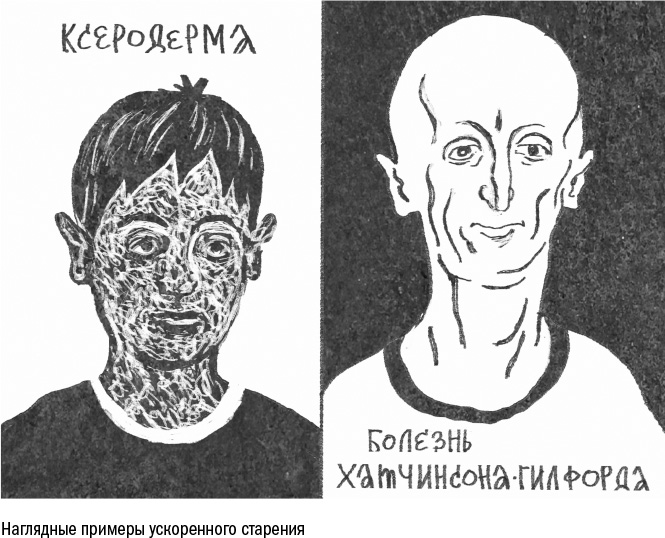
В самом легком случае прогерия поражает только отдельные органы. Так происходит, например, при ксеродерме (xeroderma pigmentosum). Внешне она проявляется как множество пятнышек на коже, это скопления пигментированных клеток. В основе этой наследственной болезни лежит нарушение системы репарации, то есть починки ДНК. Именно поэтому болезнь сильнее всего заметна на коже: на поверхность тела действует солнечный свет с ультрафиолетовыми лучами, они повреждают ДНК, а клетки не успевают справиться с этими повреждениями. Больные ксеродермой сильнее, чем обычные люди, рискуют получить рак кожи — если повреждение ДНК затронет какой-нибудь ген, который отвечает за деление или смерть клеток, а система репарации не сможет его вовремя починить. А поскольку рак считается возрастной болезнью, то можно считать, что старость у таких людей наступает раньше. Тем не менее многие больные ксеродермой живут обычной жизнью, хотя у трети из них ускоренное старение затрагивает не только кожу, но и нервную систему, вызывая глухоту, умственную отсталость и другие симптомы.
Гораздо опаснее для жизни так называемая взрослая прогерия (например, синдром Вернера) — синдром ускоренного старения, который начинает проявляться лишь в подростковом периоде. У таких пациентов сломан один из белков, которые занимаются копированием ДНК, поэтому в ходе деления клеток возникают ошибки. В какой-то момент их становится слишком много, и постепенно волосы начинают выпадать, зрение — слабеть, а кости — разрушаться. Развивается характерный набор заболеваний, который по многим признакам напоминает старение. Умирают такие люди в среднем в 47 лет.
Но самый тяжелый вариант — детская прогерия, носители которой редко доживают до 20 лет. Она проявляется с самого рождения и не оставляет больному шансов на здоровую жизнь. Видов детской прогерии известно несколько, и в основном они тоже вызваны мутациями генов, связанных с хранением и обработкой ДНК в клетке.
Самая известная из этой группы болезней, которую чаще всего имеют в виду, когда говорят о прогерии, — прогерия Хатчинсона — Гилфорда. Носителей этой болезни обычно приводят в качестве образца ускоренного старения: это низенькие люди со сморщенными, клювовидными лицами. С рождения у них появляются разнообразные внешние признаки старости: волосы выпадают, изменяется пигментация кожи, суставы раздуваются, как при артрите. Клетки таких пациентов несут мутации в гене ламина А — белка, который прикрепляет ДНК к оболочке клеточного ядра изнутри. Мутантная версия белка намертво застревает в оболочке, из-за чего та деформируется, нити ДНК теряют укладку и запутываются, а клетка не может делиться без ошибок. В такой ситуации все ткани и органы тела стареют с одинаковой скоростью.
Наблюдая за больными прогерией как за моделью старения, мы видим, что все случаи этих заболеваний вызваны поломками в ДНК, вне зависимости от того, из-за чего они возникают. Это означает, что мутации, с одной стороны, не настолько серьезная проблема, чтобы не позволить организму выжить, но, с другой стороны, их самих по себе достаточно, чтобы ускорить старение и привести к преждевременной смерти.
Лечить прогерию мы пока не умеем, можем разве что компенсировать эффект от мутаций. Например, для больных синдромом Хатчинсона — Гилфорда недавно разработали первый препарат, который запрещает мутантному ламину А заякориваться в мембране. В результате удалось снизить смертность пациентов в 10 раз: с 33,3 до 3,7% в течение двух лет. Тем не менее такие лекарства едва ли помогут справиться со старением обычным людям — они призваны исправить точечные дефекты в работе клеток, которые встречаются только при прогерии определенного типа, но не характерны для старения в целом.
Зато клетки больных прогерией могут стать хорошим модельным объектом. По крайней мере, на них иногда проверяют потенциальные "таблетки молодости", например тот самый рапамицин, который тестируют на собаках из проекта Dog Aging Project.
Чтобы окончательно победить прогерию, нужно добраться до ее главной причины — мутаций, и научиться бороться с ними напрямую. Этого можно было бы достичь с помощью генной терапии, то есть "ремонта" ДНК in vivo — запустить в клетки пациентов систему генетического редактирования, которая починит мутацию, ответственную за развитие болезни.
Пока что эту технологию пробуют только на модельных животных, и результаты первых экспериментов, с одной стороны, обнадеживают, а с другой — обнажают неочевидные трудности на пути к ремонту организма в целом.
Сами по себе мыши прогерией не болеют, но ее можно у них вызвать, если внести в ген ламина А характерную мутацию. Получившиеся прогероидные мыши стареют по тому же принципу, что и люди: всеми органами одновременно. У них сморщивается кожа, хуже заживают раны и атрофируются мышцы. Ученые разработали для таких мышей методику генной терапии: им вводили в кровь систему генетического редактирования CRISPR / Cas9 — это группа молекул, которые прицельно связываются с необходимым местом в ДНК и вырезают оттуда участок мутантного гена.
Отредактированные мыши прожили на 25% дольше, чем их прогероидные сородичи, и выглядели более молодыми — например, не так быстро теряли вес и интерес к грумингу.
Правда, возникло одно недоразумение. Экспериментальные мыши умерли по совершенно неожиданной причине — от запора. При подробном рассмотрении выяснилось, что их тело получилось отремонтировать неравномерно, потому что не все органы одинаково хорошо снабжаются кровью. В пищеварительной системе мышей, где много сосудов, лечение сработало, и кишечник стал работать, как в молодости. А вот в нервную систему, которая не контактирует с кровью напрямую, молекулы CRISPR / Cas9 не добрались. В результате нейроны, которые должны подавать кишечнику сигнал сокращаться, состарились быстрее, чем собственно клетки кишечника. Нервная система потеряла контроль над пищеварительной, что и вызвало смертоносный запор.
Сегодня генную терапию уже начали использовать для лечения разных болезней, например рака и атеросклероза. И, как и следовало ожидать, то и дело слышатся разговоры о том, что рано или поздно генетическое редактирование можно будет использовать не только для лечения ускоренного старения, но и для продления жизни тем, кто стареет в обычном темпе. Мы еще будем подробно говорить о том, какие именно гены имело бы смысл "починить" у людей, но уже сейчас понятно, что сначала придется придумать, как ремонтировать организм человека равномерно — чтобы не вышло, как с экспериментальными мышами.
Ненаглядное пособие
Коль скоро изучение тех, кто стареет быстро, не дает готового рецепта молодости, можно обратиться к другому крайнему случаю и посмотреть, чем особенны те, кто стареет медленно, то есть долгожители. Последняя волна интереса к ним поднялась после исследования итальянца Клаудио Франчески в 2004 году: вместе с коллегами он обнаружил на Сардинии "горячую точку" долголетия — регион, в котором были сконцентрированы долгожители.
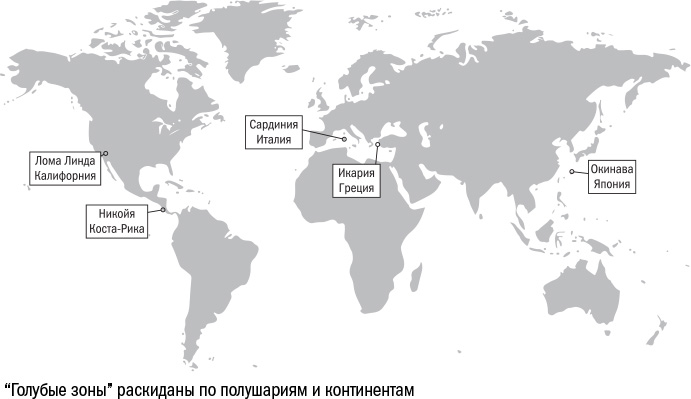
Исследователи подсчитали, как распределена средняя продолжительность жизни по острову, и построили диаграмму, на которой она была обозначена градиентом синего цвета. И оказалось, что в восточной части острова, в провинции Нуоро, есть область, где до 105 лет доживает в три раза больше людей, чем в среднем на острове. Эту область назвали "голубой зоной".
Идеей "голубой зоны" вдохновился журналист National Geographic Дэн Бюттнер и отправился на поиски новых областей долголетия. Он нашел еще три места, которые позже официально признали удовлетворяющими всем критериям "голубой зоны": японский остров Окинава, греческий остров Икария и полуостров Никойя в Коста-Рике.
Еще одну область долголетия позже отыскали в Калифорнии — это община церкви адвентистов седьмого дня. Ее сложно формально считать "голубой зоной", поскольку она географически не изолирована. Тем не менее ее часто включают в этот список. Своим существованием пятая зона, вероятно, обязана суровым ограничениям, которые церковь накладывает на жизнь своих прихожан: в общине запрещены курение и алкоголь и весьма приветствуется вегетарианство.
Еще в своей первой работе, посвященной "голубой зоне", Франчески с коллегами обратили внимание на то, что области аномального долголетия, как официально признанные, так и неподтвержденные (в России к ним относятся, например, Северный Кавказ и Алтай), обычно расположены в горах. Ученые предположили, что эти области изолированы от соседей, поэтому в них чаще заключаются близкородственные браки. Из-за этого в горных популяциях могут скапливаться варианты генов, которые способствуют долгой жизни и защищают своих носителей от возрастных заболеваний.
Другие же исследователи "голубых зон" подошли к вопросу с другой стороны. Их интересовало, чем образ жизни обитателей этих мест отличается от остальных и можно ли из него вывести "рецепт" долголетия.
Дэн Бюттнер составил для своих читателей такой список правил долгой жизни: естественное движение (не спорт, а обычная ходьба и физкультура), осмысленность (цель в жизни), дауншифтинг (избавление от повседневных стрессов), ограничения в питании (80% калорий от нормы), растительная диета, алкоголь (в небольших количествах), религиозность, любовь к близким, социальные связи (прочный и благотворно влияющий круг общения).
Мы оставим в стороне рассуждения о том, в какой степени возможно сочетать эти жизненные принципы (например, употребление алкоголя с религиозностью). К тому же многие из этих факторов и их влияние на продолжительность жизни нам еще представится повод обсудить на страницах этой книги. Пока что давайте зададимся другим вопросом: возможно ли вообще на основе обитателей "голубых зон" или любых других долгожителей сформулировать универсальные правила долголетия?
Говоря о долгожителях, важно помнить, что это крайне неоднородная группа. И далеко не все они похожи на вечно молодых: среди них не больше 25% сохраняют умственные способности и психическое здоровье. Эти люди очень разные с биологической точки зрения: два случайно выбранных долгожителя отличаются друг от друга сильнее, чем два "обычных" человека.
Увидеть эти различия можно, измерив почти что угодно, например уровень гормонов щитовидной железы в крови. Логично было бы ожидать, что с возрастом разброс значений будет снижаться, поскольку выживать будут самые крепкие люди, но он, напротив, увеличивается. Дело в том, что каждая дополнительная секунда жизни — это очередная поломка или починка внутри организма, новая болезнь или микроскопический клеточный конфликт, и у каждого человека их набор уникален. Даже генетически идентичные близнецы с возрастом начинают по составу крови все сильнее отличаться друг от друга.
Американский писатель Джон Мэйсон однажды сказал: "Зачем становиться копией, если вы рождены оригиналом?" — видимо, как наставление грядущим поколениям и призыв не копировать своих отцов. Датский геронтолог Суреш Раттан перефразировал это высказывание применительно к долгожителям и особенностям их организмов: "Мы все рождаемся копиями, а умираем уже оригиналами". И, судя по результатам измерений, чем дольше живем, тем оригинальнее становимся.
Но коль скоро все долгожители не похожи друг на друга, на кого из них ориентироваться? Рекордсменка Жанна Кальман, как говорят, всю жизнь курила, пока зрение позволяло ей поджигать сигарету. Еще она любила шоколад и не отказывала себе в вине. Значит ли это, что курение, шоколад и сигареты помогают прожить 122 года? А адвентисты седьмого дня из Калифорнии, напротив, не пьют и не курят. С кого брать пример?
В погоне за секретом долголетия не стоит забывать, что обитатели "голубых зон" бóльшую часть своей жизни провели в условиях, весьма далеких от современных мегаполисов, где живет большинство желающих воспроизвести их результаты. Например, среди итальянских долгожителей, которых исследовал Франчески, 65% закончили лишь 8 классов школы (остальные — и того меньше), поскольку родились на границе XIX и XX веков. Соответственно, многие из них занимались низкоквалифицированным трудом — были домохозяйками, фермерами, рыбаками, крестьянами и разнорабочими. Лишь 25% служили управляющими или клерками. Они пережили две войны, провели бóльшую часть жизни на ногах (в соответствии со своей профессией) и питались местными фермерскими продуктами, набор которых жестко зависел от времени года (поскольку холодильников у них не было). Я более чем уверена, что никто из читающих эту книгу и даже ни один из посетителей интернет-сайтов с "рецептами долгой жизни" не планирует провести ее именно таким образом.
Сам же Франчески, который много общался с долгожителями, не смог найти почти никаких особенностей в их образе жизни. Расспросы о пищевых привычках этих людей ни к чему не привели, равно как и разговоры про их половую жизнь. Ученый винит во всем ту же старость, а именно проблемы с памятью: долгожителям сложно воспроизвести события, которые произошли десятки лет назад. Тем не менее итальянский исследователь выделил несколько общих закономерностей.
Так, несмотря на то что долгожители питаются самой разной пищей, меню большинства из них ближе к вегетарианскому: они едят много овощей, яиц и сыра, но мало мяса. Впрочем, для сельских жителей в этом рационе нет ничего необычного. Кроме того, долгожители много времени проводят в движении: ходят пешком, ездят на велосипеде или занимаются работой по дому. Наконец, они очень консервативны — готовят еду одними и теми же способами, едят маленькими порциями, соблюдают жесткий режим дня и спят строго по часам. Поэтому, например, они не испытывают проблем со сном и не страдают бессонницей — распространенной среди жителей мегаполисов. Но на такой маленькой выборке очень сложно однозначно определить, является ли четкий режим дня особенностью именно долгожителей, или это общее правило, продиктованное жизнью на природе в традиционном сообществе.
Тем не менее исследования долгожителей продолжаются — если не для того, чтобы найти призрачные "секреты активного долголетия", то для того, чтобы разобраться, какие механизмы старения в их теле работают, а какие — молчат. Почти половина долгожителей доживает до 80 лет, еще не страдая ни одним возрастным заболеванием. А некоторым (15–30%) удается избежать их и в 100 лет. Таким образом, в их случае становится дольше не только сама жизнь (lifespan), но и здоровая ее часть (healthspan) — то есть их кривая выживаемости не только сглажена, но и сдвинута влево, поскольку их старение начинается позже. А значит, они могли бы стать хорошим примером для подражания — как только мы найдем в работе их организмов хоть что-то общее.
Вычисляем старость смолоду
Больные прогерией и долгожители находятся на противоположных полюсах старения, и их беды и достижения имеют мало отношения к остальным, среднестатистическим людям, которые находятся в "серой зоне" между однозначно ускоренным и замедленным старением. Однако именно обычные люди формируют спрос на таблетки от старости. И чтобы пробовать на них эти таблетки, нужно научиться определять скорость их старения в реальном времени, не дожидаясь, пока они пополнят или не пополнят ряды долгожителей.
Для этого геронтологи пытаются высчитывать биологический возраст, который — в противовес хронологическому — должен отражать "настоящее" положение организма на графике выживаемости. Измеряя биологический возраст через определенные промежутки времени, можно выявить и динамику старения для конкретного человека: соответствует ли она обычному старению, замедленному или ускоренному.
Я посвящу отдельную главу во второй части книги разным маркерам биологического возраста — приметам и параметрам, с помощью которых его можно подсчитать. Ими могут быть, например, набор бактерий в кишечнике, длина теломер или количество хронических болезней. Их существует множество, все они дают разные оценки, и геронтологи до сих пор не определились с тем, какой из них надежнее.

В то же время важно помнить, что никакого биологического возраста на самом деле не существует. Внутри организма человека не заложено никакого заводного механизма, который вел бы обратный отсчет. Биологический возраст не предсказывает будущее, с его помощью нельзя определить, когда умрет организм, и уж тем более каким образом. С помощью тех или иных тестов мы снимаем не какую-то объективную мерку, а лишь делаем вероятностный прогноз, и выбор того или иного маркера влияет только на его точность.
Тем не менее подобные измерения позволяют подтвердить или опровергнуть наши догадки о скорости старения людей. Так Клаудио Франчески подсчитал, что долгожители в среднем на 8,6 года моложе своего календарного возраста — то есть действительно стареют медленнее, чем положено.
Примеры ускоренного старения Франчески нашел и среди людей, которые не страдают прогерией. Оказалось, что и другие заболевания могут ускорять течение биологического времени. Например, у носителей синдрома Дауна довольно рано возникают разные возрастные болезни, например проблемы со зрением, аутоиммунные заболевания и по меньшей мере в 50% случаев развивается болезнь Альцгеймера. Как выразились Франчески и его соавторы в одной из статей, такие люди "напрямую переходят от педиатра к гериатру, перепрыгивая почти целиком положенный им долгий период здоровой взрослой жизни". По последним оценкам, биологический возраст у людей с синдромом Дауна в среднем на 6,6 года больше, чем у их сверстников.
Ускорить старение могут и ненаследственные болезни, например онкологические. У тех, кто в детстве перенес рак, чаще встречаются нарушения в работе эндокринных желез и сердечно-сосудистой системы, чем в среднем у их сверстников. Насколько тяжелыми окажутся последствия, зависит и от хода лечения: удалось ли пациентам обойтись химиотерапией или же потребовались операции и трансплантация органов. Сама по себе борьба с раком повышает биологический возраст человека, иногда даже на целых 20 лет. Но после окончания лечения он часто возвращается к нормальным значениям, что еще раз показывает: то, что мы называем биологическим возрастом — на самом деле оценка риска умереть, а вовсе не диагноз и не приговор. Как, впрочем, и хронологический возраст.
ВИЧ-инфекция тоже оказалась связана со старением. Франчески обнаружил, что, даже если ее носители принимают антиретровирусные препараты, то есть не страдают симптомами СПИДа, их биологический возраст все равно обгоняет календарный на 13 лет. Часть этого эффекта можно было бы списать на внешние факторы — например, социальный статус и финансовое неблагополучие, — поэтому Франчески отобрал группу людей, которые ведут похожий образ жизни, но не заражены вирусом. Они оказались старше календарного возраста лишь на 5,5 года. Для проверки своего метода Франчески исследовал группу доноров крови, которые прошли проверки на наличие инфекций и здоровый образ жизни. Доноры оказались в среднем на 7 лет моложе, чем ожидалось.
Получается, что повлиять на биологический возраст могут самые разные патологические состояния, как врожденные (вроде синдрома Дауна), так и приобретенные (например, СПИД). Поэтому Франчески предположил, что болезни и старость ничем принципиально не отличаются: вторая есть лишь концентрат первых. В таком случае борьбу со старостью логично начинать с возрастных болезней: причины те же, методы должны быть те же, но их эффективность отследить гораздо проще. В этом смысле он возвращает нас к медицинскому подходу: предлагает бороться с отдельными болезнями, а не со старостью в целом.
И все-таки они экспериментируют
Для проблемы слишком долгой жизни, которая осложняет наши исследования старения, мы уже придумали несколько решений — можно исследовать крайние случаи или сосредоточиться на скорости старения конкретных людей. Но на этом трудности не заканчиваются.
В природе не существует двух одинаковых живых организмов. Даже две клетки, которые получились в результате симметричного деления, по множеству параметров отличаются друг от друга. Что уж тогда говорить о людях! И если мы хотим узнать, как наша таблетка влияет на биологический возраст, то должны прежде убедиться, что никакие другие факторы на него влиять в ходе эксперимента не будут. Но старение — процесс многогранный, и не всегда ясно, какие именно параметры нам нужно контролировать. Если мышей еще можно посадить в клетку и создать им абсолютно одинаковые условия жизни, то с людьми так не поступишь. Каждый из испытуемых будет жить своей жизнью, непохожей на жизнь соседа, и поди потом пойми, что именно помогло или помешало ему эту жизнь продлить.
Самые показательные эксперименты над людьми пока что поставила история. Классическим примером здесь может служить еще одно исследование, связанное с голоданием, где в роли экспериментатора выступила Первая мировая война, а участниками стали жители Копенгагена, которые страдали от перебоев с поставками продуктов. После войны правительственный советник по продовольствию подсчитал, что люди во время войны умирали на треть реже, чем в довоенное мирное время.
Казалось бы, вот, природа подбрасывает нам готовые результаты эксперимента. Но стоит ли им доверять? В эту ситуацию могло вмешаться множество факторов, которые никто не учитывал. Например, жители города могли испытывать — и наверняка испытывали — повышенный психологический стресс. Или же среди людей, которые остались в городе во время войны, оказалось больше женщин, которые в среднем живут дольше, чем мужчины. А может быть, дело вовсе не в ограничении калорий, а в изменении соотношения каких-то продуктов в рационе.
Получается, что чем старше исследование, тем дольше оно продолжается и тем, казалось бы, больше пользы может нам потенциально принести. Однако чем раньше оно началось, тем дальше оно от стандартов клинических испытаний и тем меньше у нас шансов проверить его качество.
Третья трудность в экспериментах с людьми может поначалу показаться несерьезной, однако порой именно она сильно подводит исследователей. Это капризы испытуемых.
Наглядный пример того, как человеческая природа торжествует над замыслом эксперимента, — проект CALERIE, целью которого была попытка изучить, как влияет ограничение калорийности пищи на людей в реальном времени. Несколько лет назад в рамках этого проекта ученые запустили очередное клиническое исследование: отобрали волонтеров с небольшим избытком веса и расписали для них индивидуальные программы питания. За два года участники эксперимента должны были ограничить свой рацион до 75% от количества ежедневных энергозатрат. При этом исследователи регулярно измеряли разные маркеры их биологического возраста, пытаясь отследить изменения на небольшом отрезке времени.
Но аккуратно спланированный эксперимент столкнулся с непредвиденными проблемами. Как пожаловался один из руководителей проекта на недавней конференции, "испытуемые отказываются так мало есть". За два года они снизили калорийность своего рациона всего на 12% вместо требуемых 25%, то есть осилили всего половину необходимых ограничений. И несмотря на то, что результаты эксперимента оказались скорее позитивными — люди не испытывали серьезных побочных эффектов, зато у них снизился риск сердечно-сосудистых заболеваний, — исследователи все равно не достигли своей цели. И едва ли они в силах это изменить: контролировать все приемы пищи испытуемых и пресекать их поползновения съесть что-то еще в перерывах между завтраком и обедом — задача невыполнимая.
С учетом всех нюансов, которые делают эксперименты с людьми практически невозможными, кажется удивительным, что кто-то их все-таки проводит. Правда, для этого ученым приходится тщательно маскировать исследования старения под настоящие медицинские испытания: то есть проверять свои гипотезы об эффективности таблеток от старости на примере конкретных болезней.
Для начала нужно выбрать какой-то реальный симптом — хорошо, если бы он был как-то связан с возрастом, — например, воспаление суставов, атрофия тимуса (железы, которая производит часть иммунных клеток) или диабет.
Затем нужно подобрать вид лечения, который мог бы стать "таблеткой от старости" и в то же время облегчить течение болезни. Например, сейчас таким образом тестируют сенолитики — препараты, которые убивают старые клетки. А старые клетки вызывают множество патологических процессов, например таких, которые сопровождают сахарный диабет. Поэтому сенолитики нацелены на двух зайцев разом: маленького — диабет, и большого — старение в целом.
Дальше потребуется найти волонтеров и собрать о них максимальное количество данных, чтобы потом можно было исключить влияние их здоровья и образа жизни на ее продолжительность. И в процессе лечения придется следить не только за течением самой болезни-мишени, но и за маркерами биологического возраста, чтобы обнаружить раннее влияние на процессы старения. Так, например, недавно группа ученых проводила исследование по восстановлению тимуса и совершенно неожиданно обнаружила, что испытуемые помолодели (биологически) на пару лет.
Ну и наконец, по окончании исследования хорошо бы не терять испытуемых из вида, чтобы не пропустить отдаленные последствия лечения — вдруг они и правда проживут дольше, как участники Миннесотского эксперимента?
Эта стратегия выглядит беспроигрышной. Если пилотные исследования пройдут успешно, то у нас по меньшей мере появится способ защитить стариков от диабета и воспаления суставов. В то же время мы получим данные о том, как организм пациентов реагирует на эти лекарства, есть ли от них побочные эффекты и какова их безопасная доза. А еще чуть позже увидим, как изменилась продолжительность жизни участников этих исследований.
И даже если первоначальный эксперимент преследовал другие цели (как в случае с Миннесотским экспериментом), то к моменту, когда мы будем (если будем) готовы проводить настоящие исследования настоящих таблеток от старости, мы сможем опереться на результаты предыдущих исследований. А значит, будет проще получить разрешение этических комитетов, убедить инвесторов и привлечь участников.
Таким образом, несмотря на все препятствия, которые мы чиним сами себе на пути к продлению жизни, у нас все же есть идея, как их можно обойти. Правда, даже с помощью этого хитрого плана разработка таблеток от старости займет как минимум десятки лет — что, конечно, меньше, чем 120 лет, о которых мы говорили в начале главы, но больше, чем могут позволить себе многие исследователи и инвесторы.

