8. ВОЗРАСТНЫЕ ЗАБОЛЕВАНИЯ: БЕГ ПО КРУГУ
В моем детстве было много сборников сказок, и среди них — отдельная книжка с итальянскими. Из нее я лучше всего помню сказку про злую судьбу. Начиналось все примерно как в Золушке, но потом кто-то намекнул бедной девочке, что все ее несчастья — от злой судьбы, и надо ее найти и умилостивить, чтобы жить не мешала. Дальше эта девочка долго искала свою судьбу, которая оказалась, как и следовало ожидать, хмурой и злобной старухой. А к концу сказки героине, конечно, удалось ее обаять, отмыть, причесать и превратить в бабушку "божий одуванчик".
Эта история отлично отражает наше отношение ко многим неприятностям — кажется, что все они приходят откуда-то извне и атакуют нас снаружи. Но если в отношении некоторых болезней, например каких-нибудь инфекций или отравлений, это еще может оказаться правдой, то со старением дело обстоит не так просто. Возрастные болезни вырастают изнутри. Каждая из них складывается из множества процессов, которые, будучи в целом полезными, начинают работать в неправильном месте или с неправильной силой. И даже если сами по себе клетки в целом здоровы, и ткани целы, и иммунитет работает, и гормоны на месте, достаточно одной случайной поломки, чтобы все пошло под откос, и чтобы однажды утром, посмотрев в зеркало, девочка обнаружила там ту самую злую судьбу.
Что впереди
Несмотря на то что нам сложно подобрать аккуратное определение старению и четко обозначить время его наступления, мы точно знаем, что бывает в конце. Множество процессов на разных уровнях, о которых мы говорили в предыдущих главах, — от перемещения транспозонов по ДНК до падения концентрации гормонов, от укорочения молекул матрикса до системного воспаления — рано или поздно проявляют себя на макроуровне в виде возрастных заболеваний. Именно они ответственны за стремительное падение кривой выживаемости после определенного возраста и относятся к тем самым "естественным причинам", риск смерти от которых начал измерять Бенджамин Гомперц. Именно от них умирают пожилые люди, в том числе и долгожители. Смерти "от старости" не бывает даже среди самых крепких: в организме каждого человека можно постфактум обнаружить какую-то возрастную болезнь, даже если при жизни он казался здоровым и ему не ставили никаких медицинских диагнозов.
К возрастным заболеваниям относят все те, встречаемость которых растет со временем. Это необязательно самые тяжелые из болезней, которыми страдают пожилые люди. Если мы посмотрим на статистику смертности по естественным причинам, то встретим там, например, сердечно-сосудистые заболевания и деменцию, но не найдем среди этих причин остеопороза и артрита, которыми страдают около половины пожилых людей (по крайней мере, в США). Возрастные заболевания могут встречаться у людей разного возраста: от опухолей и болезней органов дыхания гибнут и молодые люди, и дети, но у пожилых людей их можно найти с большей вероятностью. Иными словами, если мы возьмем всю совокупность больных, скажем, раком или диабетом, то пожилых людей среди них окажется большинство.
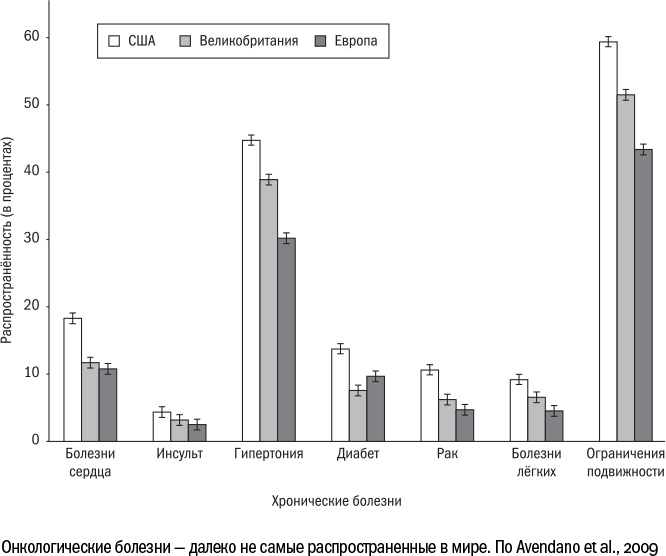
Окончательного списка возрастных болезней не существует, и не всегда понятно, считать ли, например, саркопению (возрастную атрофию мышц) самостоятельной болезнью или симптомом чего-то большего. Тем не менее есть основной круг заболеваний, которые обычно обсуждают в этом контексте. Это сердечно-сосудистые болезни (гипертония, инфаркт, инсульт, сердечная недостаточность, атеросклероз), опухоли, остеопороз (разрушение костной ткани), артрит (воспаление суставов), диабет, нейродегенеративные заболевания и хроническая обструктивная болезнь легких (воспаление, постепенно разрушающее ткань легкого). Именно их мы будем иметь в виду под "возрастными болезнями" в этой и других главах.
Перефразируя предыдущее определение, можно сказать, что возрастное заболевание — это такое, основным фактором риска для которого является возраст. Но одновременно с этим возрастные заболевания ускоряют старение, ведь они увеличивают риск умереть. Возникает замкнутый круг: возрастные болезни появляются вместе со старостью и в то же время сами приближают старость. Что здесь причина, а что следствие?
Ответ, по всей видимости, состоит в том, что и у старения в целом, и у каждого отдельного возрастного заболевания причины общие. В 2014 году международная группа геронтологов (в которую вошли и Клаудио Франчески, и Тони Висс-Кори, который занимается парабиозом и переливанием крови, и Юдит Кампизи, специалист по сенесцентным клеткам) выделила семь столпов, на которых зиждется старение и которые становятся в той или иной степени причинами всех возрастных болезней:
1. Повреждение макромолекул. Все возрастные болезни начинаются с сенесцентных клеток, а старением клеток управляет внутренний мусор. Каждая точечная замена в ДНК, каждый лишний неверно свернутый белок или окисленный липид продвигают клетку в сторону остановки деления и превращения ее в неработающего "злобного соседа".
2. Потеря протеостаза. По аналогии с гомеостазом — постоянством внутренней среды организма, существует понятие "протеостаза" — постоянства состава и функций клеточных белков. Фактически оно означает контроль клеток за сворачиванием белков: клетке приходится следить, чтобы все белки внутри нее принимали необходимую для своей работы форму. Когда этот контроль утрачен, внутри и снаружи клеток начинают образовываться агрегаты из неправильно свернутых белков, что нередко заканчивается гибелью клеток. Мы встретимся с подобной ситуацией в разговоре о нейродегенеративных болезнях.
3. Эпигенетические изменения. По мере того как клетка взрослеет, набор метильных меток на ее нитях ДНК перестраивается. Вместе с этим одни гены приобретают активность, другие теряют — и все это вместе сказывается на работоспособности клетки и ее взаимодействии с соседями.
4. Истощение пула стволовых клеток. Несмотря на то что немногие ткани активно обновляются в течение жизни, с возрастом ремонт требуется всем. И в этот момент становится важным то, что некоторые органы — такие как головной мозг и поджелудочная железа — практически лишены стволовых клеток и не могут поддерживать полноценную работу. В других же тканях, где запасы значительны, как в коже и крови, стволовые клетки не столько исчезают, сколько меняют свои свойства. Например, теряют способность дифференцироваться в том или ином направлении, склоняются к симметричному делению и утрачивают разнообразие, уступая место клонам. Все это оказывается препятствием для починки возрастных повреждений, будь то поверхностная рана, инфаркт (гибель части клеток сердца) или нейродегенерация.
5. Изменение метаболизма. Нам еще предстоит подробно поговорить о роли, которую обмен веществ на уровне каждой отдельно взятой клетки играет в процессах старения, в следующей части книги. Но и в предыдущих главах я уже упоминала об изменениях в обмене веществ, которые возникают с возрастом — например, накопление жирных кислот и глюкозы в крови — и влекут за собой воспаление и прочие неприятности.
6. Воспаление. Какую бы возрастную болезнь мы ни взяли, везде найдутся следы воспаления. Некоторые вызваны им напрямую (например, артрит или хроническая обструктивная болезнь легких), другие связаны с ним опосредованно — через старение клеток или изменение концентрации гормонов (например, диабет или остеопороз). Так или иначе, любая часть старого организма вынуждена жить в условиях перманентного воспаления.
7. Адаптация к стрессу. Многие возрастные изменения в тканях или физиологии, которые со стороны могут показаться разрушительными, являются лишь реакцией на другие изменения. Например, разрастание стенки сердца, которое лишает его способности сильно сокращаться и ведет к сердечной недостаточности, возникает как компенсация гипертонии (чтобы желудочек не разорвался под давлением крови). А увеличение количества провоспалительных маркеров — лишь следствие прогрессирующей гибели клеток в тканях и накопления мусора.
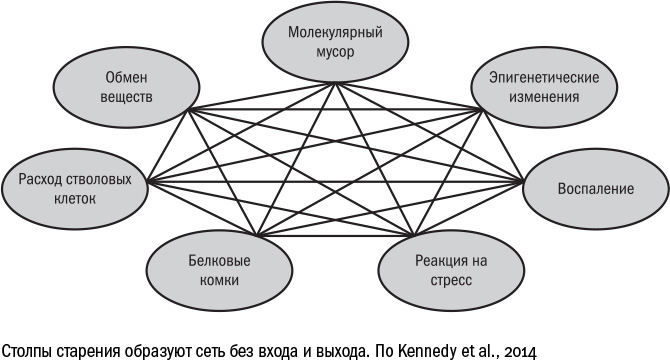
Подобно тому, как старение вытекает из возрастных болезней и через них же проявляется, семь столпов тоже образуют замкнутый круг. Каждый из них связан со всеми остальными, и получившаяся система не имеет ни входа, ни выхода. Поэтому сложно сказать, какая из этих семи колонн несущая — судя по всему, бремя старости распределено по ним равномерно, а единого виновника всех невзгод попросту не существует. Зато у этого списка причин есть важная функция: он одновременно является перечнем критериев, по которому можно определить, насколько то или иное заболевание связано со старением. Например, рак или диабет удовлетворяют большинству этих пунктов, а депрессия — нет. Поэтому, несмотря на распространенность депрессии среди пожилых людей, ее нельзя считать возрастной болезнью, а скорее, побочным эффектом других заболеваний.
Знакомьтесь: болезнь Альцгеймера
Среди множества возрастных болезней я выбрала одну, которая будет служить нам наглядным примером. Остальные, как бы сильно они ни различались по своим проявлениям, развиваются по тем же законам.
Наша модельная болезнь не самая распространенная: от нее страдает примерно 4,5% москвичей в возрасте от 65 до 74 лет и каждый третий американец старше 85 лет. Но хоть болезнь Альцгеймера поражает меньше людей, чем атеросклероз или диабет, исследуют ее не менее интенсивно, а спорят о ней гораздо серьезнее. Дело в том, что от нее до сих пор нет лекарства. Немногие зарегистрированные препараты лишь смягчают симптомы, но не останавливают ее прогрессию. Именно поэтому спор о причинах и механизмах болезни Альцгеймера идет острее, чем о других возрастных заболеваниях. И в конечном счете этот спор сводится к тому, можем ли мы в принципе победить возрастную болезнь или только свести к минимуму ее проявления.
Вкратце болезнь Альцгеймера выглядит так: в ткани головного мозга образуются амилоидные бляшки — агрегаты короткого белка бета-амилоида. Эти скопления токсичны для нейронов и разрушают связи между ними, а затем и сами клетки. Начинается нейродегенерация. Сильнее всего страдают нейроны, специализирующиеся на выделении ацетилхолина — это одно из веществ (нейромедиаторов), с помощью которых нервные клетки передают друг другу сигналы. Ацетилхолин участвует в процессах внимания, мышления и памяти. Поэтому, когда его не хватает, развиваются характерные расстройства (деменция): афазия (потеря связности речи), апраксия (утрата простых бытовых навыков вроде завязывания шнурков или чистки зубов) и агнозия (трудности в распознавании предметов и людей).
Именно на эти симптомы нацелены современные препараты против болезни Альцгеймера: они блокируют ферменты, расщепляющие ацетилхолин в мозге, и таким образом повышают его концентрацию. Но потерянные нейроны уже не вернуть, и человек постепенно теряет контроль за собственным телом. Поэтому вслед за болезнью Альцгеймера часто тянутся и другие возрастные патологии вроде сердечной недостаточности или саркопении.
Болезнь Альцгеймера — далеко не единственная возможная причина нейродегенерации и деменции. В большой семье нейродегенеративных заболеваний несколько десятков разных патологий. Одни, такие как рассеянный склероз или боковой амиотрофический склероз — тот самый, которым болел Стивен Хокинг, начинаются с дегенерации и повреждения периферических нервов. Другие атакуют мозг напрямую — например, алкогольная энцефалопатия — и сразу вызывают деменцию. Болезнь Альцгеймера находится на перекрестке этих множеств, где нейродегенерация и деменция встречаются одновременно. Вместе с ней на этом перекрестке расположены болезнь Паркинсона, прионные заболевания и другие менее известные синдромы. Некоторые из них даже объединяют в себе несколько болезней разом, например западно-тихоокеанский комплекс из паркинсонизма, деменции и бокового амиотрофического склероза (в соответствии с названием он встречается только на западном побережье Тихого океана, от Индонезии до Японии).
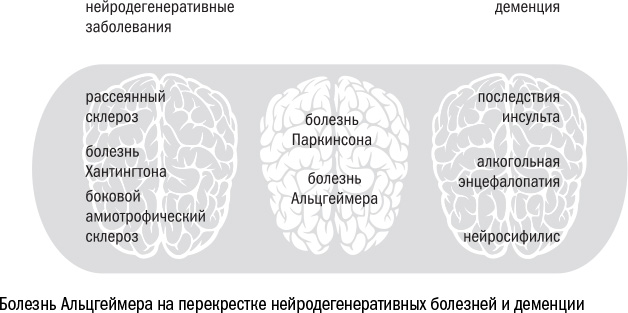
Все эти многочисленные болезни отличаются друг от друга несколькими особенностями. Во-первых, местом начала дегенерации. Болезнь Альцгеймера начинается, как правило, в нейронах гиппокампа (область мозга, отвечающая среди прочего за память), а стартовой точкой для болезни Паркинсона становятся клетки черной субстанции (область мозга, которая контролирует в основном моторику). От очага дегенерации зависит, как именно проявит себя деменция: в виде проблем со вниманием, памятью или настроением.
Второе важное отличие — в белках, которые возникают в клетках и межклеточном веществе. В ходе болезни Альцгеймера в тканях накапливается бета-амилоид и белок тау, при болезни Паркинсона — белки тау и альфа-синуклеин, многие другие виды деменции тоже сопровождаются отложением тау-белка.
Множество сочетаний "тип белка + пораженная область нервной системы" рождает целую палитру нейродегенеративных деменций. Вместе это семейство становится серьезной угрозой для человечества: по оценкам ВОЗ, сегодня деменцией страдает около 36 миллинонов человек в мире, а к 2050 году станет больше 115 миллионов, поскольку средняя продолжительность жизни неуклонно растет. Однако 60–70% всех случаев деменции завоевала себе именно болезнь Альцгеймера, потеснив на этом фронте своих братьев и сестер.
Чем именно так примечательна болезнь Альцгеймера, до сих пор не вполне ясно. Возможно, дело во множестве факторов риска, которые усиливают вероятность того, что человек ею заболеет. Сегодня мы знаем столько этих факторов, что достоверно спрогнозировать развитие болезни невозможно. Среди них и возраст, и пол, и некоторые мутации, а еще гипертония, ожирение, синдром Дауна, травмы головного мозга и социальная пассивность. Ниже мы попробуем найти общую нить, которая связала бы с болезнью Альцгеймера каждый из них.
В начале были белки
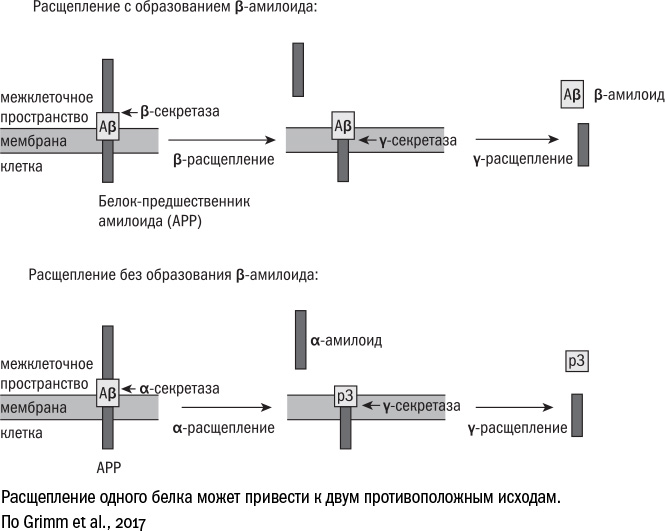
Каскад болезни Альцгеймера начинается с белка АРР (amyloid precursor protein). Он пронизывает мембраны многих клеток организма, например встречается даже в жировой ткани, но больше всего его на нейронах. Точные функции АРР мы до сих пор представляем себе смутно. Судя по всему, основная роль этого белка — сигнальная. Время от времени ферменты α-секретаза (строго говоря, это не один фермент, а целая группа) и γ-секретаза (тоже большой молекулярный комплекс) отрезают от АРР внеклеточную часть, которая уплывает в межклеточное пространство. Ее называют альфа-амилоидом, а служит она сообщением для окружающих клеток: призывает стволовые клетки к дифференцировке и способствует образованию связей между нейронами. В общем, сам по себе белок АРР полезен и для клеток жизненно необходим. Даже коварные опухолевые клетки отказываются размножаться, если отключить в них ген АРР.
Но иногда вместо α-секретазы за дело берется β-секретаза — похожий фермент, который разрушает молекулу АРР в другом месте. И когда γ-секретаза совершает последний надрез, от АРР отделяется бета-амилоид. Но, поскольку это не полноценный белок, а в некотором смысле "неправильный", он сворачивается не так, как внеклеточная часть АРР, и может вместо этого принимать самые разные формы. На поверхности бета-амилоида то и дело оказываются "липкие" части, которыми он соприкасается с другими молекулами и образует нерастворимые агрегаты — амилоиды, которые затем дорастают до крупных бляшек. В присутствии бета-амилоида нейроны постепенно гибнут, теряя связи друг с другом; смерть клеток провоцирует воспаление, а оно лишь усиливает нейродегенерацию.
Бета-амилоид может не только слипаться с другими частицами бета-амилоида, но и провоцировать их "неправильное" сворачивание. Как только несколько молекул принимают характерную форму, они собираются в комок и стимулируют окружающие молекулы принять такую же форму и примкнуть к ним. Таким образом, бета-амилоид оказывается "заразен", а комки его распространяются по мозгу как снежный ком.
Заразным может оказаться и второй белок — примета болезни Альцгеймера: тау-белок. Его основная функция — удерживать от распада клеточный скелет. Тау скрепляет "рельсы", по которым вещества путешествуют вдоль длинных отростков нейронов. Когда на клетку действует бета-амилоид или другие стрессовые факторы, на тау-белок навешивается фосфатная группа, чтобы разрушить и перестроить цитоскелет. Если таких фосфорилированных молекул тау становится много, они тоже слипаются и вызывают агрегацию соседей. Образуются нейрофибриллярные клубки — еще один снежный ком, только внутри клеток, а не снаружи.
Таким образом, в мозге каждого отдельно взятого больного разворачивается эпидемия: и бета-амилоид, и тау постепенно захватывают все больше пространства нервной ткани. Теоретически болезнь Альцгеймера могла бы быть заразна и в бытовом смысле этого слова: если бы комки амилоида из мозга больного человека попали в кровь или мозг его здорового соседа. И один такой случай уже известен.
В середине прошлого века врачи придумали новый способ лечить задержку роста. Людям вводили в кровь гормон роста, который добывали из измельченного гипофиза мертвых доноров. Как оказалось позже, помимо гормона роста эти препараты содержали еще и бета-амилоид. В результате у многих пациентов, которые прошли это лечение, позже развилась болезнь Альцгеймера. Потом ученые повторили этот эксперимент на мышах и подтвердили: пересадка бета-амилоида вызывает болезнь Альцгеймера. К счастью, сейчас эту методику лечения больше не используют, а других столь же тесных контактов с мозгом больного в жизни обычных людей не возникает.
Эффект бабочки
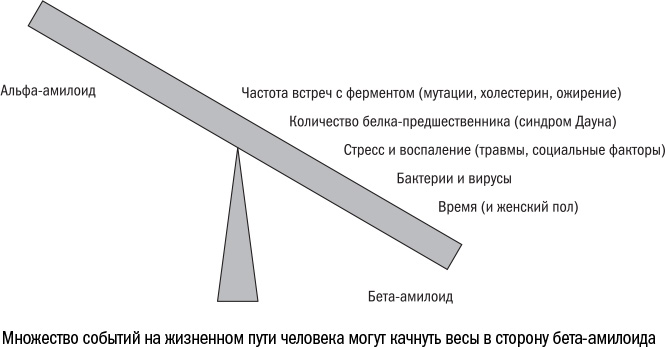
Составив молекулярный портрет болезни Альцгеймера, мы можем теперь разобраться в том, откуда берется то множество факторов, которые повышают шансы ею заболеть. На самом деле, при всем разнообразии все они бьют в одну и ту же точку: смещают равновесие между альфа- и бета-амилоидом в тканях мозга.
В некотором смысле судьба человека зависит от того, кто займется расщеплением АРР, α- или β-секретаза. Обе всегда на подхвате, в межклеточной жидкости мозга они присутствуют постоянно, вопрос только в том, кто успеет раньше или кого окажется больше. Как правило, α-секретаза приходит первой, а β-секретазе достается меньше белков АРР, и тогда мозг остается здоровым. Но факторы риска так или иначе перетягивают чашу этих весов в противоположную сторону.
Например, некоторые мутации. Они могут возникнуть в самом гене белка АРР или в генах ферментов, которые составляют β-секретазу. В любом случае они влияют на то, насколько хорошо АРР и β-секретаза прилипают друг к другу. Чем выше их сродство, тем чаще они будут встречаться и тем больше будет образовываться бета-амилоида.
Следующий фактор, который наклоняет весы в сторону болезни Альцгеймера, — избыток белка АРР на поверхности клеток. Это происходит, например, у людей с синдромом Дауна. Ген АРР находится на той самой злополучной 21-й хромосоме, которая у них есть в лишнем экземпляре. И, поскольку клетки таких людей производят в полтора раза больше АРР, чем положено, половина из них заболевает Альцгеймером в течение жизни.
Похожим образом на судьбу человека влияет еще одна важная мутация, которая связана с болезнью Альцгеймера, — в гене АРОЕ. По некоторым подсчетам, около 65% больных несут в себе хотя бы одну копию этого мутантного гена. Белок АРОЕ отвечает в организме за обмен и транспорт холестерина. А холестерин, в свою очередь, встраивается в мембраны клеток и делает их жестче и прочнее. Кроме того, он удерживает мембранные белки на фиксированных позициях, и один из этих белков — АРР. Таким образом, холестерин повышает шансы β-секретазы подобраться к своей жертве. Возможно, именно поэтому болезнь Альцгеймера часто возникает при ожирении, когда холестерина в крови больше, чем обычно.
Получается, что иногда клетки случайным образом, по воле мутации, производят слишком много бета-амилоида. Но могут ли они делать это специально? До сих пор мы говорили лишь о вреде, который бета-амилоид причиняет ткани. Но если β-секретаза и бета-амилоид существуют, значит, это кому-нибудь нужно. Было бы странно, если бы в нашем мозге работал заведомо разрушительный механизм. А польза от него на самом деле есть.
Например, известно, что бета-амилоид способен уничтожать свободные радикалы в клетках. Поэтому β-секретаза активнее работает в условиях окислительного стресса. Этот механизм объясняет, как болезнь Альцгеймера связана с травмами головного мозга или социальной пассивностью. И то и другое сопровождается выделением провоспалительных белков, воспаление повышает количество свободных радикалов в нервной ткани, а ответом на них уже становится бета-амилоид.
Кроме активных форм кислорода, бета-амилоид отличается особой жестокостью и по отношению к бактериям. Налипая на их поверхность, он нейтрализует вещества, с помощью которых они отбиваются от иммунной атаки, и тем самым ускоряет их гибель. В мозге больных Альцгеймером нередко обнаруживают микроба Porphyromonas gingivalis, поэтому некоторые ученые считают этих бактерий фактически возбудителями болезни. Свою лепту в образование амилоидных бляшек вносят и вирусы, в частности герпес. Несмотря на то что бета-амилоид никак не влияет на жизнь вирусных частиц, они могут становиться центром его агрегации, поскольку на их поверхность всегда налипает множество внеклеточных белков.
Таким образом, запустить развитие болезни Альцгеймера может практически все что угодно. И поэтому еще одним важным фактором риска становится возраст. Чем дольше человек живет, тем больше шансов встретиться у АРР и β-секретазы. Так же можно объяснить и то, почему болезнью Альцгеймера чаще страдают женщины — они просто в среднем дольше живут.
Чем больше времени проходит, тем выше вероятность, что в жизнь мозга вмешаются еще какие-нибудь события: травма, воспаление, стресс, заражение вирусом или размножение бактерий. Застраховаться от них невозможно, особенно учитывая, что многие из этих факторов риска очень распространены. Бактерия Porphyromonas, которая стала изначально известной благодаря вызываемому ей периодонтиту (воспалению связок, удерживающих зуб в десне), встречается у каждого четвертого человека в составе здоровой микрофлоры рта. А герпесом, по последним данных, заражены около 70% людей. С этой точки зрения в зоне повышенного риска развития болезни Альцгеймера оказывается почти каждый из нас. И когда мы начинаем искать пути ее лечения, ситуация становится еще сложнее.
Битва со спрутом
Подкрадываться к многоликому и неуловимому противнику можно с разных сторон. Одна стратегия — поразить его на подходе, еще до того, как начнется гибель нервных клеток. Здесь могла бы помочь, например, генная терапия: можно было бы вырезать у пациентов "рискованные" варианты гена АРОЕ. Другой вариант — уничтожать патогенов, которые провоцируют выделение амилоида, вроде Porphyromonas gingivalis. Первый метод еще находится в разработке, второй уже тестируют на пациентах с мягкой формой болезни Альцгеймера.
Но можно зайти и с другого конца и бороться с последствиями, раз уж мы не можем предугадать возникновение болезни. Так, собственно, и действуют современные лекарства от болезни Альцгеймера: они не предотвращают гибель клеток и дегенерацию, а лишь смягчают симптомы. Аналогичный подход пытается разработать Тони Висс-Кори, который начал тестировать переливание больным плазмы крови от молодых доноров в надежде на то, что GDF11 или какие-то другие "молодящие" вещества заставят нервные клетки больных размножаться. Наконец, можно бороться непосредственно с амилоидом, так или иначе настраивая против него иммунную систему, например вакцинируя пациентов его фрагментами.
Тем не менее ни один из этих подходов пока не сработал до конца. Многие компании, занимающиеся разработкой лекарств (в том числе крупнейшие — Merck, Pfizer, Roche), уже капитулировали перед врагом. На плаву держатся лишь небольшие стартапы, чьи продукты, впрочем, пока не вышли за пределы клинических испытаний. В чем же проблема? Пусть мы не воссоздали пока подробную картину заболевания, но все же примерно представляем куда стрелять. Почему мы допускаем осечку за осечкой? Одно из возможных объяснений состоит в том, что у болезни Альцгеймера слишком много причин. Удаляя амилоид, мы не мешаем его накоплению. Сражаясь с бактериями, мы упускаем из вида вирус герпеса и холестерин. Но как одним ударом обрубить все головы этой гидры?
Важный шаг в этом направлении сделал американский врач Дейл Бредесен, автор книги "Нестареющий мозг" (The end of Alzheimer's, дословно "Конец Альцгеймера"). Он предположил, что болезнь Альцгеймера — это несколько разных патологий с общими проявлениями. Бредесен разработал свою методику, согласно которой необходимо сначала определить, каким именно типом болезни страдает пациент: вызвана ли она стрессом, воспалением или дистрофией (истощением пула клеток) нервной ткани. В зависимости от этого Бредесен предлагает выбрать протокол лечения, чтобы устранить причину болезни данного конкретного пациента. Группа, которая работала по этой методике, уверяет, что смогла обратить вспять деменцию у сотни пациентов. Впрочем, клинических испытаний эта терапия еще не прошла, поэтому говорить о ее эффективности пока рано.
Но есть и другое возможное объяснение тому, что крестовый поход против болезни Альцгеймера раз за разом проваливается. Быть может, дело в том, что, пытаясь запретить клеткам производить бета-амилоид, мы забываем о том, что он выполняет в нервной ткани определенные функции. Например, защищает ее от бактерий и свободных радикалов. Если полностью лишить клетки бета-амилоида, кто будет справляться с окислительным стрессом?
Кроме того, некоторые ученые подозревают, что бета-амилоид помогает очищать нервную ткань от слабых клеток, то есть фактически является оружием в конкурентной борьбе между клетками. Помните историю с португальскими исследователями, которые экспериментировали с мушиным аналогом болезни Альцгеймера? Они отключили в нервных клетках белки, которые отвечают за конкуренцию, а нейродегенерация только усилилась. Чтобы восстановить работу мозга, им пришлось снова разрешить клеткам гибнуть в честном бою. Не исключено, что подобные процессы идут и в человеческом мозге. Пытаясь спасти клетки от пагубного влияния бета-амилоида, мы позволяем выживать слабым сенесцентным клеткам, которые тянут за собой назад и остальные.
При ближайшем рассмотрении болезнь Альцгеймера оказывается не похожа на болезнь в классическом понимании этого слова. Это не отклонение и не патология, а результат действия тех самых механизмов, которые поддерживают нервную ткань в здоровом состоянии. Бета-амилоид, как настоящий литературный злодей, оказывается не просто ангелом в душе, но еще и неотъемлемой частью хрупкого мира, который он терроризирует. Именно поэтому мы не можем позволить себе избавиться от него совсем или разглядеть его приближение издалека.
Бег по кругу
Как бы ни была страшна болезнь Альцгеймера, другие возрастные заболевания недалеко от нее ушли. На первый взгляд они могут показаться совсем разными и непохожими друг на друга, но все они, так или иначе, непобедимы, потому что развиваются по одним и тем же законам. И образ многоголового монстра, который мы нарисовали на примере болезни Альцгеймера, подойдет к любому из старческих недугов.

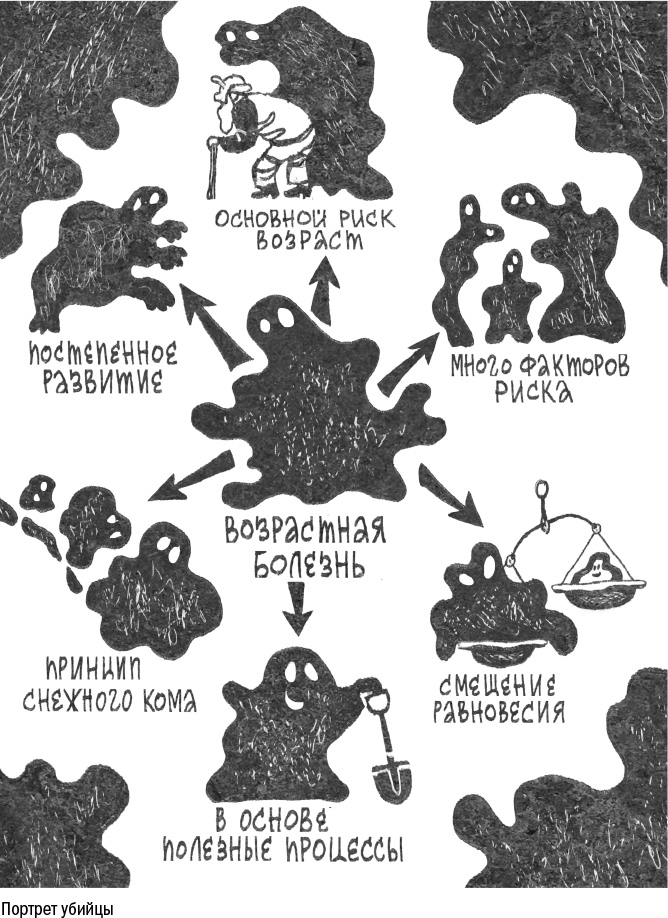
В основе любой возрастной болезни лежат хотя бы несколько из семи столпов старения. Хроническая обструктивная болезнь легких вызвана гибелью клеток из-за воспаления и нехваткой стволовых клеток для ремонта ткани. Болезни Альцгеймера и Паркинсона развиваются за счет накопления белковых агрегатов, которые изначально служили адаптацией к стрессу. Диабет и рак связаны с изменением обмена веществ — клетки организма оказываются лишены основного источника энергии, но в первом случае они теряют способность захватить глюкозу из крови, а во втором им ее просто не достается.
Причин у любой возрастной болезни всегда несколько. Главной всегда является возраст, потому что он дает время проявиться всем остальным. Среди них всегда есть генетические факторы, поскольку мутации создают "слабые звенья" в цепи, которым проще сломаться. В них всегда так или иначе участвует иммунитет: воспаление, которое может возникнуть по множеству поводов, будь то ожирение, атака патогена или аутоиммунная реакция, провоцирует старение клеток, а те, в свою очередь, постепенно разрушают ткань.
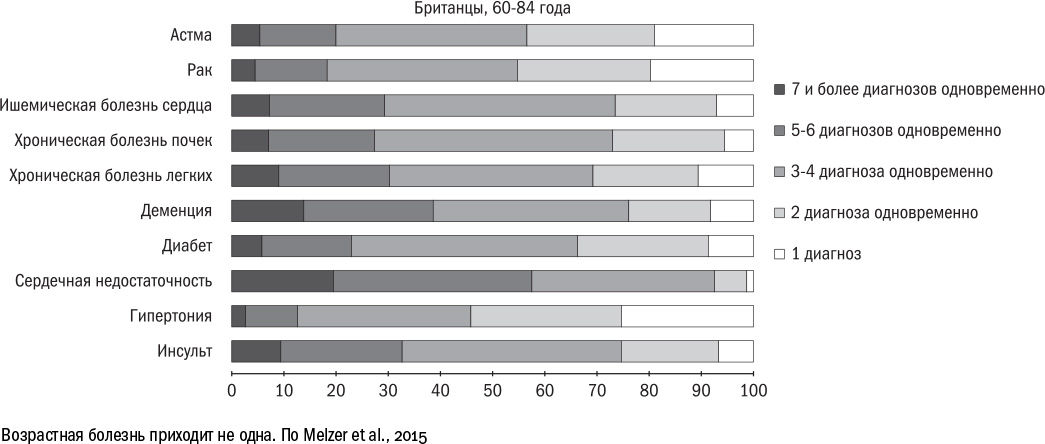
Именно поэтому многие возрастные болезни возникают одновременно и хорошо уживаются в одном организме. По подсчетам британских медиков, среди людей от 60 до 84 лет почти 40% страдают двумя-тремя заболеваниями, около 20% — четырьмя-пятью и меньше 10% — пятью-шестью. После 85 лет четыре-пять болезней одновременно мучают уже 30% людей, а пять-шесть — почти 20%. Правда, из этого правила есть исключения, например болезнь Альцгеймера редко встречается вместе с опухолями. О хитрых особенностях рака мы еще поговорим в отдельной главе в следующей части, а остальные наблюдения лишь подтверждают правила: при болезни Альцгеймера в клетках работают те же сигнальные пути, что и при остеопорозе, а повышенный уровень глюкозы в крови не только усиливает диабет, но и провоцирует воспаление в стенках сосудов, вызывая атеросклероз.
Все возрастные болезни начинаются со смещения равновесия. В их основе лежит какой-то физиологический процесс или химическая реакция, которые меняют свое направление, и то, что раньше случалось редко, начинает происходить постоянно. При болезни Альцгеймера нейроны начинают производить бета-амилоид вместо альфа-амилоида. В начале образования опухоли рушится баланс между делением и покоем клеток. Аутоиммунные заболевания вроде артрита возникают, когда провоспалительных белков становится больше, чем противовоспалительных.
Каждое такое небольшое отклонение от равновесия запускает петлю положительной обратной связи. Чем больше бета-амилоида между клетками, тем сильнее их стресс и тем больше они его производят. Чем чаще клетки умирают, тем больше образуется продуктов их распада, тем сильнее воспаление и тем больше клеток продолжает умирать. Для любой возрастной болезни можно найти такой порочный круг как на уровне отдельных химических реакций, так и на уровне клеток и целых тканей. Масла в огонь подливают другие возрастные болезни, сосуществующие в одном теле. Старение организма в этом смысле представляет собой набор замкнутых кругов, которые взаимно разгоняют и усиливают друг друга.
Тем не менее все эти процессы — лишь непомерно разросшиеся здоровые физиологические механизмы. Активное деление клеток нужно организму, чтобы заживлять раны, но может привести к образованию опухоли. Воспаление в легких важно, чтобы бороться с загрязнениями и паразитами, но с возрастом разрушает ткань и приводит к хронической обструктивной болезни и фиброзу. Снижение чувствительности к инсулину необходимо, чтобы всем клеткам в организме хватило глюкозы, но в условиях избытка пищи оно приводит к диабету.
Поскольку в основе у них лежат полезные процессы, возрастные болезни можно рассматриваться не как разрушение, а как перестройку. Теория старения как перестройки Клаудио Франчески (remodelling theory of aging) возникла сначала для описания возрастных изменений в иммунной системе: он предложил воспринимать хроническое воспаление как процесс адаптации. Но эту теорию можно распространить и на все остальные процессы стареющего организма. С возрастом то тут, то там накапливаются изменения и микроскопические сдвиги равновесия. Клетки пытаются их компенсировать — начинают делиться, производить бета-амилоид или запускают воспаление. Но чем больше изменений, тем сильнее реакция на них — и в какой-то момент деление клеток, производство белков и воспаление выходят из-под контроля. Таким образом, то, что начинается как адаптация и попытка подстроиться под изменчивые условия, не справляется с ситуацией и ускоряет деградацию системы.
Именно поэтому так сложно вылечить эти болезни раз и навсегда. Запретить, заблокировать и разрушить можно только заведомо патологический процесс, но эти процессы по природе своей адаптивны. Так что большинство возрастных болезней мы не можем обратить вспять, остается только пробовать снять симптомы. А дальше успех лечения зависит от того, насколько сложно нам компенсировать работу пораженного органа: например, заставить клетки усваивать глюкозу проще, чем стимулировать работу дегенерирующего мозга, поэтому болезнь Альцгеймера может казаться страшнее, чем диабет.

