3. ТКАНИ: БОРЬБА КЛАНОВ
Все курсы актерского мастерства, которые я видела, начинались с упражнений на коллективную импровизацию. Преподаватель задает некоторое общее обстоятельство, например "вы в секции бокса" или "вы на похоронах". Каждый из студентов, не совещаясь с другими, выбирает для себя роль и молча импровизирует в ее рамках, стараясь при этом вписаться в общий контекст. Если все студенты смогли найти себе занятие и при этом взаимодействуют друг с другом, то для стороннего зрителя сцена обретает смысл и силу, — и тогда задание выполнено успешно.
Говорят, эти упражнения давал своим актерам еще Станиславский. И однажды он сообщил ученикам: "Ваш банк горит!" Актеры тут же забегали, держась за голову, и только один продолжал неспешно прогуливаться по сцене.
Когда его спросили, почему он так спокоен, он ответил: "А мои деньги в другом банке", — и тут же стал поучительным примером. Именно такие, как он, сурово объясняют преподаватели, ослабляют и разрушают сцену. Действия всей остальной группы теряют смысл, когда хотя бы один из участников выходит из игры.
Примерно то же самое происходит с клетками в стареющей ткани. Все они заложницы одного и того же обстоятельства — неумолимого течения времени, но каждая выживает в них по-своему, а вместо фантазии у них — уникальные мутации в ДНК. Одни стареют, другие умирают, третьи остаются на плаву, но даже им не всегда удается выжить и продолжить свое дело. Ткань работает до тех пор, пока все клетки преследуют общую цель. Но как только кто-то один — например, будущая раковая клетка — начинает играть по другим правилам и избегает смерти, ткань постепенно разваливается и перестает выполнять свои функции, а за ней по кирпичикам рассыпается и остальной организм.
Кому помогают стены
Жизнь клеточной коммуны в значительной степени определяется декорациями, в которых существуют ее участники, а именно межклеточным веществом (внеклеточным матриксом). Эта трехмерная сеть, которая состоит из молекул примерно трехсот типов, формально служит лишь гнездом для клеток, но оказывается иногда даже более влиятельной, чем ее живые обитатели. Именно от нее зависит, будут ли клетки сотрудничать друг с другом или развернут гражданскую войну.
Опору матрикса составляют каркасные белки. Это толстые нити, которые, сплетаясь в сети, придают ткани форму и прочность, как пружинные каркасы в старых кроватях. Самый известный из этих белков — коллаген, он отвечает за механическую устойчивость ткани. Другой — эластин — способен скручиваться и раскручиваться обратно и позволяет всей конструкции растягиваться. В зависимости от того, какого каркасного белка больше, ткань может быть более жесткой, как, например, кость, или тянущейся, как кожа.
К каркасу крепится вторая составляющая межклеточного вещества, которая служит для клеток мягким матрасом. Это протеогликаны — белки с длинными углеводными "хвостами", — которые заполняют бóльшую часть пространства между клетками. Молекулы углеводов хорошо притягивают к себе воду и превращаются в слизь. На самом деле, все типы слизи, которые мы встречаем в живых организмах — на коже лягушки или в носу человека, — образованы такими углеводными нитями. Протеогликаны не исключение: они притягивают к себе множество молекул воды и превращаются в слизистое желе, на котором, как на подушке, лежат клетки.
Протеогликановое желе служит амортизатором для хрупких органов. А большое количество воды в ткани может сделать ее прочной и практически несжимаемой — именно это происходит с хрящом, который на молекулярном уровне похож на пакет с водой. В то же время протеогликаны создают вокруг клетки водную среду: между их слизистыми нитями могут свободно перемещаться питательные вещества, газы и сигнальные молекулы. Самый известный протеогликан и обладатель самых длинных цепей — гиалуроновая кислота, та самая, которую часто используют в косметологии, как раз для того чтобы создать "подушку" под провисшей кожей. Не столь популярны, но знакомы всем любителям спорта три протеогликана размером поменьше: хондроитинсульфат, дерматансульфат и гепарансульфат. Их много в хрящевой ткани, поэтому врачи их назначают для восстановления поврежденных суставов.
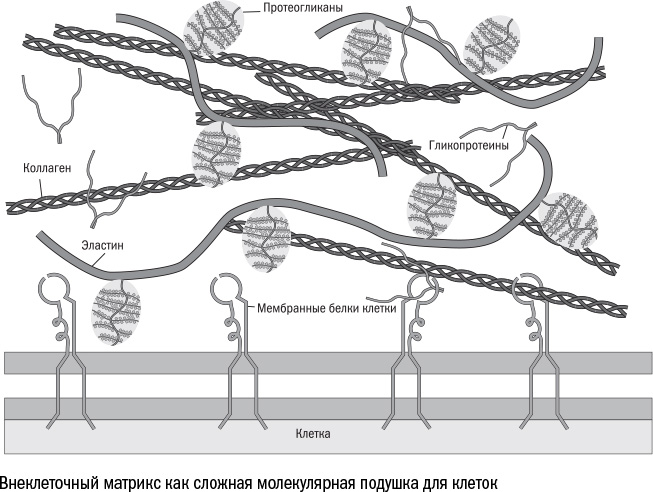
Из этого базового набора молекул можно собрать разные варианты матрикса "под запрос". Если нам нужно жесткое межклеточное вещество, как в кости, берем много коллагена, мало эластина, совсем мало протеогликанов и покрываем коллагеновые нити кристаллами фосфата кальция. Если нужна мягкая прослойка между внутренними органами, добавляем побольше протеогликанов и эластина. Если требуется упругий хрящ, делаем ставку на протеогликаны.
Чтобы удерживаться внутри межклеточного вещества, клетки цепляются своими поверхностными молекулами за его нити. И это дает матриксу возможность непосредственно передавать сигналы своим обитателям и направлять их жизнь. Так, например, от матрикса зависит судьба стволовых клеток соединительной ткани: если посадить их на подложку разной жесткости, они могут превратиться в жировую ткань (если матрикс мягкий), или в мышечную (если более прочный), или в костную (если совсем жесткий).
Работает это приблизительно так: клетка "ощупывает" матрикс с помощью мембранных белков, к которым изнутри крепится клеточный скелет (цитоскелет) — внутренний белковый каркас клетки. Этот скелет, в свою очередь, связан с мембраной клеточного ядра, внутри которого есть собственный белковый каркас, ядерный скелет. А на ядерном скелете, как белье на веревке, развешаны нити ДНК. Когда внеклеточный матрикс натягивается, клетка изменяет форму, чтобы компенсировать возникшее напряжение. Это вызывает перестройку внутриклеточного, а затем и внутриядерного скелета — в результате одни участки ДНК (и гены, расположенные на них) становятся легко доступными для прочитывания, а другие отодвигаются в сторону. Так изменения в натяжении межклеточных волокон приводят к тому, что клетка начинает пользоваться новыми генами и выбирает себе новую профессию.
Кроме того, матрикс может запретить клетке размножаться — если в ткани нет свободных мест и все затянуто белковыми волокнами. А может и, наоборот, подстегнуть ее к делению: если внеклеточные нити распадаются на мелкие кусочки, например после травмы, то это сигнал о том, что в ткани появился пробел, который необходимо заполнить. Протеогликаны вместе с водой накапливают в своей слизи множество сигнальных веществ — факторов роста, про- и противовоспалительных белков и гормонов. Когда протеогликановая сеть разрушается, сигнальные вещества высвобождаются и действуют на клетки, а те, в свою очередь, начинают деление.
Таким образом, клетка внутри организма полностью зависима от своего микроокружения, или ниши, — межклеточного вещества и ближайших соседей. В разлуке со своей нишей многие клетки теряются и начинают вести себя непривычным образом. Например, кроветворные стволовые клетки сохраняют свои способности только в красном костном мозге. Если их оттуда вытащить и оставить, скажем, плавать в крови или поместить в другой орган, они могут начать неконтролируемо размножаться или превращаться в другие клеточные типы. То же происходит и с опухолевыми клетками. Когда они расселяются по организму (метастазируют), они приживаются далеко не в каждом месте, а только там, где попадается подходящая ниша — например, с достаточно мягким матриксом, который позволяет свободно размножаться и ползать. С возрастом связь клетки и ниши не теряется: когда матрикс деградирует, клетки стареют вслед за ним.
На руинах
С течением времени внеклеточный матрикс, как и любые другие макромолекулы, становится жертвой незапланированных химических реакций. Самая распространенная среди них — это гликирование, взаимодействие белков с сахарами. Мы уже встречались с этим процессом на внутриклеточном уровне, но для матрикса это куда более серьезная проблема. Сахарные сшивки между молекулами делают матрикс жестче, и деформированные белковые нити хуже взаимодействуют друг с другом. Такой матрикс легче сломать, а клетки хуже воспринимают его сигналы.
Восстановить поврежденный матрикс очень непросто. Это типичное проявление проблемы "тела на выброс" (о которой мы говорили применительно к клеточному мусору), с которой сталкивается любой многоклеточный организм. Клетка в силу своей способности размножаться может так или иначе решить проблему утилизации мусора. А матрикс — хоть и влиятельная, но неживая структура, которая не может обновляться самостоятельно. Как только организм строит себе внеклеточный скелет — что, конечно, прочно и выгодно, — его срок жизни начинает напрямую зависеть от сохранности скелета. И встает вечный вопрос многоклеточных существ: на что потратить энергию — на размножение или ремонт своей несущей конструкции?
Постройкой и починкой матрикса занимаются клетки, которые в нем живут. Более того, для некоторых из них это единственная задача. Так работают, например, фибробласты — клетки волокнистой соединительной ткани, из которой построены внутренние слои кожи, прослойки между органами, суставные связки и частично стенки сосудов. В их должностные обязанности входит: размножаться, расползаться по ткани и производить молекулы матрикса. Повзрослев, они перестают делиться и становятся либо фиброцитами, которые поддерживают матрикс в рабочем состоянии, либо фиброкластами, которые разрушают поврежденные участки ткани.
Но и эти клетки стареют. А значит, их митохондрии работают все хуже, и запасов энергии не хватает даже на поддержание внутреннего спокойствия, не говоря уж о внешнем. Несмотря на то что каркасные белки матрикса и без того обновляются редко — время полужизни молекулы коллагена в коже составляет около 15 лет, — стареющие клетки производят его все меньше и меньше. Вместо этого они выделяют белки SASP ("вредные советы"), среди которых немало ферментов для разрушения матрикса. Поэтому длинные белковые нити с возрастом замещаются более короткими, хаотично сшитыми друг с другом.
Та же судьба ждет и гиалуроновую кислоту. В отличие от каркасных белков, она обновляется очень быстро — около трети всех молекул человеческого тела за день, — но и ее нити в старом матриксе становятся существенно короче, чем в молодом. Все это вызывает фиброз, то есть разрастание соединительной ткани, которая постепенно замещает другие ткани в органах. Клеток становится меньше, матрикса — больше, а короткие перекрестно сшитые белки делают его более жестким.
Нарастающий с возрастом в ткани хаос на руку клеткам опухоли: разрушенные волокна больше не тормозят их движение и размножение. Таким образом старый матрикс стимулирует развитие опухолей. И это позволяет объяснить парадоксальный факт, с которым мы встречались в первой части книги: люди, пережившие противоопухолевую терапию, стареют быстрее других. С точки зрения ткани это совершенно логично: возникает опухоль, организм облучают, под действием радиации опухоль умирает, а оставшиеся в живых клетки стареют, матрикс деградирует и в результате возникают условия для роста новой опухоли. Замкнутый круг из клеток и матрикса, которые стареют бок о бок, и порождает чудовищ.
Изменения в нише не проходят бесследно и для ее здоровых обитателей. Обломки матрикса привлекают в ткань иммунные клетки для разборки завалов, и начинается воспаление — битва иммунитета с внеклеточным мусором, в которой неизбежно страдают и мирные жители: им достается порция токсинов, которыми травят врага. Да и сигналов поддержки от старого матрикса поступает гораздо меньше. Поэтому, например, если поместить культуру молодых фибробластов на полуразрушенный матрикс, они начнут размножаться хуже.
Обратная процедура, кстати, тоже работает: можно заставить фибробласты 80-летних людей размножаться, если пересадить их на подушку из длинных нитей гиалуроновой кислоты. Это могло бы стать хорошей стратегией омоложения — очищать матрикс от накопленного мусора или просто вводить новые, не тронутые временем молекулы. Однако тесная связь между клетками и межклеточным веществом мешает "омолодить" всю ткань разом. Если мы научимся очищать матрикс, избавлять его от углеводных остатков и удлинять нити, старые клетки все равно не смогут поддерживать его в молодом состоянии. А если введем в старую ткань молодые клетки, они неизбежно состарятся на руинах матрикса.
Потерянное поколение
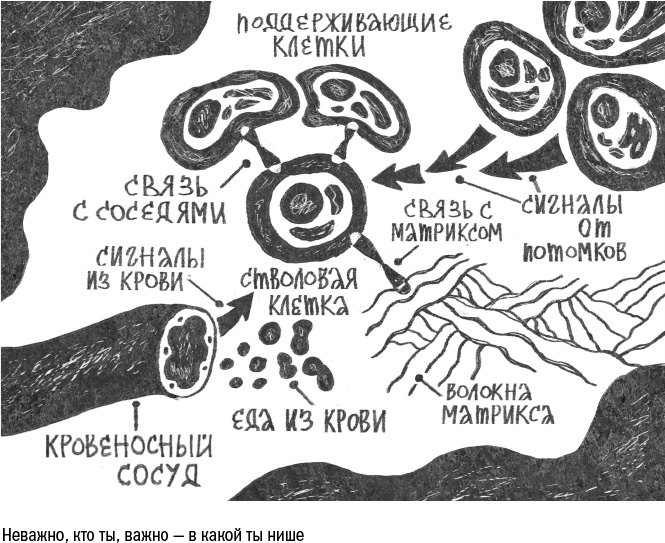
Среди множества клеток в ткани есть и те, чье старение особенно опасно, — это стволовые клетки. Подобно тому, как мы бережем детей от опасностей и тревог, ткань прячет свои стволовые клетки в самом безопасном месте, куда не проникают токсичные вещества и иммунные клетки. В коже их ниша находится под слоями остальных клеток, в стенке кишечника — на самом дне крипты (впячивания), в мышцах — на периферии, подальше от сокращающихся волокон.
Жизнь стволовых клеток устроена следующим образом: по умолчанию — покой, по сигналу — деление. Чаще всего клетки делятся асимметрично, то есть одна остается стволовой, а другая становится клеткой-предшественником, то есть активно размножается, поставляя новобранцев в клеточные ряды.
Асимметрию эту обычно задает сама ниша. Например, стволовые клетки кожи сидят на базальной мембране — подстилке из волокон матрикса. И от этой базальной мембраны поступает сигнал: оставаться стволовой, в дифференцировку не вступать. Когда клетка делится надвое, то ее верхняя половина оказывается лишена этих сигналов и теряет свои стволовые свойства. При этом число стволовых клеток в ткани остается неизменным, а ряды клеток-профессионалов пополняются.
Но если орган всерьез поврежден — например, после травмы или тяжелой болезни, — то стволовые клетки получают множество сигналов к размножению и начинают делиться симметрично, то есть дают начало двум одинаковым дочерним клеткам. В условиях травмы они сразу превращаются в клетки-предшественники, уходят в дифференцировку, и запас стволовых клеток постепенно истощается. Это одна из проблем, которая настигает многие ткани в старости: за свою жизнь человек переносит немало болезней и травм, которые заставляют стволовые клетки делиться симметрично.
Сами по себе стволовые клетки в большей степени устойчивы к старению, чем их потомки. В состоянии покоя они производят меньше свободных радикалов, синтезируют меньше белков и не копят внутриклеточный мусор, да и аутофагия у них работает эффективнее. Но стоит им "проснуться", как обмен веществ ускоряется, начинается деление, и поломок в клетке становится больше. Кроме того, стволовые клетки очень чувствительны к своей нише и стареют в ответ на ее повреждения — например, если окружающий матрикс распадается на маленькие кусочки или если сенесцентные соседи заражают их старостью, выделяя SASP.
Поэтому если мы вглядимся в стволовые клетки стареющей ткани, то увидим среди них, как в толпе людей, целый спектр возрастов. Кто-то еще способен размножаться, кто-то уже нет, кто-то начал дифференцироваться раньше времени. Например, недавно в гиппокампе (одна из немногих зон головного мозга, где клетки еще могут делиться) обнаружили внутри стволовых клеток две разные по свойствам группы: одни здоровые и могут размножаться, а вторые остаются невозмутимыми, как бы их не пытались заставить исполнять свои обязанности. Однако, если создать для клеток первой группы стрессовые условия — например, подействовать на них провоспалительными белками, — они быстро теряют работоспособность и превращаются в клетки второй группы. И в стареющем мозге вторые начинают доминировать над первыми.
Чтобы ни происходило в ткани, результат всегда одинаков: стволовых клеток, готовых к делению, становится все меньше. Поэтому, например, у людей старше 60 лет встречается так называемая анемия пожилых — стволовых клеток крови не хватает, чтобы произвести нужное количество красных кровяных телец. По этой же причине с возрастом может развиться состояние, подобное рассеянному склерозу — заболеванию, в ходе которого гибнут клетки, изолирующие нейроны от окружающей ткани. Чаще всего эта гибель вызвана атакой иммунной системы, но в пожилом возрасте может оказаться, что предшественников для клеток-изоляторов просто недостаточно, и возникают похожие симптомы.
На первый взгляд стволовые клетки могут показаться многообещающим средством борьбы со старостью. Они стали частью стратегии Обри ди Грея и других борцов со старением, их рекламируют клиники и даже добавляют в "омолаживающую" косметику. Идея проста: коль скоро тканевые резервы иссякают, а выращивать новые органы мы, за редкими исключениями, пока не умеем, то можно просто ввести в организм стволовые клетки, и они сами заменят изношенные ткани.
Но эта стратегия едва ли приведет нас к успеху. Проблема в том, что для того, чтобы клетки не вызвали иммунного ответа, они должны принадлежать самому пациенту. То есть необходимо забрать собственные клетки у человека, размножить их и вернуть обратно. Но чем старше становится человек, тем меньше у него клеток, которые еще способны размножаться. В сердце млекопитающего примерно на 1000–2000 мышечных клеток приходится лишь одна стволовая, и только около 1% стволовых клеток реально участвует в восстановлении ткани, а к 80 годам больше половины из них превращаются в сенесцентные. Поэтому добыть нужное количество, скорее всего, не получится.
К тому же для того, чтобы стволовые клетки прижились в ткани, их нужно поместить прямо в нишу или хотя бы проследить за тем, чтобы они туда добрались. Это неплохо работает в тех случаях, когда мы точно знаем, где именно должны находиться стволовые клетки, и можем их туда ввести — так сейчас делают с кожей или суставным хрящом. А вот с более сложными органами вроде печени или почки мы не сможем этого добиться, не нарушая структуру органа. Поэтому "омолодить" с помощью стволовых клеток можно далеко не любую ткань.
Наконец, как бы мы ни старались, в старом организме стволовые клетки неизбежно попадают в зону пагубного влияния ниши — разрушенного матрикса и сенесцентных соседей. И еще неизвестно, кто кого переборет: вернут ли стволовые клетки молодость остальной ткани или состарятся сами под действием внешних сигналов тревоги.
Брат идет на брата
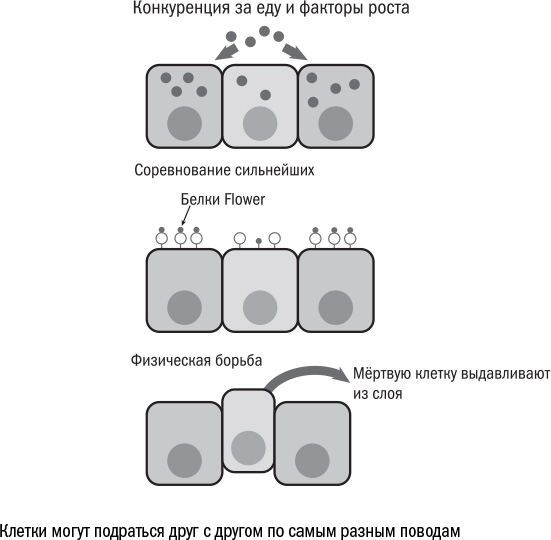
Место на подушке из матрикса и поддерживающие сигналы от него — такая же ценность для клеток, как еда и другие ресурсы. Поэтому неудивительно, что клетки в пределах одной ткани соревнуются за право ими обладать, несмотря на то что все они — в некотором роде члены одной команды. В мирном клеточном государстве встречается откровенная агрессия — клеточная конкуренция (cell competition), в ходе которой более крепкие и сильные клетки выживают из ткани слабых. Она совсем не похожа на дарвиновскую эволюцию, когда проигравшие оставляют меньше потомков, чем победители. Клеточная конкуренция — это настоящая битва клеток, которая возможна только при физическом контакте между ними.
Этот феномен впервые заметили еще в 70-е годы прошлого века. Все началось с мух дрозофил с мутацией в гене Minute, которая замедляет синтез белка. Сами по себе мухи-мутанты вполне жизнеспособны, но если смешать их клетки с клетками обычных мух, то мутантные быстро погибают.
Вот как это происходит. Клетки выставляют на свою поверхность белки Flower, которые могут быть нескольких видов: Flowerubi — "белок-победитель", а FlowerLose-A и FlowerLose-B — "белки-проигравшие". Каждая клетка делает свою ставку, и чем больше на ее поверхности оказалось белка-победителя, тем больше шансов выиграть. Клетки с мутацией в Minute не могут произвести достаточно белка Flowerubi и остаются в дураках. При контакте с доминирующим противником в побежденной клетке начинает работать ген azot, который обрекает клетку на самоубийство, то есть апоптоз.
Подобные клеточные поединки ученые позже обнаружили и у млекопитающих, как у зародышей, так и во взрослых тканях. Жертвами, как правило, становятся ослабленные клетки — те, у которых уровень обмена веществ ниже, чем у других, и которые не могут захватить извне достаточно еды или факторов роста. А это, в свою очередь, частые признаки клеточной старости. Получается, что более здоровые обитатели ткани могут выживать из нее сенесцентных соседей.
Недавно португальские исследователи предположили, что борьба молодых клеток против старых может лежать в основе нейродегенеративных заболеваний, например болезни Альцгеймера. Они работали с модельными мухами, в мозге которых накапливается бета-амилоид — белок, который часто считают причиной болезни Альцгеймера. В нервных клетках, которые производили бета-амилоид, ученые обнаружили работу генов FlowerLose-B и azot — судя по всему, эти клетки пытались конкурировать с соседями и проигрывали, а бета-амилоид мог быть частью программы самоубийства.
Ученые предположили, что достаточно прекратить соревнование и запретить слабым клеткам умирать, чтобы остановить нейродегенерацию. Но, когда работу azot заблокировали, легче мухам не стало: нейроны в мозге стали гибнуть еще чаще. Чтобы спасти мух, пришлось добавить им дополнительную копию гена azot. Ситуация выглядит парадоксальной: когда мы запрещаем клеткам умирать, они гибнут быстрее. Вероятно, дело в том, что клеточная конкуренция, какой бы жестокой и несправедливой она ни казалась, очищает ткань от ослабленных и немощных клеток, а остальные за счет этого получают доступ к ресурсам и дополнительный шанс выжить.
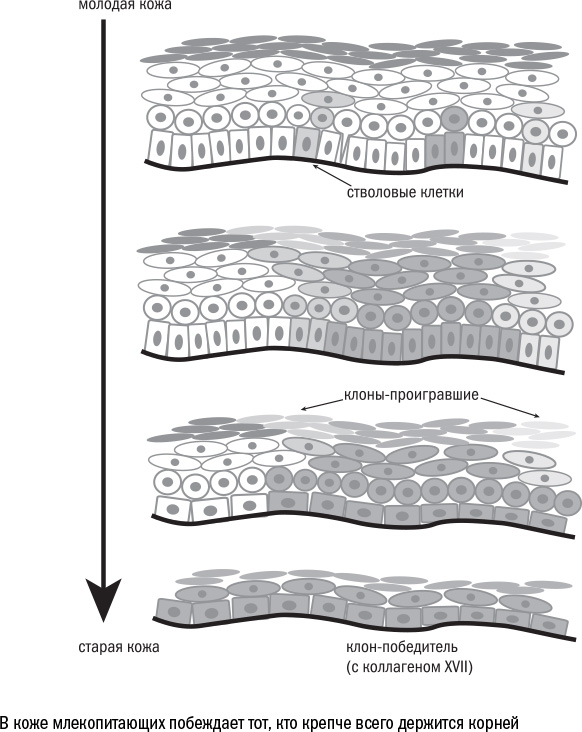
Похожие события разворачиваются в коже млекопитающих: там стволовые клетки нижнего слоя эпидермиса соревнуются за место на базальной мембране. Обычно удержаться на ней им помогает один из видов коллагена — коллаген XVII, который они сами и производят. Но, когда клетка стареет, ей становится сложно производить достаточное количество белка. Связь с базальной мембраной ослабевает, а более сильные соседи получают возможность вытолкнуть ее в верхние слои. В результате побежденная клетка, будучи оторвана от матрикса, теряет свои стволовые свойства и уходит в дифференцировку. А соседи делятся симметрично на две стволовые клетки и занимают освободившееся место на базальной мембране.
И снова клеточная конкуренция выглядит смертью во благо: стареющие клетки уступают место молодым. Если заблокировать у мышей производство коллагена XVII, то, как и в эксперименте с мозгом мух, кожа начинает стареть быстрее. В такой ситуации, опять же, уничтожение клеток оказывается полезным.
Однако у здоровых людей клеточная конкуренция приводит к противоположному эффекту. Она снижает разнообразие внутри ткани, и вся кожа заполняется клонами — потомками стволовых клеток, которые друг на друга генетически похожи больше, чем на потомков другой клетки. Причем чем дальше, тем этих клонов становится меньше и тем многочисленнее потомки каждого из них. И когда последние, в свою очередь, состарятся и потеряют коллаген XVII, будет уже некому вытолкнуть их из кожи и продолжить их работу.
Кто в выигрыше
После долгой конкуренции один или несколько клеточных кланов (то есть клонов) одерживают верх, и с возрастом разнообразие клеток в ткани уменьшается. Так, среди клеток крови иногда представителей одного или нескольких клонов становится существенно больше, чем остальных. И если у молодых людей (до 45 лет) этот феномен встречается редко, менее чем у 1% всей ниши, то после 70 лет таких людей уже 25–70%, в зависимости от метода подсчета.
Но, поскольку клоны действуют в своих эгоистических интересах, иногда их правление оказывается разрушительным не только для ткани, но и для тела в целом. Так, например, вместе с клонами распространяются и мутации, которые они носят в своей ДНК. Так как эти клетки каким-то образом выжили соседей из ткани, то можно предположить, что их мутации вовсе не безобидны. И с помощью конкуренции к власти то и дело приходят опухолевые клетки.
Арсенал их способов борьбы с соседями гораздо богаче, чем у обычных добропорядочных граждан клеточного государства. Раковые клетки могут просто захватить всю еду, оставив остальных ни с чем. Могут проглотить незадачливого соседа, поскольку вместе с необычной подвижностью часто приобретают гибкость и способность к фагоцитозу. Или могут, размножаясь, создать такое механическое напряжение в ткани, что буквально затаптывают соседей — под давлением в них запускается программа апоптоза.
Есть и еще один тип клеток, который часто становится победителем во внутритканевом соревновании. Эти клетки не просто регулярно одерживают верх, но с возрастом постепенно захватывают ткань за тканью и настолько плодовиты, что у некоторых людей занимают почти половину тела, — так что их даже иногда предлагают выделить в особый орган. Это жир.
У молодых людей есть два основных места, где можно найти жировую ткань: подкожная клетчатка и брюшной (висцеральный, он же абдоминальный) жир. С возрастом подкожная клетчатка становится тоньше, а брюшной жир, наоборот, толще. По некоторым данным, отношение объема талии к окружности бедер (чем выше, тем больше абдоминального жира) позволяет лучше предсказать риск умереть, чем индекс массы тела, то есть является в некотором роде признаком старости.
Кроме основных депо, жировые клетки рассеяны по всему телу: их можно найти в соединительных тканях и стенках сосудов, в оболочках спинного мозга и костном мозге — везде, где может потребоваться энергия из их жировых запасов. И вот внутри этих тканей они постепенно блокируют конкуренцию, мешая клеткам устранять опасных мутантов.
Вместо этого они сами вступают в конкуренцию с клетками других типов. Выглядит это так: в организме жировые клетки образуются из мезенхимных стволовых клеток, которые живут в соединительных тканях и могут произвести жир, кости, хрящи, фибробласты и клетки красного костного мозга. Чтобы выбрать, в кого превратиться, мезенхимные стволовые клетки ориентируются на сигналы извне. И когда в крови появляются жирные кислоты — это может случиться при ожирении или если жировая ткань состарилась и не справляется с их хранением, — под их влиянием мезенхимные клетки превращаются в предшественников жира вместо клеток кости или крови. Так жир постепенно захватывает органы, где раньше его было совсем мало, — поджелудочную железу, мышцы, печень и даже красный костный мозг.
Экспансия жира вызывает, с одной стороны, ожирение органов, которое мешает им работать в полную силу. В то же время, расселившись по всему телу, жир продолжает стареть — в нем накапливаются сенесцентные клетки, которые разрушают внеклеточный матрикс и выделяют "заразные" белки SASP. В недавнем эксперименте ученые откормили мышей до ожирения — и после этого даже в мозге у них выросло количество сенесцентных клеток с жировыми каплями внутри.
При избыточной массе тела даже у молодых людей в жировой ткани накапливается гораздо больше (иногда в 30 раз) сенесцентных клеток, чем у здорового человека. Поэтому в некотором смысле ожирение можно считать ускоренным старением, по крайней мере на тканевом уровне. В связи с этим не кажется удивительным тот факт, что ожирение повышает риск развития множества других возрастных болезней, начиная с диабета и заканчивая атеросклерозом, инфарктом, инсультом и раком.
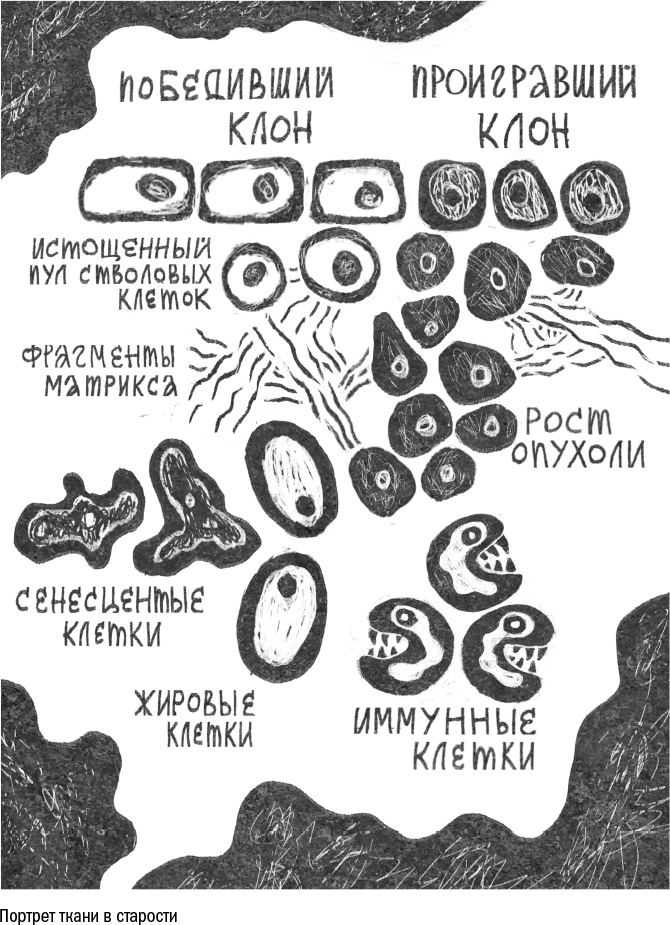
Остановить клеточную конкуренцию невозможно: как бы мы ни построили ткань, ее жители всегда будут стремиться размножиться и захватить как можно больше ресурсов. Заблокировать ее искусственно мы можем, но ни в одном из экспериментов это не приводит к ожидаемым улучшениям. Мухи, в чьих мозгах нейронам запретили убивать друг друга, гибнут от нейродегенерации, и кожа мышей стареет досрочно, если лишить ее клетки турнирного оружия. Сам по себе процесс конкуренции не плох и не вреден, проблема лишь в том, что у любого турнира есть финал, и клон-победитель, отбившись от соседей и не успев отдышаться, оказывается лицом к лицу с более серьезными противниками — белковым мусором, мутациями и стрессом, против которых в одиночку он бессилен.

