Сложная химия
…Лично я не против, если культура общества потребления вдруг возьмет и — фьюить! — сгинет в одночасье, ведь все мы окажемся в одной лодке, ну и будем жить, ничего страшного, за курами ходить, феодалов чтить и все такое прочее. Но… если бы мы все копошились тут на земле в грязных обносках, разводя свиней в заброшенных кафешках «Баскин-Роббинс», и я вдруг взглянул бы на небо и увидел самолет — пусть там был бы всего только один-единственный человек — вот тут я бы точно свихнулся! Или все откатываются назад в дремучее средневековье — или никто!
В этой книге мы немало говорили о том, как без особых сложностей превращать одни вещества в другие. Хотя эти яркие метаморфозы могут сначала показаться волшебством, при некотором старании вы сможете разобраться в свойствах разных химических элементов, вывести закономерности их взаимодействия, научиться предвидеть ход и итог реакции и наконец обратить знания в силу и управлять сложными цепочками химических реакций, чтобы добиться нужного вам результата.
Далее в этой главе мы увидим, как относительно развитая цивилизация, потратившая на возрождение жизнь нескольких поколений и крепко утвердившаяся, сможет освоить более сложные промышленные процессы, необходимые для ее движения вперед, ведь примитивных методов, о которых мы говорили, обсуждая получение соды, на все не хватает. Но сначала поговорим о том, как можно с помощью электричества получить важнейшие для возрождения цивилизации сырьевые продукты и постичь поразительные законы, действующие в мире химических превращений.
Периодическая таблица и электролиз
Мы уже видели, как технологии генерации и распределения электроэнергии открывают широчайшее поле для решения множества задач, связанных с восстановлением цивилизации, и помогают наладить коммуникацию с далекими странами. Но первым практическим применением электричества в истории — и на первых порах перезагрузки оно также окажется бесценным — было расщепление веществ на простые составляющие, то есть электролиз.
Например, если пропустить ток через рассол (раствор хлорида натрия), то у отрицательного электрода жидкость закипит пузырями водорода от расщепившихся молекул воды, а у положительного — пузырями газообразного хлора. Водород можно использовать для наполнения летательных аппаратов и как сырье для процесса Габера–Боша (о котором мы поговорим дальше), хлор же входит в состав отбеливателей, применяемых в производстве бумаги и текстиля, о чем шла речь в главе 4. А если вы немного усовершенствуете схему, то сможете получить еще и гидроксид натрия (каустическую соду), образующуюся в электролите, которая, как мы видели, представляет собой удивительно полезную щелочь. Электролиз чистой воды (с небольшим добавлением каустической соды для усиления электропроводимости) даст вам водород и кислород.
Даже алюминий из скальной руды можно извлечь с помощью электролиза — из-за высокой химической активности его нельзя выплавить на угле или коксе. Алюминий — самый распространенный металл в земной коре и главная составляющая глины, материала, освоенного человеком в числе первых. И при этом до появления в конце 1880-х гг. метода плавки и электролиза его руды алюминий был слишком дорог для широкого применения .
К счастью, возрождающемуся человечеству не нужно будет сразу добывать алюминий из руды. Этот металл настолько устойчив к коррозии, что столетиями не подвергается порче, и температура плавления у него относительно невелика (660 °C), что позволяет его переплавлять в примитивной печи, которая описана на с. 140–141.
Применение электролиза позволит синтезировать ряд важных для существования цивилизации веществ, пропустив применявшиеся на протяжении столетий менее эффективные методы их получения. К тому же электролиз поможет вам и в научном познании мира: он разлагает вещества на чистые строительные блоки — химические элементы. Например, в 1800 г. ученые с помощью электролиза убедительно доказали, что вода вовсе не элемент, а соединение водорода и кислорода. А за восемь последующих лет методом электролиза выделили в чистом виде еще семь элементов: калий, натрий, кальций, бор, барий, стронций и магний. Первые три из этого списка были открыты при электролизе распространенных химических соединений, не раз упомянутых в этой книге, — поташа, каустической соды и негашеной извести. Но электролиз не только прекрасный способ изолировать ранее неизвестные химические элементы: этот процесс показывает, что самые связи, удерживающие вместе атомы в химических веществах, имеют электромагнитную природу.
Если изучать взаимоотношения разных химических элементов, то, как они ведут себя в тех или иных соединениях, каковы их «характеры», то обнаруживается одна глубокая и поразительная истина: элементы — не одиночки, они объединяются в естественные группы, отличающиеся общими свойствами, своего рода семьи. Открытие этой структуры упорядочило химический космос так же, как осознание морфологических сходств и, соответственно, родственных связей в царстве живых организмов упорядочило космос биологический. Например, калий и натрий — металлы с высочайшей химической активностью, образующие щелочные соединения, такие как едкий натр и поташ, из которых путем электролиза и выделяют чистые элементы, а хлор, бром и йод реагируют с металлами, образуя соли. Если вы возьметесь раскладывать элементы в каком-то порядке, формируя столбцы по сходству свойств, обнаружится один и тот же повторяющийся рисунок и у вас получится периодическая таблица элементов.
Нынешняя периодическая таблица элементов — великий памятник научным достижениям человека, не менее впечатляющий, чем египетские пирамиды или любое из чудес света. Это не просто полный список элементов, когда-либо открытых химиками, это способ организации знаний, позволяющий предсказать многое о тех веществах, которые еще не открыты.
Так, в 1869 г., когда русский химик Дмитрий Менделеев составил свою периодическую таблицу из 60 с небольшим известных на тот момент элементов, он обнаружил в ее матрице пустые клетки — места, куда могли бы встать несуществующие вещества. Но замечательна система Менделеева тем, что она позволила ученому точно предсказать свойства этих гипотетических веществ, например экаалюминия, пропущенной клетки сразу под алюминием. Хотя в материальном виде его никто никогда не видел и не осязал, только на основании его положения в таблице можно было описать экаалюминий как блестящий пластичный металл с определенной плотностью, твердый при комнатной температуре, но плавящийся при необычно низком для металлов градусе. Несколько лет спустя французский химик обнаружил в природе новое вещество и назвал его галлием, в честь старинного названия Франции. Вскоре стало очевидно, что это и есть отсутствующий в таблице экаалюминий, предсказанный Менделеевым, и что прогноз о температуре плавления был точным: галлий переходит из твердого состояния в жидкое при 30 °C — этот металл буквально плавится в руках.
Эта простая истина — о скрытых закономерностях в мире элементов — поможет вам более систематически разбираться в строении материи и искать возможности лучшего применения свойств природных материалов. А теперь давайте попробуем расширить полученные в главах 5 и 6 знания и рассмотрим технологию, требующую чуть более сложного химического производства, — фотографию.
Фотография
Фотография — удивительная технология, она позволяет использовать свет для записи образов, выхватить момент жизни и сохранить его навечно. Сделанный во время отпуска фотоснимок вызывает живые воспоминания даже спустя десятилетия и описывает мир с несравнимо большей точностью, чем наша память. Но помимо снимков с дружеских пирушек, семейных портретов и головокружительных пейзажей последние два века фотография дарит нам бесценную возможность увидеть то, чего не видит человеческий глаз. Она обеспечила важнейшей технологией многие области знания и во многом поможет ускорить постапокалиптическое возрождение. Фотография позволяет документировать события и процессы, неявные для нас, слишком быстро или слишком медленно разворачивающиеся или протекающие в недоступном нашему зрению волновом диапазоне. Например, фотография с долгой выдержкой запечатлевает слабые мерцания света с намного более протяженным периодом, чем может уловить человеческий глаз, что позволяет астрономам изучать многочисленные тусклые звезды и распознавать в бледных кляксах на снимках космоса галактики и туманности со сложной структурой. Фотографические эмульсии также чувствительны к рентгеновским лучам, и это дает возможность делать медицинские снимки для диагностики внутренних повреждений.
Химическая основа фотографии довольно проста: определенные соединения серебра темнеют на солнце, так что с их помощью можно создавать черно-белые изображения. Фокус в том, чтобы найти такую растворимую форму серебра, которую можно нанести ровной тонкой пленкой, а потом превратить ее в нерастворимую соль, плотно пристающую к поверхности носителя и несмываемую.
Для начала смочите лист бумаги яичным белком (альбумином), содержащим растворы солей, и дайте высохнуть. Затем растворите в азотной кислоте, которая окислит металл до растворимого нитрата, немного серебра и нанесите раствор на подготовленный лист. В реакцию вступит хлорид натрия, и продуктом будет хлорид серебра, вещество одновременно светочувствительное и нерастворимое, а яичный альбумин не даст фотоэмульсии впитаться в волокна бумаги. Одна серебряная чайная ложечка содержит количество чистого серебра, которого хватит более чем на 1500 фотографий.
Когда лучи света попадают на чувствительный слой фотопластинки, они сообщают ему энергию, достаточную для того, чтобы высвободить электроны в зернах этого слоя и тем самым восстановить из хлорида металлическое серебро. Массивное серебро, например в виде отполированного блюда, ярко блестит, но точки крошечных металлических кристаллов, наоборот, рассеивают свет и потому выглядят темными. В то же время те области фотобумаги, на которые свет не упал, сохраняют белый цвет бумажной основы. После экспозиции на фотобумагу главное — остановить фотохимическую реакцию и закрепить пойманные тени. Тиосульфат натрия — вещество, поныне применяемое в фотографии для фиксации изображения и легко приготовляемое. Пропустите через раствор соды или каустической соды сернистый газ (с. 129), затем вскипятите раствор с порошком серы, и после высыхания вы получите кристаллический закрепитель.
Проецируя изображение через линзу на фотобумагу на задней стенке светонепроницаемой камеры, мы получаем фотоаппарат, но, если не усовершенствовать первичный химический процесс, фотография, даже сделанная при ярком солнце, будет проявляться несколько часов. К счастью, мы можем несравнимо повысить чувствительность матрицы с помощью проявителя — химического состава, ускоряющего трансформацию частично засвеченных зерен и окончательно восстанавливающего их до металлического серебра. Для этого хорошо подходит железный купорос, который нетрудно получить, растворив железо в серной кислоте. Когда возрождающееся человечество продвинется в химии, можно будет заменить хлористую соль ее атомарной родней — йодом или бромом, с ними фотоэмульсия получается гораздо более чувствительной.
Но если зерна фотоэмульсии темнеют на свету, а участки, на которые он не упал, остаются белыми, выходит, что на готовом фотоснимке свет и тень поменяются местами: это будет негатив. Не существует такой быстрой химической реакции, которая бы давала устойчивое позитивное изображение, нет такого черного вещества, которое моментально светлело бы под воздействием света, — так что нужно что-то решать с негативом. Концептуальный прорыв состоялся, когда пришла догадка: если негатив создавать в камере на прозрачном носителе, тогда потом останется только посветить сквозь него на фоточувствительную бумагу, чтобы получить изображение, на котором света и тени вернутся на свои места. При мокром коллодионном процессе пироксилин растворяют в смеси эфира и спирта (все эти вещества уже встречались нам на страницах этой книги) и получают вязкую прозрачную жидкость. Лучше всего покрыть фотоэмульсией стеклянную пластину, спроецировать на нее изображение и проявить, пока жидкость не застыла в твердую водоотталкивающую пленку. Если же вместо пироксилинового раствора использовать желатин (вываренный из костей, как о том рассказывается в главе 5), то можно сделать еще более светочувствительную пластину, притом сухую и позволяющую существенно увеличить время выдержки.
Фотография — удивительный пример новой технологии, возникшей из соединения нескольких уже существовавших методов и весьма незамысловатых материалов и веществ. Сложите горн, вымазанный огнеупорной глиной, и выплавите из песка или кварца с добавлением натриевого флюса стекло. Из одного слитка выточите фокусирующую линзу, другой расплющите в прямоугольную пластину для негатива, а затем, использовав ваши навыки в изготовлении бумаги, изготовьте листы фотобумаги. В фотопроцессах используются те же кислоты и растворители, к которым мы в этой книге обращаемся раз за разом, — примитивный снимок можно сделать, располагая серебряной ложкой, навозной кучей и поваренной солью. И если бы вы перенеслись в XVI в., вы легко нашли бы там все необходимые химикаты и оптические элементы для сооружения примитивной фотокамеры и могли бы показать Гольбейну, как, не ломая голову над изобретением масляных красок, запечатлеть короля Генриха VIII на фотоснимке.
Заполнение периодической таблицы элементов, применение фотографии для исследования мира — все это важные занятия для цивилизации, возрождающейся из пепла. Но когда общество встанет на ноги и жизнь в той или иной степени наладится, людям с каждым днем будет требоваться все больше базовых веществ, о которых мы здесь все время пишем. Чтобы удовлетворить растущий спрос, обществу придется освоить кое-какие сложные технологии химической промышленности.
Химическая промышленность
Мы часто слышим о промышленной революции, о новых умных механизмах, значительно облегчивших труд человека, существенно ускоривших прогресс и преобразивших жизнь общества в XVIII столетии. Однако не меньше, чем автоматические прядильные и ткацкие станки или рокочущие паровые машины, переход к развитой цивилизации обеспечило изобретение химических процессов для производства кислот, щелочей, растворителей и других веществ, необходимых людям.
Для удовлетворения многих важных потребностей, упоминаемых в этой книге, нужны химические агенты, помогающие превратить добытое в природе сырье в необходимые материалы или продукты. Сменятся несколько поколений возрождающегося человечества, и возросшее население уже не сможет обеспечивать спрос на жизненно необходимые вещества примитивными методами, о которых мы писали выше, так что дальнейший прогресс цивилизации окажется под вопросом.
Сосредоточимся на производстве двух веществ, становившихся в свое время причиной кризисов развития западного мира: в конце XVIII в. это была сода, в конце XIX в. нитраты. Постапокалиптическая цивилизация также неизбежно столкнется с необходимостью поддерживать достаточный запас и того и другого. Что же избавит возрождающееся человечество от необходимости добывать соду из древесной золы, а нитраты — из навоза? Начнем с промышленного синтеза соды, поскольку с него начинается история мировой химической индустрии.
Как мы видели, кальцинированная сода (карбонат натрия) — это насущно необходимое соединение, применяемое в самых разных областях хозяйства. Он незаменим в роли флюса при плавке песка для выделки стекла (сегодня больше половины производимого в мире карбоната натрия потребляет стекольная промышленность), а преобразованный в каустическую соду (гидроксид натрия), лучше любых других агентов способствует осуществлению химических реакций при изготовлении мыла и бумаги. Стекло, мыло и бумага — три главных устоя цивилизации, и начиная со Средних веков человеку для их поддержания нужен постоянный приток недорогой щелочи.
Традиционно для получения щелочей брали поташ, продукт сжигания древесины. К XVIII столетию леса на большей части Европы были вырублены, и поташ начали ввозить из Северной Америки, России и Скандинавии. Однако в ряде случаев предпочтительнее углекислая сода (карбонат натрия), ведь полученная из него каустическая сода — гораздо более мощный гидролизирующий агент, чем едкое кали. Ее производили в Испании, пережигая местное растение солерос, и на побережьях Ирландии и Шотландии — из выброшенных волнами бурых водорослей. Еще углекислую соду добывали в природных залежах рудного оксида натрия на дне высохшего озера в Египте. Но во второй половине XVIII в. население и экономика Запада настолько выросли, что спрос на соду превысил ее добычу из природных источников. Возрождающееся постапокалиптическое человечество также неизбежно столкнется с такой ситуацией. Химическая углекислая сода — близкая родственница обычной морской соли , запасы которой практически бесконечны. Можно ли переработать ее в жизненно важный хозяйственный ресурс?
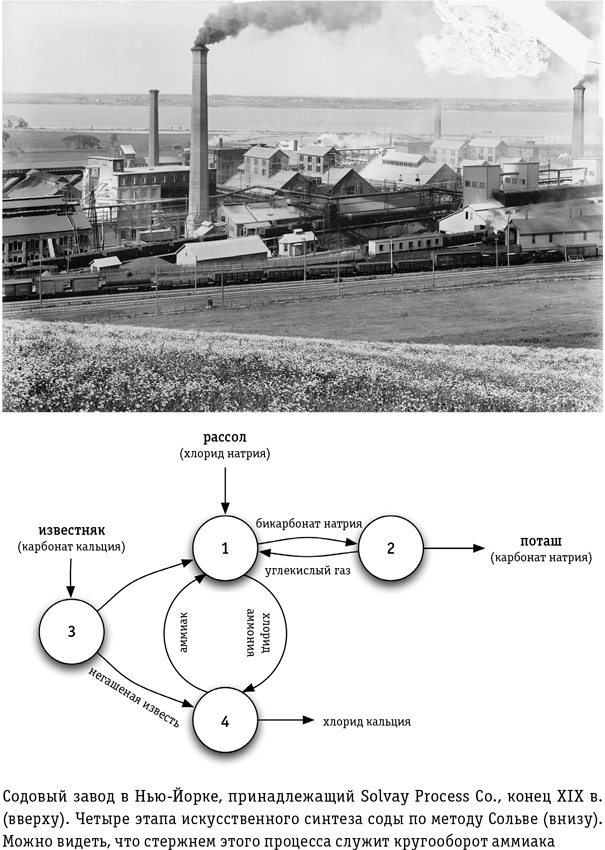
В XVIII в. французский химик Николя Леблан открыл простой двухступенчатый алгоритм решения: сначала нужно соединить морскую соль с серной кислотой, а затем прокалить продукт реакции в печи с толченой известью и углем или древесным углем при температуре около 1000 °C, пока не образуется черная, похожая на пепел масса. Карбонат натрия, который вам нужен, растворяется в воде, поэтому его можно извлечь по той же технологии, которая применялась при сжигании водорослей. Однако, хотя процесс Леблана позволяет без труда превратить морскую соль в соду и не зависеть от запасов растений и минералов, он чудовищно неэффективен и сопряжен с образованием ядовитых отходов. В идеале возрождающемуся человечеству лучше будет пропустить простой, но нерациональный процесс Леблана и сразу перейти к более эффективному варианту.
Метод, разработанный бельгийским инженером-химиком Эрнестом Сольве, чуть более сложный, но он ловко замыкает цикл добавлением аммиака: используемые реагенты восстанавливаются, и отходы, а значит, и загрязнение среды сведены к минимуму.
Процесс Сольве основан на следующей химической реакции: бикарбонат аммония соединяют с крепким рассолом, чтобы ионы бикарбоната «пересели» на натрий и образовался бикарбонат натрия (идентичный применяемому в хлебопечении разрыхлителю), который затем простым нагреванием преобразуется в кальцинированную соду. Чтобы это осуществить, рассол пропускают через две колонны, где он насыщается сначала аммиаком, а затем двуокисью углерода. Растворяясь в соленой воде, они соединяются и образуют тот самый бикарбонат аммония. Соль вступает в обменную реакцию, образуя нерастворимый бикарбонат натрия, который выпадает в осадок. На этом этапе процесса Сольве главный ингредиент — аммиак: он поддерживает в рассоле щелочную среду, достаточную для того, чтобы бикарбонат натрия не растворился, и тем самым аккуратно разделяет две соли.
Диоксид углерода, необходимый для первого этапа процесса, получают, прокаливая известь (точно таким же способом, какой описан в главе 5 для обжига извести при производстве цемента и бетона). После того как из рассола экстрагируют соду, получившуюся при прокаливании негашеную известь добавляют в рассол. Она восстанавливает закачанный туда на первом этапе аммиак, который можно использовать вновь. Таким образом, производство соды методом Сольве расходует только поваренную соль и известь, а на выходе, кроме собственно соды, мы получаем попутный продукт — чистый хлористый кальций, который применяется как антиобледенитель на зимних дорогах. Эта изящная замкнутая система, где главный реагент, аммиак, раз за разом восстанавливается для повторного использования, строится на довольно простых химических операциях и до сих пор остается основной технологией производства соды во всем мире (кроме США, где в 1930-х гг. на территории штата Вайоминг открыли богатое месторождение троны — минерала, содержащего карбонат натрия). Для возрождающегося человечества метод Сольве открывает прекрасную возможность перескочить через неэффективные и экологически грязные методы производства насущно необходимой соды.
Метод Сольве превращает легкодоступный элемент натрий (поваренную соль) в повседневно необходимое щелочное соединение — соду. Но развивающаяся цивилизация довольно скоро столкнется с нехваткой другого важнейшего материала. Один из самых нужных современному человеку химических процессов связан с азотом, и тут мы видим еще одно чудесное превращение бросового вещества в ценный сырьевой ресурс.
Если учесть, скольких людей она касается ежедневно, самой существенной технической новацией ХХ в. следует признать не воздушное сообщение, не антибиотики, не компьютеры и не атомную энергетику, а технологию получения простого и довольно неприятно пахнущего вещества — аммиака. Как мы не раз видели в этой книге, аммиак и родственные ему (и значит, химически взаимопревращаемые с ним) азотсодержащие соединения — азотная кислота и нитраты — это краеугольные камни химии, подпирающей цивилизацию. Без нитратов не обойтись в производстве удобрений и взрывчатки, но к концу XIX в. развитые страны стали испытывать дефицит этого ценного сырья. Спрос превысил предложение, и тогда американцам и европейцам пришлось крепко задуматься о том, чем вооружать армии и, хуже того, как обеспечить достаточно продовольствия, чтобы люди не страдали от голода.
Тысячелетиями у человечества был только один рецепт: если население росло, раскорчевывали больше земли под пахоту. Однако, когда доступный запас земли уже освоен, прокормить растущее число едоков можно только за счет повышения урожайности культивируемых земель, и, как мы видели в главе 3, этому способствует внесение в почву навоза и выращивание бобовых культур. А если численность населения достигает определенной пороговой величины — когда, условно говоря, все стулья заняты, — цивилизация неизбежно заходит в тупик. Нет возможности получить больше навоза от скота, поскольку для этого нужны новые пастбища, сеять больше бобовых тоже нельзя, так как тогда сократятся поля под злаки. Потенциал органического земледелия исчерпан.
Единственный выход — вносить в почву азот откуда-то извне, из-за пределов замкнутого сельскохозяйственного круга. На протяжении всего XIX в. сельское хозяйство Запада сильно зависело от привозного птичьего помета и селитры, добываемой в Чилийской пустыне. Но эти источники быстро истощились, и в 1898 г. председатель британской Ассоциации содействия наукам сэр Уильям Крукс предостерегал: «Мы одалживаемся из капитала Земли, но наши векселя не вечно будут принимать» (и нам сегодня стоило бы прислушаться к его словам, пока безудержный аппетит человечества к сырой нефти и другим природным ресурсам не истощил планету). В мире, остающемся после нас, уже не будет былых запасов природных нитратов, и взрослеющее постапокалиптическое общество упрется в эту стену довольно скоро.
В земной атмосфере много азота — в каждом вашем вдохе этот газ составляет 80% но при этом он упорно хранит химическую пассивность. Два атома азота плотно скреплены в пару тройной связью; вообще азот — самое инертное из всех двухатомных веществ, какие мы только знаем. Поэтому его совсем не просто преобразовать в удобную форму, «связать». К концу XIX в. стало ясно, что дальнейший прогресс цивилизации зависит от того, сумеет ли человек связать азот. Выручить человечество из беды предстояло химикам.
Решение, найденное в 1909 г. и применяемое поныне, носит название процесса Гaбера–Боша. На первый неискушенный взгляд он кажется простым. Азот — самый распространенный газ в земной атмосфере, водород — самый распространенный химический элемент во Вселенной: два этих компонента смешивают в соотношении один к трем в реакторе, и они, соединяясь, образуют NH3 — аммиак. Азот можно просто закачивать из воздуха, а водород сегодня получают из метана, также его легко добыть электролизом воды. Чтобы побудить азот вступить в реакцию, нужно разорвать прочные связи, сцепляющие два атома в одно целое, а для этого требуется катализатор. Пористое железо с добавлением гидроксида калия (едкого кали, о котором мы рассказывали на с. 123, 127, хорошо помогает стимулировать реакцию. Эта реакция не доходит до завершения, поэтому газы охлаждают, чтобы нужный продукт конденсировался и выпал аммиачным дождем, который сливается в емкости, а еще не прореагировавшие газы снова запускаются в реактор, пока успешно не преобразуется почти весь объем. Но, как всегда, дьявол в деталях, и на самом деле процесс Габера–Боша осуществить довольно непросто.
Многие химические реакции принципиально необратимы: поездка в один конец, во время которой реагенты перекомбинируются в новые вещества. Например, в горящей свече молекулы углеводородов воска в процессе горения окисляются до воды и углекислого газа, но обратная трансформация сама собой не произойдет никогда. Другие же химические процессы представляют собой обратимые реакции, в ходе которых два противоположных превращения происходят одновременно. «Реагенты» превращаются в «продукты», но в то же самое время последние вновь возвращаются в исходное состояние. Переход азотно-водородной смеси в аммиак — как раз один из таких обратимых процессов, и, чтобы склонить баланс в сторону нужного вещества, нужно тщательно задать условия в реакторе. Для получения аммиака это означает высокую температуру (около 450 °C) и мощное давление (около 200 атмосфер). Экстремальная среда в реакторе и трубопроводах и является причиной, по которой так непросто осуществлять процесс Габера–Боша. По сравнению с другими важными процессами, упомянутыми в этой книге и требующими использования горячих печей, например с выплавкой металла или изготовлением стекла, связывание азота — высокое достижение сложной инженерии. Если постапокалиптическому человечеству не удастся сохранить подходящий реакторный сосуд, придется научиться самим изготавливать промышленные термобарокамеры.
Но вынудить азот соединиться с водородом и образовать аммиак — это лишь первый шаг. После того как азот связан, его нужно превратить в более широко употребляемую субстанцию — азотную кислоту. Аммиак окисляется в горячем конвертере — не в печи, а в сосуде, где, по сути дела, сам газообразный аммиак служит топливом и где имеется платиново-родиевый катализатор. Этот сплав содержится в каталитических нейтрализаторах, которые устанавливаются в выхлопных системах машин, чтобы уменьшить вредные выбросы, потому его сравнительно просто будет раздобыть. Получившийся диоксид азота затем абсорбируется водой, и получается азотная кислота.
Урожайность поля не повысится, если аммиак или азотную кислоту вылить на поле в чистом виде: первый слишком щелочной, вторая слишком кислая. Но если их перемешать, они нейтрализуются, образовав соль, нитрат аммония. Она представляет собой просто волшебное удобрение, поскольку содержит двойную дозу доступного азота. Как мы видели в главе 7, нитрат аммония применяется и в медицине: разлагаясь, он высвобождает обезболивающую закись азота. Словом, процесс Габера–Боша поможет постапокалиптическому обществу дорасти до индустриальной цивилизации, избавит вас от необходимости собирать ради жизненно важного азота навоз и птичий помет, разводить в воде древесный уголь или копать в пустыне селитру, а вместо этого откроет возможность брать азот из практически неисчерпаемого атмосферного запаса.
В наши дни посредством процесса Габера–Боша ежегодно получают около 100 млн т аммиака, а изготовленные из него удобрения кормят треть населения планеты — около 2,3 млрд голодных ртов насыщаются благодаря этой химической реакции. А поскольку вещества, содержащиеся в пище, ассимилируются нашими клетками, примерно половина белков в нашем теле построена из азота, искусственно связанного при помощи технологий, изобретенных людьми. В каком-то смысле мы отчасти изготовлены на заводах.

