Критерий 4. Нарушение регенерации тканей
Клеточное старение
В 1961 году американцы Хейфлик и Мурхед показали, что клетки, полученные из соединительной ткани и содержащиеся в питательной среде вне организма, способны поделиться лишь определенное количество раз. Этим нормальные фибробласты отличаются от опухолевых клеток, способных делиться при культивировании неограниченное количество раз. Данное явление получило название клеточного старения.
Клеточное старение – это необратимая утрата способности клеток к делению в регенерирующихся тканях. Результатом клеточного старения является появление остановивших свой клеточный цикл сенесцентных клеток.
Процессы клеточного старения лежат в основе нейродегенерации, остеопороза, дистрофии сетчатки, потери слуха, сердечно-сосудистых заболеваний, саркопении, одряхления, диабета 2-го типа, метаболического синдрома, недостаточности функций легких и почек, канцерогенеза, поскольку в результате них прекращается обновление клеточного состава тканей и органов.
Явление клеточного старения – не случайный процесс. По мнению Джуди Кампизи, профессора из Института старения Бака, оно запрограммировано и выработалось в процессе эволюции как одна из форм ответа клетки на значительное повреждение. Являясь позитивным в раннем периоде жизни (подавляя развитие опухолей, участвуя в заживлении ран), клеточное старение становится негативным в позднем периоде жизни, вызывая старение организма и связанные с ним патологии.
Клеточное старение – универсальное явление. Ученым удалось наблюдать накопление неспособных к делению клеток с возрастом в коже, сетчатке, печени, селезенке, аорте, почках, легких человека и различных животных (приматов, грызунов, рыб).
Клеточное старение распространено в участках тела, затронутых возрастзависимыми патологиями – трофическими язвами, атеросклеротическими бляшками, артритом, хронической обструктивной болезнью легких, накоплением висцерального жира, доброкачественной гиперплазией предстательной железы, предопухолевыми поражениями, в головном мозге – при болезни Альцгеймера.
УЗНАЙ БОЛЬШЕ
В настоящее время активно изучаются причины клеточного старения. Выделяют, по крайней мере, три причины необратимой остановки клеточного деления (рис. 23). Первый вид – это онкоген-индуцированное клеточное старение, когда клетка перестает делиться в ответ на накопление опухолеродных белков, гиперстимуляцию деления, активацию ряда сигнальных путей, отвечающих за направление ресурсов клетки на рост и деление. Второй вид – стресс-индуцированное старение, которое реализуется в некоторых типах клеток при возникновении двухцепочечных разрывов ДНК. Третий вид – репликативное старение, возникающее в ответ на укорочение теломерных концов хромосом. Все три вида, так или иначе, способствуют предотвращению или остановке опухолевого роста. Однако в условиях генетической нестабильности, имеющей место в старости, частота возникновения сенесцентных клеток резко возрастает, что приводит к нарушению регенерации тканей.
Одна из причин, по которой клеточное старение выступает спусковым крючком возрастзависимых патологий, заключается в его способности вызывать воспалительные процессы. Сенесцентные клетки секретируют воспалительные сигнальные белки – цитокины. Это так называемый старение-зависимый секреторный фенотип стареющей клетки. Например, выделяемый сенесцентными клетками цитокин амфотерин активизирует сигнальные пути врожденного иммунитета, что приводит к усиленной секреции цитокинов воспаления макрофагами и последующей воспалительной реакции. В то же время хроническое воспаление ускоряет все основные возрастзависимые патологии – от нейродегенерации до канцерогенеза. Старениезависимый секреторный фенотип эволюционно сформировался для того, чтобы сообщать сигнал о клеточном повреждении другим клеткам и стимулировать тканевую репарацию. Эта его роль проявляется, например, в процессе заживления ран. Кроме того, он является механизмом самоустранения сенесцентных клеток. Воспалительные цитокины привлекают иммунные клетки и вызывают атаку их источника. Однако возможности иммунитета с возрастом снижаются, и сенесцентные клетки перестают эффективно удаляться.
Помимо цитокинов, сенесцентные клетки секретируют ферменты для разрушения внеклеточных белков – металлопротеиназы. Эти ферменты в том числе разрушают коллаген, глюкозаминогликан и эластин, составляющие основу межклеточного вещества. Чтобы читателю было проще представить их влияние на здоровье, отметим, что разрушение коллагена и глюкозаминогликанов проявляется, например, в нарушениях регенерации хрящевой ткани, что приводит к возрастзависимым заболеваниям суставов. Но этим их влияние не ограничивается. Образующиеся фрагменты разрушенных металлопротеиназами белков – матри-криптины – обладают сигнальной активностью. Они ингибируют рост сосудов и могут вызывать гибель клеток. Таким образом, старениезависимый секреторный фенотип нарушает структуру и функцию нормальных тканей, подавляет способность к делению стволовых клеток, стимулирует озлокачествление (рис. 24).
Благодаря заметной роли в патогенезе старениезависимых заболеваний, клеточное старение является потенциальной мишенью для терапевтических вмешательств. Среди стратегий борьбы с проявлениями клеточного старения научная группа Джуди Кампизи выделяет подавление секреторного фенотипа и индукцию избирательной гибели сенесцентных клеток. Генетически сконструированные мыши, у которых сенесцентные клетки самоликвидировались, отличались существенным замедлением в развитии возрастзависимых заболеваний, в частности саркопении, катаракты, утраты жировой ткани.
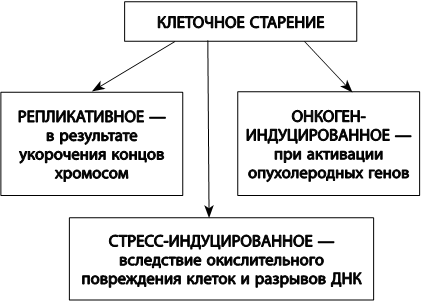
Рис. 23. Типы клеточного старения
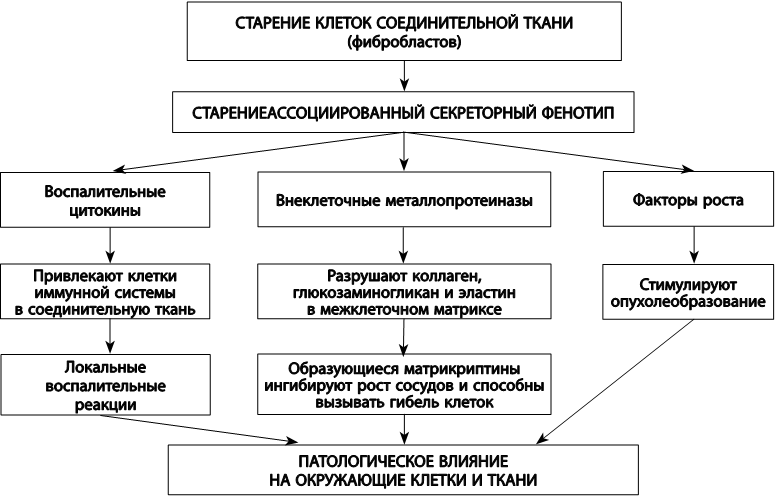
Рис. 24. Роль старениезависимого секреторного фенотипа в патологических процессах
Как снизить риск развития катаракты?
Необходимо правильное питание с достаточным количеством витаминов С, Е, В1, В12, а также каротиноидов лютеина и зеаксантина. Все проводившиеся в разное время, в разных странах исследования показывают, что у людей, потребляющих ежедневно три-пять порций овощей и фруктов, риск развития катаракты снижается в 5 раз по сравнению с теми, чей рацион лишен этого количества овощей и фруктов. Отличные пищевые источники витамина С – апельсины, грейпфруты, клубника, папайя, а также зеленый перец и помидоры. Жирорастворимый витамин Е содержится в растительных маслах, миндале и других видах орехов, проросшем пшеничном зерне и семенах подсолнуха. Лютеин и зеаксантин присутствуют в овощах с темно-зелеными листьями и в несколько меньших количествах в цветных фруктах и овощах, таких как морковь, брокколи, желтый перец, кукуруза, горох, хурма и мандарины. Витамин В1 содержится в крупах, хлебе, красном мясе, яичном желтке, зеленых овощах, бобовых, коричневом рисе, ягодах, дрожжах, картофеле и орехах. Витамин В2 содержится в зерновых, молоке, мясе, яйцах, сыре и горохе.
Имеются научно подтвержденные данные, что одним из факторов, способствующих возникновению катаракты, является диабет: у больных диабетом катаракта развивается в 3–5 раз чаще. Как известно, развитие диабета ускоряется на фоне избыточного веса. Поэтому контроль над собственным весом в какой-то мере способствует и снижению риска катаракты.
Курение – еще один из наиболее убедительно доказанных факторов риска развития катаракты. Это объясняется тем, что у курильщиков серьезно страдает обмен веществ.
Значительный вред хрусталику наносит ультрафиолетовое излучение солнца. Периодическое воздействие ультрафиолетом повышает вероятность возникновения катаракты. Для защиты глаз от яркого солнечного света полезно носить темные очки или широкополую шляпу.
Нужно избегать поднятия тяжестей, резких рывков, прыжков и падений.
Гибель клеток
Программируемая гибель клеток (апоптоз) – генетически регулируемый процесс самоликвидации клетки. При запуске апоптоза клетка активирует ферменты, разрушающие ее цитоскелет, в результате чего она распадается на фрагменты, которые близлежащие клетки используют в качестве строительных блоков. Одновременно активируются ферменты, уничтожающие ядерную ДНК ликвидируемой клетки.
Апоптоз играет важную роль в различных физиологических процессах, таких как дифференцировка органов и тканей в раннем эмбриональном развитии, надзор за вирусинфицированными клетками, иммунный ответ, удаление ненужных или поврежденных клеток в постнатальный период, подавление опухолевого роста. В то же время апоптоз побочно обусловливает процесс старения организма, поскольку приводит к гибели стволовых клеток или клеток в нервной и мышечной тканях, в которых клеточное деление прекратилось, вызывая в этих тканях дегенеративные изменения (рис. 25).
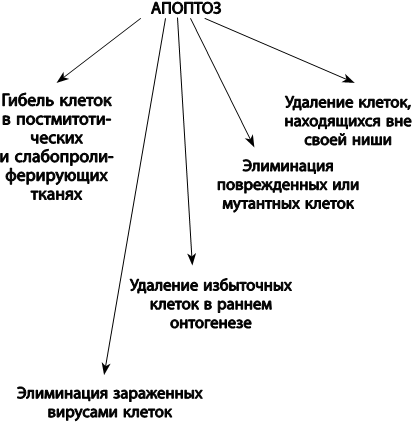
Рис. 25. Функции апоптоза в индивидуальном развитии и старении
Возможны несколько способов участия апоптоза в процессе старения. Во-первых, позитивный, через устранение опухолевых и поврежденных стареющих клеток (например, фибробластов и клеток печени), которые затем могут быть заменены путем деления; таким образом, сохраняется тканевый гомеостаз. Во-вторых, утрата постмитотических клеток (например, нервных клеток или клеток сердечной мышцы), которые не могут быть заменены, что ведет к патологии. В третьих, при старении отдельные типы клеток теряют способность подвергаться апоптозу, что может служить причиной избыточного накопления нефункциональных стареющих клеток, аутоиммунных заболеваний (таких, как ревматоидный артрит) или опухолевого процесса. Таким образом, частью феномена старения может являться как увеличение чувствительности клеток к апоптозу, так и снижение, то есть тканеспецифическая разрегулировка апоптоза.
Истощение количества стволовых клеток
Развитие каждого индивида начинается с эмбриональных стволовых клеток. Даже самые примитивные многоклеточные организмы обладают стволовыми клетками. На ранних стадиях развития эмбриона из имеющихся клеток могут сформироваться любые клетки и ткани организма (несколько сотен типов). После первых нескольких делений зародыша стволовые клетки могут давать начало только некоторым, но не всем, клеточным линиям, а еще позже они могут становиться родоначальниками всего лишь нескольких определенных клеточных типов. Последняя группа стволовых клеток присуща, в небольшом количестве, и взрослому организму. Они обычно пребывают в состоянии покоя либо делятся симметрично (самовоспроизводятся), но при необходимости могут приступить к асимметричному делению, образуя клетки, из которых далее развиваются зрелые клетки, необходимые для функционирования той или иной ткани.
Замена поврежденной клетки на новую в результате асимметричного деления стволовой клетки может обеспечить неограниченную устойчивость к дегенеративным изменениям любой ткани организма человека при условии, что сами стволовые клетки бессмертны. Однако этого не происходит. Почему стволовые клетки с возрастом реже самообновляются или неправильно созревают, а в других случаях, наоборот, начинают делиться бесконтрольно, превращаясь в раковые? На этот вопрос специалисты до сих пор не нашли однозначного ответа.
Действительно, с возрастом способность стволовых клеток делиться и восстанавливать ткани снижается. Например, поседение вызывается уменьшением в волосяных мешочках количества стволовых клеток, вырабатывающих пигмент. Получены свидетельства постепенного спада репликативной способности кроветворных, кишечных и мышечных стволовых клеток. Таким образом, изменение функциональных возможностей стволовых клеток при старении – установленный факт. Снижение активности стволовых клеток способствует прогрессивному ухудшению регенерации тканей.
Почему это происходит? Одни авторы считают, что стволовые клетки стареют «изнутри». Чем больше стволовые клетки взрослого организма делятся в течение жизни, тем больше они накапливают повреждений ДНК, в результате укорочения их теломер, стресса от «запутывания» при удвоении нитей ДНК, постепенного отказа систем починки ДНК, чрезмерного метилирования важных генов и активации «прыгающих» генов. Иногда при делении стволовой клетки даже теряются целые хромосомы.
Другие авторы, напротив, полагают, что стволовые клетки потенциально бессмертны. Например, когда стволовые клетки половой системы, из которых возникают новые сперматозоиды, от старых самцов мышей последовательно пересаживали молодым особям в течение трех лет, заметного снижения их функции не наблюдалось, что косвенно свидетельствует о незначительном вкладе внутренних причин в старение данного типа стволовых клеток. Кроме того, сателлитные стволовые клетки мышц стареющих мышей продолжают выполнять свою функцию без изменений при условии, если присутствуют определенные системные факторы, получаемые при переливании крови от молодой мыши.
Одной из причин повышенной жизнеспособности стволовых клеток по сравнению с другими типами клеток является активность особых транспортных белков, выбрасывающих из клеток поступающие в них токсины и избыточные гормоны. Кроме того, свойство бессмертия обеспечивается особой способностью перераспределять возникающие повреждения при асимметричном делении, когда одна дочерняя клетка остается стволовой, а вторая созревает в специализированную клетку данной ткани. Как было показано в специальных экспериментах, «клеточный мусор» – агрегаты окисленных и структурно неполноценных белков (агресомы), скапливающиеся в клетке, связаны только с одним из двух центров деления, вследствие чего при клеточном делении агресомы отходят лишь к одной из дочерних клеток. Как нетрудно догадаться, «клеточный мусор» достается созревающей клетке, а незрелая стволовая клетка за счет этого процесса очищается. По-видимому, при митозе стволовой клетки неслучайным образом распределяются не только поврежденные белки, но и родительская ДНК-матрица. Одним из следствий этого процесса может быть наблюдаемое снижение спонтанной частоты мутаций в стволовых клетках по сравнению с дифференцирующимися соматическими клетками, а также более медленное укорочение длины теломер. Теломеры могут укорачиваться и под действием окислительного стресса, поэтому некоторые стволовые клетки имеют активную теломеразу, при необходимости достраивающую концы хромосом. Правда, уровень активности теломеразы с возрастом падает даже в стволовых клетках, что, по мнению нобелевского лауреата Э. Блекберн, может служить маркером скорости старения у каждого конкретного человека. Таким образом, стволовая клетка «очищается» от внутриклеточного «мусора» и приобретенных в процессе репликации ДНК повреждений за счет образующейся созревающей клетки, что является менее энергозатратным и более надежным механизмом устранения повреждений, чем починка поломок, но обеспечивает более быстрое старение зрелых клеток.
Возникло и другое предположение, согласно которому старение стволовых клеток, утрата способности к делениям запускается извне – в результате изменения гормонального фона и локального микроокружения стволовой клетки.
Предположение о том, что стволовые клетки контролируются микроокружением, стимулирующим их самообновление и защищающим их от воздействий, вызывающих созревание, впервые было высказано в 1978 году и касалось кроветворных стволовых клеток. Экспериментально это предположение подтвердили значительно позже, когда было показано, что клетки костной ткани влияют на развитие кроветворных стволовых клеток, предоставляя им «инструкции» в виде сигнальных белков – факторов роста и цитокинов. Микроокружение стволовой клетки, необходимое для ее функционирования, получило название стволовой ниши. Помимо выполнения функции питания, стволовая ниша служит для стволовой клетки защитной и информационной средой. Она играет важную роль в обеспечении состояния покоя стволовой клетки и регулирует ее предрасположенность к вступлению на путь созревания в специализированную клетку. Структурно стволовая ниша представляет собой совокупность всех факторов, которые обеспечивают жизнеспособность и самовоспроизведение незрелых стволовых клеток, а также созревание дочерних специализированных клеток. К таким факторам относятся базальная мембрана, молекулы внеклеточного вещества, прочно закрепляющие стволовую клетку в нише, и определенные типы соседних клеток, продуцирующих факторы роста и различные регуляторные молекулы. В отличие от стволовых клеток, образующие стволовую нишу соседние клетки стареют с обычной скоростью. В свою очередь клеточное старение, которому подвергаются клетки – соседи стволовой клетки, вызывает изменение спектра секретируемых ростовых факторов, провоцирует выделение цитокинов воспаления, мешающих состоянию покоя или самообновлению стволовых клеток, а также секрецию металлопротеиназ – ферментов, разрушающих внеклеточный матрикс.
Состояние внеклеточного матрикса важно для правильной работы стволовых клеток и здорового состояния ткани в целом. В то время как отдельные ферменты клеток претерпевают многократное замещение в течение жизни (например, ядерные белки гистоны – 1600 раз), белки внеклеточного матрикса практически не обновляются. Коллаген кожи сменяется 5,3 раза, коллаген хряща – 0,8 раза, эластичные волокна легких – не замещаются. На фоне такого низкого замещения волокон межклеточного матрикса их разрушение металлопротеиназами крайне негативно. При этом не стоит забывать, что увеличивается уровень повреждения межклеточных волокон – в результате фотостарения, кальцификации и гликирования.
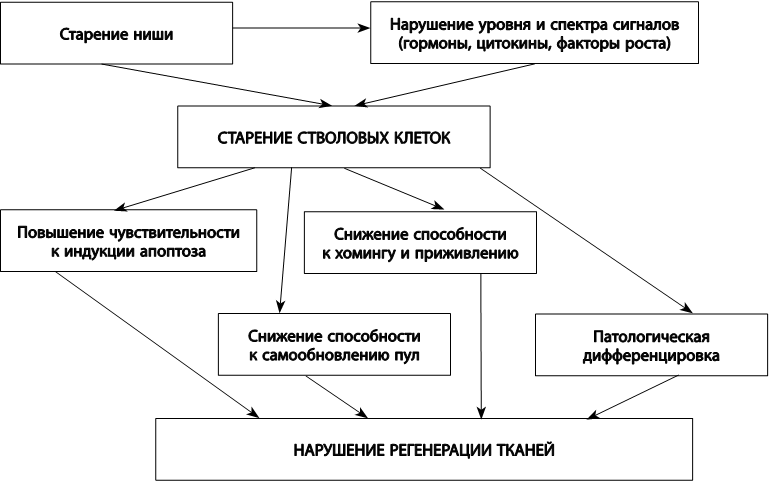
Рис. 26. Причины и следствия старения стволовых клеток
Из данного механизма старения стволовых клеток (рис. 26) следуют два вывода: 1) инъекция стволовых клеток старому человеку будет малопродуктивной, поскольку молодая стволовая клетка имплантируется в старую нишу; 2) необходимо научиться модифицировать сигналы ниши, подавляя связанный со старением секреторный фенотип или внося в нее дополнительные количества необходимых ростовых факторов в нужной пропорции.
Роль гормональных изменений в организме при старении стволовой ниши показана на примере развития саркопении и истончения сердечной мышцы. С возрастом происходят существенные изменения в стволовой нише сателлитных клеток – стволовых клеток, из которых образуются новые мышечные волокна. В частности, наблюдается изменение спектра поддерживающих сигналов в результате атрофических изменений окружающих мышечных волокон, утолщается базальная мембрана, изменяется состав локальной среды за счет увеличения доли соединительной ткани (фибробластов и жировых клеток), что нарушает функционирование сателлитных клеток. Со стороны гормонального фона возрастает влияние отрицательных и снижается влияние положительных регуляторов сателлитных клеток. Например, наблюдается нехватка в циркулирующей крови ростовых сигналов, в частности GDF-11 и гормона окситоцина. При переливании крови от молодых мышей старым у последних происходят благоприятные изменения – утолщение миокарда и регенерация скелетных мышц.
В результате старения стволовой ниши стволовые клетки не обязательно погибают. Их количество уменьшается с возрастом в результате уменьшения доли симметричных делений, когда из одной образуются две одинаковые стволовые клетки. Напротив, вследствие увеличения потребности в регенерации в стареющих тканях все больше происходит асимметричное деление, в результате которого образуются зрелые клетки, восполняющие утраченные функциональные клетки данной ткани. Таким образом, происходит истощение количества стволовых клеток в ткани.
Однако в результате получения неправильных инструкций от стареющей стволовой ниши нередко происходит ошибочное созревание потомков стволовых клеток. Образуются не те клетки, что необходимы здоровой ткани. Например, воспалительные цитокины приводят к тому, что при старении кроветворные стволовые клетки дают все большее количество клеток врожденного иммунитета – воспалительного миелоидного ростка, например, макрофагов, и все меньше эритроцитов и клеток приобретенного иммунитета – T- и B-лимфоцитов. Меланоцитные стволовые клетки в старом организме образуют атипично пигментированные меланоциты, что выражается в наличии старческих пятен на коже.

