Так что такое старение?
Прежде чем рассматривать явление, следует дать ему определение. На бытовом уровне мы интуитивно понимаем, что старение – это процесс одряхления, приводящий к смерти. Однако, говоря о старении научным языком, мы сталкиваемся с проблемой. Мы не сможем найти определение, которое позволило бы четко отличить это явление от какой-либо болезни.
По определению советского геронтолога В. В. Фролькиса, старение – это «многопричинный разрушительный процесс, вызываемый комплексом регуляторных и стохастических факторов и определяемый генетически детерминированной биологической организацией живой системы». На мой взгляд, это очень красивое определение, отражающее роль генетических, эпигенетических, внешнесредовых и стохастических факторов. Однако под это же определение подойдет и любая болезнь или синдром (например, простуда).
Общепризнано определение старения как процесса увеличения вероятности смерти с возрастом. Однако, если мы будем наблюдать снижение смертности с возрастом, будет ли это означать отсутствие старения? Например, рыбы и черепахи активно гибнут от хищников, пока они мелкие, однако те немногочисленные особи, которые доживают до определенного возраста и достигают больших размеров тела, становятся малодоступными для хищников. В этом случае мы видим снижение вероятности смерти с возрастом, но это отнюдь не за счет отсутствия старения.
Наилучшее описательное определение старения предложено Я. Вайгом и Ю. Су из Колледжа Альберта Эйнштейна в Нью-Йорке. Они определяют старение как потерю жизнеспособности, проявляющуюся после достижения пика размножения. Однако оно не отражает причины и сути происходящих при старении изменений. В большей степени отражает механизмы определение российского генетика В. С. Баранова: старение – прогрессирующее с возрастом нарушение функциональной активности генов. С точки зрения ключевых факторов старение можно определить как постепенный дегенеративный процесс, являющийся результатом взаимодействия генов и среды, регулируемый стрессом, метаболизмом, репродукцией, а также защитными системами на уровне клетки, ткани и организма.
Старение неизбежно ведет к смерти. Возможно, его стоит определять, отталкиваясь от того, что такое «жизнь»? Согласно одному из определений, жизнь – это баланс обмена веществ, энергии и информации на различных уровнях организации биосистемы, поддерживаемый в результате генетически запрограммированных метаболических процессов и направленный на ее самоподдержание, развитие и репродукцию. В таком случае старение – комплекс изменений, вызывающих постепенную замену функциональных элементов биосистемы на нефункциональные на всех ее уровнях, что приводит к дисбалансу обмена веществ, энергии и информации. Примерно об этом же говорит физиологическое определение, где под старением понимают процесс постепенного угнетения основных функций (самовосстановления, самовоспроизведения и др.), вследствие которого организм теряет способность поддерживать гомеостаз, противостоять стрессам, болезням и травмам.
В ответ на повреждения нередко возникает непропорциональный компенсаторный ответ – сверхактивация сигнальных каскадов, воспалительных реакций, сопровождающийся еще большим количеством повреждений. По убеждению американского геронтолога М. Благосклонного, именно неадекватная компенсаторная реакция оказывает наиболее пагубное влияние на организм при старении.
Обобщая вышесказанное, воспользуюсь случаем дать собственное определение, что такое старение. Старение – это результат разрушительного воздействия ошибок метаболизма и внешних стресс-факторов на индивидуальное развитие организма, выражающийся в компенсаторной гиперфункции и выходе из строя систем поддержания гомеостаза (от молекулярного до организменного уровня) и увеличении вероятности патологий и гибели индивидуума в совместимых с жизнью условиях обитания.
7 Критериев старения
У такого сложного явления, как старение, не может быть исчерпывающего определения. Тем не менее мы все же должны уметь отличать процессы старения от других изменений. Эта способность крайне необходима для того, чтобы осуществлять профилактику старения и связанной с ним нетрудоспособности, создавать и внедрять диагностику и терапию ранних стадий возрастзависимых заболеваний. На помощь могут прийти критерии, по совокупности которых мы можем выявить старение уже на ранних стадиях. Критерии – не то же самое, что симптомы: когда проявляется симптом, это означает, что процесс уже зашел достаточно далеко. Нам же необходимо определять те сдвиги в физиологии, которые приводят к возникновению и развитию симптомов.
Каждый критерий старения в идеале должен обладать несколькими свойствами: (1) он должен проявляться на самых ранних этапах естественного старения; (2) его экспериментальное обострение должно ускорить старение и (3) его предотвращение должно замедлить процесс старения и, следовательно, увеличить здоровый период жизни.
Критерий 1. Генетическая нестабильность
Основные функции нашего тела контролируются генами, находящимися в хромосомах ядра. В каждой клетке имеется всего две копии каждой хромосомы, да и те не являются идентичными – могут иметь разные варианты одного и того же гена (аллели). Поэтому повреждение молекул ДНК, из которых состоят хромосомы, может иметь печальные последствия для функций, выполняемых клеткой. Всплеск повреждений ДНК и мутаций, наблюдаемый при старении, носит название генетической нестабильности. Рассмотрим некоторые разновидности этой нестабильности.
Теломеры и теломераза
На концах каждой из хромосом имеются особые участки, называемые теломерами. Это важные области ДНК, за которые хромосомы прицепляются к внутренней оболочке клеточного ядра (рис. 22). На теломерах расположены особые белки, которые защищают хромосомы от атаки некоторых ферментов. Например, экзонуклеаз, в норме охраняющих наши клетки от вирусных ДНК, или лигаз, сращивающих обрывы нитей ДНК. Если бы не было теломер и связанных с ними защитных белков, экзонуклеазы отрезали бы от хромосом куски, а лигазы пришивали одни хромосомы к другим. Теломеры играют важную защитную роль, поэтому клетки с поврежденными хромосомами не способны поделиться или даже выжить, а иногда, напротив, начинают бесконтрольно делиться – становятся раковыми. Области хромосом, если они расположены близко от теломер, содержат большое количество метильной метки – это химическая модификация букв ДНК, способствующая более компактной упаковке нити ДНК и заставляющая молчать расположенные вблизи метилированного участка гены. Расположение теломер на самых концах хромосом приводит к тому, что с каждым клеточным делением они немного укорачиваются. Процесс укорочения хромосом при делении был предсказан советским иммунологом А. М. Оловниковым в 1971 году и экспериментально доказан нобелевскими лауреатами К. Грейдер и Э. Блэкберн. Укорочение теломер не всегда связано с делением клетки. На концах хромосом могут возникать опасные разрывы, например при избытке свободных радикалов, что также провоцирует укорочение хромосом. Э. Блэкберн указывает на положительное влияние здорового образа жизни на длину теломер. Здоровый образ жизни в целом удлиняет теломеры, тогда как стресс – укорачивает.
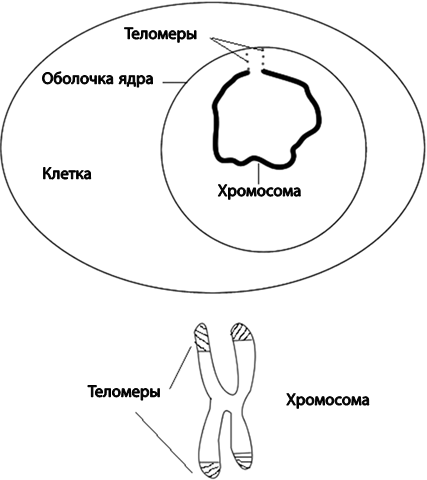
Рис. 22. Теломеры на концах хромосом в покоящемся ядре клетки (вверху) и на стадии клеточного деления (внизу)
В делящихся клетках с возрастом концы хромосом укорачиваются настолько, что они теряют защитный комплекс белков. В близко расположенных к укороченным теломерам генах также пропадает метильная метка, которая заставляла эти гены молчать. Прителомерные гены активизируются, что сеет хаос в сбалансированной системе клеточных белков. «Оголившиеся» концы воспринимаются клеткой как сигнал об обрыве. В отличие от обычного разрыва ДНК попытка клетки залечить такой «обрыв» по понятным причинам является безуспешной.
Далее возможны два варианта событий.
В одних клетках происходит необратимая остановка клеточных делений. Особенно неприятно, когда перестают делиться стволовые клетки – незрелые предшественники прочих типов клеток в каждой ткани. Это приводит к тому, что клеток нужной ткани определенного органа становится недостаточно, в результате чего нарушается функция этой ткани или органа. Например, от укорочения теломер с возрастом страдают клетки – основательницы клеток крови и клеток, выстилающих поверхность сосудов. Это является одной из причин анемий, иммунных расстройств и атеросклероза.
В других клетках при обнаружении псевдообрыва ДНК включается программа самоликвидации (апоптоза). Она также приводит к нарушениям в тканях.
О смертельной опасности укорочения концов хромосом говорит тот факт, что у лиц старше 60 лет, чем короче теломеры, например в лимфоцитах крови, тем более высокими являются показатели смертности от инфекционных и сердечно-сосудистых заболеваний.
Для того чтобы теломеры не укорачивались в половых клетках и эмбриональных стволовых клетках, в них активен специальный фермент – теломераза. Он достраивает теломеры после каждого деления. Однако в клетках большинства тканей и органов человека ген одного из компонентов теломеразы отключен или работает очень слабо. Побочным следствием такого выключения является так называемое репликативное старение – прекращение способности к делению. Природа пошла на этот шаг, чтобы обезопасить развивающийся организм от смертельного заболевания – рака. Обычные клетки не могут делиться более определенного числа раз, что тормозит образование опухолей. Действительно, теломераза каким-то образом реактивируется в большинстве видов опухолевых клеток, делая их защищенными от клеточного старения, практически бессмертными. В то время как обычные фибробласты делятся в чашках Петри примерно 50 раз и погибают, претерпевшие злокачественное перерождение способны делиться в клеточной культуре десятилетиями. Искусственная индукция теломеразы в обычных фибробластах тоже вызывает их бесконечное деление. Научной группе под руководством Марии Бласко удалось с помощью генной терапии вернуть активность теломеразы тканям старых мышей, в результате чего они стали жить дольше и меньше болеть возрастзависимыми заболеваниями.
Мутации
В 1958 году в статье «О природе процесса старения» Лео Сцилард, заложивший принципы создания атомной бомбы, выдвинул гипотезу о том, что элементарным событием старения является случайное повреждение хромосомы, инактивирующее ее гены. С возрастом накапливаются поломки хромосом не только в области теломер, но и по всей их длине. Это связано прежде всего с тем, что механизмы починки (репарации) ДНК перестают эффективно работать. Любое повреждение «букв» (нуклеотидов), из которых состоят наши гены, или разрыв цепочки ДНК на фоне недостатка репарации в стареющей клетке становится причиной мутации. Чем больше мутаций приобретает клетка, тем она менее жизнеспособна или выше риск, что она станет опухолевой.
УЗНАЙ БОЛЬШЕ
Ошибки в ДНК могут возникать также в процессе ее удвоения при делении клеток. Процесс этот сложный, он включает в себя несколько стадий. Сначала двойная спираль ДНК раскручивается и разделяется на две отдельные нити с образованием так называемой репликационной вилки. Легче всего вообразить этот процесс как расстегивание молнии на одежде. Затем специальные ферменты выполняют копирование каждой нити расплетенной двойной спирали ДНК. После этого происходит сплетение дочерних нитей с родительскими с образованием двух новых спиралей ДНК. В идеальном случае каждая дочерняя нить должна быть полностью идентичной материнской, но на практике в процесс могут закрадываться разнообразные ошибки. Это могут быть однобуквенные замены при неправильном копировании дочерней нити на материнской нити ДНК, а может быть запутывание нитей, ведущее к остановке репликационной вилки и разрывам ДНК (репликативный стресс). К репликативному стрессу ведут также межнитевые сшивки ДНК и сшивки ДНК с расположенными на ней белками. Эти неприятные явления вызываются уже знакомыми нам продуктами перекисного окисления липидов мембран и конечными продуктами гликирования, которых с возрастом возникает все больше.
Как показали сравнительные исследования, более долгоживущие виды животных обладают повышенной эффективностью или большим разнообразием механизмов репарации ДНК, защищающей от мутаций. Исследователям под руководством Joao Pedro De Magalhaes из Ливерпульского университета в 2015 году удалось расшифровать геном самого долгоживущего современного млекопитающего – гренландского кита. Как и ожидалось, кит имеет дополнительные копии и видоспецифические изменения генов, отвечающих за репарацию поврежденной ДНК. Этот факт может объяснить не только долголетие, но и устойчивость кита к возникновению раковых опухолей. До этого исследователям из группы Вадима Гладышева в Гарвардской медицинской школе было установлено, что другие долгоживущие млекопитающие – голый землекоп и ночница Брандта, тоже обладают характерными особенностями генов репарации ДНК.
Мобильныегенетические элементы
Еще одной причиной генетической нестабильности при старении является активизация «прыгающих генов» (мобильных генетических элементов, ретротранспозонов). Это вирусоподобные фрагменты ДНК, затаившиеся в наших хромосомах.
Как правило, они инактивированы при помощи большого количества метильных меток. В местах возникновения случайных разрывов ДНК хромосомы менее доступны для ферментов, расставляющих метильные метки, необходимые для поддержания прыгающих генов в молчащем состоянии.
При такой активации ретротранспозоны начинают копироваться и перепрыгивать на другие участки хромосомы.
Перепрыгивая с места на место, мобильные гены нередко прихватывают с собой фрагменты важных клеточных генов либо на новом месте встраиваются в другие гены, тем самым выключая их. Иногда, напротив, они включают гены, которые в норме должны молчать, предоставляя им свои системы активации. Происходит дестабилизация генома, приводящая к хаосу и клеточному старению.
Как показала Виктория Луняк, руководитель лаборатории Института старения Бака в Калифорнии, активность ретротранспозонов является ключевой причиной старения стволовых клеток костного мозга, а ее подавление приводит к восстановлению способности к регенерации данной ткани.
Примерно по тем же причинам, что и ретротранспозоны, в старых клетках активируются молчащие вирусные инфекции. В результате запускаются воспалительные реакции.
Синдромыускоренного старения
Важным доказательством того, что генетическая нестабильность является критерием старения, служат синдромы ускоренного старения. Все они, так или иначе, связаны с врожденными мутациями в генах, управляющими починкой ДНК. Такие мутации приводят к тому, что молодые люди или даже дети начинают проявлять признаки старения и выглядеть как пожилые. Ускоренное старение проявляется и в результате экспериментально вызываемых мутаций в генах восстановления ДНК у мышей.
Эпимутации
Несмотря на регулярные поломки хромосом и снижение эффективности их починки с возрастом, мутации довольно редки и накапливаются с возрастом медленно. Частота образования раковых заболеваний и других возрастзависимых патологий говорит о том, что изменения в активности генов при старении наступают гораздо быстрее. Как оказалось, другой тип изменений хромосом – эпимутации, то есть изменения активности генов без изменения последовательности ДНК, – наступает во много раз чаще и вносит более значительный вклад в старение. Эпимутации связаны с деактивацией или активацией генов за счет изменения рисунка метильных меток, расставленных по геному. Наличие метильных групп в буквах генетического кода заставляет ген замолчать, в то время как убирание метилирования вновь активирует ген. Все это нужно организму для того, чтобы на основе одного и того же генотипа создавать клетки и ткани с разным набором активных генов и синтезируемых ими белков. Те белки и функции, которые нужны нейронам головного мозга, ни к чему клеткам печени, и наоборот. А в нашем теле более 200 разных типов клеток.
Как известно, однояйцевые близнецы являются клонами – точными генетическими копиями друг друга. Метильный профиль их хромосом в одних и тех же сравниваемых тканях в раннем детстве тоже практически совпадает. Однако к старости рисунок метильной разметки хромосом близнецов резко отличается, несмотря на генетическую идентичность и одновозрастность. Таким образом, в различных тканях с возрастом хаотично накапливаются эпимутации, приводящие к изменению активности многих (от 1 до 10 %) генов. Как теперь известно, эпимутации являются причинами разных видов рака, атеросклероза, ишемической болезни сердца, диабета, болезни Альцгеймера.
С возрастом происходит глобальное деметилирование генома, вызывающее активацию генов, которые в норме должны «молчать». Оно провоцируется поломками хромосом, возрастным снижением активности ферментов, расставляющих метильную метку, избытком аминокислоты гомоцистеина, недостаточным уровнем половых гормонов. На вероятность деметилирования существенно влияют образ жизни человека и окружающая среда, включая особенности питания. Например, недостаток потребления и усвоения в старости витаминов – фолиевой кислоты и B12, микроэлементов цинка и селена.
Напротив, ряд важных генов, например гены рецепторов половых гормонов, теломеразы, репарации ДНК в некоторых тканях, испытывают избирательное гиперметилирование. Этот вид эпимутации приводит к отключению функции данного гена. Причины возрастного гиперметилирования пока неясны. Но уже сегодня понятно, что управление процессом метилирования может дать один из подходов к управлению старением.

