Энергетическое голодание клетки и киназа AMPK
Разменной энергетической валютой клетки является молекула АТФ. Большая ее часть образуется в митохондриях при сжигании глюкозы и жиров. От наличия АТФ зависят все строительные и ремонтные работы в клетке, поэтому ее недостаток тщательно отслеживается. Когда АТФ отдает энергию какому-либо клеточному процессу, она превращается в АМФ, которая поступает в митохондрии на «подзарядку». Количество АМФ в клетке, таким образом, является показателем энергетического голодания клетки. АМФ приводит к активации АМФ-зависимой киназы, AMPK. AMPK запускает процессы более бережного расходования клеткой энергии, расщепления запасов жирных кислот, аутофагии, подавляет синтез в клетках печени холестерина. В результате активации AMPK активизируются процессы поддержания достаточного количества стволовых клеток в тканях, увеличивается на клеточном уровне устойчивость к стрессам, уходит избыточная жировая масса, тормозятся новообразования. В экспериментах с животными активация AMPK способствовала увеличению продолжительности жизни. Стоит отметить, что уже упоминавшаяся киназа mTOR приводит к выключению AMPK.
Таблица 27
Вещества-активаторы киназы AMPK
Проще всего держать высокий уровень активности AMPK через периодическое голодание. Однако если поголодать нет возможности или не хочется, можно обратиться к продуктам, содержащим вещества, активирующие киназу AMPK (таблица 27).
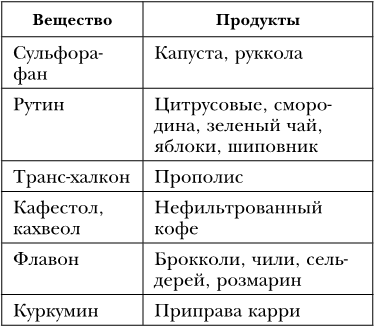
Действие токсинов, свободных радикалов и фактор транскрипции Nrf2
Нередко клетки подвергаются атаке свободных радикалов и других токсинов. Свободные радикалы могут образовываться на поверхности клетки из-за активности некоторых ферментов, связанных с метаболизмом фруктозы и мочевой кислоты. Кроме того, их продуцируют в больших количествах выработавшие свой срок поврежденные «клеточные электростанции» – митохондрии. В норме поврежденные митохондрии удаляются посредством аутофагии, однако этот процесс с возрастом угасает. Свободные радикалы перехватываются веществами-антиоксидантами, однако их эффективность не сопоставима с собственными антиоксидантными белками клетки. Для того чтобы в ответ на окислительный стресс клетка наработала необходимое количество антиоксидантных ферментов, активность их генов нужно активировать. Эта функция возложена на фактор транскрипции Nrf2. Кроме того, он отвечает за активность белков, обезвреживающих другие токсины, за сгорание в митохондриях избытка жирных кислот и блокирование образования новых жиров, он также подавляет воспаление.
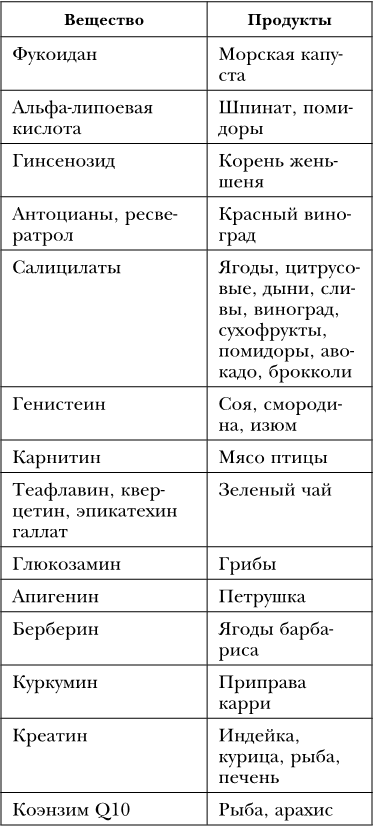
Таблица 28
Вещества-активаторы фактора транскрипции Nrf2
В повседневной пище в ряде продуктов есть вещества, активизирующие Nrf2. Это тот самый случай, когда в малых дозах умеренно вредное вещество может стать полезным, активизируя противотоксинную защиту клетки (таблица 28).
Стресс эндоплазматической сети
Эндоплазматическая сеть – это сплетение трубочек, пронизывающих все внутреннее пространство клетки. Она участвует в синтезе и передвижении по клетке белков, жиров и углеводов, в образовании оболочек клеток и клеточных структур.
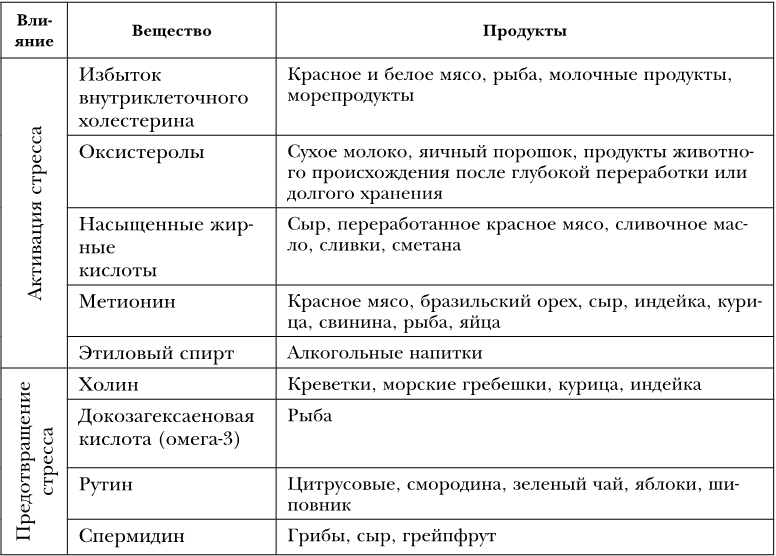
Когда в клетке в избытке образуются белки, или внутри клеток накапливаются насыщенные жиры, холестерин или этанол, эти факторы способствуют возникновению «стресса эндоплазматической сети», под которым понимают последовательность определенных процессов, ведущих в конечном итоге к старению или гибели клетки. При избытке поступления аминокислоты метионина на фоне недостатка витаминов группы B в организме накапливается гомоцистеин, также вызывающий стресс эндоплазматической сети. Именно стресс эндоплазматической сети лежит в основе патогенеза многих хронических заболеваний (рисунок). Поэтому неудивительно, что подавление этого типа стресса в модельных экспериментах продлевает жизнь. Существуют не только факторы, способствующие этому виду стресса, но и вещества, оказывающие профилактическое действие (таблица 29).
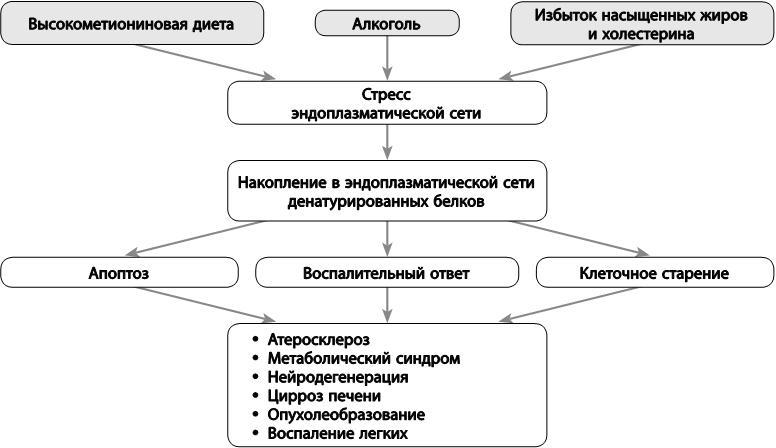
Рис. 5. Роль стресса эндоплазматической сети в возрастзависимых заболеваниях
Таблица 29
Факторы стресса эндоплазматической сети
Гипоксия, сосуды и факторы транскрипции PGC-1a и Hif-1
С возрастом все хуже работают легкие – легочная ткань перерождается в соединительную, снижается максимальное потребление кислорода. Все это, помноженное на проблемы с сосудами, приводит к кислородному голоданию многих тканей (гипоксии). Особенно серьёзно эта проблема стоит в метаболически высокоактивных тканях – головном мозге, сердечной мышце, почках и печени.
Установлено, что повысить устойчивость тканей к гипоксии способны некоторые питательные вещества, такие как нарингенин, гесперидин, кверцетин (они содержатся в цитрусовых), пирролохинолинхинон (есть в киви и петрушке), ресвератрол (в красном винограде, голубике, арахисе).
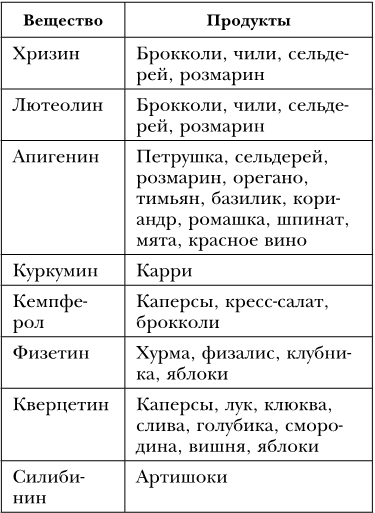
При гипоксии в клетке активируется важный белок – фактор транскрипции Hif-1, который вызывает активацию генов, необходимых для ее выживания. Его активность в профилактических целях, чтобы повысить устойчивость к гипоксии, можно вызвать, не прибегая к кислородному голоданию, воздействуя на клетку некоторыми веществами (таблица 30).
Гипоксия приводит к уменьшению количества в клетке митохондрий – именно они являются потребителями доставляемого с кровью кислорода и дают энергетическую валюту клетке АТФ. Если гипоксия кратковременная, например при гипоксической тренировке, убираются в основном отслужившие митохондрии, а на их место приходят новые. При хронической гипоксии митохондрий становится все меньше и ткань страдает от энергетического голодания.
Таблица 30
Вещества – активаторы фактора транскрипции Hif-1
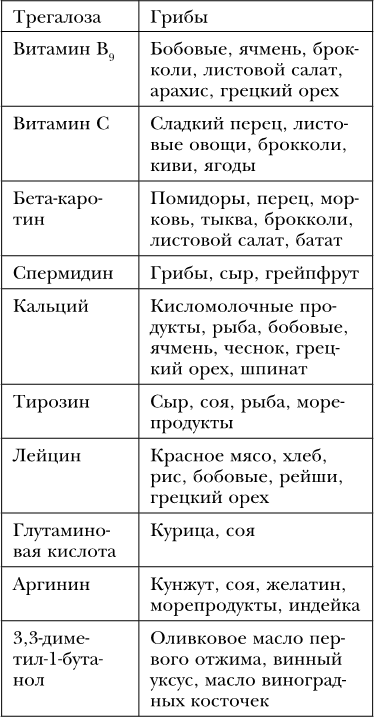
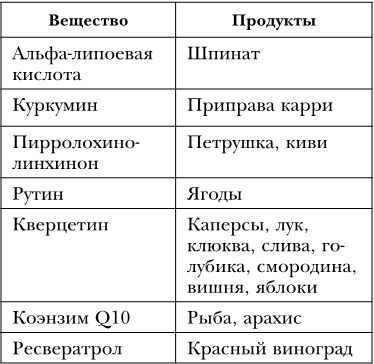
Восстановлением количества митохондрий в клетке руководит фактор транскрипции PGC-1a. Его активность можно регулировать (таблица 31).
Таблица 31
Вещества – активаторы фактора транскрипции PGC-1a
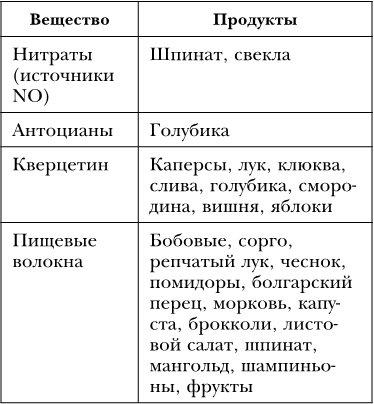
Одной из причин гипоксии тканей с возрастом являются нарушения в сосудах – изменение их проницаемости, тонуса, появление атеросклеротических бляшек. Свою негативную роль играют избыточное употребление красного мяса и сливочного масла. Несмотря на свою плохую репутацию, сосудам нужны нитраты, из которых образуется гормон оксид азота, и т. д. (таблица 32).
Таблица 32
Вещества, улучшающие состояние сосудов