5. Альфа-спираль
Сэр Лоренс Брэгг был представителем «тех самых» ученых – с детской страстью к исследованиям, которая в нем не угасала. Ко всему прочему, он был увлеченным садоводом. Когда он в 1954 г. возглавил Королевский институт на Олбемарл-стрит в Лондоне, ему пришлось съехать из своего большого дома с садом на Вест-роуд в Кембридже и переселиться в служебную квартиру на верхнем этаже. Тоскуя по саду, он нанялся раз в неделю вечером работать садовником у какой-то дамы, жившей в Болтонс – престижном районе старого Лондона. Он почтительно приподнял шляпу и представился ей как Вилли. Несколько месяцев все шло хорошо, но однажды у хозяйки оказалась гостья, которая, глянув в окно, воскликнула: «Боже мой, а что у тебя в саду делает сэр Лоренс Брэгг?» Не много я могу представить себе ученых его уровня, способных такое вытворить.
У Брэгга был великий дар упрощать проблемы: он понимал, что многие явные осложнения отпадут, если будет обнаружена базовая закономерность. Потому неудивительно, что в 1950 г. он захотел продемонстрировать, что по крайней мере некоторые отрезки полипептидной цепочки белка укладывались простым способом. Этот подход был не вполне нов. Билл Астбери, специалист по кристаллографии, пытался изучать данные рентгенограмм по кератину (белку волос и ногтей), опираясь на молекулярные модели, состоящие из повторяющихся последовательностей. Он обнаружил, что кератиновые волокна дают два типа рисунка дифракции, которые он назвал α и β. Его гипотеза о структуре β-кератина была недалека от истины, но с предположением о строении α-кератина он попал «в молоко». Отчасти это произошло потому, что он был неряшлив в построении моделей и недостаточно тщательно рассчитал нужные углы и расстояния, а отчасти потому, что результаты эксперимента запутывали дело непредвиденным образом.
Было хорошо известно, что любая цепочка из одинаковых повторяющихся звеньев, каждое из которых укладывается абсолютно одинаково и образует одинаковые связи с соседними, свернется в спираль (точнее, в винтовую линию). Крайние варианты – прямую линию и окружность – можно рассматривать математически как вырожденные варианты винтовой линии.
По первому образованию Брэгг был физиком, и основная часть его исследований молекулярной структуры касалась неорганических веществ, таких как силикаты. Он не был особенно хорошо знаком с органической химией или смежной с ней физической химией, хотя, естественно, владел основами этих дисциплин. Он решил, что лучше всего начать с построения регулярных моделей полипептидного остова, опустив сложности различных боковых цепочек. Остовом полипептидной цепи служит регулярная последовательность атомов с повторяющимся сочетанием …CH-CO-NH…, где C означает углерод, H – водород, О – кислород и N – азот. (Наглядная схема соединения атомов приведена в приложении А.) К каждому CH присоединена маленькая группа атомов, которая у химиков часто именуется R – от слова «радикал». Здесь мы будем называть R боковой цепочкой. Теперь известно, что существует лишь двадцать различных видов боковых цепочек, типичных для белков. Они характеризуют аминокислоты – небольшие молекулы, из которых образуется пептидная цепь. (Химические тонкости см. в приложении А.) У самой маленькой аминокислоты, глицина, R состоит всего из одного атома водорода – его и цепочкой-то назвать нельзя. Следующая по размеру называется аланин, и в качестве боковой цепочки у нее метильная группа (CH3). Другие бывают различного размера. Одни несут положительный электрический заряд, другие – отрицательный, третьи – вообще никакого. Большинство из них довольно малы. Самые крупные, триптофан и аргинин, содержат только по 18 атомов в боковых цепочках. (Названия всех двадцати (без формул) указаны в приложении Б.)
Когда синтезируется белок, соответствующие аминокислоты соединяются вместе головным концом к хвостовому, выделяя молекулу воды и образуя длинную цепь, называемую полипептидной. Как я уже объяснял, строгий порядок аминокислот в данном белке, диктуемый генами, определяет его свойства. Наша задача – узнать, как укладывается каждая отдельная полипептидная цепочка в трехмерной структуре белка и как именно все боковые цепочки (некоторые из них до какой-то степени гибкие) располагаются в пространстве, чтобы понять, как работает белок. Брэгг и его коллеги пытались, строя модели, понять, способна ли основная полипептидная цепь дать один или несколько вариантов регулярной укладки. Полученные Астбери α- и β-типы рентгенограмм косвенно указывали на то, что способна.
Поэтому они работали только с полипептидным остовом и игнорировали его боковые цепочки. Может возникнуть вопрос, зачем вообще понадобилось строить модели, ведь простая химическая структура звена остова была определена надежно. Все расстояния между связями и углы между ними были известны. Однако вокруг так называемых одинарных связей возможно достаточно свободное вращение (и напротив, оно невозможно вокруг двойных связей), а точная конфигурация атомов в пространстве зависит от того, как расположены углы этого вращения. Это, в свою очередь, обычно зависит от взаимодействий между атомами на некотором расстоянии друг от друга вдоль цепочки, и здесь может быть несколько допустимых вариантов, особенно если эти связи слабые.
Причина этой гибкости может нуждаться в пояснении. Проще всего пояснить ее на примере вашей руки. Расположите ладонь так, чтобы все пальцы оказались в одной плоскости, а большой – точно под прямым углом к указательному. Вы можете двигать большим пальцем так, чтобы угол оставался прямым, но трехмерная форма руки при этом меняется (см. рис. на с. 99). Даже при том, что все ближайшие соседние расстояния (длина каждого пальца) неизменны, как и углы между ними. Только так называемый двугранный угол (между плоскостью четырех пальцев и плоскостью, в которой находятся большой и указательный пальцы) меняется. Примером «взаимодействия на малом расстоянии», о котором шла речь, будет перемена расстояния между кончиком большого пальца и кончиком мизинца.
В случае молекулы какие-то взаимодействия существовать должны, если молекуле необходимо принять определенную конфигурацию. Было очевидно, что наилучший способ скрепления полипептидной цепи – образовать водородные связи между определенными атомами остова. Водородные связи – слабый вид связей. Их энергия лишь в десяток раз превышает энергию теплового движения молекул (при комнатной температуре), поэтому отдельная водородная связь легко рвется при постоянном тепловом возбуждении. Это одна из причин, по которым вода жидкая при нормальной температуре и давлении. Водородная связь образуется между атомом-донором (плюс атом водорода, с которым он связан) и реципиентом. В полипептидной цепи единственный сильный донор – аминогруппа NH, а единственный возможный реципиент – кислород в группе CO (карбоксильной). Джон Кендрю указал, что такая водородная связь по сути дает кольцо атомов определенного вида. Вычислив все возможные кольца такого вида, можно вычислить и все возможные структуры этого типа, каждая из которых будет определяться связью аминогруппы NH с конкретной карбоксильной группой CO, например, отстоящей на три звена в цепочке. Эта связь будет повторяться снова и снова по всей длине цепи. Образованные таким путем множественные водородные связи помогают стабилизировать структуру, защищая ее от разрушительной силы теплового движения.
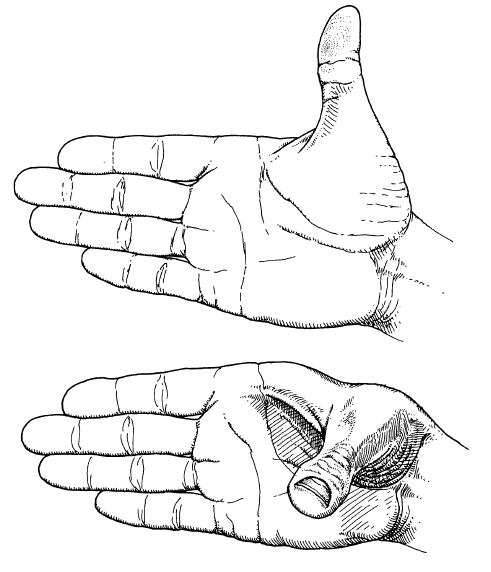
Показано, как можно поворачивать большой палец, чтобы изменить конфигурацию кисти, сохраняя все непосредственные углы и расстояния.
Используя металлические модели атомов с точным соблюдением масштабов связей, Брэгг, Кендрю и Перуц пытались смоделировать все возможные варианты укладки, отбрасывая лишь те, что были недостаточно компактны. Они надеялись, что какая-нибудь из моделей лучше подойдет для объяснения данных рентгенограмм, чем прочие. На беду, они не допустили для моделей наиболее благоприятных конфигураций. Астбери показал, что рентгенограмма α-типа дает яркую точку на так называемом меридиане, с шагом, соответствующим повтору вдоль оси волокна в 5,1 ангстрем. Это указывало, что какой-то существенный элемент структуры регулярно повторяется с таким интервалом и, возможно, это расстояние между соседними изгибами. Поскольку точка наблюдалась строго на меридиане, это указывало, что винтовая ось симметрии (элемент симметрии у правильной винтовой линии) имеет целочисленное значение, хотя и нельзя было понять какое. Брэгг допускал, что ось может быть двойной, тройной, четверной, даже пятеричной и более. Как уже говорилось, у куска обоев – двумерной последовательности повторяющегося рисунка – не бывает симметрии пятого порядка, но не предвиделось причин, по которым у отдельной полипептидной спирали не может быть пятеричной винтовой оси симметрии. Это всего-навсего означает, что, если повернуть спираль на 72 градуса (360/5) и одновременно сдвинуть ее структуру вдоль оси на определенное расстояние, она останется той же самой, если пренебречь тем, что произойдет на ее концах.
По этой причине Брэгг, Кендрю и Перуц строили все свои модели, исходя из целочисленных осей. Кроме того, их построения были несколько небрежны. Одну определенную группу атомов, так называемую пептидную группу, следовало в действительности рассматривать как плоскостную – все шесть ее атомов располагаются примерно в одной плоскости, – тогда как они допускали вращение вокруг пептидной связи, что делало их модели слишком вольными. Короче говоря, они сделали слишком жесткие ограничения для одного параметра (оси винтовой симметрии) и слишком мягкие – для другого (расположения пептидной связи на плоскости). Неудивительно, что все их модели выходили корявыми, и они не могли определить, какая лучше. Без особой охоты они опубликовали свои результаты в «Трудах Королевского общества», даже несмотря на их невнятность. Вышло так, что меня попросили вычитать гранки этой статьи (по-моему, гранки прислали в тот момент, когда все три соавтора отсутствовали в лаборатории), но я слишком плохо разбирался в тонкостях вопроса, чтобы понять, что именно было не так.
Мои коллеги не знали о том, что Лайнус Полинг следовал тому же подходу. В настоящее время он известен широкой публике главным образом в качестве пропагандиста витамина С. В то время он был, вероятно, ведущим химиком мира. Он первым применил квантовую механику в химии (объяснив по ходу дела, например, почему валентность углерода равна четырем) и был профессором химии в Калифорнийском технологическом институте, где руководил несколькими группами очень одаренных исследователей. Его особенно интересовало применение органической химии для объяснения ключевых биологических явлений.
Полинг описывает, как он впервые додумался до спирали, лежа в постели с простудой, которую схватил во время поездки в Оксфорд, куда его пригласили прочесть курс. Его основная статья об альфа-спирали вышла, наряду с рядом других его работ, в весеннем выпуске «Трудов Национальной академии наук» за 1951 г. Полинг уже знал, что пептидная связь в общем приближении плоскостная, главным образом потому, что он был более тесно знаком с органической физической химией, чем кембриджская троица. Он не пытался выстроить модель с целочисленным значением симметрии, а позволил моделям естественным образом сворачиваться в любую спираль, как им угодно. Кратность симметрии альфа-спирали оказалась равной всего 3,6 аминокислотным остаткам на один виток. Он также обратил внимание на статью Бэмборда, Хэнби и Хэппи, специалистов по полимерам, о рентгеновской дифракции на синтетическом полипептиде, где результаты вполне согласовывались с его моделью. Тот факт, что его модель не объясняла рефлекс в 5,1 ангстрем на меридиане, он проигнорировал. Ирония судьбы заключалась в том, что Брэгг, Кендрю и Перуц, среди прочих моделей, сконструировали такую, которая по существу была альфа-спиралью, но они искорежили ее, бедную, чтобы добиться строго четверной кратности. Из-за этого модель выглядела слишком натянутой, да она такой и была.
Вскоре стало очевидно, что альфа-спираль Полинга была верным решением. Брэгг был в унынии. Он медленно поднимался по лестнице. (Когда у Резерфорда дела шли хорошо, он прыжками взлетал по лестнице, распевая «Вперед, воители Христовы».) «Величайшая ошибка в моей научной карьере», – говорил Брэгг по этому поводу. Досаду усугубляло то, что не кто иной, как Полинг решил проблему, потому что Полингу уже случалось раньше уделать Брэгга. Перуц вспомнил, что однажды после его собственного семинара местный специалист по физической химии сказал ему, что пептидная группа должна быть плоской. Перуц даже сделал письменную заметку, но так и не использовал эти сведения. Не то чтобы они вовсе не пытались получить полезный совет – просто советы, которые они получали, порой оказывались неудачными. Например, Чарльз Каулсон, химик-теоретик из Оксфорда, сказал им в моем присутствии, что атом азота может быть «пирамидальным», что оказалось весьма ошибочной информацией.
Самолюбие Перуца несколько успокоилось, когда он обнаружил, что альфа-спираль должна давать яркий рефлекс на меридиане на расстоянии в 1,5 ангстрема, соответствующем высоте между последовательными звеньями спирали, и сумел подтвердить это. Совместно с двумя другими кристаллографами, Владимиром Вандом из университета Глазго и Биллом Кохрейном из Кавендишской лаборатории, я занимался общими вопросами преобразований Фурье для последовательности атомов, расположенных на правильной винтовой линии, и мы с Кохрейном продемонстрировали, что расчеты вполне согласуются с картинкой рентгеновской дифракции для синтетического полипептида. Но в некоторых отношениях мы сами себе сыпали соль на раны.
Чем же тогда объяснялось обманчивое пятно на 5,1 ангстрем? Чуть позже я и Полинг независимо друг от друга додумались до правильного объяснения. Поскольку ось симметрии у них дробная, спирали не укладываются просто так в ряд бок о бок. Лучше всего они упаковываются, когда между ними есть небольшой угол, и, если они слегка искривлены, это дает двойную намотку – то есть две или три спирали, уложенные в ряд, но медленно наматывающиеся друг на друга [отличный пример того, как слабое взаимодействие нарушает симметрию]. Эта дополнительная намотка отбрасывала проекцию рефлекса в 5,4 ангстрем, смещенного от меридиана, на меридиан в 5,1 ангстрем.
Можно возразить, что, поскольку альфа-спирали встречаются почти исключительно в молекулах живой материи, модель полипептидного остова не стоит отбрасывать лишь потому, что она некрасива. Я бы предпочел сказать, что в силу своей молекулярной простоты базовая альфа-спираль стоит ближе к физической химии, чем к биологии. На этом уровне у эволюции не так много возможностей для выбора. Только когда мы переходим к боковым цепочкам и многообразным способам, которыми способна укладываться длинная полипептидная цепь, становится возможным огромное многообразие структур. Тогда простота уступает сложности. Элегантность, если таковая существует в природе, может быть не столь очевидной, и то, что поначалу кажется натянутым или даже безобразным, может быть наилучшим решением, на которое способен естественный отбор.
Эта история провала наших коллег, упустивших открытие альфа-спирали, произвела глубокое впечатление на нас с Джимом Уотсоном. Из-за нее я стал доказывать, как важно не слишком полагаться на единичный факт экспериментальных данных. Он может ввести в заблуждение, как, несомненно, это произошло с рефлексом 5,1 ангстрем. Джим высказывался немного резче, утверждая, что ни одна хорошая модель никогда не объясняла всех фактов, поскольку часть данных всегда обречена быть обманчивой или вовсе неверной. Теория, которая объясняла бы все данные, неминуемо будет «обтесанной» под них и потому подозрительной.
Иногда утверждают, будто Полингова модель альфа-спирали или его ошибочная модель ДНК вдохновили нас на идею, что ДНК – спираль. Это весьма далеко от истины. Тема спиралей витала в воздухе, и нужно было отличаться либо тупоумием, либо крайним упрямством, чтобы не подумать о спиральных линиях. Если Полинг чему-то и научил нас, то лишь тому, что точное и тщательное моделирование может содержать ограничения, с которыми в любом случае придется увязывать конечный ответ. Иногда таким образом можно получить верное представление о структуре, используя лишь минимум прямых экспериментальных данных. Таков был урок, который мы усвоили и которым пренебрегли Розалинда Франклин с Морисом Уилкинсом, пытаясь расшифровать структуру ДНК. Плюс необходимость не выдвигать таких посылок, которые нельзя время от времени подвергать сомнению. Следует также добавить, что у нас с Джимом была высокая мотивация добиться успеха, пусть мы и подходили к задачам нестрого; мы замечали успех с первого взгляда и быстро соображали, какие уроки можно извлечь как из побед, так и из поражений.
Открытие альфа-спирали стало важной вехой на тернистом пути молекулярной биологии, но оно не имело такого резонанса, как открытие двойной спирали ДНК. Поначалу мы надеялись, что, располагая базовыми сведениями об укладке альфа-спиралей и бета-складок, мы сможем расшифровать структуру белка путем прямого моделирования. К несчастью, большинство белков слишком сложны для этого. Коротко говоря, эти два структурных шаблона предупредили нас о том, чего можно ожидать от некоторых элементов строения белков, но они не раскрыли нам непосредственно секрета специфичности и каталитической активности конкретного белка. Напротив, структура ДНК сдалась сразу, откровенно подсказав, как именно реплицируются нуклеиновые кислоты. ДНК в конечном итоге намного более простая молекула, чем высокоспециализированный в ходе эволюции белок, и потому выдает свои секреты более охотно. Мы не знали этого наперед – нам просто повезло, что мы наткнулись на столь изящную структуру.
Полинг сыграл более важную роль в молекулярной биологии, чем порой принято думать. Он не только сделал ряд ключевых открытий (например, что серповидноклеточная анемия – заболевание на молекулярном уровне), но и проявлял верный теоретический подход к этим биологическим проблемам. Он был убежден, что многие необходимые нам объяснения можно получить, воспользовавшись общепризнанными идеями химии, в особенности химии макромолекул, и что знания о различных типах атомов, в первую очередь углерода, и о связях, их соединяющих [электростатические взаимодействия, ковалентные, водородные и ван-дер-ваальсовы связи], вполне достаточно, чтобы раскрыть тайны жизни.
Напротив, Макс Дельбрюк, начинавший как физик, надеялся, что биология поможет нам открыть новые законы физики. Дельбрюк, как и Полинг, работал в Калифорнийском технологическом институте. Он стал первопроходцем важных направлений в исследовании вирусов, называемых бактериофагами (или просто фагами), а также был одним из руководителей авторитетной группы по фагам, одним из младших участников которой был Джим Уотсон. Не думаю, что Дельбрюк особенно интересовался химией. Как большинство физиков, он считал химию довольно второстепенным прикладным применением квантовой механики. Он не мог вообразить, насколько необыкновенные структуры может создавать естественный отбор, – он не представлял себе даже, какое многообразие различных белков возможно в природе.
Время показало, что по крайней мере на текущий момент Полинг оказался прав, а Дельбрюк ошибался – что Дельбрюк и сам признал в своей книге «От духа к материи» (Mind into Matter). Все, что мы знаем о молекулярной биологии, по-видимому, находит объяснение в рамках стандартной химии. И теперь мы понимаем, что молекулярная биология – не второстепенная сторона биологических систем. Она – их сердцевина и основание. Практически все аспекты жизни заданы на молекулярном уровне, и без понимания природы молекул возможно лишь весьма отрывочное представление о жизни как таковой. Ни одна теория на высшем уровне не может считаться надежной, пока не подтвердится на молекулярном уровне.

