§ 4. Химические реакции
Во всех описанных процессах атомы и ионы не меняли своих напарников. Но, конечно, возможны обстоятельства, в которых сочетания атомов меняются, образуя новые молекулы. Это показано на фиг. 1.8. Процесс, в котором атомные партнеры меняются местами, называется химической реакцией. Описанные нами прежде процессы называются физическими, но трудно указать резкую границу между теми и другими. (Природе все равно, как мы это назовем, она просто делает свое дело.) На картинке мы хотели показать, как уголь горит в кислороде. Молекула кислорода состоит из двух атомов, сцепленных очень крепко. (А почему не из трех или даже не из четырех? Такова одна из характерных черт атомных процессов: атомы очень разборчивы, им нравятся определенные партнеры, определенные направления и т. д. Одна из обязанностей физики – разобраться, почему они хотят именно то, что хотят. Во всяком случае два атома кислорода, довольные и насыщенные, образуют молекулу.)
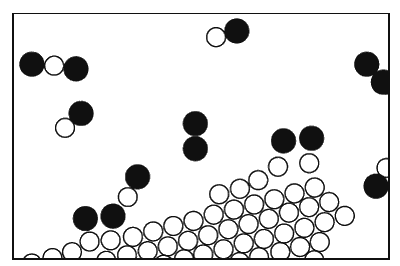
Фиг. 1.8. Уголь, горящий в кислороде.
Предположим, что атомы углерода образуют твердый кристалл (графит или алмаз). Одна из молекул кислорода может пробраться к углероду, каждый ее атом подхватит по атому углерода и улетит в новом сочетании углерод – кислород. Такие молекулы образуют газ, называемый угарным. Его химическое имя СО. Что это значит? Буквы СО – это фактически картинка такой молекулы: С – углерод, О – кислород. Но углерод притягивает к себе кислород намного сильнее, чем кислород притягивает кислород или углерод – углерод. Поэтому кислород для этого процесса может поступать с малой энергией, но, схватываясь с неимоверной жадностью и страстью с углеродом, высвобождает энергию, поглощаемую всеми соседними атомами. Образуется большое количество энергии движения (кинетической энергии). Это, конечно, и есть горение; мы получаем тепло от сочетания кислорода и углерода. Теплота в обычных условиях проявляется в виде движения молекул нагретого газа, но иногда ее может быть так много, что она вызывает и свет. Так получается пламя.
Вдобавок молекулы СО могут не удовольствоваться достигнутым. У них есть возможность подсоединить еще один атом кислорода; возникает более сложная реакция: кислород в паре с углеродом столкнется с другой молекулой СО. Атом кислорода присоединится к СО и в конечном счете образуется молекула из одного углерода и двух кислородов. Ее обозначают СО2 и называют углекислым газом. Когда углерод сжигают очень быстро (скажем, в моторе автомашины, где взрывы столь часты, что углекислота не успевает образоваться), то возникает много угарного газа. Во многих таких перестановках атомов выделяется огромное количество энергии, наблюдаются взрывы, вспыхивает пламя и т. д.; все зависит от реакции.
Химики изучили эти расположения атомов и установили, что любое вещество – это свой тип расположения атомов.
Чтобы объяснить эту мысль, рассмотрим новый пример. У клумбы фиалок вы сразу чувствуете их «запах». Это значит, что в ваш нос попали молекулы, или расположения атомов особого рода. Как они туда попали? Ну, это просто. Раз запах – это молекулы особого рода, то, двигаясь и сталкиваясь повсюду, они случайно могли попасть и в нос. Конечно, они не стремились попасть туда. Это просто беспомощные толпы молекул, и в своих бесцельных блужданиях эти осколки вещества, случается, оказываются и в носу.
И вот химики могут взять даже такие необычные молекулы, как молекулы запаха фиалок, проанализировать их строение и описать нам точное расположение их атомов в пространстве. Мы, например, знаем, что молекула углекислого газа пряма и симметрична: О-С-О (это легко обнаружить и физическими методами). Но и для безмерно более сложных, чем те, с которыми имеет дело химия, расположений атомов можно после долгих увлекательных поисков понять, как выглядит это расположение. На фиг. 1.9 изображен воздух над фиалками.
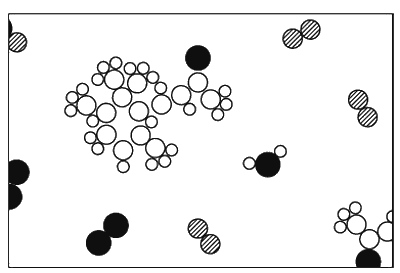
Фиг. 1.9. Запах фиалки.
Снова мы находим здесь азот, кислород, водяной пар… (А он-то откуда здесь? От влажных фиалок. Все растения испаряют воду.)
Среди них, однако, витает «чудовище», сложенное из атомов углерода, водорода и кислорода, облюбовавших для себя особого вида расположение. Это расположение намного сложнее, чем у углекислоты. К сожалению, мы не можем его нарисовать: хотя оно известно химикам очень точно, но оно ведь трехмерное, а как его изобразишь в двух измерениях?! Как нарисовать шесть углеродов, которые образуют кольцо, но не плоское, а «гармошкой»? Все углы, все расстояния в ней известны. Так вот, химическая формула – это просто картина такой молекулы. Когда химик пишет формулу на доске, он, грубо говоря, пытается нарисовать молекулу в двух измерениях. Например, мы видим кольцо из шести углеродов; углеродную цепочку, свисающую с одного конца; кислород, торчащий на конце цепочки; три водорода, привязанные вон к тому углероду; два углерода и три водорода, прилепленные вот здесь, и т. д.
Как же химик узнает, что это за расположение? Возьмет он две пробирки с веществом, сольет их содержимое и смотрит: если смесь покраснела, значит, к такому-то месту молекулы прикреплен один водород и два углерода; если посинела, то… то это ничего не значит. Органическая химия может поспорить с самыми фантастическими страницами детективных романов. Чтобы узнать, как расположены атомы в какой-нибудь невероятно сложной молекуле, химик смотрит, что будет, если смешать два разных вещества! Да физик нипочем не поверит, что химик, описывая расположение атомов, понимает, о чем говорит. Но вот уже больше 20 лет, как появился физический метод, который позволяет разглядывать молекулы (не такие сложные, но по крайней мере родственные) и описывать расположение атомов не по цвету раствора, а по измерению расстояний между атомами. И что же? Оказалось, что химики почти никогда не ошибаются!
Оказывается, что действительно в запахе фиалок присутствуют три слегка различные молекулы, они отличаются только расстановкой атомов водорода.
Одна из проблем в химии – это придумать такое название для вещества, чтобы по нему можно было бы узнать, какое оно. Найти имя для его формы! Но оно должно описывать не только форму, а указывать еще, что здесь стоит кислород, а вон там – водород, чтобы было точно отмечено, где что стоит. Теперь вы понимаете, почему химические названия так сложны. Это не сложность, а полнота. Название молекулы запаха фиалок поэтому таково: 4-(2,2,3,6-тетраметил-5-циклогексан)-3-бутен-2-он. Оно полностью описывает строение молекулы (изображенной на фиг. 1.10), а его длина объясняется сложностью молекулы.
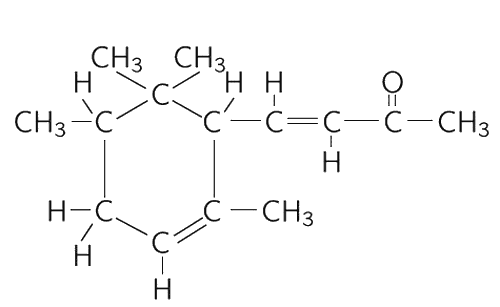
Фиг. 1.10. Структурная формула запаха фиалки.
Дело, значит, вовсе не в том, что химики хотят затуманить мозги, просто им приходится решать сложнейшую задачу описания молекулы словами!
Но откуда мы все-таки знаем, что атомы существуют? А здесь идет в ход уже описанный прием: мы предполагаем их существование, и все результаты один за другим оказываются такими, как мы предскажем, – какими они должны быть, если все состоит из атомов. Существуют и более прямые доказательства. Вот одно из них. Атомы так малы, что ни в какой микроскоп их не увидишь (даже в электронный, а уж в световой и подавно). Но атомы все время движутся, и если бросить в воду большой шарик (большой по сравнению с атомами), то и он начнет подрагивать. Все равно как в игре в пушбол, где большущий мяч толкают с разных сторон две команды. Толкают в разных направлениях, и куда мяч покатится, не угадаешь. Точно так же будет двигаться и «большой мяч» в воде: в разные моменты времени с разных сторон на него будут сыпаться неодинаковые удары. Поэтому когда мы глядим в хороший микроскоп на мельчайшие частички в воде, то видим их непрерывное метание – итог бомбардировки их атомами. Называется это броуновским движением.
Другие доказательства существования атомов можно извлечь из строения кристаллов. Во многих случаях их строение, определенное из опытов по прохождению рентгеновских лучей через кристаллы, согласуется по своему пространственному расположению с формой самогó природного кристалла. Углы между разными гранями кристалла согласуются с точностью не до градусов, а до секунд дуги с углами, высчитанными в предположении, что кристалл сложен из множества «слоев» атомов.
Все состоит из атомов. Это самое основное утверждение. В биологии, например, самое важное предположение состоит в том, что все, что делает животное, совершают атомы. Иными словами, в живых существах нет ничего, что не могло бы быть понято с той точки зрения, что они состоят из атомов, действующих по законам физики. Когда-то это не было еще ясно. Потребовалось немало опытов и размышлений, прежде чем высказать это предположение, но теперь оно повсеместно принято и приносит огромную пользу, порождая новые идеи в области биологии.
Да посудите сами! Если уж стальной кубик или кристаллик соли, сложенный из одинаковых рядов одинаковых атомов, может обнаруживать такие интересные свойства; если вода – простые капельки, неотличимые друг от друга и покрывающие миля за милей поверхность Земли, – способна порождать волны и пену, гром прибоя и странные узоры на граните набережной; если все это, все богатство жизни вод – всего лишь свойства сгустков атомов, то сколько же еще в них скрыто возможностей? Если вместо того, чтобы выстраивать атомы по ранжиру, строй за строем, колонну за колонной, даже вместо того, чтобы сооружать из них замысловатые молекулы запаха фиалок, если вместо этого располагать их каждый раз по-новому, разнообразя их мозаику, не повторяя того, что уже было, – представляете, сколько необыкновенного, неожиданного может возникнуть в их поведении. Разве не может быть, что те «тела», которые разгуливают по улице и беседуют с вами, тоже не что иное, как сгустки атомов, но такие сложные, что уже не хватает фантазии предугадывать по их виду их поведение; Когда мы называем себя сгустками атомов, это не значит, что мы – только собрание атомов, потому что такой сгусток, который никогда не повторяется, прекрасно может оказаться способным и на то, чтобы сидеть у стола и читать эти строки.

