Книга: Биология веры. Как сила убеждений может изменить ваше тело и разум
Назад: Эпигенетика: новая наука о самоуправлении
Дальше: Глава 3. Волшебница мембрана
Как жизненный опыт родителей влияет на генетику детей
Как теперь известно, такие тонкие подстройки под влиянием окружающей среды могут передаваться из поколения в поколение. В замечательной работе, опубликованной в номере журнала Molecular and Cellular Biology за 1 августа 2003 г., исследователи из Университета Дьюка доказывают, что за счет обогащенной среды можно даже преодолеть генные мутации у мышей. Ученые исследовали влияние пищевых добавок на беременных мышей – носительниц аномального «гена агути». Такие мыши имеют золотистую окраску и страдают ожирением, из-за которого становятся особо подвержены диабету, а также сердечно-сосудистым и онкологическим заболеваниям.
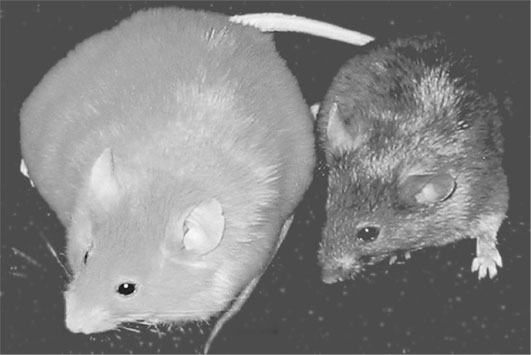
Сестры агути. Годовалые генетически идентичные женские особи мышей агути. Обогащенный метильными группами рацион матерей меняет окрас их потомства с золотистого на бурый, а также уменьшает частоту случаев ожирения, диабета и рака. (Фото предоставлено Джертлом и Уотерлендом©)
В ходе эксперимента группа страдающих ожирением мышей агути получала пищевые добавки, богатые метильными группами (продаются в магазинах здоровой пищи): фолиевую кислоту, витамин B 12, бетаин и холин. Богатые метилом добавки были выбраны потому, что перед тем ряд свидетельств показали, что эта группа принимает участие в эпигенетических модификациях. Прикрепляясь к молекуле ДНК, метильные группы изменяют условия для связывания с ней регуляторных хромосомных белков. Если такие белки связываются с ДНК чересчур сильно, белковый «рукав» оказывается невозможно удалить, и содержащиеся в ДНК гены не поддаются считыванию. Метилирование ДНК способно подавить или изменить генную активность.
На сей раз газетные заголовки наподобие «Диета побеждает гены» говорили чистую правду. Матери, получавшие пищевые добавки, обогащенные метильной группой, производили на свет обыкновенных бурых мышей нормальной комплекции, хотя у них присутствовал тот же самый ген агути, что и у их собственных матерей. Что же до матерей, не получавших таких добавок, то их потомки имели золотистый окрас, ели вдвое больше обычных мышат и набрали в конце концов намного больший вес, чем их поджарые сверстники «псевдоагути».
Приведенный на предыдущей странице снимок, предоставленный Университетом Дьюка, производит огромное впечатление. Будучи генетически идентичными, две мыши кардинально отличаются по внешнему виду. Одна из них поджарая и бурая, другая – тучная и желтая. Кроме того, хотя этого и нельзя увидеть на фотографии, тучная мышь страдает диабетом, а поджарая полностью здорова.
Другие исследования обнаружили, что эпигенетические механизмы являются причиной целого ряда заболеваний – онкологических, сердечно-сосудистых, диабета. Вообще говоря, только 5 % сердечников и раковых больных имеют право списывать свою болезнь на наследственность. Средства массовой информации, поднявшие большой шум вокруг открытия генов рака груди BRCA1 и BRCA2, почему-то гораздо меньше распространялись о том факте, что в 95 % случаев рак груди возникает не из-за уна следованных генов. У значительной части онкологических больных злокачественность возникает вследствие экологически обусловленных эпигенетических изменений, а не дефектов в генах. Не так давно выдающийся ученый и врач Дин Орниш открыл, что одна только смена диеты и образа жизни в течение 90 дней у пациентов с раком простаты меняет активность более чем 500 генов. Многие из этих генов изменяют биологические процессы, критически важные для формирования опухолей.
Эпигенетические свидетельства оказались столь убедительными, что некоторые особо смелые ученые даже рискнули вспомнить многократно обхаянного эволюциониста Жана-Батиста Ламарка, считавшего, что приобретенные при взаимодействии с окружающей средой признаки могут передаваться по наследству. Философ Эва Яблонка и биолог Марион Лэм в своей вышедшей в 1995 г. книге «Эпигенетическое наследование и эволюция – ламаркистский аспект» пишут: «В последние годы специалисты по молекулярной биологии установили, что геном – объект гораздо более подвижный и подверженный влиянию среды, чем предполагалось ранее. Они показали также, что информация может быть передана потомкам иными путями, нежели базовая последовательность (код) ДНК».
Итак, мы вернулись к тому, с чего начали эту главу, – к среде. В лаборатории мне приходилось неоднократно наблюдать, как перемены в окружении влияют на изучаемые мной клетки. Но только в конце моей научной карьеры в Стэнфорде я проникся этой идеей по-настоящему, когда обратил внимание, что эндотелиальные клетки, которые выстилают изнутри кровеносные сосуды, изменяют структуру и функцию в зависимости от среды. Например, если я добавлял в тканевую культуру раздражающие химические вещества, то клетки быстро превращались в некое подобие макрофагов – этих мусорщиков иммунной системы. Больше всего меня поразило, что превращение этих клеток происходило, даже если я разрушал их ДНК с помощью гамма-лучей. Эндотелиальные клетки таким образом были энуклеированы, однако они полностью меняли свое биологическое поведение в ответ на раздражающие вещества – как если бы их ядра оставались нетронутыми. Эти клетки явно служили примером некоего «разумного» управления при полном отсутствии генов.
Через двадцать лет после того, как мой учитель Ирв Кенигсберг посоветовал мне обращать внимание на среду, если с клетками что-то не в порядке, я наконец-то в полной мере оценил этот совет. ДНК не управляет живыми организмами, и ядро – не мозг клетки. Точно так же, как вы или я, клетки приспосабливаются к окружению, в котором они живут. Иными словами, для особо непонятливых: все дело в среде!
* * *
Бурлящее поле эпигенетических исследований не только придало Жану-Батисту Ламарку образ провидца – оно сделало похожим на него моего наставника, профессора Ирва Кенигсберга, вдохновившего меня на название этой главы. Опять же более чем пятьдесят лет спустя повторяю для особо непонятливых: все дело в среде!
Представьте себе Стэнфордское исследование, разрекламированное в прессе с заголовками вроде «Биология веры»! (Мне и сегодня приходится сдерживать себя, чтобы лишний раз не подчеркнуть, что новейшие исследования подтверждают выводы первого издания «Биологии веры». Это непросто, ведь долгое время мое заявление оставалось гласом вопиющего в пустыне.) Вот из U. S. News: «Окружающая среда одерживает победу над генами при формировании иммунной системы: исследования ученых». Из ScienceDaily: «Окружающая среда, а не гены, предписывает иммунные изменения у человека. Открытия ученых».
Согласно Стэнфордскому исследованию, три четверти изменений иммунной системы у однояйцевых близнецов происходили вследствие «ненаследственных» воздействий, связанных с окружающей средой, среди которых – микробы, токсины, диеты и вакцинации. По результатам этой работы воздействие факторов окружающей среды со временем сформировало иммунную систему обоих близнецов. Причем результаты у однояйцевых близнецов старше шестидесяти лет различались в большей степени, чем у близнецов младше двадцати лет. Стэнфордский микробиолог и иммунолог, ведущий исследователь Марк Дэвис заявляет: «Иммунная система здорового человека постоянно приспосабливается к встрече с враждебными микроорганизмами, дружественными кишечными микробами, пищевыми и другими компонентами, отодвигая на второй план влияние большинства наследственных факторов».
Все более очевидным становится ложность самого убеждения, будто программирование генома предсказывает, какими болезнями в жизни будут страдать люди. Что же до проекта «Геном человека», то вызванное им сомнение в традиционном понимании эволюции только увеличилось в масштабах. Когда я писал эту главу, исследования того времени предполагали, что у человека все-таки на 1 тысячу генов больше, чем у простого червя Caenorhabditis, но теперь даже это незначительное преимущество исчезло. Недавние технические достижения в чтении генов показали, что у человека их всего около 19 тысяч – или приблизительно столько же, сколько у этого червя. Более того, сегодня происхождение более 90 % генов человека отслеживается на более сотни миллионов лет тому назад – следовательно, в геноме червя и человека в основном содержатся схожие гены.
Таким образом, если вести счет эволюции в терминах генной метрики, то мы, люди, находимся значительно ниже к основанию «генеалогического древа» – картины, созданной в 1886 г. немецким эмбриологом Эрнстом Геккелем вскоре после того, как Дарвин, а потом Ламарк огласили свои представления об эволюции. У Геккеля эволюция животных прослеживается от простейших (бактерий) на стволе дерева до людей, занимающих его верхние ветви. Такая родословная имела смысл, когда ДНК расценивалась наукой как фактор управления жизнью, – ясно, что эволюционные биологи считали, что с продвижением по дереву более высокие эволюционные черты будут связаны со все большей генетической сложностью. Однако теперь, когда человек опустился к самому основанию генетического древа, стало более очевидным, что популяции генов не определяют эволюцию организма.
Вот еще один факт, который я привожу на своих лекциях в качестве предостережения против придания чрезмерного значения генам: ген кодирования кератина волос также определяет и все следующие структуры: кожу, ногти, когти, копыта и рога. То есть кодирующий синтез кератиновых белковых строительных блоков ген не контролирует способы использования молекул кератина.
Итак, кодирующие белок гены используются как строительные блоки клеток, но не определяют структуру организма или его сложность. Это ставит перед нами фундаментальный вопрос: кто же за это отвечает?
Поиски ответа приводят к следующему, совершенно неожиданному выводу из проекта «Генома человека»: гены, кодирующие белковые строительные блоки клеток, составляют менее 2 % от общего количества генома ДНК, и поэтому значительная часть ДНК не вносит вклада в популяцию белков клетки. Предположив, что эти ДНК не являются функциональными, Фрэнсис Крик обозначил их как «мусорные». Такой термин, с готовностью принятый публикой, раздражает большое число биологов, которым претит сама идея, что клетки несут в себе огромное количество «бесполезных» ДНК. Поэтому при обсуждении некодирующей ДНК генетики предпочитают использовать термин «темная материя».
Сосредоточившись на раскрытии тайн этой темной материи, консорциум ученых-генетиков создал проект Энциклопедия элементов ДНК, или ENCODE (сокращение от Encyclopedia of DNA Elements), чтобы разобраться в функциях так называемой «мусорной ДНК» генома. Исследования на момент публикации первого издания этой книги показали, что более 80 % некодирущих ДНК заняты регулированием производства и сборки белков, кодируемых генами. Большим открытием также стало, что «темные» ДНК содержат механизмы, благодаря которым информация об окружающей среде может использоваться для изменения считывания генов, кодирующих белок. Выяснилось, что темные ДНК используют эпигенетические механизмы, дающие человеческой клетке 19 тысяч генных программ, благодаря которым можно кодировать более сотни тысяч различных молекул белка!
Возможно, самым большим сюрпризом из находок консорциума, полученных по результатам 300 лет компьютерного времени, оказался вывод, что большая часть темных ДНК состоит из генетических «переключателей». Более четырех миллионов генетических переключателей в некодирующей ДНК образуют информационную кабельную систему, разобраться в которой почти невозможно. Такая система включает и выключает гены и обеспечивает механизм перезаписи структуры белка, кодируемой ДНК.
Подобная сложная информационная кабельная система напоминает мне игрушечный набор компании A. C. Gilbert Erector, от которого я был без ума в детстве. К ужасу родителей, в этот набор входили сотни запчастей, включая гайки и болты, различные металлические балки с размеченными отверстиями для сборки, шкивы, колесики, шестерни, а также маленький электромотор. Главное достоинство такого набора, как и современного конструктора LEGO в том, что пользователь может построить модель, а затем разобрать ее и без конца создавать из тех же частей нечто совершенно другое.
В аналогичном биологическом конструкторе гены являются кирпичиками физического здания, а некодирующая ДНК – «инструкцией» по сборке конкретных моделей (животных и растений) из набора, куда входят одни и те же кирпичики. Как и в конструкторе A. C. Gilbert Erector, из произведенных генами белков может быть собрано, разобрано, а затем вновь собрано множество разных организмов. Образ тела каждого организма, закодированный в темной ДНК, непосредственно связан с динамическим окружением через эпигенетические механизмы, интерпретирующие, переводящие и контролирующие активность генов, кодирующих белок.
Результаты деятельности Энциклопедии элементов ДНК существенно изменили исследовательские парадигмы, связанные с такими заболеваниями, как рак. До появления новых сведений о роли темной ДНК изучающие генетические заболевания ученые стремились лишь распознать мутации в генах генома, кодирующих белки. Но благодаря проводимой Энциклопедией оценке мы узнаем, как много связанных с заболеваниями мутаций скрывает темная материя или некодирующая ДНК, а также сколько их еще предстоит открыть. Объединив данные по проекту «Генома человека» и Энциклопедии элементов ДНК, исследователи могут распознать некодирующие участки ДНК, называемые «сверхчувствительными» областями. Эти участки мусорных ДНК показывают те же уровни мутаций, что и в кодирующих белок генах. Прочитав геномы 90 пациентов с раком груди, простаты и опухолью мозга, исследователи обнаружили около сотни мутаций некодирующих, сверхчувствительных областей, напрямую связанных с раком. Эти первые исследования таких ДНК, а также изучающие влияние некодирующей ДНК на другие заболевания сегодня находятся под пристальным вниманием.
Позитивный взгляд на жизнь, ощущение счастья и благодарности, служения и любви усиливают активность теломеразы и способствуют долгой и здоровой жизни.
Работы генетиков за последнее десятилетие не только принесли нам поразительные знания о структуре и функции некодирующих элементов генома (его «мусорной ДНК»), но и сообщили удивительные сведения, что лишь 2 % генома, кодирующих белки, влияют на здоровье и заболевания. Эти исследования проводились с участками ДНК, называемыми теломерами, находящимися на концах кодирующих белок генов. Хотя теломеры ДНК не кодируют белковые молекулы – не дают вклада в планирование структуры белка, – они обеспечивают две жизненно важные функции.
Во-первых, теломеры физически препятствуют разматыванию двойной спирали ДНК. Функция эта очень важна, потому что структурно неустойчивая, «изношенная» ДНК подвергает риску закодированную информацию для сборки функционального белка. С этой точки зрения, теломеры напоминают пластиковые наконечники на концах шнурков – эглеты. Когда эглет выходит из строя, нити на кончике шнурка расплетаются и изнашиваются, что препятствует его использованию. Сколько раз вам приходилось, испытывая свое терпение, просовывать толстый, обтрепавшийся шнурок в маленькую, крохотную проушину?
Во-вторых, теломеры служат физической основой для воспроизводства ДНК. Перед своим делением клетка должна дублировать свои ДНК так, чтобы каждая дочерняя клетка получила полный геном. В этом процессе фермент (ДНК-геликаза) расплетает двойную спираль, а большой белковый комплекс ДНК-полимераза прикрепляется к свободному концу нити ДНК. Фермент полимераза перемещается, как поезд по рельсам, вдоль всей этой нити. В этом процессе он собирает за собой дополняющую цепочку ДНК. Но когда «поезд» полимеразы доходит до конца нити, он сталкивается с технической проблемой… фермент не может дублировать ту часть ДНК, которой он равен по размеру (см. рисунок). Следовательно, всякий раз при дублировании нити ДНК она становится короче предыдущей копии, потому что «терминал» (или последний отрезок ДНК под ферментом полимеразы) не дублируется.
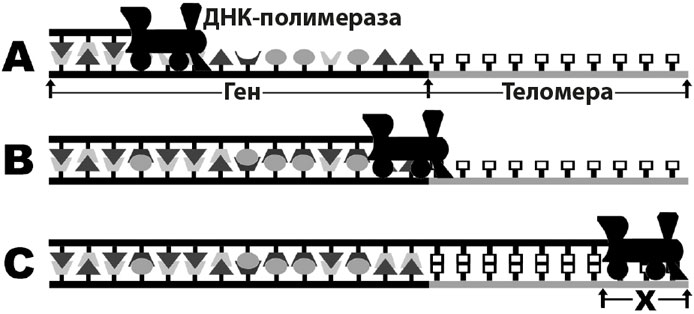
Репликация ДНК.
Перед копированием ДНК двойная спираль разделяется на две отдельные спиральные пряди. На схеме А фермент ДНК-полимераза, копирующий ДНК, изображен как локомотив поезда. Фермент полимераза движется по одной нити ДНК. Участок кодирования гена нити ДНК, обозначенный черными «рельсами», представляет собой последовательность оснований, кодирующих белок. Участок теломеры, обозначенный серыми «рельсами», – это некодирующая последовательность (белые «коробочки»). По мере движения полимеразы по ДНК она последовательно собирает дополнительную нитку ДНК. На схеме В новая дополнительная нить ДНК длиннее, так как полимераза скопировала больший объем изначальной нити. На схеме С полимераза достигла конца нити ДНК («рельсов»). Построение новой дополнительной молекулы ДНК завершено. Однако она короче исходного шаблона, потому что фермент полимераза не может скопировать ту часть ДНК, на которой он сам размещается (Х). Каждый раз при копировании новая нить ДНК короче предыдущей версии. После серии делений клеток длина теломеры доходит до нуля, и полимераза начинает отсекать кусочки ДНК, содержащие генетический код. Белок, синтезированный на основании укороченного кода ДНК, – некачественный и может стать причиной недееспособности клетки.
Теломеры предотвращают потерю кодирующей белок информации в ходе репликации гена, выделяя некодируемый участок ДНК, потеря которого не скажется на белке. Такая дополнительная длина ДНК позволяет «поезду» полимеразы терять часть ДНК, не ставя при этом под угрозу область, содержащую код белка. Длина теломеры определяет, сколько раз может копироваться ДНК, пока полимераза не пройдет всю кодирующую часть генома. Когда при частом делении клеток длина теломеры истощается, то последующие копии гена производят нефункциональные белки.
По мере накопления некачественного белка клетка работает с перебоями и в конечном итоге умирает, однако это происходит не так быстро! В 1960-е гг., проводя наблюдения за культивируемыми клетками, Леонард Хейфлик подсчитал, что они способны к безопасному делению на протяжении примерно пятидесяти поколений, прежде чем теломеры будут полностью утрачены, и последующие репликации ДНК станут воспроизводить дефектные белки, подвергающие риску здоровье клетки и способность к их дальнейшему делению. Понимание функции теломер привело его к убеждению, что продолжительность жизни человека определяется количеством делений стволовых клеток, которые способны при делении заменять миллиарды умирающих ежедневно клеток.
Однако не спешите впадать в депрессию из-за надвигающейся старости: у меня есть и хорошие новости! Клеточные биологи обнаружили особый фермент теломеразу, функция которого – удлинять теломеры. По своей деятельности теломераза – молекулярный эквивалент «фонтана молодости», которая повышает жизнеспособность и воспроизводство стволовых клеток. Активность теломеразы улучшает здоровье и продлевает жизнь.
Но есть одна ловушка. Жизненные переживания могут стимулировать или подавлять активность теломеразы. Например, стрессовые дородовые переживания, жестокое обращение в детстве (как вербальное, так и физическое), домашнее насилие, посттравматическое стрессовое расстройство (ПТСР), недостаток питания и отсутствие любви – все это препятствует активности теломеразы. Такие факторы способствуют возникновению болезней и сокращению продолжительности жизни. Зато физические упражнения, хорошее питание, позитивный взгляд на жизнь, ощущение счастья и благодарности, служения и любви – в особенности любви к себе, усиливают активность теломеразы и способствуют долгой и здоровой жизни. И действительно, недавнее канадское исследование показало, что пациенты с раком груди, которые занимались медитативной практикой наполненности ума, сохранили длину теломер, а в контрольной группе их длина стала короче.
В последующих главах мы рассмотрим этот вопрос подробнее, а пока скажу лишь, что основное влияние на длину теломер оказывает наш разум, на который воздействует программирование до возраста семи лет. И я утверждаю – ДА… мы можем сознательно сделать себя сильнее за счет активного увеличения нашей собственной теломеразы. Я буду и буду это повторять, опираясь на удивительные исследования, проведенные за последние десять лет: для особо непонятливых – все дело в среде!

