Книга: Биология веры. Как сила убеждений может изменить ваше тело и разум
Назад: Глава 2. Для особо непонятливых: все дело в среде!
Дальше: Как белки создают жизнь
Строительный материал живого – белок
Нам не составит труда понять, как и почему закрепилась метафора генного управления, если мы вспомним, с каким рвением ученые набросились на изучение механизмов ДНК. Химики-органики в свое время установили, что клетки состоят из четырех типов очень крупных молекул – полисахаридов (сложных сахаров), липидов (жиров), нуклеиновых кислот (ДНК и РНК) и белков. И хотя клетке необходимы все эти четыре типа молекул, наиболее важным компонентом живых организмов является белок. По существу, наши клетки представляют собой сооружения из белковых «кирпичей». Поэтому один из способов рассмотреть наши состоящие из триллионов клеток тела – это представить их себе в виде белковых машин (хотя, как вы уже знаете, я считаю нас чем-то большим, нежели машины!). Однако в действительности это несколько сложней, чем может показаться, хотя бы потому, что в нашем теле действуют более 100 тысяч белков различных видов.
Давайте внимательней присмотримся к тому, как соединены друг с другом в наших клетках эти сто с лишним тысяч белков. Каждый белок представляет собой линейную цепочку связанных друг с другом молекул аминокислот – что-то вроде детского ожерелья с бусинками (см. рисунок).

Каждая такая бусинка – это молекула одной из двадцати используемых в клетках аминокислот. При всей своей наглядности аналогия с бусами здесь не совсем верна, поскольку молекула каждой аминокислоты несколько отличается по форме от другой. Если быть совсем точным, то придется сказать, что наши бусы слегка помяли на фабрике.
А еще лучше принять во внимание, что аминокислотное ожерелье, этот «остов» клеточных белков, гораздо мягче и податливей бус, которые разорвутся, если их перегнуть чересчур сильно. Структура и поведение аминокислотных цепочек в белках во многом напоминает позвоночник змеи (фото на стр. 70). Составленный из множества связанных друг с другом элементов (позвонков), он дает возможность змее принимать самые разные формы – от прямой линии до клубка.
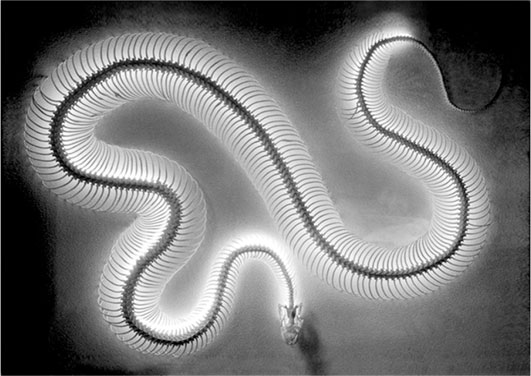
Гибкие сочленения (пептидные связи) между аминокислотами в белковой «змейке» позволяют белкам принимать множество конформаций. Какую из них примет «змейка» – определяется в основном двумя факторами. Прежде всего, это первичная структура белка, т. е. последовательность бусинок-аминокислот, которые его составляют.

В отличие от бусинок, каждая из 20 аминокислот, составляющих каркас белковой цепи, имеет собственную конфигурацию. Обратите внимание на то, как отличаются между собой «змейка» из одинаковых шариков, и та, что составлена из трубчатых сегментов различной формы.
Второй фактор связан со взаимодействием электрических зарядов в связанных друг с другом аминокислотах. Большинство аминокислот положительно или отрицательно заряжены, из-за чего они ведут себя подобно магнитам: одноименные заряды заставляют молекулы отталкиваться, а разноименные – притягиваться. Как показано на рисунке, гибкий остов белковой цепи легко принимает необходимую форму, когда его аминокислотные «позвонки» поворачиваются и изгибают соединяющие их сочленения, чтобы уравновесить силы, которые возникают из-за положительных и отрицательных зарядов.
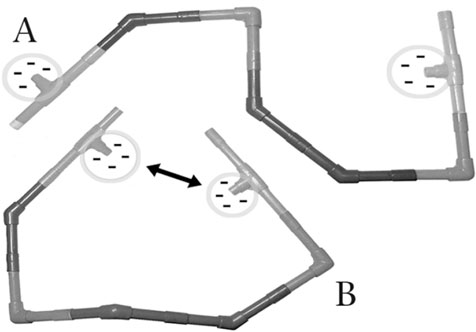
Белковые каркасы А и В имеют одну и ту же последовательность аминокислот (трубчатых сегментов), но кардинально отличаются по своей конфигурации. Вариации возникают из-за поворота соседних сегментов друг относительно друга в сочленениях. Подобно трубчатым сегментам, аминокислоты белков разных размеров также поворачиваются относительно соединяющих их «сочленений» (пептидных связей), из-за чего каркас приобретает способность извиваться, как змея. Форма белков не задана жестко, но обычно они принимают две-три конкретные конфигурации. Какую же из конфигураций, А или В, предпочтет наш гипотетический белок? Ответить на это можно, приняв во внимание, что две концевые аминокислоты несут отрицательный заряд. Поскольку одноименные заряды отталкиваются, конфигурация будет тем более устойчивой, чем дальше друг от друга они окажутся. Поэтому предпочтение будет отдано А.
Молекулярные цепи некоторых белков бывают такими длинными, что для сворачивания (фолдинга, или укладки) им необходима «помощь» особых вспомогательных белков, называемых хаперонами. Неправильно свернутые белки, подобно людям с дефектами позвоночника, не могут функционировать должным образом. Такие белки клетка маркирует как подлежащие уничтожению – соответствующая аминокислотная цепь разлагается на составляющие, и заново собирается другая в процессе синтеза новых белков.

