Синтез и круговорот АТФ (цикл АДФ-АТФ)
Несмотря на то что кофермент Q10 и L-карнитин представляют собой важнейшие условия нормальной работы митохондрии, они не могут производить АТФ, если клетка не обладает достаточным количеством АДФ качестве сырого материала. В конце концов, АДФ не появляется из воздуха по мановению волшебной палочки.
При нормальных обстоятельствах цикл АДФ-АТФ миллионы раз каждую секунду совершается в каждой клетке. Однако если запас кислорода исчерпан или ограничен или есть та или другая дисфункция митохондрий, то окислительное фосфорилирование (производство АТФ в митохондриях) прекращается или замедляется, в результате чего клетка использует АТФ быстрее, чем происходит замена топлива. (Мы помним, что окислительное фосфорилирование является основным источником АТФ – только две молекулы АТФ синтезируются вне этого процесса.)
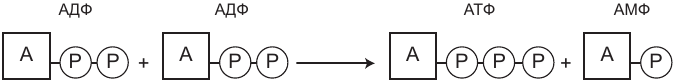
Рис. 2.1. Синтез АТФ посредством соединения двух АДФ. Этот процесс называется аденилаткиназной реакцией, или миокиназной реакцией. Кроме АТФ соединение двух АДФ приводит к появлению молекулы АМФ
Когда это происходит, концентрация АТФ в клетке уменьшается, а АДФ – увеличивается. В попытке исправить ситуацию клетка запускает процесс соединения двух молекул АДФ, вследствие чего в рамках процесса, называемого аденилаткиназной реакцией, формируются одна молекула АТФ и одна молекула АМФ (аденозинмонофосфата).
Эта реакция действительно сокращает количество накапливаемых в клетке молекул АДФ, но одновременно растет и число молекул АМФ. В результате перед клеткой встает задача справиться с обилием АМФ. Она делает это с помощью двух биохимических циклов реакций, продукты которых покидают клетку, что в итоге приносит ей вред, хотя удаление чрезмерного количества АМФ восстанавливает соотношение АТФ-АДФАМФ, общее количество соответствующих соединений в клетке становится гораздо меньше. Другими словами, клетка теряет свой энергетический потенциал вместе с потерей топливного сырья. Хорошим сравнением здесь является батарейка и ее электрическая емкость. Две батарейки ААА могут обеспечить энергией одинаковые устройства, так как обладают идентичными размером и функционалом. Однако время, которое пройдет до их истощения, определяется энергетической емкостью каждой из них и сильно отличается, в зависимости от качества конкретной батарейки. Скажем, батарейка с емкостью 1200 мА/час является более мощной и «держится» дольше, чем батарейка емкостью в 540 мА/час, даже если обе они относятся к батарейкам размера AAA.
Топливные блоки в клетке называются пуринами, и их потеря может иметь для клетки катастрофические последствия. К счастью, в случае дефицита пуринов организм сразу же начинает работать над их восстановлением, однако это длительный процесс, который может начаться только с помощью пятиуглеродного моносахарида D-рибозы.
Есть две биохимические цепочки реакций, в рамках которых происходит синтез D-рибозрибозы (начальный этап восстановления пула пуринов). Первый из них называется путем синтеза пуринов de novo. Этот каскад реакций является слишком медленным. Ученые подсчитали, что человеческому сердцу понадобилось бы больше сотни дней для того, чтобы синтезировать все необходимые ему пурины при использовании пути de novo. Организм просто не способен достаточно быстро производить D-рибозу для пути de novo, чтобы преодолеть свое болезненное состояние. Вернемся к нашей метафоре – целлюлозно-бумажному заводу. Создание новой D-рибозы с нуля подобно выращиванию деревьев в течение многих лет (вместо переработки использованной бумаги).
Второй путь может быть назван реутилизационным. При его использовании клетка вместо того, чтобы удалять за свои пределы конечные продукты распада АМФ, сохраняет их в качестве блоков для строительства D-рибозы. Однако и в этом случае скорость синтеза D-рибозы является недостаточно высокой.
Легкое решение проблемы – компенсация недостатка D-рибозы за счет внешних источников типа БАДов. В этом случае с организма снимается ответственность за производство собственной D-рибозы, которая может поступать в него в практически неограниченном объеме и с неограниченной скоростью.
Важность обладания большим запасом (и резервами) энергии позволяет сократить ущерб, возникающий в результате кислородной депривации (например, в случае нарушения кровообращения того или иного органа (напомню, такого рода ситуация называется ишемией), как это случается при инфаркте или инсульте). Мы знаем, что клетки умирают, если митохондрии прекращают вырабатывать энергию. При ишемии уровень кислорода в клетках падает, и митохондрии больше не могут производить энергию посредством окислительного фосфорилирования. Напоминаю, что, по мере того как клетка пытается компенсировать эту потерю с помощью объединения двух молекул АДФ и создания одной молекулы АТФ, растет и концентрация АМФ, вследствие чего клетка должна расщеплять молекулы аденозинмонофосфата, чтобы избавиться от них. Если к моменту нарушения кровообращения энергетический запас соответствующих клеток находится на низком уровне, то они быстро оказываются в катастрофическом положении (а пурины быстро вымываются из цитоплазмы). При наличии же относительно надежного запаса топлива клетка может продержаться сравнительно долго. Величина энергетического запаса определяет степень не подлежащего восстановлению ущерба, который наносится лишенному притока крови органу, будь это мозг, сердце или любой другой функциональный центр организма.
Отсюда следует, что восстановление кровообращения – основная задача при ишемии. Чем быстрее будет восстановлено кровоснабжение пострадавшего органа (и, стало быть, к нормальным значениям вернется уровень концентрации кислорода), тем больше останется пуринов в энергетическом пуле клеток пораженной части организма.
Картина кислородного дефицита является яркой и понятной в таких случаях, как инсульт или инфаркт, однако многие болезни вызываются менее явными нарушениями кровообращения. Речь идет о гипоксии – пониженном содержании кислорода в организме или отдельных органах и тканях. Одной из причин гипоксии является накопление бляшек в сердечных артериях, что приводит к ограничению полноценного кровотока. При гипоксии скорость синтеза АТФ падает, а вымывание пуринов из клеток, наоборот, ускоряется (хотя и в меньшей степени, нежели при выраженной ишемии). Клетки не могут производить столько энергии, сколько требуется для их нормальной работы. У гипоксии множество имен. Например, когда дефицит кислорода возникает в сердечно-сосудистой системе, речь идет о заболеваниях коронарных артерий или о застойной сердечной недостаточности.
Что ж, поскольку мы об этом заговорили, начнем обсуждение темы болезней с нарушений в сердечно-сосудистой системе.

