Книга: Гиппократ не рад. Путеводитель в мире медицинских исследований
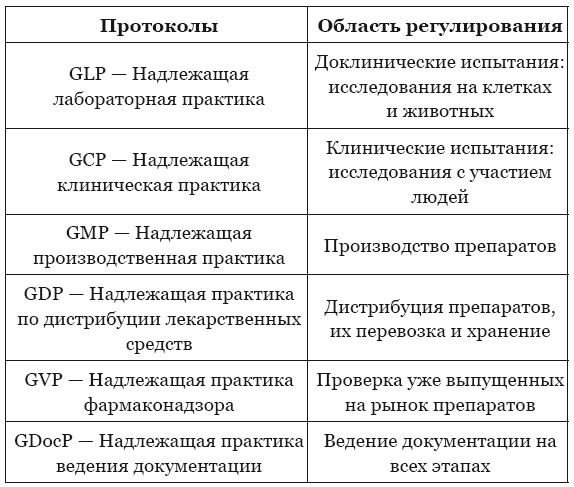
Назад: Надлежащая практика
Дальше: Медицинская статистика
А как у нас?
В России существуют аналоги всех указанных протоколов. Основное их отличие – язык. Да, действительно, производство лекарственных препаратов – это слишком серьёзная штука. Для того чтобы этим заниматься, необходимо получать специальную лицензию. Согласно Федеральному закону «Об обращении лекарственных средств» «обязательным условием предоставления лицензии на производство лекарственных средств является приложение к заявлению соискателя лицензии лекарственных форм и (или) видов фармацевтических субстанций, которые производитель лекарственных средств намерен производить». То есть если вы внезапно соберётесь открывать свою фармкомпанию, надо иметь чёткое представление о том, что же вы собираетесь производить, иначе лицензию вам не дадут. Также в законе указывается, что если вы соберётесь производить что-то новенькое, расширить своё производство и добавить туда пару новых веществ, то вам придётся получать новую лицензию. Такого рода лицензию получают в Министерстве промышленности и торговли, а действует она только в том субъекте России, где было получено, хотя и с несколькими оговорками. Этот же Федеральный закон подразумевает получение иных необходимых документов и сертификатов, а также наличие у работников специального образования.
В России аналогами являются различные ГОСТы, инструкции, стандартные операционные действия (это поэтапные инструкции, которым обязательно и без нареканий должны следовать все работники лаборатории). Но возьмём, например, ГОСТ 33044-2014p[27]. Данный ГОСТ действует с 2015 года на территории не только России, но и других стран Евразийского экономического союза. В самом документе на второй странице указывается, что «настоящий стандарт идентичен международному документу…», представляющему собой не что иное, как принципы надлежащей лабораторной практики.
Аналогично и с правилами клинических испытаний, и производства лекарств, и других протоколов: практически сразу указывается, что они были подготовлены на основе соответствующих зарубежных протоколов. Все эти документы являются обязательными для выполнения. В некоторых случаях, как, например, с ГОСТ Р 52249-2009[28], указывается, что стандарт идентичен какому-то документу Европейского союза, за исключением определённого приложения.
Назад: Надлежащая практика
Дальше: Медицинская статистика

