Исследование № 19
Генетическое разнообразие выше у тех, кто не заботится о потомстве
Материалом эволюционных изменений всегда служит генетический полиморфизм (разнообразие аллелей в генофонде популяции). Высокий уровень полиморфизма раздвигает рамки возможностей для отбора, что, по идее, должно повышать эволюционную пластичность вида, его способность адаптироваться к меняющимся условиям. Разные виды живых организмов очень сильно различаются по уровню внутривидового генетического полиморфизма. Причины этих различий не вполне ясны. Разобраться в этом помогло обобщение новых данных по генетическому разнообразию 76 видов животных, относящихся к 31 семейству и 8 типам. Ключевым фактором, коррелирующим с уровнем полиморфизма, оказался родительский вклад в потомство, который можно оценить по размеру особей на той стадии, когда они покидают родителей и переходят к самостоятельной жизни. Как выяснилось, низкий полиморфизм характерен для видов, выпускающих в мир немногочисленное, но зато крупное и способное за себя постоять потомство, а высокий – для тех, кто бросает многочисленных мелких, незащищенных потомков на произвол судьбы. Таким образом, забота о потомстве выступает одним из факторов, модулирующих эволюционный процесс.


Уровень генетического полиморфизма популяции (или вида в целом) считается в популяционной генетике важнейшим показателем, от которого зависят эволюционная пластичность вида, его приспособляемость к переменам среды и риск вымирания.
У разных видов животных уровень полиморфизма может сильно различаться. Например, у гепардов разнообразие крайне низкое. Это объясняется недавним “бутылочным горлышком” – экстремальным снижением численности, в результате которого почти весь предковый полиморфизм был потерян. Поэтому все ныне живущие гепарды являются близкими родственниками, а генетически они почти идентичны друг другу. У ланцетников, наоборот, полиморфизм рекордно высок. Это, предположительно, объясняется тем, что численность их популяции оставалась очень высокой в течение долгого времени.
Впрочем, одной лишь численностью популяции невозможно объяснить межвидовые различия по уровню полиморфизма. Выдающийся эволюционный генетик Ричард Левонтин еще в 1974 году называл объяснение этих различий центральной проблемой популяционной генетики. Однако добиться полной ясности в данном вопросе пока не удалось.
В теории проблема выглядит простой. Считается, что преобладающая часть имеющегося в популяции генетического полиморфизма – это нейтральные (не влияющие на приспособленность) различия. В большинстве случаев, скорее всего, так и есть. Дело в том, что наследственные вариации, влияющие на приспособленность (то есть не нейтральные), быстро распространяются или, наоборот, выбраковываются отбором. Поэтому основная масса генетических различий между особями в каждый момент времени – нейтральные или почти нейтральные, на которые отбор не действует и которые поэтому долго могут сохраняться в генофонде, не фиксируясь, но и не исчезая. Получается, в “идеальной” популяции (со случайным скрещиванием, неизменной численностью, равным числом самцов и самок и т. д.) должен поддерживаться постоянный, равновесный уровень полиморфизма, зависящий только от двух переменных: темпа мутагенеза (частоты появления новых нейтральных мутаций) и эффективной численности популяции, Ne. Последняя в идеале равна числу особей, участвующих в размножении, но в далекой от идеала реальности оценивать ее приходится сложными, окольными путями – например, по косвенным признакам, указывающим на силу генетического дрейфа (чем ниже Ne, тем сильнее должен быть дрейф; подробно об этом мы рассказали в книге “Эволюция. Классические идеи в свете новых открытий”).
У большинства видов измерить Ne затруднительно. Гораздо проще оценить обычную численность, N. Поскольку Ne все-таки должна (со всеми оговорками) положительно коррелировать с N, логично считать, что у видов с высокой численностью генетическое разнообразие должно быть в среднем выше, чем у малочисленных.
Эмпирические данные, однако, не дают этой гипотезе однозначного подтверждения. Похоже, различия по N позволяют объяснить лишь небольшую долю межвидовой вариабельности по уровню полиморфизма. Чем же объясняется все остальное? Большинство специалистов предполагают совокупное влияние множества факторов, таких как темп мутагенеза (прямые данные по которому есть пока лишь для немногих видов), популяционная структура (например, едина ли популяция или подразделена на какие-то части), отбор полезных мутаций, способный приводить к “выметанию” нейтрального полиморфизма из окрестностей мутантного локуса (потому что вместе с полезной мутацией распространяются те нейтральные варианты, которым повезло оказаться рядом с ней, а все прочие нейтральные варианты, встречающиеся в этом участке генома, вытесняются из генофонда; подробнее см. в нашей книге “Эволюция. Классические идеи в свете новых открытий”). Но главным фактором обычно считают историческую динамику численности, в том числе наличие в прошлом периодов резкого сокращения численности (как в случае с гепардами) или длительное их отсутствие (как в случае с ланцетниками).
Коллектив генетиков из Франции, Великобритании, Швейцарии и США попытался разрешить вопрос о факторах, определяющих уровень полиморфизма, при помощи современных методов секвенирования транскриптомов (совокупностей всех матричных РНК, “считываемых” с ДНК в ходе транскрипции). Ученые исследовали транскриптомы 76 видов животных, относящихся к разным ветвям эволюционного дерева (Romiguier et al., 2014). Изученные виды представляют 31 семейство животных, принадлежащих к 8 типам: нематодам, членистоногим, моллюскам, немертинам, кольчатым червям, иглокожим, хордовым и книдариям.
Всего было исследовано 374 транскриптома, то есть примерно по пять особей каждого вида. Этого достаточно, чтобы с приемлемой точностью оценить уровень полиморфизма белок-кодирующих последовательностей. В качестве меры нейтрального полиморфизма авторы использовали стандартный показатель – процент синонимичных различий между двумя случайно выбранными гомологичными последовательностями (обозначается πs). Он был подсчитан для каждого вида на основе попарных сравнений гомологичных мРНК.
Оказалось, что уровень полиморфизма варьирует в широких пределах. Рекордно низкое генетическое разнообразие обнаружилось у термита Reticulitermes grassei (πs = 0,1 %), максимальное – у морского брюхоногого моллюска Bostrycapulus aculeatus (πs = 8,3 %). Различие почти на два порядка!
Виды с высоким и низким полиморфизмом распределены по эволюционному дереву довольно хаотично. При этом родственные виды в среднем более сходны друг с другом по уровню полиморфизма, чем представители разных семейств. Этот факт противоречит гипотезе о том, что главным фактором, влияющим на полиморфизм, являются случайные перипетии популяционной истории. Ведь нет оснований полагать, будто у видов, относящихся к одному семейству, должна быть сходная историческая динамика численности.
Ученые сопоставили полученные значения πs с биологическими и другими характеристиками видов. Биологических характеристик было шесть: размер взрослой особи, масса тела, максимальная продолжительность жизни, подвижность (расселительная способность) взрослых особей, плодовитость и размер так называемой пропагулы (то есть особи на той стадии жизненного цикла, когда животное покидает родителей и переходит к самостоятельному существованию: у кого-то это беззащитная икринка, у кого-то – почти взрослая, тщательно выкормленная и выпестованная родителями молодь). Биогеографические и экологические характеристики были выбраны следующие: площадь ареала, приуроченность к широтным зонам, водный или наземный образ жизни.
Никакой корреляции полиморфизма с биогеографическими и экологическими показателями обнаружить не удалось. А все шесть биологических характеристик, напротив, достоверно коррелируют с полиморфизмом, в совокупности объясняя 73 % вариабельности видов по показателю πs. Наилучшим предиктором полиморфизма, намного превосходящим в этом отношении остальные пять переменных, оказался размер пропагулы (рис. 19.1).
Это и есть главная закономерность, обнаруженная исследователями: чем более крупных потомков выпускают родители в мир, тем ниже (в среднем) генетический полиморфизм вида. Размер пропагулы, в свою очередь, отрицательно коррелирует с плодовитостью, причем эта корреляция весьма сильна. Что неудивительно: мелких икринок вы можете выметать хоть миллион, а попробуйте-ка вырастить миллион слонят.
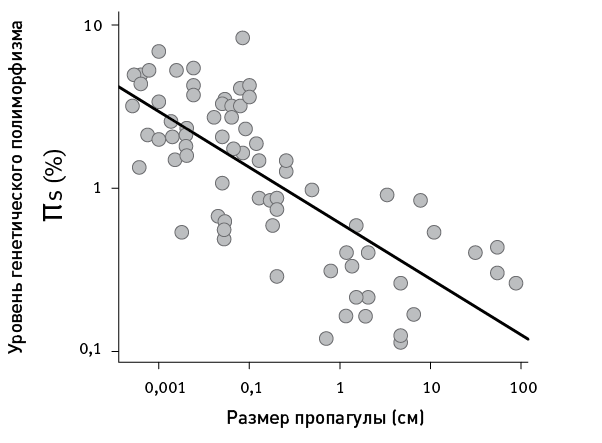
рис. 19.1. Размер пропагулы коррелирует с уровнем генетического полиморфизма (πs). По рисунку из Romiguier et al., 2014.
Таким образом, низкий полиморфизм характерен для животных, производящих небольшое число тщательно выпестованных, хорошо подготовленных к самостоятельной жизни потомков (это называют K-стратегией), а высокий – для тех, кто производит множество мелких и слабых потомков, бросая их на произвол судьбы (r-стратегия).
Размер взрослого животного коррелирует с полиморфизмом намного слабее. Это неожиданный результат, потому что размер взрослой особи, как правило, отрицательно коррелирует с численностью, то есть популяции крупных животных в среднем имеют меньшую численность. А меньшая численность предполагает пониженный полиморфизм. Поэтому логично было бы ожидать, что именно размер взрослого животного будет наилучшим предиктором полиморфизма, – но нет, эта логичная гипотеза не подтвердилась. Среди видов с низким полиморфизмом есть как мелкие животные, так и крупные. Виды одинакового размера могут иметь контрастно различающиеся уровни полиморфизма, если одни из этих видов – K-стратеги, а другие – r-стратеги. Например, из пяти рассмотренных видов морских ежей два не заботятся о потомстве, производя много мелких яйцеклеток с небольшим количеством желтка, и поэтому их потомкам приходится начинать самостоятельную жизнь в виде крохотных, питающихся бактериальным планктоном личинок – эхиноплутеусов. Три других вида относятся к “сумчатым” морским ежам, чьи самки производят крупные, богатые желтком яйца и вынашивают молодь в специальных выводковых камерах, представляющих собой видоизмененные органы дыхания. У этих видов пропагула, переходящая к самостоятельной жизни, – это уже вполне сформированный морской ежик диаметром в несколько миллиметров. Соответственно, у первых двух видов полиморфизм высокий, у трех остальных – низкий. При этом по размеру взрослых особей все пять видов мало отличаются друг от друга. Аналогичная картина характерна для K– и r-стратегов среди офиур, немертин, насекомых и др.
Что касается насекомых, то в категорию K-стратегов здесь попали эусоциальные виды: термиты, пчелы, муравьи. В данном случае очевидно, что по размеру взрослой особи нельзя судить об эффективной численности (Ne): численность (N) муравьев может быть очень высокой, что соответствует их небольшим размерам, но размножаются из них лишь немногие (Ne << N). Понятно, что K-стратегия, обусловленная эусоциальностью, ведет к резкому снижению Ne. В других случаях негативное влияние К-стратегии на Ne не столь очевидно.
Тем не менее авторы данной работы полагают, что обнаруженная связь между K-стратегией и низким полиморфизмом обусловлена именно отрицательным влиянием K-стратегии на эффективную численность, даже если природа этого влияния пока непонятна. Альтернативное объяснение могло бы состоять в том, что для K-стратегов характерен пониженный темп мутагенеза. Однако факты говорят скорее об обратном: темп мутагенеза (среднее число мутаций на геном за поколение), судя по всему, у K-стратегов выше, чем у r-стратегов. Одна из причин состоит в том, что K-стратеги живут в среднем дольше, а поколения у них разделены бóльшим числом клеточных делений. Так что различия в темпах мутагенеза скорее должны ослаблять, чем усиливать, найденную отрицательную корреляцию между вкладом в потомство и полиморфизмом.
Таким образом, исследование показало, что уровень генетического полиморфизма можно довольно точно предсказать, зная определенные биологические характеристики рассматриваемого вида, такие как величина родительского вклада в потомство, приверженность K– или r-стратегии и продолжительность жизни. Случайные колебания численности популяции, полагавшиеся до сих пор чуть ли не главным фактором, влияющим на уровень полиморфизма, по-видимому, играют менее важную роль. Хотя, конечно, нельзя отрицать их определяющее значение в некоторых частных ситуациях (как у тех же гепардов).
Исследователи полагают, что K-стратегия в долгосрочной перспективе должна коррелировать с более низкими значениями Ne, а r-стратегия – с более высокими. Возможно, дело в том, что K-стратеги, благодаря эффективной заботе о потомстве, в целом более толерантны к низкой численности популяции: они могут долго так существовать, не вымирая. Подобно гепардам, они способны успешно восстановиться даже после экстремальных снижений численности, когда от вида остается всего несколько десятков особей. Напротив, r-стратеги сильнее зависят от изменений среды, приводящих к резким колебаниям численности. Их стратегия более рискованная, поэтому в долгосрочной перспективе будут сохраняться только те виды, чья численность практически всегда остается высокой. Косвенно это рассуждение подтверждается палеонтологическими данными: во время массовых вымираний K-стратеги, по-видимому, имеют больше шансов выжить, чем r-стратеги. Например, во время великого вымирания на рубеже мела и палеогена 66 млн лет назад вымерли динозавры, у которых были большие проблемы с заботой о потомстве, но выжили птицы (впрочем, их теперь тоже относят к линии динозавров) и млекопитающие – ярко выраженные K-стратеги; вымерли аммониты (r-стратеги), но выжили наутилоидеи с крупными пропагулами.
Это исследование заставляет задуматься об общих тенденциях эволюции K– и r-стратегов. На первый взгляд кажется, что у первых эволюционные перспективы должны быть в целом гораздо хуже, чем у вторых. У K-стратегов ниже смертность на ранних стадиях развития, что ограничивает возможности для естественного отбора. Как мы теперь знаем, у них ниже и нейтральный генетический полиморфизм, который считается важнейшим показателем “генетического благополучия” вида и эволюционной пластичности. У них, вероятно, в среднем ниже и эффективная численность популяции. Это способствует ослаблению отбора и усилению дрейфа, что, в свою очередь, должно замедлять отбраковку слабовредных мутаций и фиксацию слабополезных. Если посмотреть на ситуацию под таким углом, то становится вообще непонятно, почему K-стратеги до сих пор не вытеснены повсеместно r-стратегами. В действительности же, судя по палеонтологическим данным, тенденция скорее обратная, особенно у таких ключевых представителей наземной биоты, как сосудистые растения и тетраподы (наземные позвоночные). В этих группах в течение фанерозоя прослеживается явный сдвиг в сторону K-стратегии: беззащитные пропагулы в виде мельчайших спор и икринок уступают место увесистым семенам и подрощенным, хорошо упитанным детенышам. В целом из 34 типов животных представители 21 типа выработали ту или иную форму матротрофии – “подкармливания” потомства за счет материнского организма (Ostrovsky et al., 2015). Это явно говорит об эволюционной выгоде подобного свойства.
По-видимому, K-стратегия каким-то образом компенсирует все перечисленные недостатки. Одним из факторов может быть отмеченная выше толерантность к низкой численности, обусловленная меньшей зависимостью смертности от непредсказуемых колебаний среды: сравните положение беззащитных лягушачьих икринок в пруду и птичьих яиц в теплом гнездышке с заботливой наседкой. Кроме того, хотя у K-стратегов уровень смертности ниже, она наверняка более избирательна и неслучайна, чем у r-стратегов. Гибель мелких пропагул часто происходит случайно и вообще не зависит от качества генов. Возможно, отбор у K-стратегов даже при низком уровне смертности достаточно эффективен за счет более избирательной (зависящей от качества генов) элиминации. Наконец, можно допустить, что забота о потомстве делает многие потенциально вредные мутации (которые снизили бы шансы на выживание молодняка, будь он брошен на произвол судьбы) де-факто нейтральными. В этом случае часть значимого (несинонимичного) полиморфизма у K-стратегов в действительности может оказаться не мутационным грузом (слабовредными мутациями, не отбракованными своевременно из-за сильного дрейфа и слабого отбора), а нейтральным полиморфизмом, повышающим эволюционную пластичность.

