Бор: физик, философ, футболист
Следующий шаг в квантовой революции был сделан молодым датским физиком по имени Нильс Бор, который в 1911 году приехал в Англию, только что получив докторскую степень и прихватив с собой полное собрание сочинений Чарльза Диккенса (по которому он изучал английский язык). Само собой, Бор еще не был известным физиком, но считал научную карьеру более надежной, чем футбольную, хотя на любительском уровне он преуспел и в спорте. Однако до уровня своего младшего брата Гарольда, который играл в защите за датскую команду на Олимпиаде 1908 года и проиграл матч за золото Великобритании, он не дотягивал. Гарольд впоследствии стал очень уважаемым математиком.
Жизни Нильса Бора и автора этой книги пересеклись всего на два месяца, так что мне, к сожалению, не довелось повстречаться с ним. А если бы мне все же довелось с ним познакомиться, наша беседа вряд ли вышла бы особенно продуктивной. Но я много лет сотрудничал с человеком, который знал его очень хорошо. Физик-теоретик Йенс Банг был последним научным ассистентом Бора, а потому он может многое рассказать об этом великом человеке и глубоко понимает его философские воззрения. Да, Бор-философ был едва ли не менее знаменит, чем Бор-ученый.
Он начал свое квантовое путешествие, когда в 1912 году устроился в Манчестере на работу к выходцу из Новой Зеландии Эрнесту Резерфорду. В то время Резерфорд был одним из ведущих ученых и в 1908 году получил Нобелевскую премию по химии, хотя и занимался физикой. Бор появился у него в лаборатории примерно тогда, когда Резерфорд разработал свою модель атома. Он только что выяснил, что атомы состоят из крошечного плотного ядра, которое окружено еще более крошечными электронами.
Бор попытался понять структуру модели атома Резерфорда и тем самым начал полувековую работу по объяснению сути квантовых феноменов. Именно его сегодня по праву и считают истинным отцом-основателем квантовой механики. Может, Планк и Эйнштейн и сделали первые шаги в эту область, но вклад Бора оказался гораздо существеннее.
Первый успех пришел к нему, когда он решил две проблемы, связанные со структурой атомов: установил происхождение линейчатого спектра и нашел объяснение стабильности атома.
Модель атома Резерфорда предполагала, что электроны находятся за пределами ядра на расстоянии, в тысячи раз превышающем радиус этого ядра. Такая картина сразу же ставила вопрос о стабильности атома. Прежде всего, физики были уверены, что электроны не могут находиться в покое внутри атомов, так как электрическая сила, источаемая положительно заряженным ядром, должна притягивать электроны внутрь. Так что проще всего было представить себе планетарную модель, в которой электроны постоянно вращались вокруг ядра, как Земля вращается вокруг Солнца, чтобы ее не притянуло к нему под действием гравитационных сил.
Однако Бора озадачило одно важное отличие атома от Солнечной системы (не считая их размеров, конечно). В соответствии с классической теорией электромагнетизма, вращающийся вокруг ядра электрон должен излучать свет. Следовательно, по мере потери энергии он будет по спирали приближаться к ядру. Этот процесс будет происходить очень быстро – примерно за одну тысячемиллионную долю секунды – и атомы будут схлопываться.
В ретроспективе идея Бора кажется очевидной, но в то время она произвела настоящий переворот. Он предположил, что если материя испускает излучение сгустками (как в случае с черными телами) и поглощает его тоже сгустками (фотоэлектрический эффект), то атомы, из которых состоит материя, возможно, просто не способны обладать энергией, значение которой равняется нецелому числу этих сгустков.
С этой идеей Бор зашел дальше Планка, который полагал, что квантование излучения происходит исключительно из-за колебаний атомов в теплых черных телах и не является чертой, характерной для всех атомов вследствие их внутренней структуры.
Бор допустил, что энергия электронов в атомах тоже состоит из квантов. В таком случае электроны не могут выбирать любую орбиту, как было бы возможно в соответствии с законами движения Ньютона, а вынуждены следовать по определенным «отдельным» орбитам, подобным концентрическим кругам. Электрон может перескочить на более низкую орбиту, только испустив квант электромагнитной энергии (фотон). Точно так же перепрыгнуть на более высокую орбиту он может, только поглотив фотон. Впоследствии стабильность атомов более подробно изучил молодой немецкий гений Вольфганг Паули, который доказал, что каждая электронная орбита может вместить только определенное количество электронов. В связи с этим электроны могут перепрыгивать на более низкую орбиту, только если там для них есть место. Позже мы увидим, что электроны нельзя считать крошечными частицами, вращающимися вокруг ядра, поскольку каждый из них является распространенной волной, а каждая из этих «электронных волн» замыкается в кольцо вокруг ядра.
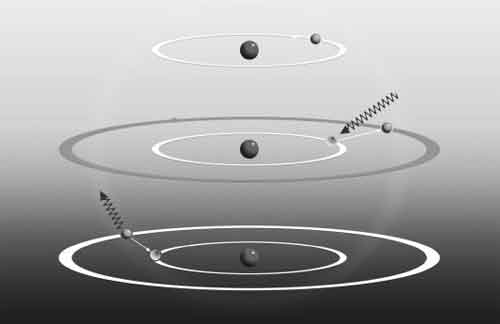
Предложенная Бором модель атома водорода состояла из электрона на фиксированной орбите вокруг атомного ядра. Если электрон поглощал фотон верной частоты (средняя диаграмма), он получал достаточное количество энергии, чтобы «перепрыгнуть» на более высокую (более отдаленную от ядра) орбиту. В таком случае атом оказывался в возбужденном состоянии. Эта ситуация в целом нестабильна, поэтому вскоре атом терял свое возбуждение (нижняя диаграмма). Электрон испускал фотон с такой же точно энергией, что и первый, благодаря этому сам терял энергию и падал обратно в свое «основное состояние».
Бор также сумел объяснить значение атомных спектров – того факта, что элементы отдают свет на точно определенном наборе частот (называемых спектральными линиями), причем каждый спектр уникален для конкретного элемента. Характерные частоты, на которых каждый конкретный тип атома испускает свет, соответствуют определенным энергиям (по уравнению Планка). Энергии испущенных фотонов соответствуют энергии, потерянной электронами атома при опускании на более низкие орбиты.
Следует подчеркнуть, что, хотя Бор и применил идею квантования Планка к атомной структуре, объяснить, как именно электроны перепрыгивают с орбиты на орбиту, он не смог. Прямо как несчастный Планк, Бор представил свою формулу для решения конкретной задачи. Несмотря на мнение многих физиков-теоретиков, он не вывел ее на основании глубоких фундаментальных принципов. Хотя его атомная модель миниатюрной Солнечной системы работала как будто очень хорошо, в ней все еще учитывались аспекты ньютоновской физики, которые оказались неверными. Хуже всего, его модель фактически работала только для водорода, атом которого содержит лишь один электрон! Более сложные конструкции в модель не вписывались. Более полное понимание структуры атома требовало серьезного развития квантовой механики, которое произошло лишь десять лет спустя.
Сегодня физики не зря возмущаются, что детям в школах до сих пор показывают разработанную Бором модель атома. Атомы выглядят совсем не так. Предложенная Бором модель атома водорода поставила точку в первой фазе квантовой революции, которую сегодня называют квантовой теорией.
Назад: Нобелевская премия Эйнштейна
Дальше: В дело вступает французский герцог

