Книга: ДНК и её человек [litres]
Назад: Фредерик Сенгер и его метод секвенирования
Дальше: Новое поколение выбирает…
Автоматическое распознавание
Как это происходило на практике? О-о… Классическое секвенирование по Сенгеру – процедура, которая у старшего поколения ассоциируется с золотым веком молекулярной биологии, когда было мало простого, покупного и готового и все умели работать руками, не то что сейчас. Не удержусь и расскажу подробнее: я ее еще застала.
Итак, гель нам понадобится не агарозный, как для крупных фрагментов, сильно различающихся по размеру, а полиакриламидный и очень тонкий. Разделить молекулы ДНК, различающиеся всего на один нуклеотид, – серьезная задача. Гель готовим из акриламида (канцероген; распишитесь, студенты, что поняли, а также насчет радиоактивной метки – хоть фосфор-32 и смешной по активности изотоп, но все-таки пить его не надо). Горячую прозрачную жидкость заливаем в пространство между двумя идеально плоскими стеклами размером примерно А3 с зажатыми по краям полосками пластика – спейсерами. Стеклянная струйка сбегает вниз, гель заливается, заливается, залива… черт-черт, пузырь застрял и не всплывает! Подхватываем что-нибудь твердое, вроде ножниц, стучим по стеклу деликатно, но сильно: уходи, пузырь, уходи! Если повезло, пузырь неохотно поднимается вверх, если нет – застывает в геле, делая значительную его часть непригодной для фореза, а студент слышит у себя за спиной: “Ничего, ручки кривые, зато старательный”… Сверху заливаем чуть менее крепкий гель, в который вставляют гребенку, чтобы получились лунки. Ждем. Гель застыл. В реакционные смеси добавляем глицерина, чтобы смесь не всплывала в растворе, а сиропчиком оседала на дно лунки, а также синего и фиолетового красителя с отрицательно заряженными молекулами, чтобы видно было, достаточно ли далеко прошел форез: раствор ДНК сам по себе прозрачен, по нему не поймешь. Вносим смесь в лунки. Аккуратненько, только не мимо лунки, а то будет каша. Не путаем, что куда, запоминаем, а лучше записываем. Готово. Ставим электрофорез. На табло источника питания четырехзначное число, обозначающее вольты, кстати, распишитесь, студенты, что поняли насчет высокого напряжения.
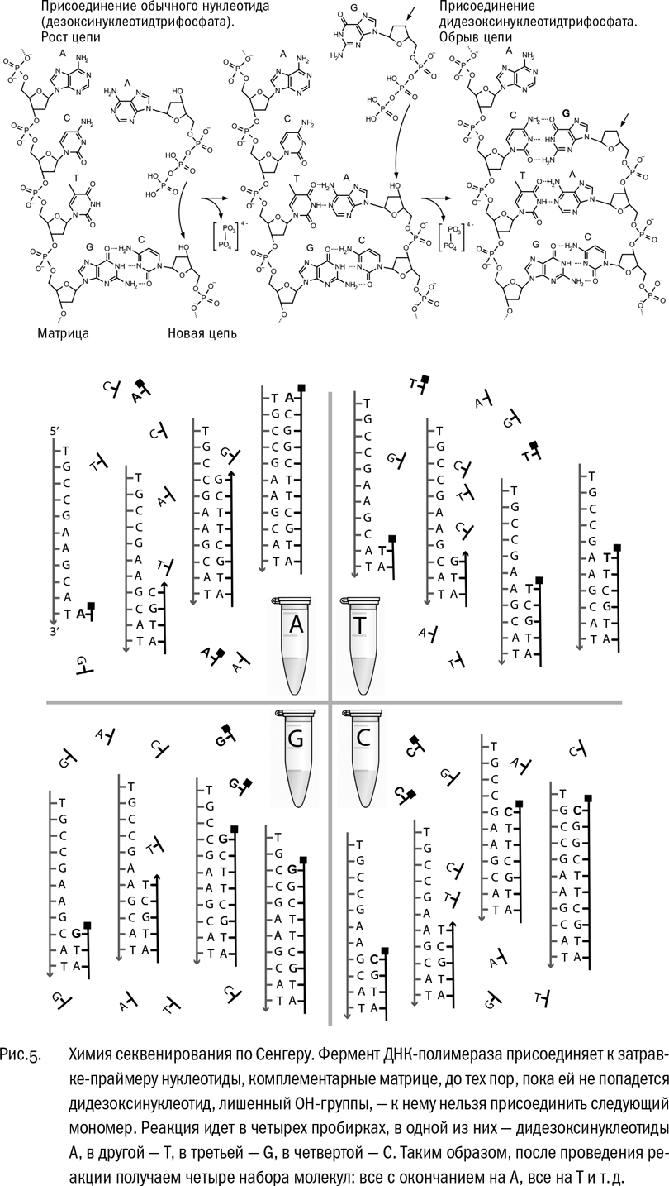

По прошествии изрядного времени, когда мы видим, что синее и фиолетовое пятна проехали к плюсу сколько надо, снимаем гель и сушим. Он у нас слегка радиоактивный, мы не забыли? При синтезе меченые нуклеотиды включались в цепочки ДНК, поэтому все новые молекулы фонят. Мы берем гель в темную комнату и аккуратно прижимаем его к рентгеновской пленке размером с наше стекло. Зажимаем в металлическую коробку и оставляем, скажем, до завтра. Потом проявляем пленку – и вуаля: если все сделали правильно, на прозрачной пленке темнеют полосочки, выстроенные лесенкой. Это называется “радиоавтограф геля”. Каждая полоска соответствует нуклеотиду ДНК. Кстати, сама идея метить молекулы ДНК, заставляя полимеразу включать в них нуклеотиды с радиоактивными изотопами, для удобства последующих наблюдений тоже принадлежит Фредерику Сенгеру.
Вот теперь наконец-то читаем нашу ДНК! Сначала две полоски на левой дорожке, затем одна на правой, затем на второй слева – ААGТ… Одному это расшифровывать не с руки. Зовешь помощника, даешь ему в руки линейку, велишь диктовать, а сам вбиваешь в компьютер буквы ДНК – текст, который никто еще не читал, кроме вас двоих и Господа Бога, если он вникал в такие мелочи, а не предоставил все эволюции. За один раз на четырех дорожках можно прочесть несколько сотен нуклеотидов, в идеале до тысячи. (Для сравнения, “плюс-минус” секвенирование давало около 80 нуклеотидов.) Уф-ф.
Теперь, с появлением приборов-секвенаторов, взаимодействие человека и ДНК стало менее интимным и утомительным. Человек ставит реакционную смесь в прибор и идет пить кофе… то есть писать обзор литературы для статьи. Никакой романтики преодоления трудностей. (Шучу. На самом деле трудности теперь в других местах – например, там, где начинается обработка огромного количества данных.)
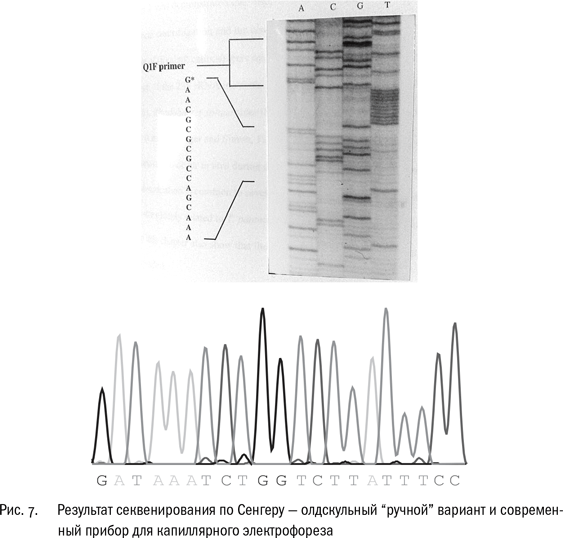
Принцип метода остается тем же, что и в классическом секвенировании по Сенгеру, – синтез четырех наборов нуклеотидных цепочек, кончающихся на А, на Т, на G и на С. Только электрофорез теперь происходит не в плоском геле, а в капилляре, из которого синтезированные молекулы выходят поочередно, от самых коротких к самым длинным. И метка не радиоактивная, а флуоресцентная: каждый терминаторный нуклеотид светится своим цветом, условно говоря, А – зеленым, Т – красным, С – синим, G – желтым. (Реакционных смесей уже не четыре, а одна!) Регистрирующее устройство фиксирует вспышки на выходе из капилляра и отмечает пики свечения каждого цвета. Прибор выдает график с четырьмя кривыми, где пики соответствуют нуклеотидам; последовательность нуклеотидов сохраняется в памяти компьютера.
Первые автоматические секвенаторы начала поставлять фирма Applied Biosystems (1986). Они использовали принцип, разработанный в Калифорнийском технологическом институте, в лаборатории Лероя Худа. Что интересно, в первоначальном варианте секвенирования от Applied Biosystems реакционных смесей было четыре, и флуоресцентную метку несли не дидезоксинуклеотиды, а праймеры. Это было своего рода промежуточное звено между сенгеровским методом и последующим автоматизированным – реакция идет в четырех смесях, но все продукты бегут по одной дорожке электрофореза. Эволюция техники иногда похожа на эволюцию живых существ: полезные изменения накапливаются последовательно.
Applied Biosystems (к тому моменту подразделение компании PerkinElmer) принимала непосредственное участие в создании компании Celera Genomics, основателем которой был знаменитый Крейг Вентер, человек, который многое сделал для того, чтобы чтение ДНК вышло на новый уровень – от сотен и тысяч нуклеотидов к целым геномам. Celera Genomics вскоре прославилась как главный конкурент международного проекта “Геном человека”, а Крейг Вентер, как он сам пишет в своей автобиографии, был одним из первых клиентов Applied Biosystems еще в то время, когда руководил лабораторией в Национальных институтах здравоохранения. Важную роль в его последующих успехах, да и вообще в секвенировании генома человека сыграли автоматические секвенаторы. И наоборот: поставленная грандиозная задача – 3 млрд нуклеотидов, во времена, когда и тысячи считались успехом! – способствовала автоматизации секвенирования.
В 1995 г. Институт геномных исследований Крейга Вентера (TIGR) прочитал первый полный геном бактерии Haemophilus influenzae (1,8 млн нуклеотидных пар). И заодно, “просто чтобы проверить метод”, геном Mycoplasma genitalium (0,58 млн н.п.) – той самой бактерии, на основе которой Крейг Вентер с соавторами в первом десятилетии будущего века начнет создавать синтетический геном. Секвенирование полных бактериальных геномов микробиологи восприняли как сенсацию, историческое событие, Вентеру на конференции, когда он объявил об этом, аплодировали стоя. В 1998 г. был секвенирован геном многоклеточного организма – круглого червя Caenorhabditis elegans (100 млн н.п.).
Проект “Геном человека” стартовал в 1990 г. О получении первой “черновой” последовательности руководитель международного проекта Фрэнсис Коллинз и Крейг Вентер торжественно объявили 26 июня 2000 г. в Белом доме. Окончательное завершение проекта было анонсировано в апреле 2003 г.
Кстати: многие издания писали тогда, что, мол, “расшифрован генетический код человека”. Некоторых биологов это бесило почти так же, как “ваше ДНК”. Дело в том, что по-русски кодом принято называть шифр – правило соответствия между двумя системами символов, в нашем случае – между аминокислотами белка и нуклеотидными триплетами. Генетический код, то есть соответствие аминокислот и триплетов, у человека тот же, что у всех живых организмов, и расшифрован он давно! По-английски же кодом можно назвать и шифр, и шифровку, так что аналогичный английский заголовок не кажется глупым. Впрочем, сейчас уже и в русском языке так прочно прижился “код” как текст компьютерной программы, что это значение задним числом легитимизирует и “генетический код человека”.
Стоимость проекта “Геном человека” составила $3 млрд – по доллару за букву. Сейчас цена вопроса – порядка $1000 геном (в России пока подороже), ближайшая цель конкурирующих фирм – снижение до сотен долларов.
Во всем этом Сенгер уже не принимал непосредственного участия. В 1983 г. он ушел в отставку и прожил три десятилетия, с удовольствием работая в своем саду. Младшие коллеги о нем не забывали – тот же Крейг Вентер с гордостью приводит факсимиле поздравительной записки от Сенгера по поводу расшифровки генома H. influenzae. В 1992 г. в Великобритании был создан Институт Сенгера – некоммерческий геномный исследовательский центр. Двукратный нобелиат напутствовал коллег словами: “Пусть только попробуют не добиться успеха”. Но сам он не любил публичности и даже отказался от рыцарского звания за научные заслуги. Умер Фредерик Сенгер в 2013 г. в возрасте 95 лет. Вот как он объяснял, почему так рано удалился от дел: “Я и сам не думал об отставке, пока внезапно не осознал, что через несколько лет мне будет 65 и я буду иметь право перестать работать и заняться чем-то, чего я всегда хотел и на что не имел времени. Это возможность выглядела неожиданно привлекательной, особенно потому, что наша работа достигла высшей точки с методом ДНК-секвенирования, и я в некотором роде чувствовал, что продолжать – значит двигаться к низшей точке. Решение, что я принял, было мудрым – не только потому, что я получил огромное удовольствие от своего нового образа жизни, но и потому, что старение не улучшило мою производительность в лаборатории, и я думаю, что если б я продолжил работать, то мог бы найти это разочаровывающим и чувствовал бы вину за то, что занимаю место, нужное молодым людям”.

