Серебряное великолепие
Серебро до сих пор незаменимо именно в тех областях человеческой деятельности, с которых, собственно говоря, и началось его использование: изготовление бытовых предметов и ювелирных украшений. Оно необычайно пластично – из 1 г серебра можно вытянуть тончайшую проволочку длиной в сотни метров, пригодную для изготовления легких кружевных узоров, так называемой скани. Свободное пространство в переплетениях узоров часто заполняли цветной эмалью (рис. 8.33 и 8.34).

У серебра высокая ковкость, гибкость, оно легко полируется, из него можно отливать объемные скульптурные изделия, точно передающие мельчайшие детали литьевой формы.
С помощью стального резца на поверхность серебра легко наносятся различные орнаменты, оно хорошо воспринимает мельчайшие штрихи чеканки и гравировки. Таким видам отделки часто сопутствовала чернь – это особый сплав, состоящий из серебра, меди (или олова), свинца и серы в определенных пропорциях, который наносили после гравировки в углубленные места для получения контрастного рисунка (рис. 8.35).

С древнейших времен серебро золотили, выделяя отдельные элементы нанесенного на поверхность рисунка. Сначала проводили золочение тончайшими листочками (сусальное золото), затем амальгамой (сплав ртути и золота), а с XIX в. – гальваническим способом.
Исключительно широкий набор различных приемов обработки серебра обеспечил ему широкое применение для изготовления высокохудожественных произведений, которые были почитаемы и любимы во все времена и у всех народов. На рисунке 8.36 показаны «художественные возможности» серебра на примере некоторых антикварных изделий из коллекций различных музеев.
Формы посуды и бытовых предметов весьма традиционны и мало менялись со временем, зато украшающий их орнамент менялся постоянно, отражая смену художественных вкусов. Например, строгий стилизованный растительный орнамент на рубеже XVII–XVIII вв. постепенно сменился сложными узорами с включением птиц, лесных зверей и мифологических героев. Источником орнамента служило традиционное народное изобразительное искусство. Поэтому в разных странах стиль украшений изделий из серебра заметно отличался.

Всевозможные стили и вкусы определяли свою эстетику серебра: например, французскому серебру было свойственно сочетание гладкой белой поверхности и «сахарной» фактуры. Английское серебро было блестящим. Древнерусское серебро не знало жесткой полировки, цвет его был приглушенным.
Cлитки серебра издавна служили торговым эквивалентом, наряду с золотом и медью оно было одним из основных монетных металлов. Чистое серебро – весьма мягкий металл, поэтому со времен глубокой древности серебряные изделия и монеты изготавливали из сплава серебра с медью. Такой сплав обладает заметной твердостью. Медь не изменяет цвета серебра, пока ее содержание не превышает 40–50 %; при большем содержании сплав приобретает желтоватый цвет. Содержание серебра в 1000 весовых частях сплава называют пробой, которая обычно выражается трехзначным числом. Например, проба 875 означает, что в 1000 г сплава содержится 875 г серебра.
Само слово «серебро» звучное и привлекательное, вызывает приятные ассоциации, и потому не удивительно, что его используют в качестве эпитета (серебристый звук трубы или колокольчика, Серебряный век в российской поэзии и др.). Существуют музыкальные группы, использующие в названии коллектива это слово: например, российская музыкальная поп-группа «Серебро» и украинская музыкальная рок-группа (г. Николаев) с таким же названием.
Химия серебра
Сравнительно высокая химическая стойкость серебра позволила отнести его к благородным металлам. В сухом воздухе без агрессивных агентов при обычной температуре серебро покрывается слоем оксида толщиной 10–12 ангстрем (1 ангстрем = 10−10 м). Таким образом, серебро, находящееся в чистом сухом воздухе, покрывается бесцветной пассивной пленкой, не приводящей к изменению его внешнего вида. Серебро не взаимодействует с соляной и разбавленной серной кислотой даже при нагревании. Однако существует определенная группа химических реагентов, активно воздействующих на серебро. Оно легко реагирует с сероводородом, при этом на поверхности образуется тончайшая пленка сульфида (рис. 8.37).
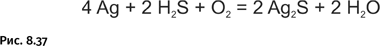
Источником сероводорода в воздухе городов могут быть продукты разложения белковых соединений, резиновые изделия, а также некоторые полимеры. Серебро также темнеет при соприкосновении с веществами, содержащими серу: например, яичным белком, шерстью и др.
Постепенно пленка сульфида утолщается, темнеет, становится коричневой, а потом черной. В результате многие декоративные серебряные изделия покрываются красивой чернью в углублениях рельефа, что хорошо подчеркивает его выразительность. Это привело к тому, что со временем для усиления привлекательности изделия и придания ему состарившегося вида начали производить искусственное чернение (патинирование). В отличие от упомянутого ранее чернения с помощью специального сплава, использовали полисульфид калия, в результате на поверхности серебра образуется черная пленка сульфида Ag2S.
Потемневший за счет естественных процессов внешний вид неустойчив, постепенно при хранении вся поверхность металла становится тусклой, серой, иногда с цветами побежалости – первой стадией образования темного слоя, или покрывается пятнами, привлекательность черненого рельефа заметно снижается, причем этот процесс идет довольно быстро. Известно, например, что владельцы, обладавшие большими коллекциями таких изделий, держали специальную прислугу для чистки серебра. В основном чистили серебро механическими способами, например замшей, позже стали использовать мел.
Помимо сероводорода на серебро действует также и хлор, вызывая его потускнение; в этом случае пленка содержит хлорид серебра белого цвета (так называемое роговое серебро) (рис. 8.38).
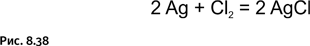
Озон как сильный окислитель также вызывает потускнение серебра вследствие образования оксида Ag2O.
Существуют и иные реагенты, активно взаимодействующие с серебром. В быту соприкосновение с ними почти исключено, и они представляют интерес для различных химических превращений серебра. Наиболее известный реагент для «растворения» серебра – крепкая азотная кислота (рис. 8.39).
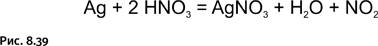
Концентрированная серная кислота взаимодействует с серебром только при нагревании (рис. 8.40).
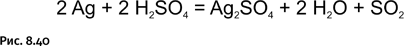
Горячий водный раствор цианида калия при доступе воздуха растворяет металлическое серебро, образуя растворимую в воде двойную соль (рис. 8.41). Эту реакцию прежде использовали для извлечения серебра из руд.
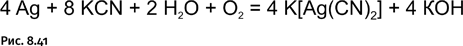
Поверхность серебряных предметов, долго пролежавших в земле и найденных в результате археологических раскопок, всегда содержит налет сульфида серебра Ag2S, а также хлорида серебра AgCl, который образуется при совместном действии NaCl, содержащегося в почвенных водах, в присутствии кислорода и углекислого газа (рис. 8.42).
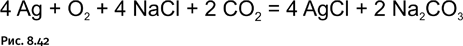
Восстановление серебряных изделий разработано весьма детально. При реставрации археологического серебра вначале удаляют AgCl действием концентрированного водного раствора NH3, а затем обрабатывают водным раствором двойной соли тиосульфата натрия и тиосульфата закиси меди 4Na2S2O3·3Cu2S2O3·H2О, легко растворяющим сульфид серебра Ag2S.
Существует большой набор методик, как химических, так и электрохимических, для реставрации и очистки серебряных предметов, что позволяет вернуть старинным изделиям прежний вид. Такие сложные проблемы, какие возникают при реставрации медных или железных изделий, в случае серебра отсутствуют. Основные трудности возникают на другом этапе: реставрированные экспонаты обычно попадают в музеи, и тут возникает целый комплекс проблем, связанных с консервацией, т. е. сохранением результатов реставрации при экспозиции.
Для защиты музейных экспонатов из серебра от потемнения иногда применяют покрытие покровными лаками. Однако при этом заметно изменяется внешний вид серебряной поверхности, нанесение лака кистью дает неравномерное по толщине покрытие, кроме того, защитные свойства лака невелики. Другой способ защиты серебряных изделий – пассивирование в хроматном растворе. Для этого хорошо очищенное изделие погружают при комнатной температуре на 20 минут в слегка подкисленный 1 %-ный водный раствор дихромата калия K2Cr2O7. В результате образуется тонкая пленка Ag2Cr2O7, которая препятствует потемнению, но только на некоторое время. Все эти приемы не позволяют полностью решить комплекс проблем, связанных с сохранением серебряных экспонатов. Решение этой задачи стало предметом специальных исследований.

