Металлы и органические растворители
В 90-х гг. ХХ в. исследователями было обнаружено, что металлы можно «растворять» в органических растворителях. Внешне это выглядит, как «растворение» металла в кислоте, только вместо кислот используют органические соединения, что весьма необычно. Наиболее универсальной оказалась пара органических растворителей: диметилсульфоксид (ДМСО) Me2S=O и четыреххлористый углерод CCl4. Такая смесь способна растворять Co, Cr, Fe, Ni, Cu, Zn, Cd, Mo, W. Вместо ДМСО с таким же успехом можно использовать диметилформамид (ДМФА) Me2N – C(O)H. В результате образуются комплексы хлорида металла с ДМФА, что показано на примере растворения меди. Состав такого комплекса можно изобразить компактно как (CuCl2)2(ДМФА)4 (рис. 4.30).
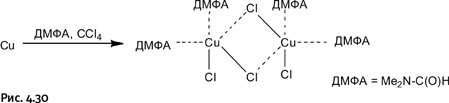
Принцип одновременного действия двух растворителей понятен: CCl4 – галогенирующий агент, а ДМФА, образуя комплекс, удерживает полученное соединение в растворе.
Благородные металлы тоже не устояли. При действии на золото смеси диметилсульфоксида Me2S=O и бутилбромида C4H9Br образуется AuBr3. Итак, по существу это новая царская водка (рис. 4.31).
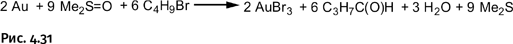
ДМСО участвует в качестве реагента, а его избыток удерживает получившуюся соль золота в растворе за счет комплексообразования.
Иные растворители – новые возможности
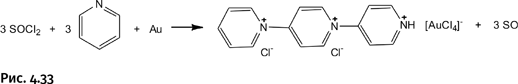
В 2010 г. профессор К.П. Вонг (рис. 4.32) из Технологического института в штате Джорджия, США, нашел новый способ переводить в раствор благородные металлы. Вначале он обнаружил, что золото растворяется в смеси пиридина С5H5N и тионилхлорида Cl2S=O. Молекулы пиридина образуют катион из трех соединенных молекул, который соединен со знакомым нам уже анионом AuCl4–. Последующие эксперименты показали, что такая система растворяет и другие благородные металлы; вместо пиридина можно использовать диметилформамид (ДМФА), пиразин N2(CH2)4 и некоторые другие соединения, но тионилхлорид оказался незаменимым компонентом.

Автор этих работ употребляет термин «растворение» условно, на самом деле происходит окисление нуль-валентного металла, или, точнее, окислительное растворение (рис. 4.33).
Основное достоинство новых систем состоит в том, что изменение состава позволяет «настроить» их на определенный металл. Например, в смеси SOCl2 + ДМФА растворяется только золото. Композиция SOCl2 + пиридин растворяет золото и палладий, но не платину. При изменении условий (температура, длительность процесса) реализуется более тонкое разделение металлов. Все это может быть использовано при очистке благородных металлов от примесей и для извлечения их из отслуживших свой срок деталей электроники или отработанных катализаторов. Новая технология может также найти применение в процессах избирательного формирования нанопокрытий.
Эти композиции, состоящие из SOCl2 и органического соединения, представляют собой удобную замену традиционной царской водки, которая, не разбираясь, растворяет все подряд.
Водородная карусель
Нам теперь – имей в виду! –
Надо быть с толпой в ладу:
Деспотизм сейчас не в моде,
Демократия в ходу.
Уезжал бы ты отсель
В энтот… как его… в Бруссель,
Раз такая происходит,
Извиняюсь, карусель!
ЛЕОНИД ФИЛАТОВ. «ПРО ФЕДОТА-СТРЕЛЬЦА»
Фундамент всей органической химии – это углеводороды, вещества, в которых атомы углерода окружены атомами водорода. Химическая связь С – Н очень типична для органической химии, она присутствует практически всегда и хорошо изучена.
Ближайший аналог углерода – кремний – тоже может образовывать связи с водородом Si – H, но только их свойства совсем не те, что у связей С – Н. Электроотрицательность – способность притягивать к себе электроны – у кремния ниже, чем у углерода, поэтому электроны связи Si – H сдвинуты к водороду. Такой сдвиг обозначают значком δ (дельта) с плюсом или минусом, например Siδ+–Hδ–. Если оторвать от кремния атом Н, он уйдет в виде аниона Н‾, а кремний останется в виде катиона Si+.
Существуют реагенты, которые могут забрать Н‾ у кремния: например, соединение, представляющее собой ионную соль [Ph3C]+[B(C6F5)4]– (такое же, как Na+Cl–). Происходит это следующим образом: катионная часть Ph3C+ комплекса забирает у кремния Н–, а анион [B(C6F5)4]– остается неизменным, только у него теперь уже другой противоион Si+, т. е. фрагменты молекул меняются партнерами (рис. 4.34).
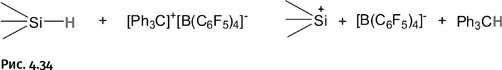
Напомним, что в реакционной смеси катион не существует без аниона или анион без катиона, но в схемах реакции иногда показывают только тот ион, с которым происходят превращения.
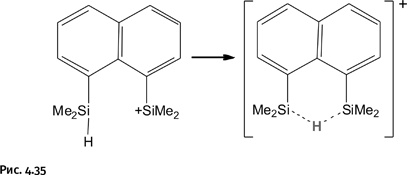
Самое интересное случается, если рядом с «обнаженным» атомом кремния Si+, окажется другой атом со связью Si – H, как, например, в молекуле, показанной на рисунке 4.35. Атом Si+ потянет на себя атом водорода от соседа, но полностью оторвать его не сможет. Атом Н окажется в равноправном совместном владении двух атомов Si, что обозначено пунктирными связями. Атомы кремния становятся полностью одинаковыми по своему положению и окружению, такие атомы называют структурно эквивалентными. В результате положительный заряд потеряет свое конкретное место, поэтому молекулу помещают в квадратные скобки и указывают, что это катион (+).
Чтобы не загромождать рисунок, обычно используют не обе квадратные скобки, включающие ион, а только часть правой скобки и рядом указывают знак заряда. Далее именно так мы и будем поступать.
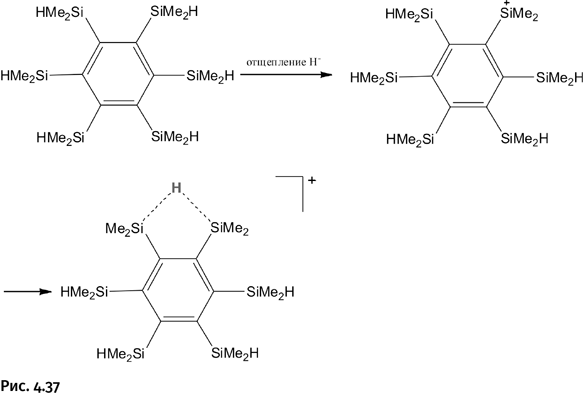
Что произойдет, если у триады Si – H – Si окажутся еще соседи со связями Si – H? Такое сумел реализовать наш соотечественник профессор Г.И. Никонов (рис. 4.36), работающий сейчас в Канаде (а совсем не Брюсселе, как сказано в эпиграфе). Он заместил все атомы Н в бензоле группами Me2SiH, а затем отщепил Н‾ от одного из атомов кремния. Вначале произошло то, что и следовало ожидать: точно так, как показано ранее, атом Н в соседней группе Si – H подтянулся к атому Si+ (рис. 4.37).

Интересно, что на этом процесс не остановился. Один атом Н на два атома Si в группировке Si – H – Si создал некую «неуютность». Каждому из этих двух атомов кремния хочется иметь свой персональный атом Н, и участники триады Si – H – Si подтянули к себе водородные атомы от соседей, но в равноправное владение их заполучить не удалось, поэтому одна связь показана штрихами, а вторая – обычной валентной палочкой (рис. 4.38).
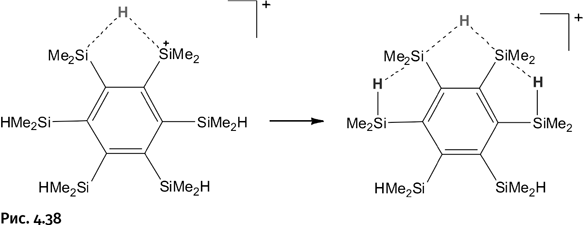
Возникает естественный вопрос, как Г.И. Никонов узнал, что молекула находится в таком необычном состоянии. Существует удобный спектральный метод ядерно-магнитного резонанса (ЯМР), который «чувствует» неэквивалентность («неодинаковость») атомов и даже показывает, сколько сортов таких атомов в веществе; чаще всего этот метод применяют для наблюдения за атомами водорода. На рисунке 4.38 мы видим, что присутствует три «сорта» атомов Н в связях Si – H. Это та самая структурная неэквивалентность. На спектре ЯМР были обнаружены именно три сигнала, причем в количественном соотношении 1:2:2, т. е. с помощью метода ЯМР буквально их пересчитали. Кстати, атомы Н в метильных группах СН3 тоже видны, но совсем в другой части спектра. Спектр был получен при –80 °С.
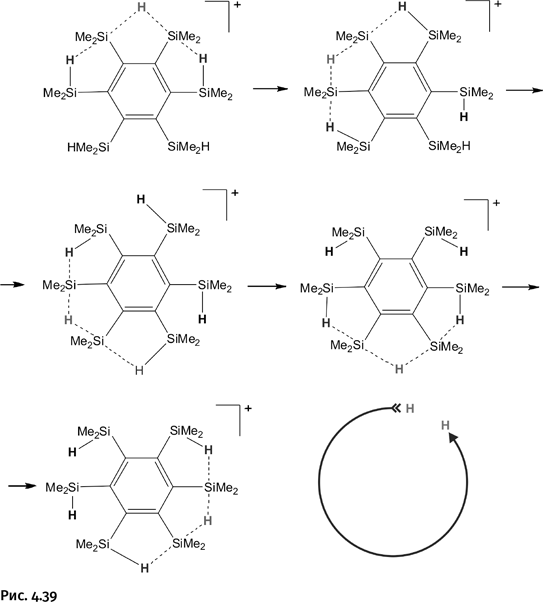
Самое интересное произошло, когда такой спектр сняли при комнатной температуре. Получили всего один сигнал для атомов Н, связанных с Si, т. е. все они стали структурно эквивалентными. Дело в том, что при повышении температуры в эту «игру «включились все атомы кремния, расположенные вокруг бензола. Фрагмент Н–Si–H–Si–Н стал перемещаться по кругу, на рисунке это видно по перемещению атома Н (рис. 4.39).
Эта «карусель» вращается столь быстро, что спектр не успевает зафиксировать каждое отдельное состояние и показывает усредненную картину, что приводит к появлению только одного сигнала в спектре. Если бы состояние атомов Н в группировке Н–Si–H–Si–Н можно было отметить лампочками разного цвета, то мы увидели бы перебегающие по кругу цветные огоньки. Но и без них воображения химика вполне достаточно, чтобы представить, насколько красив такой процесс.