Книга: Теломераза. Как сохранить молодость, укрепить здоровье и увеличить продолжительность жизни
Назад: Сердечная недостаточность
Дальше: Глава седьмая Как замедлить старение
Неврологические возрастные заболевания
Многие неврологические заболевания связаны с возрастом. Самое известное из них – болезнь Альцгеймера, хотя болезнь Паркинсона не уступает ей ни по известности, ни по пугающей репутации. Существует много других возрастных заболеваний и состояний – потеря моторной координации, плохое функционирование рефлексов, возрастные нарушения сна и т. д. Все эти заболевания и состояния довольно давно получили отдельные определения, и считалось, что и патология у них тоже разная, но сейчас многие постепенно приходят к мнению, что это спектр заболеваний, объединенных одной причиной. Болезнь Паркинсона проявляется в основном в черной субстанции, а болезнь Альцгеймера атакует много разных областей, но особенно часто – кору мозга и некоторые подкорковые структуры. Тем не менее, причина клеточной смерти у всех этих неврологических заболеваний может быть одна и та же, вне зависимости от того, какую именно часть мозга они поражают.
Тем не менее, мы обсудим болезнь Альцгеймера и болезнь Паркинсона отдельно.
Болезнь Альцгеймера
О, горы разума, вершины, скалы —Лишь тот на них без страха мог смотреть,Кого ни разу бездна не смущалаИ страх пасть в пропасть с кручи, в круговерть,Но утешенье нам приносит смерть,Так день умрет, спустившись в сна провалы...Джерард Мэнли Хопкинс
Из всех возрастных заболеваний самое страшное – болезнь Альцгеймера.
Болезнь Альцгеймера, словно тать в ночи, крадет наши души, оставляя лишь пустую телесную оболочку. Многие возрастные заболевания убивают нас, другие – ограничивают способность что-то делать, но вот болезнь Альцгеймера ограничивает то, что мы способны понимать. Она отбирает у нас внутреннее «я», разум, интеллект, личную жизнь. Она лишает нас способности быть теми, кто мы есть. Во всей мировой литературе есть рассказы, в которых какая-то темная сила – дьявол, проклятье, черная магия, дементоры – отбирает душу и оставляет только голема, зомби, оболочку. Вот это ужасная реальность болезни Альцгеймера.
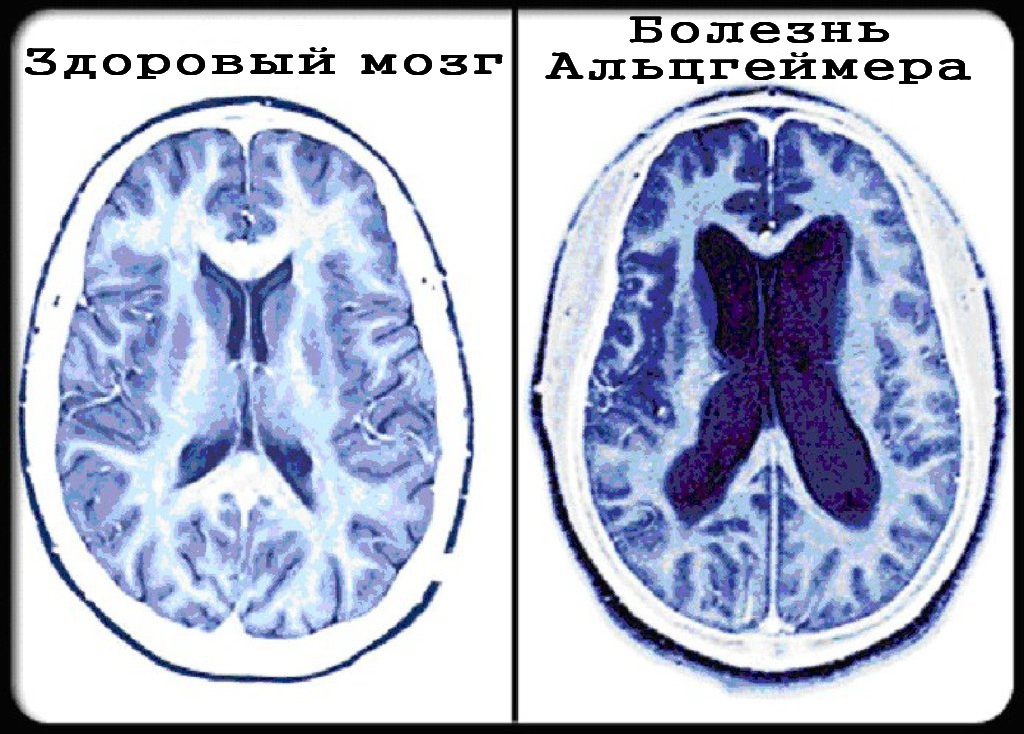
Поперечное сечение здорового мозга и мозга с продвинутой стадией болезни Альцгеймера.
Многие люди, которые кое-что знают о теломерах, но ничего – о человеческих патологиях, говорили, что клеточное старение не может вызывать болезнь Альцгеймера. Они наивно утверждают, что раз нейроны (обычно) не делятся, то их теломеры не могут укорачиваться с возрастом, так что клеточное старение никак не может быть связано с болезнью Альцгеймера. Но, как и в случае с болезнями сердца, этот аргумент совершенно не важен.
Нейроны, возможно, не стареют непосредственно, но они страдают из-за ярко выраженного старения клеток, обеспечивающих их выживание. Если конкретно, стареют клетки микроглии в мозге, так что «невинные наблюдатели» – нейроны – теряют поддержку. Результатом становится болезнь Альцгеймера.
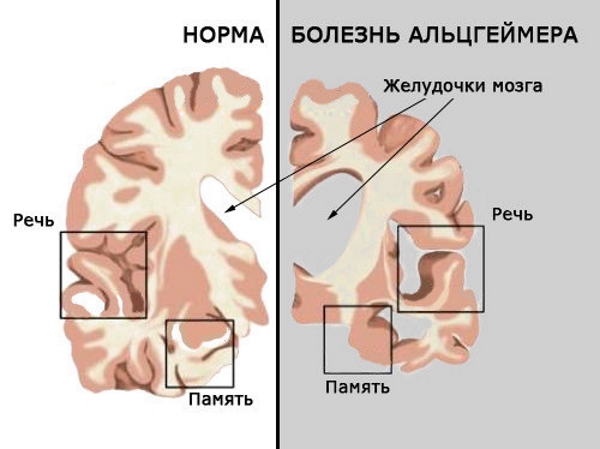
Как и в случае с атеросклерозом, патология болезни Альцгеймера сложнее, чем считают некоторые ученые и врачи. В случае с болезнью Альцгеймера нужно понимать роль β-амилоидных и τ-белков. Да, эти два белка играют роль «злобных подручных» болезни, но главную роль в трагедии играет микроглия, которая руководит атакой. Клетки микроглии подвергаются старению; именно она – критически важное действующее лицо в процессе гибели наших нейронов.
Глия составляет примерно 90% всех клеток мозга, а микроглия – около 10% всех глиальных клеток; микроглия чаще располагается вблизи нейронов. Микроглия – это «иммигранты» нервной системы. По сути они являются иммунными клетками, которые вторгаются в мозг из кровеносной системы и поселяются вокруг нейронов. Когда они активируются травмой или инфекцией, то превращаются в макрофагов, делятся и пытаются справиться с проблемами. При делении у них укорачиваются теломеры, и они со временем начинают хуже функционировать. Это первый шаг к развитию болезни Альцгеймера.
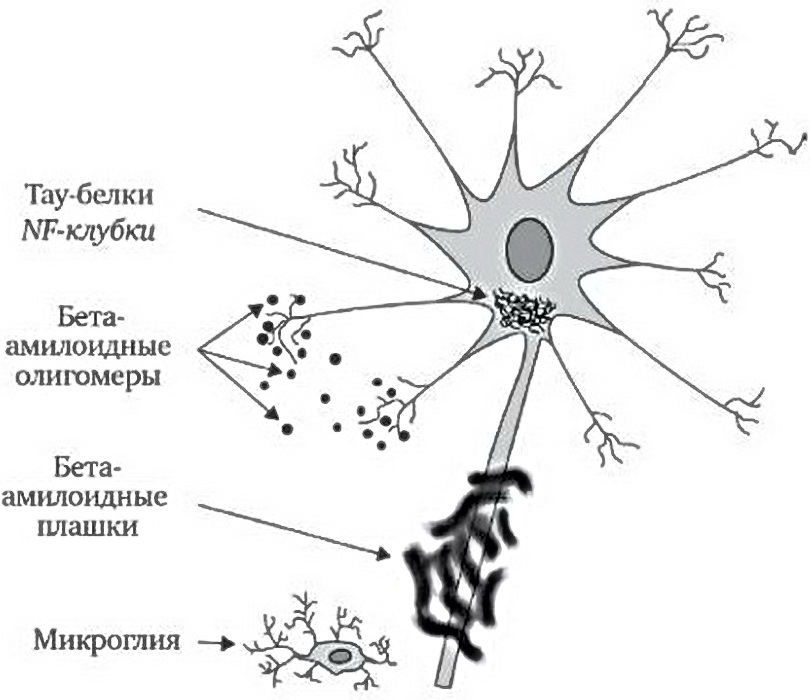
Стареющие клетки микроглии все менее эффективно поддерживают работу нейронов, особенно в плане того, что касается производства и обновления β-амилоидов. Микроглиальные клетки «активируются» и изменяют и свою форму, и функцию: они вызывают все более сильное воспаление, что лишь увеличивает повреждения. Микроглия и нейроны начинают производить короткие, поврежденные β-амилоидные молекулы – олигомеры, – которые ядовиты для нейронов. Чем сильнее повреждения, тем больше накапливаются β-амилоидные бляшки. Когда нейроны повреждаются слишком сильно, их τ-белки, жизненно необходимые для поддержки аксонов и, соответственно, переноса сигналов от одного нейрона к другому, начинают накапливаться в теле нейронов. В конце концов нейроны уже не могут справиться с повреждением от воспаления, отказа микроглиальных клеток, ядовитых β-амилоидов и τ-белковых клубков и умирают.
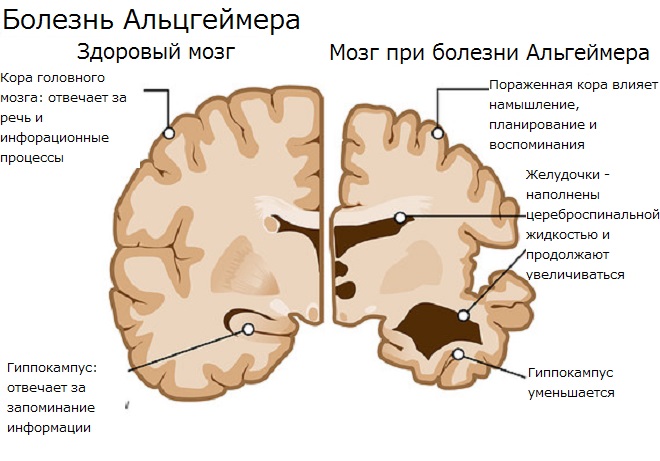
Болезнь Альцгеймера набирает ход. Сначала мы забываем ключи, потом – имена близких, потом – как за собой ухаживать.
Сейчас мы уже начинаем понимать, что старение артерий тоже играет определенную роль – или, по самой меньшей мере, коррелирует – с болезнью Альцгеймера, но большинство исследователей сосредоточилось исключительно на нервных клетках. Из-за этого узкого взгляда они игнорировали изменения не только в артериях, но и в других структурах, например, гематоэнцефалическом барьере и других типах клеток, в том числе глиальных. С исторической точки зрения узость взглядов вполне понятна. Самые очевидные гистологические изменения наблюдаются в нейронах коры мозга, а именно эти клетки мы в первую очередь ассоциируем с когнитивными способностями. Более того, мы уже давно знаем, что смерть нейронов сопровождается накоплением β-амилоидного белка вокруг нейронов и τ-белков – внутри этих самых нейронов. К сожалению, это слишком очевидное наблюдение привело к многочисленным, затратным и неизменно провальным попыткам вылечить или предотвратить болезнь Альцгеймера, сражаясь только с двумя этими целями – β-амилоидами и τ-белками.
Результаты клинических испытаний оказались удручающе предсказуемыми: не сработало ничего. Клинических испытаний провели более 1,6 тыс., еще 500 сейчас в процессе. Некоторые средства обеспечивают лишь симптоматическое облегчение (например, ингибиторы ацетил холинэстеразы), но разработчики многих других ставили перед собой задачу изменить все течение патологии – замедлить или даже остановить развитие болезни. Многие из этих клинических испытаний борются только с двумя целями: β-амилоидами и τ-белками. Это вполне понятно: и β-амилоиды, и τ-белки являются заметной частью микроскопической патологии, так что вполне понятно, почему их считают ее главной причиной, β-амилоиды, например, важны для работы нейронов, но известно, что в больших количествах они токсичны – например, в таких, которые окружают умирающие нейроны в мозге пациента с болезнью Альцгеймера, τ-белки тоже являются жизненно необходимой частью внутренней структуры нейронов, но те же самые умирающие нейроны в мозге пациента с болезнью Альцгеймера наполнены клубками из τ-белков. Следовательно, оба этих белка – вполне разумные кандидаты для терапевтических испытаний. К сожалению, нет никаких доказательств того, что прямое медицинское вмешательство, нацеленное на какой-либо из этих белков, приносит хоть какую-то пользу, а это говорит о том, что и β-амилоиды, и τ-белки – всего лишь результат заболевания, а не ее причина.
Давайте рассмотрим аналогию.
При диабете, когда организм вырабатывает недостаточно собственного инсулина, ваши клетки не могут эффективно усваивать сахар из крови, так что уровень сахара в крови растет. В то же время, поскольку ваши клетки не могут получить энергию из сахара, они вместо этого начинают сжигать жиры. К сожалению, из-за этого клетки начинают вырабатывать нежелательные кислоты, которые затем выпускают в кровь. В середине XX века хорошим средством ухода считалось уменьшение опасного уровня кислот в крови с помощью внутривенных инъекций гидрокарбоната натрия. Это не только не помогало, но и вызывало дополнительные осложнения. Проблема заключалась в том, что повышенный уровень кислот в крови был не причиной, а следствием. Лишь позже мы наконец поняли, что лечить нужно не повышенный уровень кислот, а повышенный сахар в крови. После того, как мы справлялись с повышенным сахаром, избыточная кислотность ушла сама собой.
В случае с болезнью Альцгеймера мы по-прежнему очень прилежно работаем и тратим огромнейшие деньги, чтобы лечить следствия, а не причины, несмотря на хронические, раздражающие провалы всех наших усилий. Мы смотрим «вниз по течению» на последствия, а не «вверх по течению» на причину. На самом же деле болезнь Альцгеймера, как и многие другие заболевания, – не просто «ручей» патологии, а целый каскад, но, тем не менее, мы по-прежнему пытаемся найти средство профилактики или лечения, стоя у подножия водопада, а не у истока реки.
Так что на самом деле нужно задавать другие вопросы. Где находится исток? Что происходит в каскаде патологий, которые приводят к болезни, и, что важнее, где находится самая важная точка вмешательства?
Что именно вызывает повреждение микроглии и активацию микроглиальных клеток, пока неизвестно. Есть определенные намеки, что различные вирусы или другие микробы вызывают в этих клетках инфекцию, в микроглии запускается иммунный ответ, и микроглиальные клетки начинают делиться. Поскольку микроглиальные клетки – это часть иммунной системы, похожая на макрофаги, которые вторгаются в субэндотелиальные слои коронарных артерий, предположение может оказаться вполне верным. Кроме того, несколько исследований показали, что различные антибиотики, в том числе доксициклин, могут помочь замедлить или предотвратить развитие болезни Альцгеймера, хотя ни в одном из этих исследований не удалось продемонстрировать заметной пользы, да и особого признания они не получили. Короче говоря, микробная инфекция – это одна из возможных причин, но в действительности мы пока просто не знаем, почему микроглиальные клетки активируются и делятся.
Зато мы знаем, что активация микроглии предшествует всем остальным очевидным патологиям, а еще, что теломеры микроглиальных клеток укорачиваются до появления β-амилоидных отложений или накопления τ-белков в пораженных нейронах. Если проще, всем другим изменениям предшествует укорочение теломер и клеточное старение. Это, конечно, говорит о том, что старение микроглиальных клеток находится «вверх по течению» в патологическом каскаде по сравнению с β-амилоидами и τ-белками, но можно поспорить по другому вопросу: обязательно ли клеточное старение для развития патологии (т. е. «вызывает» её), или же оно является всего лишь еще одним побочным эффектом основной патологии. Этот взгляд вполне разумен, но логика проблемы говорит о том, что клеточное старение – важнейшая часть болезни и что старение микроглиальных клеток «вызывает» болезнь Альцгеймера. Все данные отлично сходятся, а какие-либо опровергающие данные отсутствуют. Дело не только в том, что похожий базовый каскад патологий происходит и в других системах, например в коронарных артериях, но и в том, что изменения в функциях клеток дают ясное объяснение того, почему при этой болезни происходит накопление β-амилоидов и τ-белков.
Самым важным вопросом остается медицинское вмешательство. Если предположить, что старение микроглиальных клеток запускает каскад патологий, приводящих к болезни Альцгеймера, на каком этапе мы должны вмешиваться? Можно попытаться предотвратить гипотетическую инфекцию, но мы даже не знаем, есть ли вообще эта инфекция, не говоря уж о том, как ее надежно диагностировать и вылечить. Более того, после того, как микроглиальные клетки постареют и станут работать хуже, никакие антибиотики (даже если они и помогли бы до этого) не остановят патологию. К тому же, после того, функционирование этих клеток нарушится, трудно представить, как и где найти терапевтическое средство, которое уберет отложения β-амилоидов и растворит τ-белковые клубки, при этом оставив нейроны здоровыми и сохранив достаточное количество β-амилоидов и τ-белков в нужных местах, чтобы нейроны получили все необходимое. Где бы мы ни пытались вмешаться, микроглия остается перекрестком, в котором накапливаются все повреждения. Самая многообещающая цель для лечения болезни Альцгеймера – микроглия, а самая эффективная цель внутри микроглии – теломеры, которые контролируют старение клетки.
Если мы хотим предотвратить и вылечить болезнь Альцгеймера, то самой эффективной точкой вмешательства должны стать микроглиальные теломеры. Микроглиальные теломеры – это узкое место в потоке патологии, то самое место, в котором можно предотвратить возникающий внизу по течению каскад, который уничтожает человеческие жизни.
Если мы хотим вылечить болезнь Альцгеймера, нам нужно удлинять теломеры.
Болезнь Альцгеймера: краткая справка
Возраст: вероятнее всего, болезнь Альцгеймера начинается еще до старости, но диагностируется лишь через 10-20 лет после начала малозаметных изменений в клетках мозга. Патологическая лавина начинается задолго до того, как первые нейроны умирают, а мы впервые замечаем когнитивные проблемы. Первоначальный клинический диагноз обычно ставится после 65 лет, хотя бывают и формы с более ранним началом. Болезнь Альцгеймера неизлечима и смертельна. Среднее время между постановкой диагноза и смертью составляет 7 лет[46]. В небольшом числе случаев, особенно в семейной болезни Альцгеймера, определенную роль играет генетический риск, но самый значительный фактор – все-таки сам по себе возраст. Время от времени делаются довольно диковатые заявления – например, болезнь Альцгеймера вызывается алюминиевой посудой или зерновой пищей, – но они практически никогда не подкрепляются конкретными данными.Статистика: оценки распространенности болезни Альцгеймера разные. Диагноз чаще ставится в развитых странах – благодаря более развитым системам здравоохранения и тому, что люди чаще доживают до возраста, в котором она развивается. Но даже в развитых странах статистика заболеваемости болезнью Альцгеймера недооценивается, потому что часто указывается лишь самая непосредственная причина смерти (например, пневмония). По современным оценкам, болезнью Альцгеймера болеют не менее 25 млн человек, причем заболеваемость растет вместе со средней продолжительностью жизни.Убытки и затраты: говорят, что болезнь Альцгеймера – самое дорогое возрастное заболевание, в основном из-за необходимости постоянного ухода и лекарств. В США расходы на эту болезнь составляют более 100 млрд долл. США и продолжают расти[47].Генетический риск: ген, имеющий наибольшую связь с болезнью Альцгеймера, кодирует белок апоЕ4, одну из трех форм аполипопротеина, часто встречающегося в астроцитах и нейронах мозга. АпоЕ играет важную роль в транспортировке липидов (липопротеинов, жирорастворимых витаминов и холестерина) и реакции на нейронную травму. У большинства людей есть гены, кодирующие более «невинные» формы белка, апоЕ2 (7% населения) и апоЕЗ (79%), но вот у людей с геном, кодирующим апоЕ4 (14%), болезнь Альцгеймера развивается с большей вероятностью и в более раннем возрасте[48]. У людей с двумя копиями гена апоЕ4 риск развития болезни Альцгеймера намного больше (в 10-30 раз[49]), чем у тех, у кого гена апоЕ4 нет вообще. Тем не менее, наличие гена апоЕ4 не приводит к автоматическому развитию болезни Альцгеймера и уж точно не «вызывает» ее.Диагноз: первичный диагноз обычно ставится на основе жалоб самого пациента или членов его семьи на потерю памяти, интеллектуальных функций или других изменений поведения. До недавнего времени диагноз в основном основывался на клиническом обследовании и нейропсихологическом тестировании, но сейчас врачи начинают применять более объективные методики – например, лабораторные анализы крови или спинномозговой жидкости, радиологические исследования или офтальмологические исследования малозаметных биохимических изменений в хрусталике или сетчатке.Лечение: в настоящее время не существует никаких способов предотвратить, вылечить или обратить вспять болезнь и даже остановить или более-менее надежно замедлить ее прогресс. Применялось (а иногда и до сих пор применяется) немало лекарств, которые не приносят никакой заметной пользы – просто потому, что врачи и пациенты в отчаянии пытаются попробовать хоть какой-нибудь метод. Среди применяемых средств – ингибиторы ацетил холинэстеразы, NMDA-антагонисты, эстрогены, моноклональные антитела к β-амилоидам, жирные кислоты омега-3 и т. д. Некоторые исследования говорят, что витамин Е (токоферол) замедляет первичное развитие болезни Альцгеймера, хотя данные других исследований ставят эти результаты под сомнение.
Болезнь Паркинсона
Болезнь Альцгеймера поражает в основном когнитивные функции, а вот болезнь Паркинсона – моторные. Отличительные черты болезни Паркинсона – изменение походки, тремор, ригидность мышц, неспособность начать идти или остановиться, движения пальцев, напоминающие счет монет, языковые проблемы, – объединяются в одну большую группу: проблемы с контролем и координацией мышц.
Тем не менее, между болезнями Альцгеймера и Паркинсона столько общего, что их можно практически считать одной болезнью, проявляющейся в двух разных участках мозга. Болезнь Альцгеймера поражает нейроны коры мозга, особенно переднего мозга, а болезнь Паркинсона – нейроны среднего мозга, особенно черной субстанции и хвостатого ядра. Да, это, конечно, очень сильное упрощение, потому что болезнь Паркинсона может действовать на самые разные отделы мозга, а клинические эффекты обоих заболеваний – особенно слабоумие и другие когнитивные изменения – довольно значительно пересекаются. Одно из ключевых различий состоит в том, что вместо отложений β-амилоидов и τ-белков, как при болезни Альцгеймера, мы видим отложения другого белка – α-синуклеина.
Тем не менее, фундаментальное сходство между болезнями Альцгеймера и Паркинсона весьма заметно. В обоих случаях глиальные клетки – особенно микроглиальные – играют важную роль в первоначальном развитии и прогрессе патологии. При болезни Паркинсона еще в самом начале отказывают микроглиальные клетки, а также астроциты – звездообразные глиальные клетки. У пациентов с болезнью Альцгеймера в нейронах накапливаются τ-белки, образуя клубочки, а при болезни Паркинсона в нейронах накапливаются α-синуклеины, формируя тельца Леви. В обоих случаях патология – как видно по накоплению этих ненормальных белков – начинается в нейронах, когда пациент еще с клинической точки зрения здоров. К тому времени, как развиваются клинические симптомы, нейроны уже начинают массово умирать. Когда патология ограничена нейронами среднего мозга – черной субстанцией, – то симтомы в основном моторные; когда она поражает и кору мозга, то симптомы уже включают в себя деменцию и напоминают болезнь Альцгеймера. Как и при болезни Альцгеймера, дисфункция глиальных клеток при болезни Паркинсона приводит к гибели нейронов, которые должны были поддерживаться этими клетками. В них наблюдается отказ внутриклеточных органелл, в том числе митохондрий, рибосом, протеасом и лизосом. Нейронам требуются здоровые глиальные клетки, и когда они перестают работать, нейроны вскоре гибнут.
Болезнь Паркинсона: краткая справка
Возраст: болезнь Паркинсона явно связана с возрастом – средний возраст начала развития заболевания равняется 60 годам, – но она может проявиться практически в любом возрасте. Среди факторов риска – отравление некоторыми пестицидами и гербицидами, а также травмы головы. Болезнь Паркинсона обычно не считается генетической, но генетическая предрасположенность к ней существует, и обусловлена она самыми разными мутациями. Тем не менее, заболеваемость и тяжесть протекания болезни Паркинсона растет с возрастом.Убытки и затраты: как и обычно, точные убытки подсчитать трудно, но в США, по некоторым оценкам, болезнь обходится ежегодно примерно в 25 млрд долл. США[50], в основном из-за затрат на уход за пациентами и других косвенных издержек.Диагноз: в большинстве случаев болезнь Паркинсона первоначально диагностируется по истории болезни и результатам обследования. Подтвердить ее как-то иначе, как при вскрытии, не представляется возможным, потому что нет никаких простых лабораторных или радиологических анализов, которые могут это сделать, хотя с помощью анализов можно исключить некоторые альтернативы. Таким образом, клинические испытания часто считаются полезными и с терапевтической, и с диагностической точки зрения.Лечение: поскольку главный отличительный признак болезни – потеря нейронов, производящих дофамин, большинство методов лечения связаны с лекарствами вроде леводопы и дофаминовых агонистов, которые усиливают дофаминергический эффект тех дофаминовых нейронов, что еще функционируют. К сожалению, у этих лекарств наблюдаются сильные побочные эффекты, к тому же они теряют эффективность, когда болезнь прогрессирует, и все больше дофаминовых нейронов умирает. В этих случаях все чаще рассматриваются нейрохирургические операции, стимуляция мозга или трансплантация клеток (например, стволовых клеток).
Назад: Сердечная недостаточность
Дальше: Глава седьмая Как замедлить старение

