Книга: Теломераза. Как сохранить молодость, укрепить здоровье и увеличить продолжительность жизни
Назад: Гормональное старение
Дальше: Глава шестая Косвенное старение: невинные наблюдатели
Отдельные системы и особые случаи
Старение легких
Чем старше мы становимся, тем труднее нам становится дышать. Многие пожилые люди даже не замечают особых изменений в своем дыхании, потому что в покое или при повседневной деятельности мы пользуемся лишь малой частью дыхательных способностей. Но вот когда мы даем себе нагрузку, проявляются все скрытые проблемы с легкими, которые у нас могут быть. Старость сначала сказывается на объеме остаточного воздуха в легких и только потом уже начинает влиять на дыхание в обычной жизни.
Наши легкие медленно и постепенно стареют – вне зависимости от курения, травм, инфекций и прочих факторов. В молодости одышка у нас возникает только после очень сильных или долгих нагрузок. С возрастом – после все более малых объемов нагрузки. Кроме того, любые проблемы с легкими быстро ускоряют этот процесс, так что, например, многие хронические курильщики страдают от одышки даже безо всяких нагрузок.
Само по себе старение – опять-таки, вне зависимости от других проблем, – вызывает в легких изменения нескольких типов, прежде всего – структурные, сосудистые и иммунные. Старение сосудистой и иммунной систем обсуждаются в других местах этой книги, так что сейчас мы рассмотрим структурные изменения.
Возрастные структурные изменения в легких практически полностью определяются постепенной потерей альвеолярной поверхности (как при ХОБЛ), хотя изменения происходят и между альвеолами (интерстициальные заболевания легких). Альвеолы – маленькие мешочки, благодаря которым в организме происходит газообмен с кровью – с возрастом теряют в численности.
Представьте себе два маленьких мыльных пузыря, которые срастаются в один пузырь, чуть побольше. Примерно то же происходит и со многими нашими маленькими альвеолами; в результате уменьшается площадь газообмена, и легкие начинают работать намного менее эффективно. По большей части эта проблема обусловлена потерей самих альвеол, но легочная ткань тоже теряет эластичность, поддержку и мышечные функции, так что мелкие дыхательные пути сужаются. Из-за этих двух проблем мелкие дыхательные пути вообще закрываются, еще уменьшая доступную альвеолярную поверхность. Общий результат всех этих факторов состоит в том, что, несмотря на то, что объем легких с возрастом практически не меняется, количество, площадь поверхности и сложность альвеол внутри легких уменьшается, так что эффективный газообмен становится поддерживать все сложнее и сложнее. Чтобы поддерживать концентрацию кислорода в крови и удалять из кровеносной системы двуокись углерода, требуется все больше и больше нагрузок. Уровень двуокиси углерода в крови может медленно расти, а уровень кислорода – медленно уменьшаться.
Возникающие в результате симптомы – особенно субъективная нехватка дыхания, – это, пожалуй, самая пугающая из всех возрастных проблем. Затруднение дыхания, как и утопание или удушение, заставляет нас вспомнить самые глубоко засевшие страхи и порождает панику. Острые инсульты и сердечные приступы убивают сразу и внезапно. Болезнь Альцгеймера – это трагедия, а другие возрастные заболевания могут сделать вас инвалидом, но вот затруднение дыхания приводит нас в ужас, и этот ужас лишь увеличивается, когда наши легкие отказывают. К счастью, при нормальном старении легкие до такой степени обычно не отказывают. Большинство из тех, у кого проявляются заметные симптомы, либо были курильщиками, либо имели другие тяжелые проблемы с легкими. Тем не менее, если бы мы жили достаточно долго и у нас раньше не развивались другие возрастные заболевания, то эти симптомы проявлялись бы у всех. Единственный способ предотвратить их – что-то сделать с фундаментальными клеточными причинами старения легких.
Когда мы стареем, у нас в легких не просто становится меньше клеток: в оставшихся клетках теломеры становятся все короче. Это верно и для клеток, из которых состоят сами альвеолы, и для других типов легочных клеток – интерстициальных, иммунных (например, макрофагов), клеток, из которых состоят стенки капилляров. Во всех случаях эти эффекты – в том числе укорочение теломер – лишь ускоряются курением, тяжелыми и повторяющимися пневмониями и другими травмами легких.
Самая часто диагностируемая возрастная легочная болезнь обычно называется ХОБЛ, хотя с годами терминология менялась. Этот диагноз часто пересекается с эмфиземой, идиопатическим легочным фиброзом, диффузным интерстициальным фиброзом, интерстициальной пневмонией и т. д. Эти диагностические пересечения объясняются тем, что возрастные изменения легких – это целый спектр: меняются как сами альвеолы (при ХОБЛ), так и ткань между альвеолами (интерстициальные болезни легких). Конечно, все подобные изменения так или иначе приводят к снижению функциональности легких, но они могут по-разному проявляться, давать разные симптомы при диагностике и немного по-разному протекать. Впрочем, почти во всех случаях у этого разрозненного набора болезней есть один общий признак: они связаны с возрастом и усугубляются любыми травмами легких, такими как курение, загрязнение окружающей среды, инфекции и т. д. И, что важнее всего, вне зависимости от конкретной болезни результат для пациента одинаков: ухудшение функциональности легких, одышка, неспособность вести нормальную повседневную жизнь и высокий риск смерти.
Возрастные легочные болезни, скорее всего, имеют одну и туже клеточную патологию: повреждение, потеря клеток, укорочение теломер, изменение паттернов экспрессии генов, изменение функциональности клеток, нарушение функции тканей и в конце концов болезнь. Легочные травмы – курение, воздействие вредных веществ, инфекции и т. д. – лишь ускоряют изменения в клетках легких. Эти травмы повреждают и убивают клетки в легких, заставляя другие клетки быстрее делиться, чтобы заменить их, что, в свою очередь, ускоряет укорочение теломер, эпигенетические изменения и наступление возрастных легочных заболеваний. Кроме симптоматической терапии, сейчас не существует никакого метода лечения, который бы предотвращал, останавливал или значительно замедлял развитие возрастных легочных заболеваний.
Как и в случае с другими системами, для эффективной терапии нам потребуется возможность заново удлинять теломеры легочных клеток.
Старение легких: краткая справка
Возраст: заметная потеря альвеол наблюдается уже на третьем и четвертом десятке жизни. После этого возраста мужчины теряют альвеолы быстрее, чем женщины. Интерстициальные изменения – в тканях между альвеолами – тоже развиваются с возрастом, но их часто диагностируют позже, а протекают они быстрее.
Статистика[33]: ХОБЛ диагностируется примерно у 5% населения. В некоторых развитых странах это четвертая по «популярности» причина смерти. Заболеваемость, скорее всего, будет возрастать в развивающихся странах из-за роста употребления табака, а также по всему миру, когда продолжительность жизни увеличится.
Убытки и затраты[34]: по оценкам – около 50 млрд долл. США только в Америке.
Диагноз: диагноз часто ставят на основе симптомов (одышка, кашель, мокрота) или медицинского обследования; обычно они подтверждаются рентгеном, анализами легочной функции, уровнем газов в артериальной крови и компьютерной томографией высокого разрешения, особенно в случае интерстициальной болезни легких. В некоторых случаях используется также биопсия легкого.
Лечение: нынешние методы лечения – в основном поддерживающие. Это лечение, конечно, дает облегчение острых симптомов, но вот на развитие заболевания практически никакого влияния не оказывает. Во всех случаях пациенты обязаны бросить курить, а также должны избегать других факторов, ускоряющих повреждение легких, например загрязненного воздуха и инфекций. При лечении применяются антибиотики (для острых бактериальных инфекций), сосудорасширяющие средства, стероиды, прививки (для профилактики пневмококковых и вирусных инфекций), кислородная терапия, легочная реабилитация и – в самых крайних случаях – пересадка легких.
Старение желудочно-кишечного тракта
Желудочно-кишечный тракт идет ото рта до анального отверстия; это набор разнообразных тканей, выполняющих пищеварительные функции: они приносят еду, разлагают ее на компоненты, усваивают питательные вещества и избавляются от остатков. С топологической точки зрения человеческое тело эквивалентно бублику (тороиду); желудочно-кишечный тракт в этом случае представляет собой дыру – или трубку, – проходящую через центр «бублика», хотя эта трубка очень сложна и по форме, и по функциям.
Во рту возрастные изменения в основном касаются зубов – в том числе все более частые периодонтиты и гингивиты. Очень заманчиво было бы списать все возрастные изменения зубов, в том числе постепенную эрозию эмали и потерю зубов, просто на «неизбежный износ». Во многом это верно, и – не считая исходной замены молочных зубов постоянными – нет никаких особых причин считать, что проблемы, связанные только и исключительно с использованием зубов, можно как-то исправить. С другой стороны, многие возрастные изменения усугубляются диетическими факторами риска (сахара, кислоты и т. п.) и отказом от чистки зубов. Можно также предположить, что определенную роль играет и старение иммунной системы – особенно при периодонтите, который вызывается хроническими слабыми инфекциями. Данные показывают, что и периодонтит, и иммунное старение коррелируют с укорочением теломер.
Благодаря генам, рациону или гигиене некоторым людям удается сохранить свои зубы более или менее невредимыми до старости, а другие теряют большинство зубов в относительно молодом возрасте, еще до того, как возрастные изменения проявятся в других системах. Да, вполне возможно, что удлинение теломер в иммунных клетках заметно улучшит здоровье полости рта – в частности, предотвратит периодонтит, – и позволит большему числу людей сохранить свои зубы и в старости, но вместе с тем данные показывают, что и диета, и гигиена полости рта всегда будут важными предиктивными факторами для возрастных проблем с зубами.
Возрастные изменения в печени и кишечнике часто трудно отличить от болезней, никак не связанных со старением, потому что многие из них начинаются или ухудшаются, когда мы стареем, в том числе гастроэзофагеальная рефлюксная болезнь и различные кишечные заболевания – болезнь Крона, регионарный энтерит, синдром раздраженного кишечника и т. д. Во многих случаях эти болезни вызываются (или усугубляются) старением клеток в желудочно-кишечном тракте или иммунной системе, но нет никаких явных причин для обсуждения большинства этих болезней в контексте старения.
Впрочем, в кишечнике все же есть и настоящие возрастные изменения. Большинство этих изменений связано с функционированием стенок кишечника, а не вышеупомянутыми болезнями. В стареющем кишечнике – даже в отсутствие конкретной болезни – возникают, например, заметные проблемы с абсорбцией, иммунными функциями и подвижностью. Старый кишечник не так эффективно усваивает питательные вещества и хуже производит различные ферменты и коферменты, необходимые для более эффективной абсорбции, в частности, железа, кальция, цинка и витаминов B12 и D. Оральные препараты также могут хуже усваиваться, из-за чего дозировка средств становится ненадежной или недостаточной. Стенки кишечника теряют мышечную силу, из-за чего перистальтика – волнообразные сокращения, с помощью которых еда движется по кишечнику – становится менее эффективной, что повышает риск запора. Кроме того, стенки кишечника утрачивают и эластичность, и перистальтические волны заставляют их вспучиваться, образуя маленькие кармашки, торчащие сквозь стенки. Эти дивертикулы воспаляются (дивертикулез), или в них развивается инфекция (дивертикулит), что приводит к значительному повышению морбидности или смертности у престарелых пациентов. Почти у половины людей старше 70 лет[35] уже есть дивертикулез, который часто сопровождается ухудшением состояния.
В целом клетки желудочно-кишечного тракта – особенно те, что отвечают за абсорбцию и производство коферментов, мышечные и иммунные – делятся и демонстрируют признаки укорочения теломер. Удлинение теломер, скорее всего, поможет смягчить возрастные изменения.
Старение мочеполовой системы
Почки, мочевой пузырь и связанные с ними структуры заметно меняются с возрастом. Некоторые из этих изменений важнее всего для вас лично, например функция ваших почек, а другие отражаются и на тех, кто с вами живет – например, когда вам по несколько раз за ночь приходится будить человека, спящего с вами в одной постели, чтобы сбегать в туалет. И, конечно же, мочевой пузырь – отнюдь не единственный орган мочеполовой системы, который с возрастом начинает работать хуже, а это важно и для вас, и для вашего партнера или супруга.
Работа почек заключается в фильтрации крови: они возвращают в кровообращение то, что вам нужно, и удаляют то, что не нужно. И та и другая функции – и фильтрация, и удаление – с возрастом становятся менее эффективными. Когда мы теряем клетки и заменяем их, теломеры в почечных клетках становятся все короче и короче. Этих старых клеток, во-первых, меньше, во-вторых, они менее эффективны. Потеря почечных клеток приводит к потере нефронов, фильтрующих аппаратов, которые и выполняют всю работу почек. Как и в других органах, с возрастом меняются и стенки артерий и капилляров. В целом, изменения в почках и кровеносных сосудах с возрастом приводят к увеличению риска гипертонии. Из-за уменьшения количества нефронов и старения клеток эффективность почек уменьшается. Из-за старения артерий и неэффективной фильтрации повышается давление. Наконец, уровень некоторых важных молекул в крови, который почки тщательно поддерживают в определенных пределах, тоже идет вразнос. Даже когда эти уровни нормальны, они все равно менее стабильны, и перепады случаются намного чаще, чем у молодых людей. У большинства людей даже старые почки обладают достаточным запасом прочности, чтобы справляться с повседневными потребностями, но чем меньше этот запас прочности, тем вероятнее развитие почечной недостаточности. Чем мы старше, тем меньший стресс требуется, чтобы вызвать серьезные проблемы с почками – вплоть до их полного отказа.
Мочевой пузырь не только сам теряет клетки и клеточную функциональность: клетки стенки мочевого пузыря теряют способность производить и поддерживать эластин и коллаген. В результате мочевой пузырь становится менее эластичным и менее растяжимым и может удерживать меньшие объемы мочи, чем в молодости. Мышцы становятся слабее и уже не могут быстро и полностью освободить мочевой пузырь. В результате нам все реже удается проспать целую ночь без похода в туалет. Из-за всех этих изменений, сопровождающихся еще и старением иммунной системы, постепенно растет вероятность развития инфекций мочевых путей, недержания мочи или ишурии.
Значительные изменения в стареющей мочеполовой системе заметно влияют на способность заниматься сексом, причем у обоих полов. Мужчинам с возрастом все труднее поддерживать эрекцию.
На развитие и степень тяжести эректильной дисфункции влияют многие факторы, например ожирение, курение, употребление алкоголя, недостаточные физические нагрузки, – нет никаких сомнений в том, что по большей части в проблеме виновато само старение. Алгоритм все тот же: клетки, отвечающие за реакцию сосудов, которая необходима для эрекции, теряют функциональность, когда делятся, теряют теломеры, и у них меняется эпигенетические паттерны. У женщин самые заметные изменения в слизистой оболочке влагалища происходят вместе с менопаузой, но даже там клетки тоже делятся и теряют длину теломер. Изменение эпигенетических паттернов в данном случае вызвано двумя факторами: укорочением теломер и понижением уровня эстрогенов. Эстрогены, как и другие половые гормоны, прикрепляются непосредственно к хромосомам и модулируют экспрессию генов. В результате слизистая оболочка влагалища становится тоньше, мышцы – менее сильными и эластичными, да и смазка выделяется не так обильно.
Старение органов чувств
Изменений в органах чувств происходит великое множество – в осязании, зрении, слухе, обонянии, вкусе. Изменения в осязании нередко остаются незамеченными – возможно, потому, что они происходят очень постепенно и играют не такую большую роль в повседневной жизни и общении. Ухудшение обоняния и вкуса тоже постепенно, но более заметно, особенно когда мы грустим, например, что больше не можем наслаждаться любимой едой. Впрочем, хуже всего – потеря остроты слуха и зрения. Зрение и слух жизненно важны и для работы, и для игры, и для общения. Ухудшение зрения и слуха с возрастом мы ощущаем очень остро.
Мы отмечаем потерю эффективности всех органов чувств, но эта потеря чаще связана не с чувствительностью внутри рецептора, а со способностью отличать один рецептор от другого. Например, в случае с осязанием каждый отдельный рецептор может сохранять прежнюю чувствительность, а вот количество рецепторов сокращается.
Этот принцип практически универсален, и его часто неправильно понимают. Например, слуха можно лишиться двумя разными способами. Из-за потери чувствительности рецепторов мы теряем возможность слышать тихие звуки. А если мы лишимся способности отличать разные рецепторы друг от друга, то, слыша речь, не сможем разобрать слова.
Осязание
С осязанием все довольно просто: с возрастом мы теряем рецепторы. Мы рождаемся с заранее определенным количеством рецепторов. Это значит, что количество рецепторов на 1 мм2 кожи уменьшается, когда мы взрослеем, и общая площадь кожи увеличивается. Впрочем, с возрастом мы начинаем еще и терять рецепторы. Любой конкретный рецептор, например определяющий легкие прикосновения, может оставаться таким же чувствительным, как и всегда, но наша способность точно определить точку контакта уменьшается из-за потери рецепторов. Мы по-прежнему понимаем, что к нам прикоснулись, но не уверены, где и что именно нас коснулось. Точнее всего такая потеря чувствительности измеряется тестом на «различение двух точек»: способность отличить, коснулись вас однажды, или же это два одновременных прикосновения на небольшом расстоянии друг от друга. Впрочем, субъективно мы скорее замечаем потерю чувствительности, когда уже не можем на ощупь идентифицировать, например, типы ткани или содержимое карманов или сумок. Короче говоря, мы с возрастом все хуже определяем предметы на ощупь.
Данные говорят[36], что количество осязательных рецепторов к 70 годам уменьшается более чем на 80%, так что осязание у нас работает хуже, чем в молодости. Если внимательнее присмотреться к коже, то можно заметить, что количество нервов часто практически не меняется, а вот количество рецепторов на нерв и проводимость с возрастом очень заметно снижается. В старости мы медленнее замечаем и хуже понимаем, к чему прикоснулись.
Все эти изменения, скорее всего, объясняются клеточным старением. Периферические нервы делятся редко, так что клеточное старение в них маловероятно, но вот клетки, из которых состоят миелиновые оболочки периферических нервов, которые обеспечивают быструю передачу сигналов, стареют – как и клетки самих периферических рецепторов. Периферические рецепторы, определяющие легкое прикосновение, боль, температуру или давление, заменяются при нормальном использовании и, таким образом, подвержены клеточному старению из-за укорочения теломер.
Обоняние и вкус
С возрастом мы постепенно теряем возможность различать запахи и вкусы. Как и в случае с периферическим обонянием, это побочный эффект старения клеток-рецепторов – обонятельных рецепторов в носу и вкусовых сосочков во рту. Мы практически не теряем способности реагировать на резкие стимулы – горький вкус и неприятные запахи, – но вот чувствовать тонкие различия вкуса или запаха уже не можем, что особенно заметно при приеме пищи. Еда становится менее заманчивой и менее приятной.
Потеря эффективности всех органов чувств чаще связана не с чувствительностью внутри рецептора, а с возникающей неспособностью отличать один рецептор от другого.
Обоняние явно ухудшается с возрастом, но точные измерения сделать трудно: как подсчитать что-то настолько субъективное, как запах? Тем не менее, большинство исследований показывает, что потеря обонятельной чувствительности происходит у многих людей к 70 годам, а к 80 лишь обостряется. Эти изменения коррелируют с заметным уменьшением числа обонятельных рецепторов. Рецепторы, конечно, восстанавливаются – особенно у молодых млекопитающих, – но скорость восстановления снижается с возрастом, так что обонятельная площадь в носовой полости уменьшается, как уменьшается и количество рецепторов в ней. Примерно такой же процесс – правда, не такой резкий и менее заметный – происходит и со вкусовыми сосочками на языке. Например, у молодых взрослых рецепторов вполовину меньше, чем у детей, и мы продолжаем терять их с возрастом. Впрочем, наша способность различать пять основных вкусов – сладкий, кислый, горький, соленый и умами – ухудшается намного меньше, чем способность чувствовать запахи. Поскольку запахи играют большую роль в наслаждении пищей, мы ощущаем заметную субъективную потерю способности получать удовольствие от еды или отличать тонкий вкус от самого простого.
Постепенная потеря вкусовых и обонятельных рецепторов и способности их восстанавливать, скорее всего, вызвана клеточным старением. На данный момент утрату этих чувств невозможно вылечить, но удлинение теломер в оставшихся рецепторах выглядит многообещающим клиническим методом.
Слух
Даже в век СМС-сообщений и электронной почты слух остается одним из важнейших средств поддержания общения. В нашей культуре использование звука для функционирования является практически обязательным требованием – не считая разве что языка жестов и письма. Когда мы стареем, то начинаем слышать хуже; один из известнейших штампов – изображение старика, который прикладывает руку к уху и переспрашивает: «Что?» Пресбикузис – старческая глухота – встречается практически у всех, хотя, конечно, по тяжести она может различаться. Что интересно, самое распространенное возрастное ухудшение слуха связано со способностью слышать не очень тихие, а высокочастотные звуки, из-за чего становится трудно различать согласные звуки в чужой речи, слышать щебет птиц или звонок телефона в соседней комнате.
Итак, с возрастом нам становится труднее понимать речь – как людей, стоящих рядом с нами в комнате, так и персонажей кино или телешоу. Тугоухость мало влияет на низкочастотные звуки – гласные, – но вот с согласными возникают немалые трудности. Дело не в том, что мы не слышим, что нам говорят. Нам просто становится труднее различить, допустим, слова песком и пешком, огород и оборот или холод и голод, и, соответственно, труднее понять смысл произнесенной фразы.
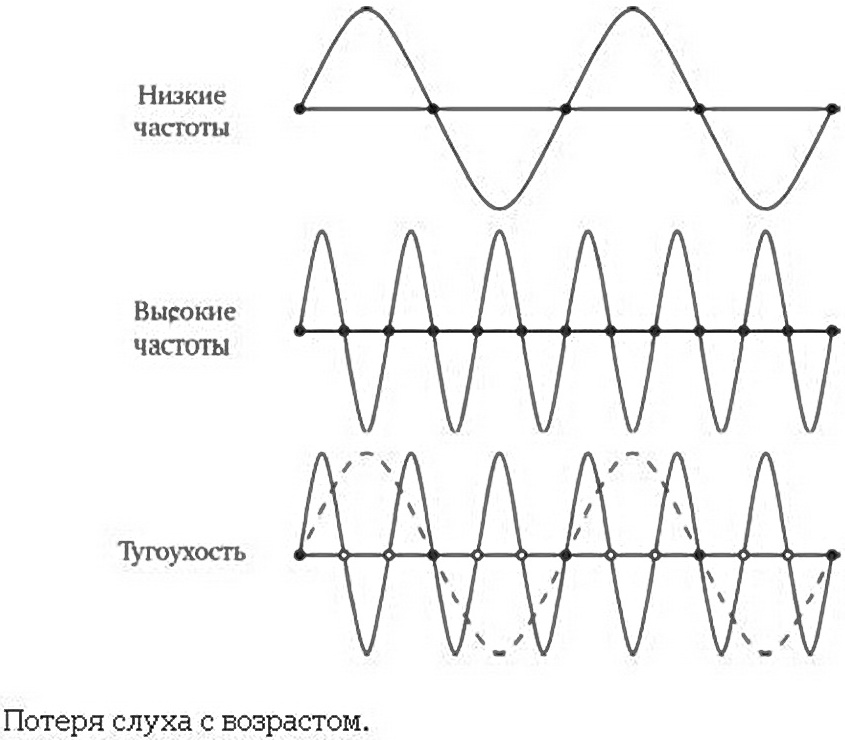
Потеря способности различать высокочастотные согласные вызвана тем, как работают наши слуховые рецепторы. Звук состоит из коротких стоячих волн (см. график), вызывающих сигналы слуховых рецепторов (обозначены черными кружками). Высокочастотные звуки вызывают сигналы в большем числе рецепторов, низкочастотные – в меньшем числе. Старея – и теряя часть слуховых рецепторов, обозначенных белыми кружками, – мы теряем способность различать высокочастотные звуки, в том числе и согласные звуки в речи.
От потери способности слышать высокочастотные звуки (и понимать речь) страдают практически все пожилые люди, но многие из нас с возрастом сталкиваются и с другими, менее специализированными видами тугоухости и глухоты. Потеря слуха может вызываться самыми разными причинами – потерей большого количества слуховых рецепторов, повреждением нервов, атеросклерозом, диабетом, гипертонией, травмами, повреждениями от лекарственных средств и т. д. Многие из этих причин, например атеросклероз, напрямую связаны с клеточным старением, но другие, например травмы и повреждения от лекарственных средств, не имеют к старению никакого отношения. Потеря рецепторов, впрочем, напрямую вызвана старением клеток, потому что слуховые рецепторы не обновляются и не функционируют так, как должны. Опять-таки, единственным эффективным методом вмешательства видится удлинение теломер оставшихся клеток.
Зрение
Большинство из нас считают зрение самым жизненно важным чувством. Зрение с возрастом меняется по-разному, хотя полная слепота очень редка. После 40 лет практически все начинают испытывать трудности при фокусировке зрения на близких предметах. Нам становится трудно читать и, например, вдевать нитку в иголку или насаживать крючок на леску. Обычно считается, что это изменение – пресбиопия – связана с возрастными изменениями хрусталика, но, возможно, оно вызывается изменениями в цилиарных мышцах, контролирующих форму хрусталика, а также в форме глазного яблока и связанных с ним структур (астигматизм). Сам хрусталик состоит из прозрачных клеток, которые преломляют свет, создавая сфокусированное изображение на сетчатке; он может фокусироваться либо на близких, либо на далеких предметах. У клеток хрусталика нет ни прямого кровоснабжения, ни митохондрий, но они остаются метаболически активными. Эти клетки производят основной прозрачный белок, кристаллин, но обновляются ли эти белки во взрослом хрусталике, пока не очень ясно.
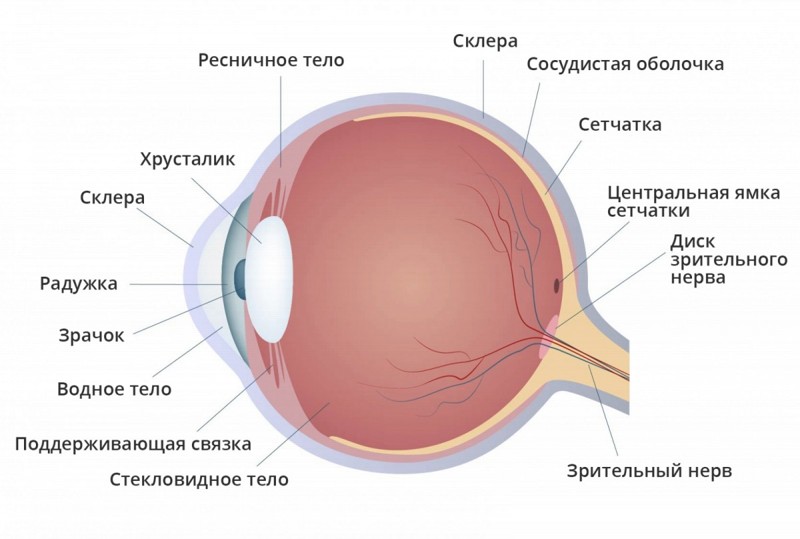
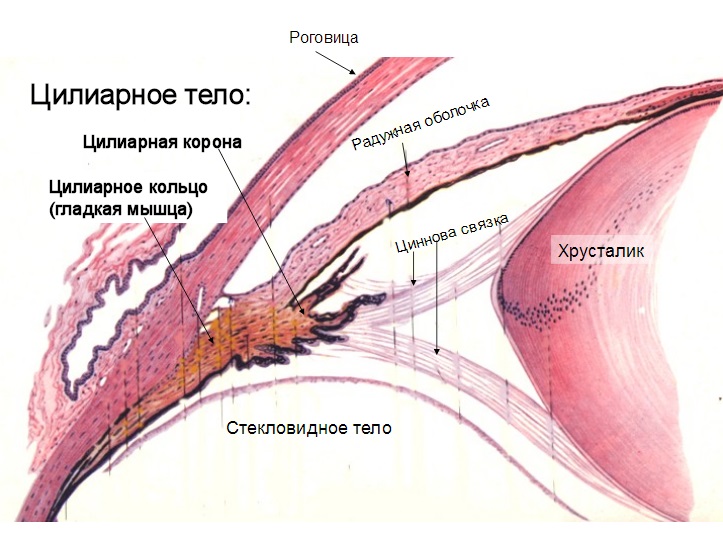
Цилиарные мышцы контролируют форму хрусталика человеческого глаза, позволяя ему фокусироваться и на близких, и на далеких предметах. По поводу того, почему нам с возрастом становится труднее фокусироваться на близких предметах, есть разные мнения.
Общего согласия по поводу главной причины возрастной пресбиопии пока нет, но, возможно, дело в постепенном накоплении клеток на внешних слоях хрусталика, что делает его менее эластичным и меняет его форму. После 20 лет хрусталик становится круглее, из-за чего цилиарным мышцам приходится прилагать больше усилий, чтобы сфокусировать взгляд. Если эта простая модель точна, то клеточное старение само по себе, скорее всего, значительной роли не играет, так что для борьбы с пресбиопией придется и дальше использовать проверенный временем подход – очки и контактные линзы. С другой стороны, вполне возможно, что эпигенетические изменения косвенным образом влияют на обновление белков хрусталика или формы самого хрусталика. Точно так же возможно и то, что клетки цилиарных мышц стареют, ослабляя их, и мышцы уже не могут так же эффективно фокусировать хрусталик, так что эти клетки могут быть хорошей точкой для медицинского вмешательства, если мы научимся удлинять теломеры. Вопрос, можно ли с помощью теломеразной терапии облегчить течение пресбиопии, пока остается открытым.
Менее очевидное возрастное изменение зрения – постепенная потеря контрастной чувствительности, которая происходит, когда сетчатка уже не может различать мелких деталей. Это может вызываться различными факторами, но одна из главных причин – скорее всего, потеря ганглионарных клеток сетчатки. Ганглионарные клетки отвечают за первоначальную обработку визуальной информации в сетчатке, еще до отправления ее в мозг. Ганглионарные клетки настроены на разные частоты, так что с уменьшением численности этих клеток мы в определенной степени теряем способность различать мелкие детали. Представьте, что вместо современного телевизора с высоким разрешением вам дали старый кинескопный – это примерно то же самое. Что интересно, определенная часть этих клеток также отвечает за реакцию зрачка на свет и модуляцию наших циркадных ритмов; и то, и другое с возрастом начинает доставлять проблемы – скорее всего, именно из-за постепенной потери этих клеток.
Пресбиопия – это самое распространенное возрастное изменение зрения, но не его больше всего боятся. Резкая потеря реального зрения, а не просто его остроты, может стать результатом разнообразных заболеваний, в том числе макулодистрофии, глаукомы, катаракты, диабетического поражения глаз и т. д. Некоторые из них явно связаны с изменениями в сосудистой системе – о них речь пойдет в следующей главе, – но причины других находятся внутри глаза.
Возрастная макулодистрофия – одна из главных причин слепоты, особенно у пожилых людей. Она печально знаменита тем, что атакует «центр визуального внимания», центральную ямку сетчатки, так что у людей просто не получается разглядеть то, на чем они пытаются сфокусировать зрение, даже если их периферийное зрение сохранилось в более-менее нормальном состоянии. Из-за этого они не могут читать, видеть лиц и вообще делать что-либо, что связано с визуальными деталями. Люди с макулодистрофией могут видеть периферийные предметы, и это помогает им передвигаться и выполнять многие повседневные действия, но заболевание постепенно прогрессирует. У пожилых людей риск высок и постоянно возрастает. Макулодистрофия наблюдается примерно у каждого десятого пожилого человека в первое десятилетие после ухода на пенсию (в возрасте 65-75 лет), а вот в следующее десятилетие – уже у каждого третьего. Макулодистрофия начинается с осаждения желтого пигмента (формирования друз) в желтом пятне. Источник этого пигмента пока не выяснен – возможно, соседние клетки, возможно, клетки иммунной системы, – но можно предположить, что он производится и модулируется клетками, и эти функции при старении клеток нарушаются. Если дело действительно в этом – если отложения вызываются эпигенетическими изменениями стареющих клеток, – то можно с уверенностью сказать, что нынешние методы лечения неэффективны: так и есть, потому что они занимаются лечением симптомов, а не причин. Можно ли предотвратить или вылечить возрастную макулодистрофию с помощью удлинения теломер, пока не ясно, но, скорее всего, работа в этом направлении будет эффективнее нынешних видов терапии.
Катаракта – это заболевание хрусталика, которое чаще развивается с возрастом; является причиной примерно половины всех случаев слепоты в мире. Одной из основных причин катаракты считается просто старение, но также обнаружены ее связи с диабетом, травмами, воздействием ионизирующего излучения (особенно ультрафиолетового), генетикой, болезнями кожи, курением и некоторыми лекарствами. Когда катаракта прогрессирует, хрусталик становится все менее прозрачным, и в конце концов зрение полностью теряется. Само слово – метафора, обозначающая белую (а не прозрачную) воду в водопаде. Катаракта, похоже, связана с увеличением содержания воды в белках хрусталика. Сами белки денатурируются и с возрастом начинают деградировать. Предполагалось, что белки хрусталика в течение жизни не меняются – и, соответственно, не ремонтируются и не обновляются, – но недавние исследования показывают, что это слишком упрощенный взгляд[37]. Механизмы пока неясны, но белки хрусталика постепенно все же обновляются, даже у взрослых, и это, судя по всему, результат изменения паттерна экспрессии генов. Хрусталик – даже взрослого человека – это динамический орган, который обычно сохраняет способность к транспортировке и замене кристаллиновых белков. Когда хрусталик лишается этой способности, возникает катаракта. Можно ли предотвратить или вылечить катаракту с помощью нормализации эпигенетических паттернов и возвращения к нормальному обновлению белков? Пока неизвестно, но на клинические испытания возлагается немало надежд.
Глаукому иногда называют «безмолвным вором зрения», хотя быстро наступающая закрытоугольная форма обычно вызывает боль, так что «безмолвной» ее назвать трудно. После катаракты глаукома – вторая в мире по частоте причина слепоты. Глаукому обычно вызывает повышенное давление в передней камере глаза – пространстве между роговицей и хрусталиком. Оно отталкивает хрусталик назад и повышает давление внутри глазного яблока, а это постепенно приводит к ухудшению кровоснабжения глаза.
Результатом может стать гибель клеток сетчатки, визуальных рецепторов и зрительного нерва, что в конце концов вызывает слепоту. Причина проблемы лежит в ресорбции жидкости – водянистой влаги – из передней камеры. Жидкость продолжает производиться, и если ее ресорбция недостаточна, то поднимается давление, и развивается глаукома. В современной медицинской терапии больше всего внимания уделяется либо уменьшению производства водянистой влаги, либо увеличению ее оттока с помощью различных механизмов. Существует по крайней мере два основных типа глаукомы, открытоугольная и закрытоугольная, но точные клеточные механизмы и их связь с клеточным старением остаются неисследованными. Впрочем, в нескольких случаях гены из теломерного региона оказались связаны с некоторыми формами глаукомы. У более типичных форм глаукомы ее связь со старением определенно говорит о том, что эпигенетические изменения являются одной из причин болезней, и они будут реагировать на теломеразную терапию.
Болезни, прямо связанные с теломерами
Кроме нормальных возрастных заболеваний, существует еще и несколько болезней, которые, как было доказано, непосредственно связаны с обновлением теломер. Многие из них вызваны ненормальным функционированием теломеразы или самих теломер и обычно являются генетическими.
Врожденный дискератоз
Врожденный дискератоз (ВДК) – это генетическая болезнь, вызванная ненормальным обновлением теломер; если конкретно – одной из как минимум трех (а возможно, и большего числа) мутаций, влияющих на РНК-компонент теломеразы. В результате клетки – особенно стволовые – не могут поддерживать нормальную длину теломер во время развития. Как и можно было бы ожидать, у хромосом с укороченными теломерами повышается риск генетических мутаций и, соответственно, рака. Кроме того, у больных ВДК наблюдаются необычная пигментация кожи, преждевременная седина, ненормальные ногти и т. д. Болезнь обычно диагностируется еще до полового созревания; примерно 75% пациентов – мужского пола. Самая большая клиническая проблема – не очевидные симптомы, а то, что у 90% больных ненормально работает костный мозг, и это приводит к смерти примерно 70% из них от кровотечения или (реже) отказа печени. Что вполне предсказуемо, учитывая ненормальное развитие теломер, многие свойства ВДК чем-то напоминают раннее старение. Есть все причины считать, что теломеразная терапия сможет эффективно вылечить ВДК, в частности, потому, что в лабораторных условиях проблему удалось исправить, удлинив теломеры[38].
Прогерии
Прогерии – это ряд болезней со схожими симптомами: прогерия Гетчинсона – Гилфорда, синдром Вернера, акрогерия, метагерия и другие. В случае с «классической», или детской, прогерией Гетчинсона – Гилфорда, редким генетическим расстройством, теломеры короткие уже с рождения – судя по всему, это связано с дефектом ламина А, белка, воздействующего на внутреннюю мембрану ядра и вызывающего ненормальное обновление теломер. Длина теломер при рождении соответствует длине нормальных теломер 70-летнего человека. Учитывая, насколько у таких детей «старые» клетки, неудивительно, что они выглядят, как пожилые, и умирают в среднем в возрасте 12,7 лет, обычно – от атеросклероза (сердечных приступов и инсультов). Причем, хоть они и выглядят стариками, и у них «старые» кровеносные сосуды, кожа, волосы и суставы, у них при этом нет повышенного риска развития болезни Альцгеймера или одряхления иммунной системы. Дефект в ламине А приводит к образованию неправильной формы белка, которая называется прогерии – он встречается и в нормальных старых клетках. Поначалу эта ненормальность привлекла большое внимание, но попытки исправить неправильную форму белка с помощью ингибиторов фарнезилтрансферазы оказались неудачными – с тем же успехом можно запирать конюшню после того, как из нее уже увели лошадь. Более очевидное медицинское вмешательство – удлинение теломер – не рассматривалось, несмотря на то, что было предложено еще 20 лет назад[39], в том числе в учебниках по медицине[40].
ВИЧ / СПИД
ВИЧ и СПИД очень любопытным образом связаны с более распространенными возрастными заболеваниями, потому что быстрое обновление клеток приводит к не менее быстрому укорочению теломер в лимфоцитах. Результат напоминает старение иммунной системы, правда, ограниченное конкретными типами клеток, но усугубленное дополнительными повреждениями, нанесенными вирусом организму. Вирус ВИЧ заражает клетки иммунной системы, особенно T-лимфоциты и дендритные клетки. Когда зараженные клетки умирают, организм реагирует, вызывая деление иммунных клеток, и длина теломер в этих клетках с течением болезни становится все меньше. Пока организму удается восстанавливать гибнущие лимфоциты, сохраняется нестабильное равновесие, но когда теломеры укорачиваются, скорость деления клеток замедляется, а функциональность новых клеток становится все ограниченнее. А затем наступает относительно внезапная точка перегиба от морбидности к смертности. Уже довольно давно выдвигалось предположение, что теломераза, хоть она и не является лекарством от ВИЧ, может предотвратить смерть, помогая организму постоянно поддерживать иммунный ответ, а не постепенно лишаться всех иммунных клеток. Поскольку сейчас уже существует несколько довольно эффективных методов лечения ВИЧ – противовирусные средства, высокоактивная антиретровирусная терапия (ВААРТ) и особенно ингибиторы протеазы ВИЧ, а также ожидаемая в обозримом будущем вакцина от ВИЧ, – возможную пользу от применения теломеразы практически не рассматривали, хотя она и остается потенциально эффективной точкой медицинского вмешательства.
Рак
Рак – это больной вопрос в любой дискуссии по поводу использования теломер в качестве цели для терапии. Вопрос ставится в самых разных формах, но суть его состоит в том, безопасна ли теломераза, или, если сложнее, защищают ли длинные теломеры от рака или, наоборот, вызывают его. Лаконичнее всего он формулируется так: вызывает ли теломераза рак?
✓ Нет, теломераза не вызывает рак.
✓ Да, теломераза может предотвратить большинство видов рака.
Дискуссия начинается со своеобразного парадокса: большинство раковых клеток производят теломеразу, которая должна удлинять теломеры, но при этом у большинства раковых клеток короткие теломеры. С другой стороны, среди нормальных клеток, которые обычно не производят теломеразу, с наименьшей вероятностью становятся раковыми именно клетки с длинными теломерами. Присутствие теломеразы в раковых клетках, казалось бы, говорит о том, что она вредна, но тот факт, что длинные теломеры защищают от рака, в то же время говорит, что она полезна.
Более того: теломеразный ингибитор считается хорошим кандидатом для противораковой терапии, а использование теломеразного активатора помогает для профилактики рака. Иными словами, ингибированием теломеразы можно лечить рак, а активированием теломеразы – предотвращать его.
Как и то, и другое может быть верно одновременно?
Чтобы понять ценность теломеразы для раковых и нормальных клеток, нужно для начала кое-что знать о самом раке. Причина большинства видов рака – ненормальный ген или, зачастую, несколько генов, которые либо получены по наследству (что редко), либо являются результатом приобретенной мутации. Многие наследуемые гены не вызывают рак, но повышают вероятность его развития. Самый известный из этих генов – ненормальный BRCA1 и BRCA2; в зависимости от конкретного варианта гена вероятность рака груди у женщин достигает 80%. Этот конкретный набор генов участвует в ремонте ДНК, так что ненормальный ген BRCA повышает риск повреждения ДНК, потому что поврежденные участки больше не ремонтируются. У большинства видов рака мы видим похожий шаблон: все растущие проблемы с поддержкой нормальных генов и хромосом – это называется геномной нестабильностью. При раке, каким бы ни был источник ненормальности – унаследованным, приобретенным, и то и другое, – клеточным результатом обычно является геномная нестабильность, а клинический результат прост: рано или поздно клетка становится раковой.
С метафорической точки зрения раковые клетки можно считать социопатами, которые разгуливают по неблагополучным районам тканей. У нормальных клеток есть специфические локальные функции, и от ненормального деления их удерживают разные внутренние и внешние факторы. В нормальных тканях клетки получают химические сигналы, которые говорят им, когда делиться, а когда не делиться. Например, нормальные клетки в груди не делятся, если не требуется замена, а вот раковые клетки делятся вне зависимости от подобных сигналов. В нормальных, не раковых, клетках, у которых повреждена ДНК, есть внутренние сигналы, которые не дают им делиться, даже когда приходит внешний сигнал «делиться». Раковые клетки, с другой стороны, игнорируют все ингибирующие сигналы – и внешние, и внутренние, вне зависимости от того, повреждена ДНК или нет, – и делятся.
С раковыми клетками есть две проблемы: во-первых, они делятся, во-вторых, они не работают. Частое деление приводит к образованию массы ненужных клеток, и эти клетки не только оттягивают на себя метаболические ресурсы: сама по себе масса может быть смертельно опасной, как, например, при раке мозга, который сжимает мозг внутри черепа. Более того, из-за того, что раковые клетки не реагируют ни на внутренние, ни на внешние сигналы – именно поэтому они делятся, даже когда не должны, – страдают и другие клеточные функции. Раковые клетки, которые должны производить конкретный белок, например некоторые лейкоциты, начинают производить не тот белок, или нужный белок, но в избыточном количестве, или вообще перестают что-либо производить. Конечно, если так себя будет вести единственная поврежденная клетка, никаких проблем не будет – вокруг нее целый миллион нормальных. Причина, по которой раковые клетки так смертельно опасны, – они продолжают делиться, пока их не становится очень много. Короче говоря, с клинической точки зрения ключ к борьбе с раком – предотвращение несанкционированного деления клеток.
Один из способов победить рак – заставить раковые клетки умереть от старости. Эту функцию берут на себя теломеразные ингибиторы.
Во всех нормальных клетках вашего тела есть три основных защитных механизма от несанкционированного деления клеток из-за повреждений ДНК. Первый: клетка обнаруживает поврежденные участки ДНК и чинит их. Раковые клетки неспособны ремонтировать повреждения своей ДНК, так что первая линия обороны не срабатывает. Второй механизм: когда обнаруживается повреждение ДНК, нормальная клетка отключает клеточный цикл, чтобы не копировать поврежденную ДНК и не делиться. Даже если ДНК никогда не отремонтируется, клетка, по крайней мере, не станет делиться и создавать новые поврежденные, т. е. раковые клетки. Система остановки клеточного цикла невероятно эффективна. Но представьте, что произойдет, если повредится участок ДНК, отвечающий как раз за остановку клеточного цикла. В этом случае поврежденная клетка продолжает делиться, невзирая на риск для организма. Раковые клетки становятся все многочисленнее.
Укорочение теломер (и клеточное старение) – это третий механизм защиты от рака.
Теломеры работают двумя способами. Когда они укорачиваются, то деактивируют клетку с помощью эпигенетических изменений, а если не удается и это, то потеря теломер в конечном итоге гарантирует, что хромосомы станут нерабочими, потому что начнут терять не только теломеры, но и (в очень крайнем случае) даже гены. Клетки с укорачивающимися теломерами с большой вероятностью умирают из-за все усиливающихся эпигенетических изменений, но вот клетки без теломер вообще не могут выжить из-за потери генов. Чтобы выжить, раковые клетки должны поддерживать в себе теломеры, по крайней мере, минимально, и они это делают.
Большинству видов рака удается поддерживать в себе короткие, но едва-едва работающие теломеры; в результате им удается выживать и размножаться, но из-за коротких теломер они очень быстро мутируют. Раковые клетки мутируют постоянно; многие из них умирают, но вот те, которым удается выжить, все сильнее сопротивляются и ингибирующим сигналам, и другим ограничениям, накладываемым на рост нормальных клеток. По сути, после того, как одной клетке удается сбежать из-под ограничений и начать мутировать, ее дочерние клетки становятся все более и более злокачественными, потому что отбор проходит именно по этим характеристикам. Этот процесс продолжается, и раковые клетки учатся обходить иммунную защиту организма: быстрая скорость мутаций гарантирует выживание именно тем клеткам, которые умеют так делать.
Можно задать вполне логичный вопрос: как раку удается выжить, несмотря на все внутренние и внешние защитные механизмы и на то, что он постоянно мутирует, потому что мутации повреждают клетку? Ответ прост: большинство раковых клеток не выживает.
Большинство раковых клеток первых поколений прекращают делиться, реагируя либо на внешние, либо на внутренние ингибирующие сигналы. У тех клеток, которые переживают этот этап, теломеры укороченные, так что почти все они умирают от клеточного старения или прямого повреждения хромосом. Те, которым удается выжить, поддерживая минимальную длину теломер, часто умирают от иммунного ответа организма или – в случае с раковыми опухолями – потому, что не могут поддерживать кровоснабжение. Большинство раковых клеток не выживает, и именно поэтому большинство из нас не умирает от рака еще в детстве.
Проблема рака – в том, что не все раковые клетки гибнут в столкновении с нашими защитными системами. Тех очень немногих, которым удается преодолеть все перечисленные препятствия, обычно оказывается вполне достаточно, чтобы вызвать рак, от которого умирает столько людей.
Так какую же роль теломераза играет при заболевании раком?
Если теломеры достаточно длинны, клетки обладают геномной стабильностью: они могут эффективно предотвращать или чинить генетические повреждения и с большой вероятностью никогда не станут раковыми. Так что если клетка производит достаточно теломеразы, чтобы ее теломеры оставались длинными, то теломераза защищает от рака.
Но если теломеры короткие, то у клеток начинается геномная нестабильность; они не могут предотвратить генетические повреждения и мутации, и вероятность того, что они станут раковыми, высока. Проблема состоит в том, что многие раковые клетки производят ровно столько теломеразы, чтобы поддерживать у себя очень короткие теломеры (или находят какой-то альтернативный способ поддержки коротких теломер). Если проще, для пациентов в плане выживания было бы лучше всего, если бы наши нормальные клетки производили много теломеразы, чтобы защитить нас от рака, или если бы раковые клетки вообще не производили теломеразу и быстро умирали. Худший возможный сценарий – это когда раковые клетки производят ровно столько теломеразы, чтобы не только выжить, но и со временем становиться все хуже – а именно так большинство раковых клеток и работает.
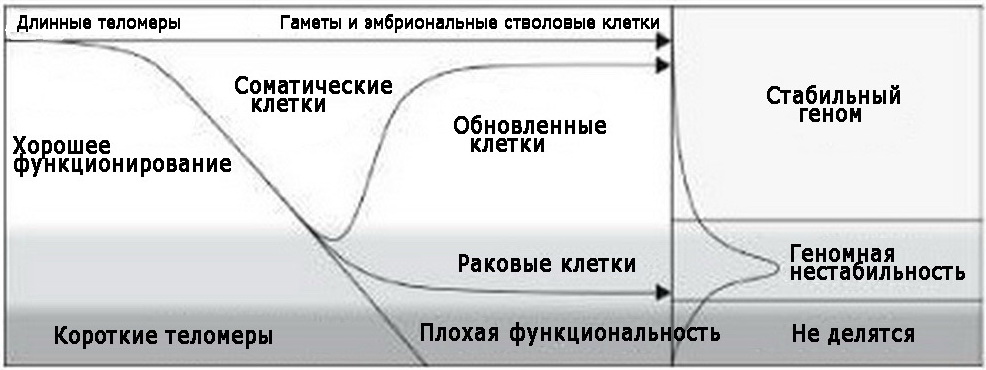
Длина теломер и рак.
Вот почему один из многообещающих способов лечения рака – использование теломеразных ингибиторов, чтобы заставить раковые клетки умереть от старости. При этом, конечно, будет неприятный побочный эффект – теломераза будет ингибироваться и в стволовых клетках, которые важны для нашего выживания в долгосрочной перспективе, но это, возможно, будет не очень высокой ценой за лечение рака. Польза – выживание здесь и сейчас, риск – хроническая недостаточность тканей и высокий риск развития различных возрастных заболеваний.
Учитывая все, что мы знаем о раке, будет ли полезна теломераза здоровым людям? В большинстве случаев теломераза будет невероятно полезной: она предотвратит или вылечит многие возрастные заболевания и значительно снизит риск возникновения рака. Но вот если у пациента уже есть рак, результат не так однозначен. Удлинение теломер у пациента, больного раком, может быть полезным: клетки снова получат возможность ремонтировать свою ДНК и восстанавливаться от раковых изменений. При таком развитии событий теломераза не только предотвратит, но и вылечит многие виды рака. С другой стороны, если теломеразная терапия сможет лишь поддерживать длину коротких теломер, а не удлинять их, то мы просто будем продлевать жизнь раковых клеток. Есть и еще одно соображение: восстановление длины теломер в клетке с наследственным дефектом в механизме ремонта ДНК только лишь даст этой клетке возможность делиться и передавать дефект и дальше; какой бы длины ни были ее теломеры, проблему это не решит.
Что действительно интересно, так это то, что у людей с возрастом вероятность развития рака растет, но точно так же вероятность растет у мышей и крыс, хотя они живут в 30 раз меньше нас. Получается, что раковые мутации – это не просто накопление повреждений, нанесенных космическими лучами, ультрафиолетовым излучением и спонтанными молекулярными изменениями (молекулы могут изомеризоваться при температуре тела), потому что все эти факторы с одинаковой скоростью воздействуют и на мышей, и на людей. В большей степени это следствие кумулятивного спада в ремонте ДНК, который вызывается укорочением теломер. Короче говоря, если мы сможем восстановить теломеры, то сможем уменьшить заболеваемость раком. С помощью ингибиторов теломеразы мы, возможно, сможем лечить некоторые виды рака, но, скорее всего, с помощью активаторов теломеразы мы сможем предотвратить – вообще в принципе – большинство видов рака. Теломераза, если она достаточно активна, скорее всего, сможет предотвратить или вылечить некоторые виды рака на ранней стадии (а не усугубить их), но вот людям с наследственными генетическими проблемами она не поможет.
В целом картина ясна: по большей части теломераза защищает от рака.
Итоги и выводы
В рассмотренных нами возрастных заболеваниях клинические проблемы старения вызываются клеточным старением. В клетках, которые делятся, укорачиваются теломеры, меняется паттерн экспрессии генов, и клетки становятся все менее эффективными, а потерянные клетки медленнее восстанавливаются. Когда старые клетки не работают и плохо восстанавливаются, стареющие ткани теряют свою функциональность, и развивается очевидное возрастное заболевание.Если мы сможем восстановить длину теломер в этих клетках, то сможем и восстановить паттерн экспрессии генов и сделать их молодыми с функциональной точки зрения. Как мы увидим, есть все причины считать, что теломеразу можно использовать для профилактики и лечения большинства возрастных заболеваний.

