Книга: Неалкогольная жировая болезнь печени
Назад: Глава 6 Патогенез НАЖБП
Дальше: Глава 8 Диагностика НАЖБП
Глава 7
НАЖБП как предиктор ССЗ
В общей медицинской практике НАЖБП и особенно НАСГ рассматриваются как мульсистемное заболевание, в связи с его ролью в атерогенезе и формировании кардио-метаболического континуума [29]. Действительно, в глобальном масштабе социально-значимым при НАСГ является увеличение риска развития сахарного диабета 2 типа, ССЗ, хронической болезни почек, а также рака печени и толстой кишки [30]. НАСГ в 6-10 раз увеличивает риск смерти от цирроза и рака печени и в 5 раз — риск смерти от ССЗ, вне зависимости от всех других предикторов кардиоваскулярной патологии [3, 7]. Marchesini G. et al. (2003) в относительно «ранней» работе показали, что у пациентов без диабета и с гистологически верифицированной формой НАЖБП метаболический синдром на 35 % чаще встречается при НАСГ, чем при простом стеатозе печени (рис. 29). Авторы показали, что тяжесть НАСГ вне зависимости от пола, возраста и степени ожирения тесно коррелирует со степенью фиброза печени (OR, 3.5; 95 % CI, 1.1-11.2; P =.032) и тяжестью MC, которую маркирует инсулинорезистентность (ИР) (OR, 3.2; 95 % CI, 1.2–8.9; P =.026) [31].
Механизм такого кардио-метаболического влияния заключается в том, что прямо или опосредованно НАСГ приводит к накоплению в организме проатерогенного, токсичного для клеточных мембран и вызывающего ускоренный апоптоз клеток свободного холестерина [32] (рис. 30).
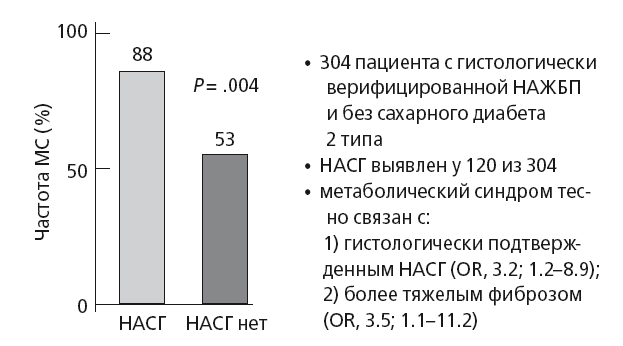
Рис. 29. Частота развития НАСГ при метаболическом синдроме (модифицировано по Marchesini G. étal. (2003) [31]
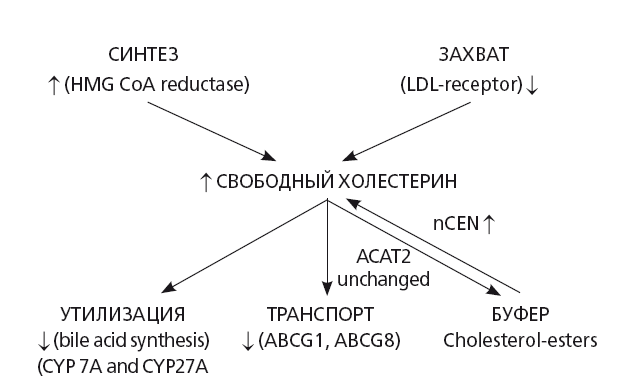
Рис. 30. Нарушения метаболизма холестерина при НАСГ (модифицировано по Min Н.К. et al., 2012) [32]
При ожирении первичное нарушение утилизации циркулирующего в организме холестерина развивается вследствие уменьшения экспрессии скавендер-рецепторов к ЛПНП на наружной цитоплазматической мембране гепатоцитов, что стимулирует синтез холестерина de novo, для чего и используются уже накопленные в организме и синтезируются дополнительные ТГ, жирные кислоты и ЛПОНП [33]. Таким образом, НАСГ является причиной формирования главного предиктора атерогенеза — высоко атерогенной дислипидемии: ↑ титров и размера ЛПОНП, хиломикронов, ↑ циркулирующих ЛПНП, ↑ титров циркулирующих ТГ и ЛПП, ↓ титров ЛПВП 2 типа (рис. 32). При этом, активность синтеза холестерина в гепатоците и титры ЛПНП при НАСГ выше, чем при стеатозе печени и коррелируют со степенью инсулинорезистентности/гиперинсулинемии и титрами АЛТ [32, 34].
Вследствие нарушения работоспособности клеточных мембран и прямого подавления синтеза желчных кислот (фБХК, ^LXR ядерных рецепторов) при НАСГ в гепатоците нарушаются основные пути утилизации избытков холестерина — синтез из холестерина желчных кислот и активный транспорт холестерина в желчь [35]. Оба процесса тесно связаны с метаболической активностью клеточных мембран гепатоцита: как мембран органелл, так и наружной мембраны — ее базолатеральной части, отвечающей за активный транспорт избытка холестерина в желчь, и синусоидальной, отвечающей за захват гепатоцитом холестерина-ЛПНП. Нарушение вязкости, текучести и метаболической активности клеточных мембран является универсальным патогенетическим механизмом, который на молекулярном уровне ложится в основу формирования тканевых и системных осложнений НАСГ: апоптозе гепатоцитов и активности воспаления в печени и организме в целом, дислипидемии, билиарной недостаточности, нарушения метаболического ресурса печени. Одна из причин дисфункции клеточных мембран гепатоцита — оксидативный стресс, вторая — избыток в гепатоците свободного холестерина.
Свободный холестерин легко проникает в клеточные мембраны и уменьшает относительное содержание эссенциальных фосфолипидов (ЭФЛ) — основных метаболически активных компонентов мембраны, обеспечивающих ее вязкость и текучесть. Имбибирование свободным холестерином особенно негативно влияет на метаболическую активность митохондрий, эндоплазматического ретикулума и аппарата Гольджи, в мембранах которых соотношение холестерин/ЭФЛ (в частности — фосфатидил-холин) не должно превышать 0,2 (рис. 31) [23].
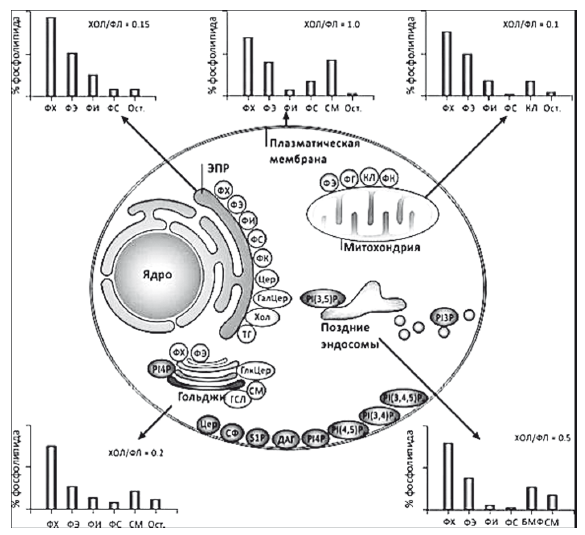
Рис. 31. Нормальное соотношение холестерин/ЭФЛ в различных клеточных мембранах гепатоцита [23]
Кроме того, существует гипотеза, что избыток свободного холестерина способен увеличивать образование в цитоплазматической мембране различных клеток дополнительных сигнальных зон — «липидных рафтов». Известно, что они участвуют в образовании сигнального пути иммуноглобулина Е, рецептора эпидермального фактора роста, Т и В-клеточных антигеновых рецепторов, инсулинового рецептора, а также сигнального пути с участием toll-like рецепторов, опосредующих секрецию ядерного фактора транскрипции Κβ и запуск апоптоза и хронического воспаления [36]. Таким образом, НАСГ приводит к кардинальному нарушению метаболизма холестерина и накоплению в печени его прекурсоров, а также формирует и второй важнейший предиктор атерогенеза — системное воспаление (рис. 32).
С клинической точки зрения, развитие НАСГ сопровождается мультисистемными проявлениями раннего атеросклероза и ССЗ [37,38]. В мета-анализе 27 перекрестных исследований вне зависимости от классических предикторов ССЗ и MC установлена связь между НАСГ и маркерами субклинического течения атеросклероза:
✓ ↑ толщины интима-медиа сонных артерий — 16 исследований;
✓ ↑ кальцификации коронарных артерий — 7 исследований:
✓ ↓ вазодилатации, обусловленной током крови (эндотелиальная дисфункция) — 7 исследований;
✓ ↓ эластичности артерий — 6 исследований [39].
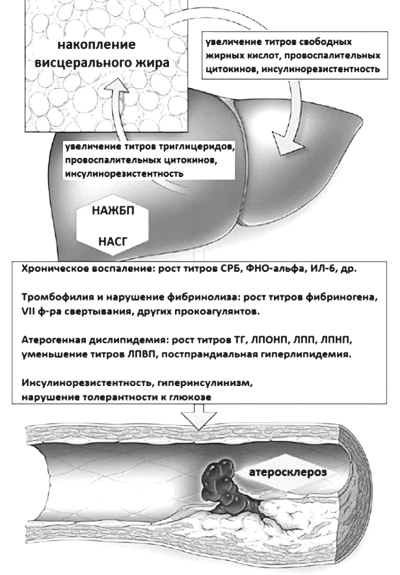
Рис. 32. Проатерогенные эффекты НАЖБП (модифицировано по Targher G. et al. (2010) [37]
У пациентов с НАСГ вследствие нарушения обмена высоко энергических фосфатов и инсулинорезистентности увеличивается толщина эпикардиального жира и развиваются ранние изменения субстратного метаболизма миокарда, приводящие к диастолической дисфункции сердца, ранней гипертрофии миокарда левого желудочка, жировой дистрофии и очаговому фиброзу миокарда с ф риска застойной сердечной недостаточности [1, 40]. При верифицированных ССЗ у пацинентов с НАСГ раньше образуются атеросклеротические бляшки в коронарах и каротидах, увеличивается прокоагулянтная активность плазмы, чаще развивается безболевая ишемия миокарда, фибрилляция предсердий и желудочковые нарушения ритма сердца [37, 38, 41–43]. В течение 10 лет у пациентов с НАСГ и СД 2 типа риск фибрилляции предсердий был в 5 раз выше, чем у пациентов без НАЖБП вне зависимости от наличия MC и других факторов риска ССЗ [44]. В российском эпидемиологичеком исследовании у 76 % амбулаторных пациентов с НАЖБП имела место атерогенная дислипидемия, у 70 % — артериальная гипертензия [5,6].
В клинических исследованиях накапливаются доказательства прямой связи НАСГ и раннего развития хронической болезни почек, базирующейся на нарушении секреции адипонектина и фетуина-А: белка-промотера инсулинорезистентности (рис. 33). Увеличение секреции фету-ина А и снижение секреции адипонектина приводят к потере чувства насыщения и дальнейшему набору веса с увеличением и НАЖБП, стеатозу, метаболической гломерулопатии и хронической болезни почек и тесно коррелируют с выраженностью эндотелиальной дисфункции и субклинических проявлений атеросклероза [45]. При гистологически верифицированной НАЖБП (мета-анализ 20 перекрестных и 13 долгосрочных исследований, п = 63 902) хроническая болезнь почек встречается почти в 2 раза чаще (OR 1.79,95 % ДИ 1.65-1.95). НАСГ связан с еще более высокой частотой хронической болезни почек (OR 2.12, 95 % ДИ 1.42-3.17), чем простой стеатоз [46].
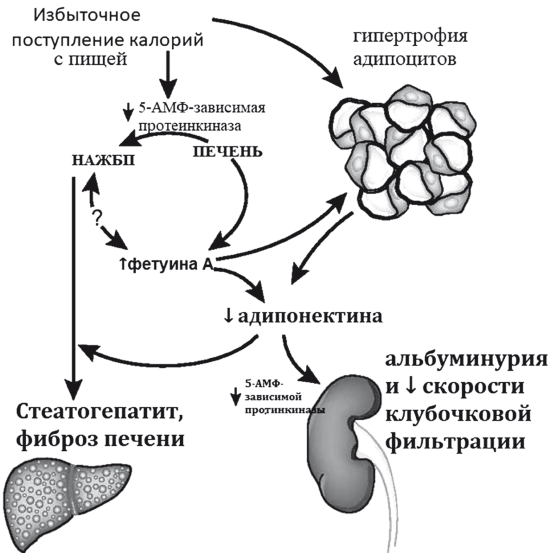
Рис. 33. Взаимосвязь ожирения, хронической болезни почек и НАСГ (модифицировано по IxJ.H. et al.) [45]
Суммируя результаты многочисленных научных и клинических исследований, можно заключить, что НАЖБП и особенно НАСГ — это прогрессирующее проатерогенное заболевание, задействующее ранние доклинические механизмы развития ССЗ (рис. 34).
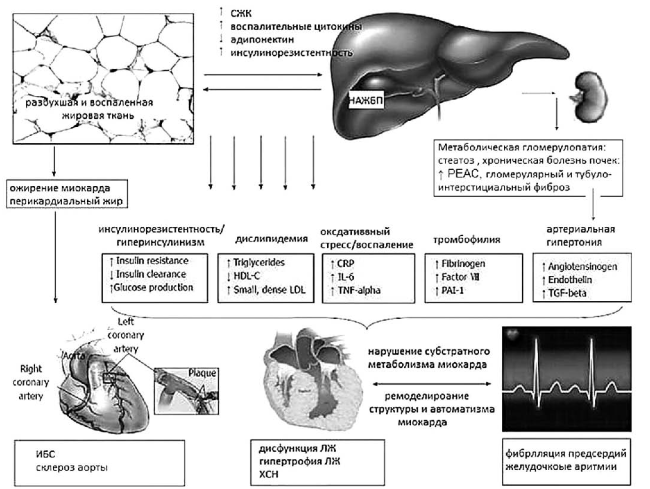
Рис. 34. Мультисистемные влияния НАЖБП как компонента МС(модифицировано по Lonardo A., Targher G., 2016) [44]
Назад: Глава 6 Патогенез НАЖБП
Дальше: Глава 8 Диагностика НАЖБП

