Книга: Неалкогольная жировая болезнь печени
Назад: Глава 4 Печень и обмен холестерина
Дальше: Глава 6 Патогенез НАЖБП
Глава 5
Нарушение обмена липидов при ожирении
Принципиальное значение уменьшения количества и нарушения функционального состояния ЛПНП-рецепторов гепатоцитов для развития атерогенной дислипидемии доказано Brown M.S., Goldstein J.L., которые за исследования в области регуляции метаболизма холестерина в 1985 году получили Нобелевскую премию (рис. 20). Захват циркулирующих в плазме ЛПНП и ЛППП генетически детерминирован и становится «слабым» звеном в механизме мобилизации излишков холестерина из плазмы. При хронической перегрузке рациона жирами и холестерином, а также в случаях генетических дефектов рецепторы к ЛПНП на синусоидальной мембране гепатоцита блокируются, и их количество уменьшается по механизму обратной связи. Афинность рецепторов к ЛПНП также уменьшается при длительной активации симпатической нервной системы и старении — оба состояния, как уже говорилось, всегда сопровождаются повышеннием потребности в холестерине и его производных.
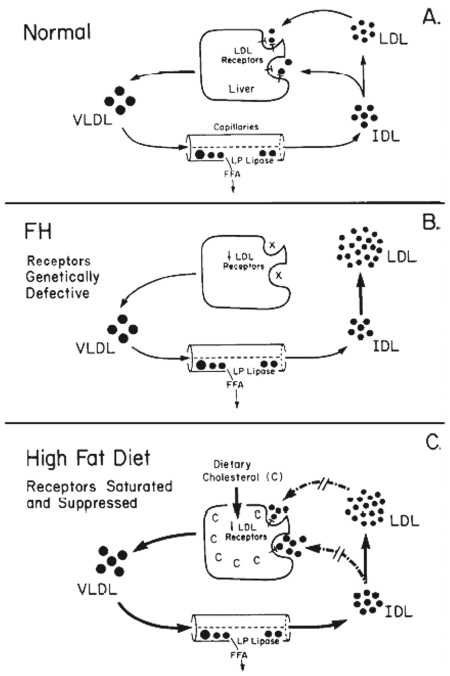
Рис. 20. Механизм контроля продукции и утилизации ЛПНП и ЛППП из плазмы при помощи печеночных ЛПНП-рецепторов (по Brown M.S., Goldstein J.L., Nobel lecture, 9 December, 1985)
Гепатоцит теряет способность к захвату ЛПНП, и поступление в него «готового» холестерина резко снижается. В этих условиях гепатоцит начинает накапливать ТГ и СЖК для синтеза нового холестерина и обеспечения потребностей организма в гормонах и других его производных — развивается жировая инфильтрация печени и одновременно перегрузка систем утилизации дополнительно синтезированного холестерина. При этом уже накопленный в составе ЛПНП холестерин остается во внепеченочном и внетканевом компартменте и начинает избыточно накапливаться в клеточных мембранах, соединительной ткани, эндотелии артерий.
Установлено, что при ожирении, особенно в пожилом возрасте, желчь всегда пересыщена холестерином: увеличение массы жира на 1 кг приводит к приросту суточной экскреции холестерина приблизительно на 20 мг. Полагают также, что увеличению литогенности желчи способствуют и два дополнительных фактора:
1) недостаточная секреция ФХ, вследствие чего образуются дефектные перенасыщенные холестерином везикулы, из которых легко образуются кристаллы холестерина;
2) нарушение синтеза первичных желчных кислот из холестерина и изменение пропорции первичных/вторичных желчных кислот в сторону увеличения пула дезоксихолевой кислоты.
Как известно, в действительности факторов, способных увеличить литогенность желчи, значительно больше. Но, так или иначе, в Европе частота ЖКБ у больных с ССЗ в 1,5 раза превышает частоту ЖКБ в нестратифицированной популяции (26). Предполагают, что у пациентов с инсулинорезистентностью и СД 2 типа эндокринная функция желчных кислот может быть нарушена изначально. Тонкие механизмы этих нарушений пока не установлены. Очевидно одно: у пациентов с СД 2 типа и MC частота встречаемости существенно выше, чем у больных с простым экзогенно-конституциональным ожирением. Так, в США среди больных с ожирением частота ЖКБ составляет 20 %, а в Мексике — 60 % [36]. Действительно, в странах с эпидемическим ростом заболеваемости СД 2 типа и ЖКБ присутствуют не только общие социально-экономические предикторы атерогенеза, но и близкие особенности экологической обстановки и структуры питания, способствующие НАЖБП и холелитиазу. Так, в десятку мировых лидеров не только по абсолютному числу жителей, страдающих СД 2 типа, но и по ежегодному приросту больных ЖКБ, за исключением постиндустриальных, но обладающих существенной неоднородностью населения США, Японии и Италии, входят преимущественно страны с развивающейся экономикой: Индия, Китай, Индонезия, Пакистан, Россия, Бразилия, Бангладеш (ВОЗ, 2006). Общие для этих стран:
1) «средний» уровень доходов населения;
2) недавно начавшийся процесс активной урбанизации и необходимость для еще недавно сельского населения в течение жизни 1–2 поколений адаптироваться к высокой стрессовости жизни в мегаполисе;
3) урбанистический литогенный и атерогенный рационы питания приводят к срыву генетически детерминированных механизмов активной экскреции холестерина и поддержания его растворимости в желчи [36].
Универсальными признаками «литогенного» рациона современных горожан можно считать нарастающие в течение последних 2000 лет диспропорции в рационе:
✓ обилие продуктов с высоким содержанием рафинированных углеводов, насыщенных и жареных транс-жиров;
✓ дефицит продуктов, содержащих ПНЖК и антиоксиданты;
✓ недостаточное количество природных холеретиков и балластной (неперевариваемой) растительной клетчатки (рис. 21).
Среди факторов городской жизни существует еще один триггер НАЖБП — экологическое загрязнение, прежде всего органическими соединениями тяжелых металлов и диоксинами (ВОЗ, 2006). Например, в таком мегаполисе, как Москва, по данным Мосэкомониторинга, 100 % жителей живут в условиях «высокого и очень высокого» загрязнения воздуха: в 1 кубометре содержится 6–7 мг диоксида азота, диоксида серы, формальдегида и органических соединений хлора, ртути и свинца, мышьяка и т. д. (Авалиани С., Ревич Б., 2009).
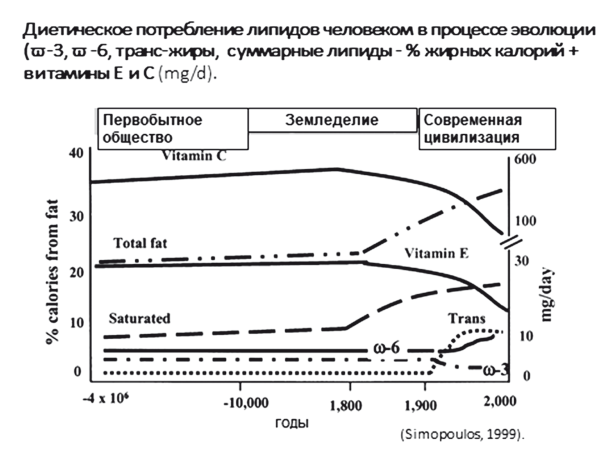
Рис. 21. Динамика структуры жиров в рационе человека в течение 10 тысяч лет (модифицировано по Simopoulos А.Р., 2000) [74]
Попадая внутрь организма с воздухом и водой, диоксины или органические соединения свинца из автовыхлопа включаются в энтерогепатическую циркуляцию и накапливаются в наружных клеточных мембранах и органеллах клеток, разрушая их ПНЖК и нарушая функциональное состояние мембран. В печени органические соли свинца нарушают синтез гема и снижают активность микросомальных оксидаз-ферментов I фазы метаболизма ксенобиотиков: С-редуктазы и CYP450, в частности, СУР 1А2 и ЗА4, находящихся в эндоплазматическом ретикулуме гепатоцитов и ответственных за окисление субстратов из окружающей среды, а также СУР2А6, 2С19, 2D6, 2Е6, 2D6, участвующих в окислении около 30 лекарств. Посредством блокады митохондриальной феррохелатазы свинец вызывает митохондриальную цитопатию и снижение уровня метаболической активности гепатоцита по всем направлениям [36].
Органические соли свинца также прямо нарушают детоксикацию желчных кислот и продуктов перекисного окисления липидов, поскольку они истощают гепатоцит по содержанию глутатионпероксидазы и сульфотрансферазы — ферментов II фазы метаболизма ксенобиотиков. Однако важнейшим механизмом, реализующим особую роль соединений свинца в развитии НАЖБП и ЖКБ, служит его универсальная способность избирательно накапливать в печени холестерин и липиды, вызывая, таким образом, формирование НАСГ и билиарной недостаточности (рис. 22).
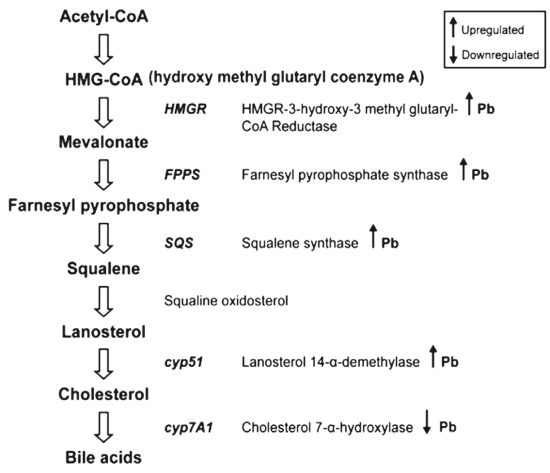
Рис. 22. Влияние свинца на синтез холестерина в печени (модифицировано по A Mudipalli, 2007)
Последствия хронической экологической интоксикации особенно опасны для пациентов групп риска:
✓ злоупотребляющих алкоголем;
✓ людей, работающих во вредных условиях;
✓ больных с MC и СД 2 типа;
✓ длительно принимающих гепатотоксичную лекарственную терапию (туберкулостатики, НПВП, фибраты, кетоконазол, пероральные контрацептивы);
✓ беременных женщин.
Таким образом, в печени сосредоточены метаболические и эндокринные механизмы, тонко регулирующие содержание ТГ, СЖК и холестерина в соответствии с:
1) потребностями в энергии (температурой окружающей среды, физической нагрузкой, активностью щитовидной железы);
2) потребностью в синтезе биологически активных веществ.
Так, большая, но ограниченная во времени физическая или другая стрессорная нагрузка приводит к активации липолиза в жировой ткани и росту концентрации СЖК, увеличению синтеза холестерина и его производных — прогестерона, минерало- и глюкокортикоидных гормонов, половых стероидов, а также фосфолипидов и желчных кислот, увеличению содержания в крови ЛПОНП, ЛПНП и ЛПВП. По окончании нагрузки избыточные липиды утилизируются или выводятся из организма. Нормальный физиологический процесс утилизации липидов и холестерина в плазме крови нарушается и приводит к стойкой гиперлипидемии, только если:
1) вследствие хронического стресса или возрастной инволюции активация симпатической нервной системы и потребность в увеличении содержания холестерина становится постоянной:
2) нарушается механизм выведения избытков холестерина.
У пациентов с МС, НАЖБП и СД 2 типа развивается специфический вариант высоко атерогенной дислипидемии, который образно назвают «липидный квартет»: ↑ титров ТГ, ЛПОНП, ЛППП и ЛПНП, ↓ титров ЛПВП — фенотип II b (рис. 23).
У пациентов с MC, НАЖБП и СД 2 типа развивается специфический вариант высоко атерогенной дислипидемии, который образно называют «липидный квартет»: ф титров ТГ, ЛПОНП, ЛППП и ЛПНП, ф титров ЛПВП — фенотип II b (рис. 23).
Ранее считалось, что высокие титры ЛПОНП и ЛППП не являются высоко атерогенными, поскольку эти липопротеиды содержат холестерин, который не может быть прямо мобилизован в сыворотку крови, не доступен для тканей и, следовательно, не может инфильтрировать интиму артерий или клеточные стенки. Согласно современным представлениям, роль ТГ, ЛПОНП в атерогенезе является важнейшей: из ЛПОНП образуются ЛППП, которые:
1) служат основным субстратом для образования высокоатерогенных ЛПНП;
2) будучи мелкими и жесткими частицами, способны инициировать локусы повреждения эндотелия артерий, в которых позднее образуются атеросклеротические бляшки.
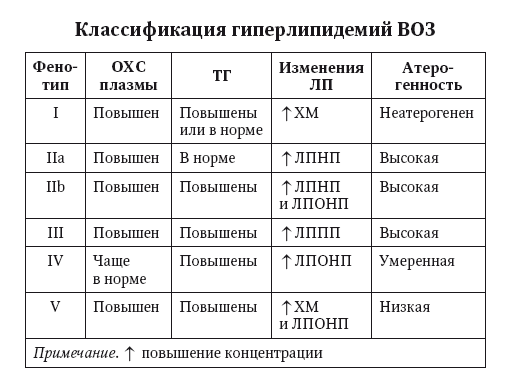
Рис. 23. Классификация гиперлипидемий (ВОЗ, 2009)
Терапия статинами, ингибирующими конечный этап синтеза холестерина, остается единственным эффективным методом снижения уровня ЛПНП и является «золотым стандартом» лечения атерогенной дислипидемии. Во множестве рандомизированных исследований показана высокая эффективность статинов в отношении уменьшения концентраций ЛПНП и снижения частоты коронарных событий и внезапной коронарной смерти (на 25–40 %). Терапия статинами показана всем больным с высоким фатальным риском по шкале SCORE уровнями ЛПНП > 2,5 ммоль/л для риска > 5 %, уровнем ЛПНП > 3,0 для риска < 5 %. Однако терапия статинами практически не влияет на уровень ЛПОНП и триглицеридов и, кроме того, в 5-10 % случаев сопровождается развитием диспепсии и преходящими нарушениями печеночных проб, а в 0,5 % случаев — миопатией и развитием рабдомиолиза, риск которых увеличивается при назначении в комбинациях с фибратами и ниацином. У пациентов с НАЖБП, получающих статины, также повышен риск неблагоприятного лекарственного взаимодействия при одновременном лечении амиодароном, клопидогрелем, глюкокортикоидами и другими широко применяемыми лекарственными средствами.
Блокаторы всасывания холестерина. Относительно недавно в медицинской практике появились препараты, уменьшающие реабсорцию холестерина из тонкой кишки, в частности — эзетимиб. Препарат блокирует белок-транспортер, переносящий холестерин с поверхности слизистой оболочки тонкой кишки в энтероциты. В рандомизированных исследованиях было показано, что назначение эзетимиба одновременно со статинами (розувастатином) является более эффективным в отношении снижения риска коронарной смерти и смерти от всех причин, чем монотерапия статинами. Кроме того, назначение эзетимиба в комбинации позволяет уменьшить дозы статинов, что улучшает общий профиль безопасности лечения гиперхолестринемии. Препарат также обладает низким потенциалом неблагоприятного лекарственного взаимодействия с фибратами, дигоксином, варфарином и оральными контрацептивами. Исследования, в которых изучается влияние эзетимиба на общую смертность и канцерогенез еще проводятся. На сегодняшний день единственным существенным препятствием к длительной терапии эзетимибом является стоимость лечения.
Однако у пациентов с MC и НАЖБП существует проблема низкой эффективности или иногда рефрактерное™ к лекарственной монотерапии статинами. Трудности лечения этого «липидного квартета» обусловлены тем, что традциционная терапия статинами не позволяет успешно контролировать все компоненты дислипидемии — титры ТГ и ЛПОНП — и это нивелирует гиполипидемический эффект в целом. В течение последних десятилетий для коррекции гипертриглицеридемии применяют несколько классов препаратов.
Фибраты (клофибрат, безафибрат, гемифиброзил, ципрофибрат, фенофибрат) являются агонистами PPAR — ядерных рецепторов-пролифераторов пироксисом: органелл гепатоцитов и адипоцитов, в которых происходит окисление жирных кислот. Фибраты стимулируют резервный путь липолиза посредством активации липопротеинлипаз печени и крови и ингибирования синтеза жирных кислот в печени и жировой ткани. Этот путь окисления в норме является «запасным» и включается при диете, богатой жирами. Согласно результатам крупных рандомизированных исследований Helsinki Heart Study (HHS) и VA-HIT study (Veterans Affairs High-density lipoprotein cholesterol Intervention Trial) длительная терапия фибратами, в частности гемифиброзилом, приводит к значимому уменьшению частоты коронарных событий. Через 18 лет после лечения гемифиброзилом риск смерти от ИБС у пациентов HHS был на 23 % ниже, чем в контрольной группе. В исследовании VA-HIT, включавшем около 30 % больных с сахарным диабетом, трехлетняя терапия гемифиброзилом при вторичной профилактике привела к уменьшению частоты коронарных осложнений на 22 % и снижению уровня триглицеридов на 31 %. В этом исследовании снижение риска коронарной смерти (на 71 %) и смерти от всех причин (на 33 %) было наиболее впечатляющим именно у больных с выраженным ожирением и гипертриглицеридемией. Другие фибраты в исследованиях BIP (Bezafibrate Infarction Prevention) и FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) также продемонстрировали способность на 30–50 % снижать уровень ТГ плазмы и на 10 % — уровень ЛПНП, на 10–20 % увеличивая содержание ЛПВП, демонстрируя наибольшую эффективность именно у пациентов с метаболическим синдромом и сахарным диабетом. Однако на фоне лечения фибратами у больных развиваются нежелательные побочные эффекты лечения: у 10–15 % больных развиваются боли в животе, метеоризм, диарея, кожный зуд и сыпь, нарушение печеночных проб. У людей, принимающих клофибрат, в два раза чаще развивается желчнокаменная болезнь. Помимо образования желчных камней, другим существенным следствием побочного действия клофибрата является развитие миозита, риск которого резко возрастает при одновременном лечении статинами. Клофибрат усиливает эффект непрямых антикоагулянтов и у больных диабетом, получающих сульфанилированные производные мочевины, может стать причиной гипогликемии.
Никотиновая кислота (ниацин) проявляет гиполипидемическое действие при приеме более 3 г в сутки. Как и фибраты, ниацин уменьшает содержание ЛПОНП, ТГ и холестерина. Механизм действия ниацина связан с блокированием катаболизма ароА-1 и блокадой в печени ключевого фермента синтеза триглицеридов — DGAT2, что приводит к уменьшению образования ЛПОНП. Ниацин также уменьшает липолиз в жировой ткани. Терапия ниацином в дозе 3–5 г в сутки обеспечивает снижение ЛПНП на 10–20 %, триглицеридов — на 20–40 %, а повышение ЛПВП на 15–30 %. Эффективность ниацина в отношении снижения ЛПОНП, ТГ и повышения ЛПВП была показана еще в стартовавшем в 1966 году масштабном исследовании CDP (Coronary Drug Project). У больных, получавших ниацин для вторичной профилактики ИБС через 6 и через 15 лет, частота коронарных событий и коронарной смерти оставалась на 11 % ниже, чем в контрольной трупе. Ниацин применялся бы значительно шире, если бы не побочные эффекты: резкое расширение сосудов кожи лица и верхней части тела с чувством жара, которое приводит к низкой комплаентности больных и которое нельзя полностью устранить приемом лекарственных форм с медленным рассасыванием. Кроме того, длительная терапия большими дозами ниацина не может быть рекомендована пациентам с НАЖБП, поскольку у 10–15 % больных приводит к декомпенсации СД 2 типа, подагры и нарушению печеночноклеточной функции.
Секвестранты желчных кислот. Как уже говорилось, уменьшение реабсорбции желчных кислот приводит к такому же изменению содержания ЛПНП, которого можно добиться назначением статинов. Впервые это было установлено у больных с синдромом мальабсорбции и нарушением функции тонкой кишки после операций, выключающих из пищеварения повздошную кишку. В 80-х годах в клиническую практику был выпущен первый представитель нового класса препаратов — секвестрантов желчных кислот — холестирамин. Эти препараты (как и колестипол и колесевелам) способны на 40 % уменьшать всасывание желчных кислот и на 15–26 % снижать уровень ЛПНП. Широкое применение этих препаратов, к сожалению, ограничено рядом нежелательных побочных эффектов, среди которых лидируют тяжелые запоры, развитие дефицита жирорастворимых витаминов, приводящее к остепорозу и сухости кожи. Побочные эффекты приводят к низкой комплаентности больных, но также важно другое: секвестранты не уменьшают, а увеличивают гипертриглицеридемию при жировой болезни печени. Кишечно-печеночную циркуляцию можно резко ограничить и хирургическим способом — путем выключения из пищеварения подвздошной кишки — места преимущественной реабсорбции желчных кислот. В современной практике, этот метод вытесняет применение секвестрантов желчных кислот и становится все более популярным у пациентов с НАЖБП и морбидным ожирением, прибегающим к барометрической хирургии для уменьшения веса. Однако, как и терапия секвестрантами, выключение повздошной кишки приводит к 18–28 % приросту содержания триглицеридов и ЛПОНП в печени и плазме.
Основные желчные кислоты. Расшифровка механизма регуляции синтеза желчных кислот позволила установить, что наиболее выраженная коррекция триглицеридемии происходит в результате стимуляции FXRa, что априори несет риск ЖКБ, который теоретически может быть уменьшен дополнительным введением желчных кислот per os. Было показано, что стимуляция FXRa желчными кислотами, как и терапия фибратами, одновременно включает несколько механизмов утилизации триглицеридов:
1) увеличение количества PPAR — ядерных рецепторов-пролифераторов пероксисом;
2) увеличение количества тканевых рецепторов к ЛПОНП;
3) рост активности липопротеидлипазы плазмы.
Действительно, во всех исследованиях терапия большими дозами холевой и хенохолевой желчными кислотами (сильные неселективные агонисты FXR) оказалась эффективной в отношении уменьшения ТГ в плазме, но сопровождалась гепатотоксичностью, развитием кожного зуда и вследствие небезопасности была запрещена к применению в клинической практике. УДКХ — слабый агонист FXR — оказалась единственной желчной кислотой, применение которой оказалось эффективным и безопасным, правда УДК назначали не для коррекции дислипидемии, а для лечения холестаза и желчных камней. Было установлено, что УДК увеличивает растворимость холестерина в желчи посредством образования в желчи слоистой жидкокристаллической фазы. Считается, что при хорошей сократительной функции желчного пузыря и желчных камнях диаметром до 15 мм лечение УДК в течение двух лет в дозе 10–13 мг/кг/сут позволяет добиться растворения камней у 50–60 % больных. Кроме того, позднее выяснилось, что УДК при длительном лечении способна подавлять активность ГМГ-КоА-редуктазы, что приводит к уменьшению синтеза холестерина. Впрочем, к существенной коррекции атерогенной дислипидемии УДК не приводит, поскольку полноценно участвует в энтерогепатической циркуляции желчи и не способна стимулировать синтез новых желчных кислот или необратимо связывать холестерин как литохолевая кислота.
Надежду на фармакологическую коррекцию «липидного квартета» в настоящее время связывают с селективной стимуляцией FXR, которая сможет привести к коррекции триглицеридемии без подавления синтеза первичных желчных кислот. Помимо включения указанных выше механизмов утилизации триглицеридов, селективная стимуляция FXR также приводит к активации липолиза и межуточного жирового обмена посредством стимуляции тиреоидных гормонов. Селективные стимуляторы FXR активно разрабатываются, и некоторые из них (AGN-34, guggulsterone) уже находятся в 3 фазе клинических исследований. Многообещающие перспективы по коррекции «липидного квартета» открывает и появление нового класса препаратов — конъюгатов жирных и желчных кислот (fatty acid bile acid conjugate — FAB AC). Одним из первых FABAC, предложенным для увеличения солюбилизации холестерина в желчи и растворения желчных желчных камней, стал арамхол (aramchol). В эксперименте на инбредных мышах, получающих обогащенную жирами литогеную диету, назначение aramchol в дозе 25 мг/кг/сут (примерно соответствует средним терапевтическим дозам УДК 14 мг/кг/ сут) в течение двух месяцев привело к растворению желчных камней у всех экспериментальных животных. Терапия не приводила к изменению липидного спектра желчи, а увеличение солюбилизации холестерина желчи происходило за счет увеличения содержания в желчи желчных кислот. Растворение желчных камней при назначении aramchol происходило быстрее, чем на фоне терапии УДК, и не обладало токсичностью. В эксперименте у животных, получающих литогенную диету, aramchol также оказался эффективен в отношении предотвращения НАЖБП. В эксперименте было установлено, что на фоне атерогеной диеты aramchol обладает плейотропным действием на обмен липидов и холестерина и вызывает:
✓ увеличение вывода холестерина из фибробластов путем стимуляции транспортеров системы АСВ, но не anoAl;
✓ увеличение активности СУР7А1 и стимуляцию синтеза желчных кислот;
✓ снижение активности ГМК-КоА-редуктазы и уменьшение синтеза холестерина.
Механизмы влияния FABAC на печеночный метаболизм триглицеридов и холестерина требуют дальнейшего изучения, однако важно, что aramchol, который содержит искусственную, не абсорбируемую желчную кислоту, не подавляет FXRa и синтез желчных кислот из холестерина, а стимулирует его. Таким образом, в отличие от секвестрантов, FABAC не приводят к увеличению содержания в печени триглицеридов, а также имеют ресурс по уменьшению реабсорбции из кишечника холестерина, связанного с желчными кислотами. Вероятно, близким механизмом действия обладают и природные негомологичные для человека вторичные и третичные желчные кислоты (из медвежьей, барсучьей, бычьей желчи), исторически применяемые для растворения желчных камней народной медициной. Например, в сравнении с человеческой бычья желчь, как и желчь всех травоядных, содержит больше вторичных и третичных желчных кислот, в частности: стерохолевую и дегидрохолевую кислоты. Эти желчные кислоты не обладают токсичностью, поскольку при приеме внутрь практически не реабсорбирутся сами и уменьшают реабсорбцию связанного с ними холестерина. Как и FABAC, препараты, содержащие бычью желчь, также активизируют синтез желчных кислот из холестерина, то есть одновременно стимулируют важнейшие из путей выведения избыточного холестерина, притом что не приводят к накоплению в печени триглицеридов и ЛПОНП. В отечественной фармакопее лиофилизированная бычья желчь входит в состав препаратов лиобил и аллохол, а в комбинации с ферментами поджелудочной железы — в препарат фестал. Фестал — единственный современный препарат панкреатина, стандартизованный по количеству липазы (6000 ME) и содержащий лиофилизированную бычью, а не свиную желчь, которая оказывает антихолестериновое и холеретическое действие при атеросклерозе и ЖКБ. Фестал усиливает секреторную функцию гепатоцитов и холангиоцитов, увеличивает количество печеночной желчи в постпрандиальный период и, таким образом, корректирует билиарную недостаточность и диспепсию, ассоциированную с нарушением гидролиза липидов. Поскольку желчные кислоты обладают физиологическим расслабляющим влиянием на сфинктер Одди, при лечении фесталом холеретическое действие сочетается со спазмолитическим, а следовательно, его могут принимать пациенты с дисфункцией желчевыводящих путей.
При выборе режима гиполипидемической терапии у пациентов с MC и НАЖБП необходимо помнить, что в условиях инсулинорезистентности/гипергликемии существует прямая зависимость между синтезом условно неатерогенных ТГ, ЛПОНП и высоко атерогенных ЛППП и ЛПНП, а следовательно, эффективность гиполипидемической терапии будет напрямую зависеть от контроля гипергликемии, а также от включения всех механизмов активизации метаболизма ТГ: увеличения титров ЛПВП, окисления ТГ и СЖК в тканях, активации энтерогепатической циркуляции желчных кислот, снижения реабсорбции ТГ и холестерина из тонкой кишки.
Назад: Глава 4 Печень и обмен холестерина
Дальше: Глава 6 Патогенез НАЖБП

