Глава 9
Лечение НАЖБП
Лечение НАЖБП, как и ее ранняя диагностика, является прерогативой врача общей практики, поскольку нацелено на модификацию образа жизни и преимущественно нелекарственные методы воздействия. Согласно международному консенсусу «…в настоящее время лекарственной терапии НАЖБП/НАСГ, эффективность которой подтверждена в РКИ, не существует».
Ключом к лечению НАЖБП/НАСГ являются ранее выявление болезни и модификация нездорового образа жизни пациентов (уровень доказательности А1):
✓ снижение веса само по себе или в сочетании с увеличением физической активности уменьшает жировую инфильтрацию печени при НАЖБП (уровень доказательности А1);
✓ коррекция диеты предполагает уменьшение калорийности рациона, исключение жареного и продуктов с фруктозой (уровень доказательности В1);
✓ состав макро нутриентов рациона должен соответствовать Средиземноморской диете (уровень доказательности В1) [47, 51].
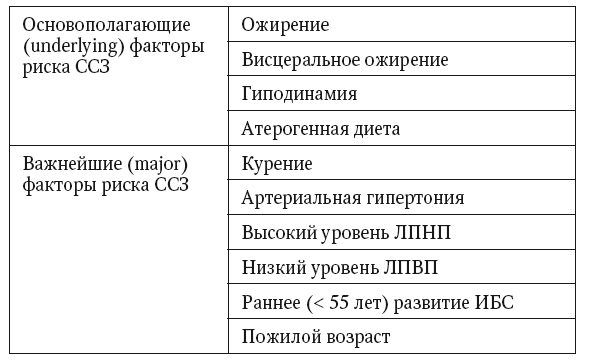
Даже при беглом взгляде становится понятно, что указанная стратегия у пациентов с НАЖБП направлена на те же факторы образа жизни, которые указаны для таргетного воздействия в международных программах по профилактике ССЗ (табл. 3).
Таблица 3
Факторы риска ССЗ (ATP III, 2004)

Выполнение указанных выше рекомендаций кажется простым и очевидным, однако на практике встречает значительные трудности. Прежде всего, вследствие отсутствия конкретных знаний и единой стратегии нутрицевтической терапии, и, во-вторых, в связи с низкой комплаентностью больных в отношении изменения пищевого поведения. Между тем, у пациентов с НАЖБП выялены специфические паттерны пищевого поведения, которые на фоне «западного городского образа жизни и питания» неуклонно ведут к набору веса и требуют направленной коррекции в любом возрасте (табл. 4) [52–54].
Согласно современным научным данным, основная цель коррекции пищевого поведения при НАЖБП — снижение массы тела на 5-10 % до (ИМТ<25 kg/m2). Для достижения целевого уровня ИМТ калорийность рациона пациентов с НАЖБП не должна превышать калорийности рациона 1700–2000 ккал/сутки [55]. Рацион пациента с НАЖБП должен содержать не более 40–45 % углеводных калорий от суточной калорийности и не включать легко усваиваемых простых углеводов (продуктов с высоким гликемическим индексом) — прежде всего, содержащих глюкозу и фруктозу [56, 57].
Таблица 4
Нарушения пищевого поведения у пациентов с НАЖБП модифицировано по Yasutake К., et al., [52]

Рацион должен содержать сложные углеводы и не менее 50 г/сут растительной клетчатки (по сухому веществу) [56–58]. Позитивное действие непереваривамои растительной клетчатки включает множество аспектов, важнейшие из которых для НАЖБП:
1) стимуляция гастроинтестинального транзита химуса и вследствие этого — замедление липолиза алиментарного жира и уменьшение всасывания ЖК, холестерина и углеводов;
2) желчегонное дейстивие и активация энтерогепатической циркуляции желчных кислот (оборот желчных кислот между печенью и кишечником до 30 раз в сутки) [59, 60].
Установлено, что активная циркуляция эндогенных основных желчных кислот (дезоксихолевой и хенохолевой) вызывает физиологическую блокаду ядерных FXR-рецепторов в гепатоците, аналогично той, что наступает в постпрандиальном периоде и маркирует поступление в печень большого количества алиментарных жиров. Этот базовый эндокринный механизм активирует основной обмен, липолиз и окисление ЖК, препятствует накоплению в печени ТГ, уменьшает инсулинорезистентность [61].
Однако важнейшей целью нутрицевтической коррекции является коррекция жирового рациона, не только как его наиболее калорийной части, но и как прямого стимулятора эктопического отложения жира и причины провоспалительной деформации внутренней среды организма. Согласно международному консенсусу, доля «жирных калорий» в рационе для лечения НАЖБП не должна превышать 30–35 % от суммарной калорийности, а доля калорий, полученных из насыщенных жиров, должна быть менее 7 % от общей калорийности рациона. Поступление холестерина с пищей не должно превыщать 200 mg/dL при обязательном исключении употребления транс-жиров. Основным источником жирных калорий должны быть 8-10 г/сутки жиров с полиненасыщенными жирными кислотами (ПНЖК) [53–56].
В качестве модели для построения лечебного пищевого рациона при НАЖБП международный консенсус клинических практических рекомендаций предлагает Средиземно-морскую диету (уровень доказательности В1) [47,51]. Средиземноморская диета как понятие была введена в медицинскую практику после 1960 года, когда Ансель и Маргарет Кейс опубликовали результаты эпидемиологического исследования «Seven Countries’ Study», согласно которым в 7 странах средиземноморского бассейна заболеваемость ССЗ и раком оказалась значительно ниже, чем в США, Северной Европе и Японии [62].
Отличительными признаками Средиземно-морской диеты являются:
✓ высокое потребление свежих фруктов, овощей, картофеля, бобов, орехов, кунжута, льняного семени и других семян;
✓ хлеб, макаронные изделия и другие продукты на основе зерновых культур:
✓ оливковое масло для готовки и заправок, а также и другие источники жиров, которые не содержат насыщенные жирные кислоты, обеспечивающие 25–35 % суммарной калорийности;
✓ умеренное потребление кисломолочных продуктов из цельного молока и йогуртов;
✓ умеренное употребление рыбы и морепродуктов, изредка — мясо;
✓ умеренное потребление красного вина, обычно во время приема пищи;
✓ выбор свежих сезонных продуктов [63].
Начиная с 70-х годов, во множестве теоретических и экспериментальных исследований было показано, что Средиземноморская диета является оптимальным рационом для сохранения здоровья, снижения риска ССЗ и ожирения, хронических дегенеративных заболеваний, уменьшения массы тела [64, 65, 66]. В новейших исследованиях на фоне Средиземноморской диеты уменьшалась жировая инфильтрация печени и лабораторные проявления НАСГ (уменьшение AST/ALT) [67–69]. В ряде работ, по данным авторов, приверженность Средиземноморской диете приводила к увеличению чувствительности к инсулину у больных с инсулинорезистентностью даже без достижения существенного уменьшения массы тела [70–72].
Эффективность Средиземноморской диеты и близких к ней рационов питания («северный рацион»: рыба + капуста + ржаной хлеб + овсяная каша + яблоки + корнеплоды или «восточный рацион»: рыба + морепродукты + продукты из сои и других бобовых + столовая зелень) обусловлена высоким содержанием в ней пищевых источников антиоксидантов и незаменимых (эссенциальных) для человека ПНЖК [73].
В указанных продуктах со-3 ПНЖК могут содержаться в свободной форме (α-линоленовая кислота в семенах, орехах, водорослях, растительных маслах — кроме оливкового; эйкозапентаеновая и докозагексаеновая кислоты в жирной морской рыбе) или в форме эссенциальных фосфолипидов (бобовые, соя, яичный желток, цельное молоко). Для поддержания «здоровья» клеточных мембран организма и успешной борьбы с оксидативным стрессом пищевой рацион современного горожанина должен содержать не менее 2 г взаимозаменяемых ω-3 α-линоленовой/эйкозапентаеновой и 6–8 г со-6 линолевой/арахидоновой ПНЖК из любых пищевых источников или из биологически активных добавок и лекарственных препаратов [74]. Доказано, что при перманентном поступлении с пищей ПНЖК насыщают фосфолипиды клеточных мембран, чем и обусловлено их кардиопротективное, антиаггрегантное и противовоспалительное действие как системное в печени (табл. 5) [75–77].
Таблица 5
Этнические различия в содержании мембранных фосфолипидов в тромбоцитах (модифицировано по Rodriguez-Leyva D. et al. 2009) [76]

Однако важнейший механизм лечебного действия ПНЖК, особенно со-3 α-линоленовой и эйкозапентаеновой жирных кислот, при НАЖБП обусловлен их антиатерогенным влиянием на липидный обмен: способностью активировать окисление ТГ и уменьшать жировую инфильтрацию печени, минимизировать последствия липотоксичности и уменьшать инсулинорезистентность во всех тканях-мишенях, а также препятствовать избыточному синтезу холестерина и его обратному всасыванию в кишечнике (табл. 6) [22, 23, 78, 79].
Таблица 6
Интегральное влияние ω-3ПНЖК на липидный обмен и его нарушения при НАЖБП [22, 23, 78].

Больным с морбидным ожирением (ИМТ > 30 кг/м2) рекомендованы все стратегии снижения веса, за исключением назначения адрено-позитивных препаратов (сибутрамин). С осторожностью должны назначаться препараты, вызывающие диарею и нарушающие энтерогепатическую циркуляцию желчных кислот (орлистат), стимулирующие жировую инфильтрацию печени. У пациентов с НАСГ сегодня активно рассматривается безопасность бариатрической хирургии. Очевидно, что схемы с выведением из пищеварения повздошной кишки, как и длительная терапия орлистатом, пациентам с НАСГ противопоказаны.
Согласно международным клиническим рекомендациям, медикаментозная терапия показана только пациентам с верифицированным НАСГ и значимым уровнем фиброза печени (> F2), пациентам с СД, метаболическим синдромом и стойким повышением АЛТ (уровень доказательности В1). Такой осторожный подход рекомендован для терапии инсулиносенситайзерами: пиоглитазоном (высокая частота побочных эффектов — увеличение веса, остеопороз, сердечная недостаточность) и высокими дозами витамина Е (увеличивают риск канцерогенеза и тромботических осложнений), при том что оба метода лечения приводят к улучшению гистологической структуры у пациентов с НАСГ (уровень доказательности В1). Несмотря на потенциальное гепатотоксическое действие, пиоглитазон рекомендован для применения у больных НАСГ, однако с оговорками, что убедительных данных о безопасности при длительном приеме нет и его можно назначать только после гистологической верификации НАСГ. Близкую позицию эксперты Американской ассоциации по изучению заболеваний печени занимают по витамину Е. Показано, что у больных с НАСГ длительная терапия витамином Е в дозе 800 мг/ сутки оказывает выраженное антиоксидантное действие и приводит как к гистологическому, так и к клинико-лабораторному улучшению. В рекомендациях 2016 года было вновь почеркнуто, что терапия метформином (А1) и УДХК (В1) не оказывает значимого влияния на гистологию печени при НАЖБП и не рекомендована как метод специфической терапии НАСГ у взрослых. Доказано, что метформин, который широко применяется для уменьшения инсулинорезистенотности, приводит к снижению массы тела, ингибированию глюконеогенеза и липогенеза в печени, стимуляции β-окисления жирных кислот и улучшению клинико-лабораторного профиля пациентов. Однако в целом ряде исследований терапия метформином при НАСГ не сопровождалась гистологическим улучшением. Это привело к коррекции его места в клинических рекомендациях, но совершенно не отменяет необходимости назначения метформина как препарата 1 выбора для лечения инсулинорезистентности при MC и СД 2 типа.
Вследствие отсутствия доказательств эффективности, не рекомендуется пациентам с НАЖБП и НАСГ целенаправленно назначать препараты УДХК (рис. 39). Что, конечно, не исключает применения препаратов УДКХ по прямым медицинским показаниям: для лечения рентген-негативных желчных камней, при рефлюкс-гастрите, при внутрипеченочном холестазе, в том числе — при хронических холестатических заболеваниях печени. Важно так же помнить, что УДКХ является холеретиком. Терапия УДКХ противопоказана при хроническом панкреатите, ЖКБ, циррозе печени.

Рис. 39. При НАЖБП УДКХ не показана
Одновременно, среди перспективных препаратов для специфической терапии НАСГ можно выделить препараты других желчных кислот — обетихолевую желчную кислоту (ОЖК) и фармакологически модифицированную холевую желчную кислоту, связанную с арахидоновой ПНЖК (арамхол) (рис. 40).
Оба препарата направлены на активацию энтерогепатической циркуляции эндогенных желчных кислот и уменьшение, таким образом, накопления ТГ в печени. ОЖК: полусинтетическая 6α-этил-хенодезоксихолевая желчная кислота — это сильный (в 100 раз сильнее эндогенной вторичной хенодезоксихолевой кислоты) специфический агонист FXR и слабый активатор рецепторов TGR5 и секреции глюкагоноподобного пептида-1 клетками тонкой кишки. Закончена 3 фаза рандомизированного плацебо-контролируемого исследования FLINT с применением ОЖК при НАСГ, в котором за 1,5 года лечения удалось достичь уменьшения стеатоза, дистрофии и воспаления в печени (рис. 41).
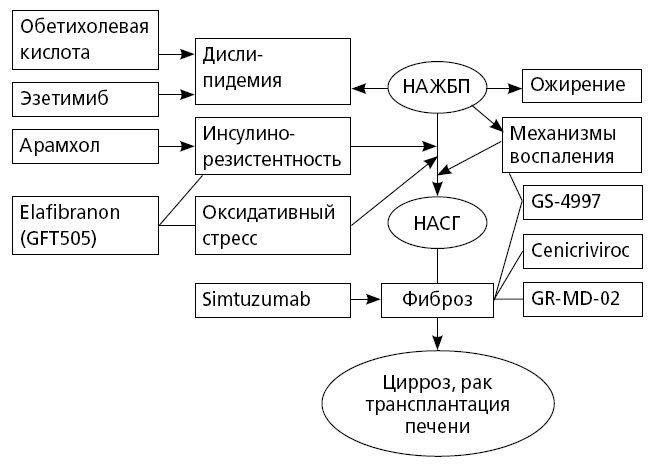
Рис. 40. Перспективные методы таргетной терапии НАЖБП/НАСГ
(модифицировано по Mazzella N. et al., 2014) [87]
К сожалению терапия ОЖК также не оказалась безопасной: на фоне лечения у больных дозозависимо развивался внутрипеченочный холестаз (увеличение титров ЩФЭ, а также происходили нежелательные сдвиги липидной формулы — увеличение титров ЛПНП и уменьшение титров ЛПВП. Кроме того, результаты лечения оказались нестойкими — через 1 год после прекращения терапии все эффекты нивелировались.
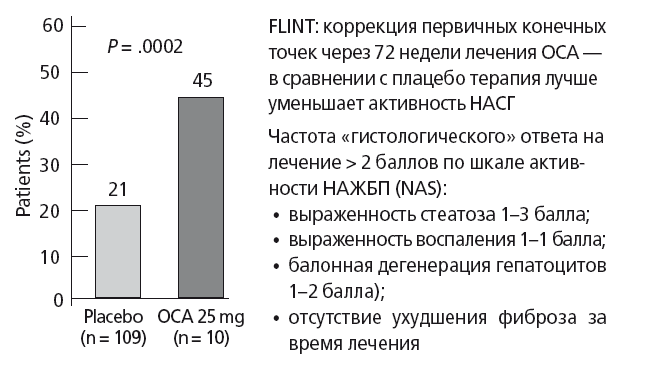
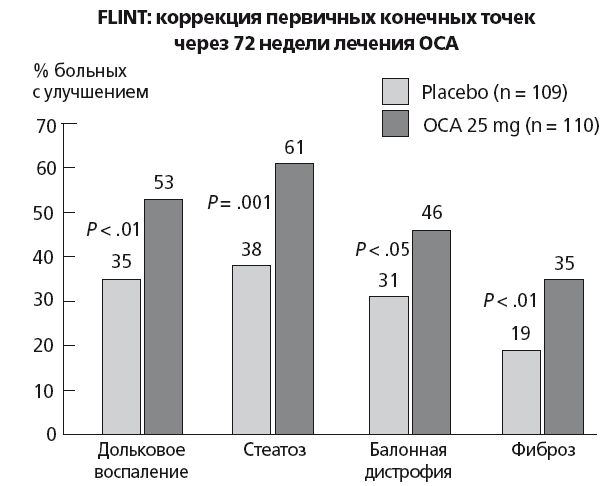
Рис. 41. Основные результаты исследования FLINT
Арамхол (ARAMCHOL®) — синтетическая молекула, содержащая конъюгированную желчную кислоту (близкую к холевой) и арахидоновую жирную кислоту. В эксперименте арамхол уменьшал жировую инфильтрацию печени 2 путями: посредством снижения активности ключевого фермента метаболизма жирных кислот — SCD1 и путем активации АВСА1-зависимой экскреции холестерина из печени в желчь.
По данным рандомизированного клинического исследования ARREST (исследование 3 фазы), терапия арамхолом дозозависимо приводит к значимому уменьшению жировой инфильтрации печени (рис. 42).
Особое место в терапии НАЖБП занимают препараты ω3,6-ПНЖК. По данным метаанализа, длительная терапия ω3,6-ПНЖК (как и направленное обогащение рациона питания незаменимыми ПНЖК) приводит к улучшению гистологической структуры и уменьшению стеатоза печени (рис. 43, 44).

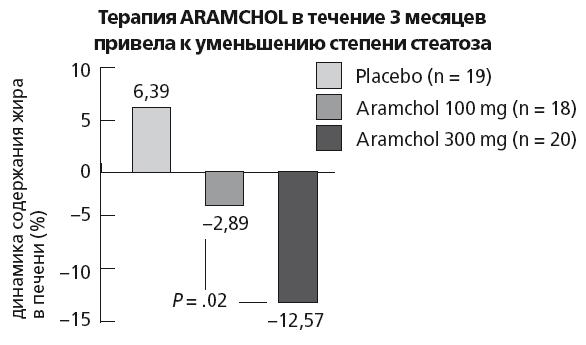
Рис. 42. Основные результаты исследования ARREST
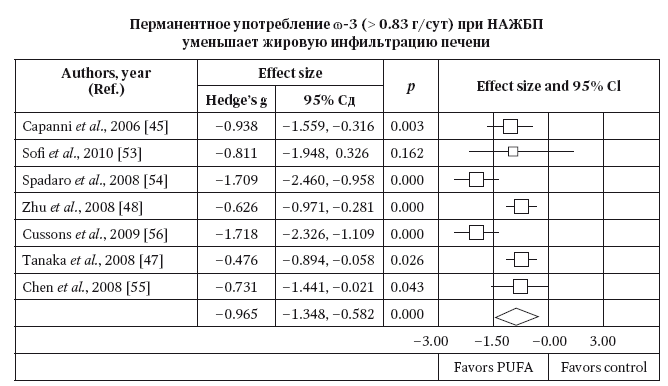
Рис. 43. Постоянное употребление т-3 (>0,83 г/сут. при НАЖБП уменьшает жировую инфильтрацию печени
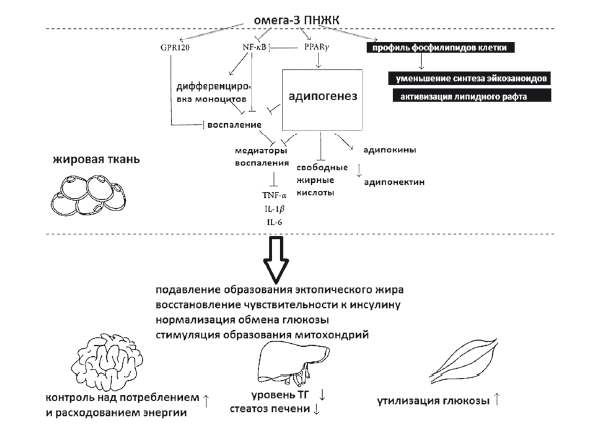
Рис. 44. Плейотропные эффекты терапии ПНЖК при НАЖБП и MC
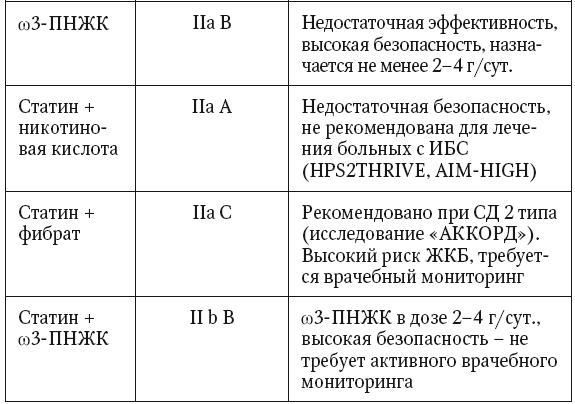
Базируясь на имеющихся данных по позитивному влиянию ω3,6-ПНЖК на струтуру печени и способности активировать метаболизм ТГ, уменьшать инсулинорезистентность и уровень хронического воспаления, консенсус практических рекомендаций по лечению НАЖБП рекомендует назначение ω-3 ПНЖК как фармакологическую стратегию первого выбора для пациентов с высокими титрами ТГ в плазме, в том числе — одновременно с назначением статинов (табл. 7), что также поддерживается консенсусом практических рекомендаций по лечению дислипидемии Европейского общества кардиологов и Европейского общества по лечению атеросклероза (уровень доказательности В1) [47, 51].
Таблица 7
Практические рекомендации по лечению дислипидемии с гипертриглицеридемией (EAS/ESC, 2016) (модифицировано из Atherosclerosis, 2016,253:281–344)

Среди источников ПНЖК в нашей стране хорошо известны препараты и БАДы, содержащие комбинацию добываемых из рыбы эйкозапентаеновой и докозагексаеновой жирных кислот, и препараты эссенциальных фосфолипидов (эссенциале форте Н, эсслидин, эссливер и другие). Эссенциале форте Н явлется референтным препаратом по составу и содержанию ЭФЛ. В одной капсуле эссенциале форте Н содержится 76%
ЭФЛ: 50 % — дилинолеоил-фосфатидилхолина и до 11 % ω-3 линоленоил-фосфатидилхолина, которые обладают 90 % биодоступностью и служат источником биоидентичных эссенциальных ω3,6-ПНЖК растительного происхождения, получаемых из соевых бобов [80]. К настоящему времени накоплена солидная доказательная база данных РКИ, в которых показана эффективность терапии ЭФЛ в отношении нормализации высокоатерогенной дислипидемии, улучшению лабораторной и ультразвуковой картины печени, уменьшению инсулинорезистентности, минимизации системного и тканевого воспаления и уменьшения активности фиброгенеза в печени, в том числе — при сочетанной алкогольно-метаболической этиологии жировой инфильтрации [80–86]. Показано, что терапия ЭФЛ является структурно- и функционально-модифицирующей для клеточных мембран гепатоцитов и других клеток, востанавливает их работоспособность и вытесняет из них свободный холестерин. При НАЖБП терапия ЭФЛ оказывает мощную антиоксидантную поддержку гепатоцитам и позволяет печени противостоять липотоксиности и сопутствующему стрессу эндоплазматического ретикулума и митохондрий, вызванных избытком ТГ [87, 88].
Противовоспалительное и антифибротическое действие ЭФЛ минимизирует риск активации звездчатых клеток печени, активность которых запускает процесс фиброза в паренхиме и препятствует воспалительному апоптозу гепатоцитов [88]. Терапия ЭФЛ активирует обмен ТГ в печени и плазме, нормализует транспорта и метаболизм холестерина в печени, в целом корректирует дислипидемию «липидного квартета».
Ранняя диагностика НАЖБП и выявление НАСГ среди пациентов общей практики — это важнейшая задача первичного звена здравоохранения и, по-видимому, единственная возможность противопоставить медицину набирающей обороты эпидемии метаболического ожирения и СД 2 типа. Тем не менее, по данным американских специалистов, проблема НАЖБП повсеместно остается недооцененной и даже при раннем выявлении жировой инфильтрации пациенты не получают верного медицинского консультирования и наблюдения (рис. 46).
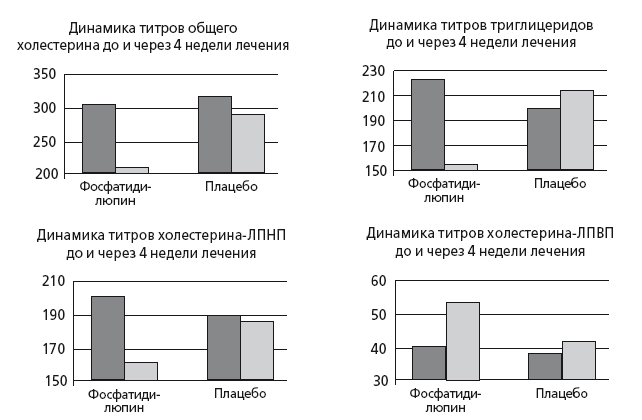
Рис. 45. Динамика липидного профиля у 240 больных ССЗ на фоне терапии эссенциале форте H (1, месяца, 1.8 г/сут.) была достоверно более выраженной, чем в группе плацебо (модифицировано по Kidd PM.) [81]
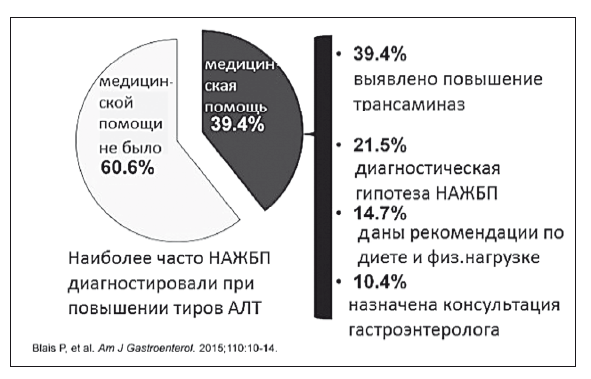
Рис. 46. Охват медицинской помощью пациентов с НАЖБП
Это происходит потому, что для модификации образа жизни пациентов с НАЖБП недостаточно «сухих» знаний о патологии, верификации диагноза и назначения более или менее адекватной синдромной терапии. Для достижения этой терапевтической цели врачу общей практики помимо профессиональной и гуманистической мотивации необходима стратегия действий и технические возможности для ее реализации. В частности, сформировать у пациента с НАЖБП первичную мотивацию для изменения образа жизни может модель врачебного консультирования за 20 минут (рис. 47), предложенная Hallsworth К и соавт. (2016) [90].
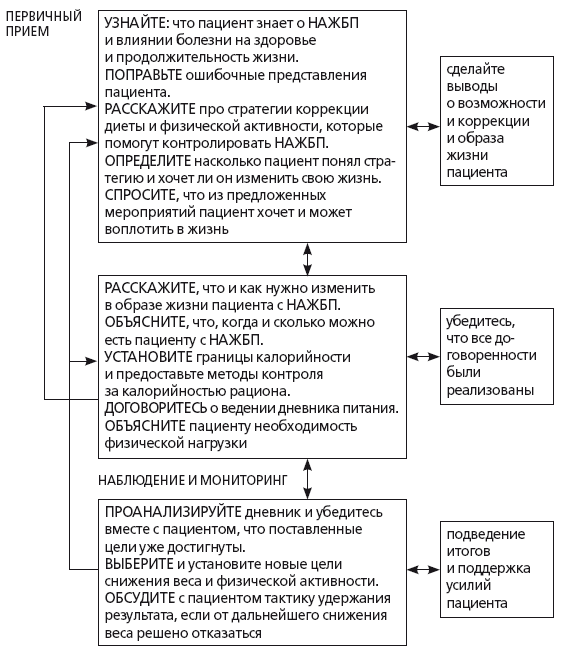
Рис. 47. Алгоритм врачебного консультирования, направленный на модификацию образа жизни при НАЖ, (модифицировано по Hallsworth К и соавт. (2016) [90]
Назад: Глава 8 Диагностика НАЖБП
Дальше: Литература

