Книга: Воля и самоконтроль: Как гены и мозг мешают нам бороться с соблазнами
Назад: Доход семьи
Дальше: Литература
Стресс
Стресс – фактор, способный влиять на развитие мозга
"Ах, для меня это был такой стресс!" – говорим мы почти по любому поводу, от утренней поездки в переполненном вагоне метро до смерти близкого человека. Google выдает 24,5миллиона статей про стресс, а психологические глянцевые журналы в каждом номере объясняют, что он – корень всех бед. И это не мода последних лет: известное выражение "Все болезни от нервов" бытовало еще в советские времена. При этом большинство людей толком не знают, что же такое стресс и как именно он воздействует на организм. И даже поминающие стресс при каждом удобном случае до конца не верят, что он действительно может всерьез навредить. А зря. Многочисленные исследования доказывают, что стресс, особенно хронический, вызывает в организме физические изменения, зачастую необратимые. Этот процесс затрагивает и мозг, включая области, ответственные за самоконтроль.
Как впервые был обнаружен стресс, или о том, что ошибки иногда помогают делать замечательные открытия
Но прежде чем выяснять, как стресс делает нас безвольными, нужно разобраться, что же это, собственно говоря, такое. Как ни странно, но четкого определения нет не только у обывателей, но и у ученых. Начало исследований стресса – и сам этот термин в его нынешнем значении – связаны с именем канадского эндокринолога родом из Австро-Венгрии Ганса Селье. Ученый исследовал, как организм мышей реагирует на всевозможные травмирующие воздействия, – хотя тема эта возникла в его исследованиях вынужденно. Только что, в 1921 году, был открыт инсулин, в 1923 году за эти работы присудили Нобелевскую премию, и амбициозный 28-летний ученый тоже намеревался найти какой-нибудь новый гормон. Селье решил попытать счастья с половыми гормонами, и чтобы сделать воздействие гипотетического неизвестного соединения более заметным, вкалывал мышам концентрированные вытяжки из яичников. Манипуляции неизменно давали ярко выраженный эффект: у мышей появлялись язвы, лимфоидные ткани уменьшались в размерах, а надпочечники, наоборот, увеличивались. Более того, чем больше вытяжки вкалывал ученый, тем сильнее проявлялись последствия. Селье ликовал: он был уверен, что новый гормон (а заодно и Нобелевская премия) у него в руках.
Но честолюбивый эндокринолог был прежде всего хорошим ученым и понимал, что без правильных контрольных опытов его открытие мало чего стоит. Желая убедиться, что наблюдаемые физиологические изменения действительно произошли из-за неизвестного гормона, Селье вколол мышам вытяжки гипофиза и плаценты. К страшному разочарованию исследователя, у животных развились точно те же изменения. Чувствуя, как уплывает премия, Селье стал вкалывать мышам вытяжки всего подряд, от почек до селезенки – и каждый раз наблюдал изъязвление желудка и кишечника, рост надпочечников и уменьшение лимфоидных тканей. Отчаявшись понять, что происходит, исследователь вколол грызунам формальдегид – и обнаружил, что он "работает" так же, как вытяжки внутренних органов. Мечта о новом гормоне окончательно рассыпалась. Селье был раздавлен. "Мне было настолько плохо, что несколько дней я просто сидел в лаборатории, размышляя, как можно было бы избежать такого провала и что делать теперь", – писал ученый в своих воспоминаниях. Самым очевидным решением было признать свою неудачу и забыть все опыты по поиску нового гормона. Но что-то мешало Селье сделать это. Навязчивая мысль, которая преследовала его со времен, когда он был студентом медицинской школы при Пражском университете, подсказывала, что в полученных результатах есть нечто очень важное.
Осматривая своих первых пациентов, 19-летний будущий врач заметил, что у всех больных, независимо от диагноза, много общего. Они чувствовали себя неважно и выглядели нездоровыми, язык был обложен, пациенты жаловались на боли в разных частях тела и суставах, расстройства пищеварения и потерю аппетита. Первичный осмотр показывал, что многих лихорадило, печень и селезенка были увеличены, небные миндалины воспалены, на теле выступала сыпь. При этом специфические симптомы конкретного заболевания проявлялись позже. "Это были мои первые пациенты, поэтому я изучал их без предвзятости, которую навязывают устоявшиеся в медицине взгляды, – писал Селье. – Если бы в тот момент у меня было больше знаний, я бы никогда не задал себе все эти вопросы, потому что всё выглядело так, как оно и должно было выглядеть". Юный медик поделился предположением, что существует некий общий "синдром нездоровья", со своим куратором, тот посмеялся над его наивностью, и Селье забросил эту идею. Но теперь, когда он сидел перед клетками с больными мышами и горевал о разбитых мечтах найти новый гормон, она появилась вновь. Что, если язвы и изменение органов – это реакция не только на болезнь, а на любое травмирующее воздействие? Озарение Селье стоило здоровья еще нескольким десяткам мышей: ученый заставлял животных бегать до изнеможения, выставлял на мороз, перерезал спинной мозг, впрыскивал колоссальные дозы морфина, адреналина, атропина и вообще всего, что нашлось в лабораторных шкафах. На этот раз гипотеза подтвердилась: самые непохожие воздействия приводили к одному и тому же физиологическому эффекту. И он очень напоминал тот самый "синдром нездоровья", который Селье обнаружил у пациентов пражского госпиталя.
Ученый заключил, что организм животных реагирует таким образом на любые повреждения [24]. Позже Селье назвал комплекс наблюдаемых симптомов стрессовым ответом, или просто стрессом. Исследователь определил его как "неспецифический ответ организма на любое воздействие, требующее изменения <работы организма>". Работы Селье вызвали огромный интерес у коллег, а слово "стресс" немедленно стало модным. При этом его значение размылось: одни понимали под стрессом собственно раздражающий фактор, например, злобного начальника. Другие употребляли термин, говоря о конкретных реакциях на этот фактор, – скажем, сердцебиении и головной боли после очередного унижения от шефа. Третьи рассматривали стресс как отдаленный итог неприятных событий, т. е. в их трактовке невыносимые условия на работе вполне могли приводить к серьезным расстройствам, скажем, язве. В 1951 году остроумный врач по имени Роберт Франгкон в одной из статей в авторитетном медицинском журнале British Medical Journal суммировал все эти разночтения: "В дополнение к тому, что стресс есть собственно стресс, он еще и причина стресса, и его результат".
Плюс ко всему, то, что для одних людей – безусловный стресс (неважно, в каком из значений), для других – всего лишь легкая встряска или даже вовсе незаметное событие. Большинство людей каждый день ездят в лифте, но не рассматривают это мероприятие как приключение и в принципе что-то примечательное. Однако у клаустрофоба от перспективы оказаться запертым в железной коробке хотя бы на несколько секунд начинают дрожать поджилки, ноги становятся ватными, а сердце колотится так, будто он только что пробежал стометровку. Но если клаустрофобы еще признают, что у них есть некие отклонения, то люди, которые боятся летать на самолетах, не считают, что с ними что-то не так. Однако любой перелет для аэрофоба – мучение. Каждый, кто хоть раз видел такого страдальца – бледного, с испариной, судорожно вцепившегося пальцами в подлокотники, понимает, что его организм в этот момент работает не так, как обычно.
С середины XX века ситуация не слишком изменилась, и под стрессом в зависимости от контекста по-прежнему подразумевают совершенно разные вещи: мол, все примерно понимают, о чем речь, – и ладно. Я тоже буду использовать этот термин в его разных значениях – и как само воздействие, и как спровоцированное им состояние организма, поясняя, о каком из смыслов идет речь38. И начну со второго значения: что представляет собой стресс как физиологическая реакция на неприятный раздражитель, может ли он глобально влиять на организм и есть ли связь между уровнем стресса и самоконтролем (как вы, наверное, уже поняли, учитывая, что стрессу в книге посвящена отдельная глава, – есть).
Стресс кардинально меняет физиологию организма и позволяет быстро среагировать на опасность
Представьте: обычное утро, вы выходите из дома, поворачиваете к дороге, смотрите направо, налево, убеждаетесь, что машин нет, и начинаете переходить улицу. Вдруг из-за припаркованного автомобиля на огромной скорости выскакивает грузовик и несется прямо на вас. Задолго до того, как вы осознаете, что происходит, в вашем организме произойдут десятки стрессовых реакций. Первым делом ваши глаза и уши передадут информацию о приближающемся грузовике прямиком в миндалину – древнюю область мозга, которая осталась у нас со времен, когда мы были покрыты шерстью и бегали на четырех конечностях. Как вы помните, миндалина отвечает за эмоционально окрашенные реакции, в первую очередь негативные, а стремительно увеличивающийся в размерах грузовик – серьезный повод как раз для таких эмоций. Миндалина немедленно посылает сигнал тревоги в гипоталамус – командный центр мозга, который заведует нейроэндокринными процессами, т. е. регулирует "несознательную" работу организма, дергая за рычаги нервной и гормональной систем.
Гипоталамус имеет дело с так называемой вегетативной нервной системой, которая управляет внутренними органами, – его приказы идут к ним напрямую, в обход медленной префронтальной коры. Вегетативная нервная система, в свою очередь, делится на симпатическую и парасимпатическую. Симпатический отдел – это своеобразная педаль газа, которая "заводит" организм, чтобы он мог быстро убежать от тигра или отпрыгнуть от летящего автомобиля (помните, реакция fight or flight – "бей или беги", о которой мы говорили в разделе об эмоциях в главе 3). Парасимпатическая нервная система работает как тормоз, останавливая избыточный поток энергии после того, как опасность миновала (состояние rest and digest, т. е. "отдыхай и переваривай"). Итак, получив от миндалины предупреждение, что на организм мчится грузовик, гипоталамус "дает по газам", т. е. активирует симпатическую нервную систему. Первым делом он активирует надпочечники, посылая им сигнал по нервным отросткам. В ответ они немедленно выбрасывают в кровь гормон адреналин, который запускает цепочку физиологических реакций: сердце начинает биться чаще, к нему и к мышцам приливает кровь, давление растет, дыхание учащается, бронхиолы в легких расширяются, стремясь принять как можно больше кислорода, зрачки увеличиваются, чтобы ловить малейшие детали и изменения окружающего пейзажа. Адреналин по кровотоку добирается до хранилищ сахара39 и жиров в мышцах и заставляет их расстаться с запасами – учитывая, что сейчас предстоит очень быстро бежать и, может, даже драться, необходима лишняя энергия. Заведшийся организм резво отпрыгивает от тигра, в смысле от грузовика, и вот вы уже поднимаетесь с обочины, удивленно глядя вслед уносящемуся КамАЗу и не до конца понимая, что же произошло. Если бы миндалина общалась напрямую с префронтальной корой, то шансов, что человечество развилось бы до стадии, когда одни его представители могут описывать в книгах стрессовые реакции, а другие – читать об этом, было бы заметно меньше. ПФК отлично работает, если дать ей немного времени, но для принятия мгновенных решений она приспособлена плохо.


Первоначальный впрыск адреналина работает как экстренная мера, и к моменту, когда его действие проходит, гипоталамус успевает активировать основную машинерию ответа на опасный стимул – так называемую гипоталамо-гипофизарно-надпочечниковую ось, или систему (ГГНС). Как следует из названия, ГГНС состоит из гипоталамуса, гипофиза (небольшой отдел мозга, непосредственный начальник всех желез, вырабатывающих гормоны) и надпочечников. При помощи гормональных стимулов ГГНС держит нажатой педаль газа симпатической нервной системы, и если это длится достаточно долго, гипоталамус запускает режим длительной обороны. Он выбрасывает гормон кортиколиберин, иначе называемый кортикотропин-рилизинг-фактор (КРФ), гипофиз улавливает его и понимает, что пришла пора синтезировать адренокортикотропный гормон (АКТГ). АКТГ отправляется к надпочечникам и приказывает им запустить производство кортизола – того самого "гормона стресса", о котором очень любят писать в журналах по популярной психологии.
При этом функционально кортизол – это гормон частичного восстановления после первоначальной реакции на стресс. Его задача – запустить в организме процессы, которые помогут ему хоть сколько-нибудь нормально функционировать во время встряски. Потому что долго существовать в "адреналиновом" режиме невозможно. Кортизол разносится по организму и действует на самые разные системы и органы, от печени до иммунной системы. В печени он запускает синтез гликогена – полимера, составленного из молекул глюкозы. Это оперативный резерв сахара: в случае необходимости организм может быстро расщепить гликоген и получить энергию – как, собственно, и происходит во время острой фазы стресса. С другой стороны, кортизол стимулирует глюконеогенез – т. е. производство глюкозы de novo. Если в этом месте вам показалось, что организм занимается какой-то ерундой, пытаясь повторить школьную задачку про ванну, которую заполняют водой из крана и одновременно опорожняют через незакрытый слив, не торопитесь с выводами. Действуя на противоположные по смыслу процессы, кортизол тонко регулирует уровень сахара в крови: на начальной стадии ответа на стресс активирует синтез глюкозы, а на поздних стадиях – гликогена. Таким образом кортизол следит, чтобы организм не погиб от истощения, истратив всю энергию на стрессовый ответ.
Еще одна задача кортизола – восстановить баланс ионов (прежде всего, натрия и калия) в клетках, взбудораженных реакцией на нервную ситуацию. В норме внутри клеток почти нет ионов натрия, зато очень много калия, и если это соотношение не выдерживается, многие процессы, в том числе передача нервных импульсов, идут наперекосяк. Наконец, кортизол влияет на иммунную систему, оптимизируя ее работу для условий стресса. Он усиливает подразделения, которые отвечают за борьбу с внешними патогенами вроде бактерий и вирусов, но угнетает отдел, который провоцирует реакцию воспаления (т. е. длительный иммунный ответ) и сражается с "внутренними врагами", в том числе с опухолями. Эволюционно это вполне объяснимо: когда на тебя несется тигр или соплеменник с дубинкой, логичнее сосредоточиться на противостоянии непосредственной опасности – бактериям, которые немедленно начнут размножаться в месте укуса или перелома. А с хроническими болячками можно разобраться и попозже, когда источник стресса исчезнет. Наконец, кортизол напрямую влияет на мозг. Скажем, в гиппокампе, регионе, отвечающем за память, очень много рецепторов к кортизолу. Гормон стресса стимулирует гиппокамп, помогая нам запоминать критически важную информацию.
Слишком длительный стресс убивает организм – в буквальном смысле
Когда опасность миновала, организм отпускает педаль газа – активность симпатической нервной системы падает. Включается парасимпатическая – тормоз, и мы потихоньку приходим в себя. Но если источник опасности не исчезает и педаль газа остается нажатой постоянно, стрессовая реакция из полезной адаптации превращается в источник проблем. Учащенный сердечный ритм, повышенное давление и усиленная свертываемость крови хороши, чтобы человек убежал от тигра и не умер от кровотечения, но в постоянном режиме все это повреждает сердечно-сосудистую систему и провоцирует инфаркты и инсульты. Выброс глюкозы в кровь дает силы для решительного прыжка или удара, но если концентрация сахара повышена все время, рано или поздно разовьется диабет. Если неожиданные стрессовые ситуации происходят часто, этот риск еще больше возрастает, так как адреналин, присоединяясь к своим рецепторам, дополнительно блокирует выработку инсулина, гормона, без которого клетки не могут поглощать глюкозу, и она остается плавать в крови. Интенсивное расщепление жиров дает много энергии, но увеличивает вероятность, что в сосудах будут формироваться атеросклеротические бляшки. Ослабление перистальтики кишечника и замедление пищеварения – полезная мера при кратковременной реакции на стресс, но в долгосрочной перспективе угнетение важнейшей функции организма грозит язвой. У лабораторных мышей именно язва служит достоверным симптомом того, что длительный стресс "удался". Переключение иммунной системы на борьбу с немедленной опасностью помогает не тратить ресурсы на "несрочные" болячки, но если экстренный режим работы затягивается, человек начинает постоянно болеть – вспомним симптомы общего нездоровья, которые вычислил молодой Селье. Офисные работники любят списывать свои бесконечные простуды на сквозняки и кондиционер, но данные британского Исследования работающего населения (Labour Force Survey) связывают минимум 37 % всех случаев недомогания именно со стрессом [25]. По другим данным, эта цифра может достигать 50 % [26].
Длительный стресс не проходит даром и для мозга. Если концентрация кортизола в крови остается стабильно высокой долгое время, гиппокамп вместо того, чтобы активироваться, начинает работать еле-еле. Отчасти поэтому у студентов редко получается освоить годовой курс сопромата или истории Древнего мира за неделю до экзамена, а ученики вечно орущего учителя так часто подтверждают его обвинения в тупости и неспособности хоть что-либо запомнить [27]. По той же причине на ответственном собеседовании вы вдруг забываете, что полезного сделали на предыдущей работе, – сильный и/или длительный стресс влияет и на способность извлекать воспоминания из памяти. Еще два региона, на которые действует кортизол, – миндалина и префронтальная кора. Вполне предсказуемо, что древняя и проверенная миллионами лет опасных ситуаций миндалина при стрессе получает карт-бланш: она напрямую общается с зонами мозга, экстренно перенаправляющими внимание на опасный стимул, и вообще работает очень быстро. Не то что обстоятельная и размеренная ПФК, которая обычно миндалину придерживает. При стрессе эти вожжи ослабевают, и миндалина действует почти целиком на свое усмотрение, моментально отделяя угрожающие жизни стимулы от нейтральных. У людей с повышенным уровнем кортизола миндалина все время находится в "приподнятом" состоянии. Но помимо правильной оценки потенциально опасных стимулов этот регион, как вы помните, отвечает за любые эмоционально окрашенные желания, – а значит человеку, который постоянно живет в состоянии стресса, сложнее сдерживать свои порывы. Это еще одна причина, почему столько людей заедают проблемы, во время сдачи годового отчета проводят вечера в барах и заводят интрижку в первые несколько месяцев после рождения ребенка, особенно если он плачет ночами напролет и не дает родителям спать.

Постоянно высокий уровень кортизола не только держит на взводе миндалину – этот гормон еще и напрямую тормозит ПФК. В итоге контроль за эмоциями радикально ослабевает: мало того, что при стрессе миндалина сама активируется, так еще и область, которая должна ее усмирять, выводится из игры. Подавлять работу миндалины помимо ПФК может еще гиппокамп, но, как мы только что обсудили, его активность тоже угнетается при стрессе. Поэтому неудивительно, что в стрессовой ситуации люди часто действуют неразумно, подчиняясь могущественному зову миндалины – которая немедленно заставляет выбирать что-нибудь приятное прямо сейчас, а не ждать туманных бонусов в будущем. Говоря проще, стресс снижает нашу способность откладывать вознаграждение и притормаживать порывы. Причем так работает даже не очень сильный кратковременный стресс, с которым мы регулярно сталкиваемся в жизни. Наорал начальник, в автобусе наступили на ногу, в магазине прямо перед вами купили последний пакет молока – да мало ли раздражающих ситуаций. Они заставляют нас злиться, но в целом кажутся безвредными. Но это не так: находясь под воздействием кортизола, мы теряем изрядную долю самоконтроля. И если сразу после того, как вы, красный и злой, вышли из кабинета начальника, нужно принять какое-то важное решение, назавтра собственный выбор может вас удивить. А если это важное финансовое решение или, скажем, выбор, отвечать ли вам "да" на предложение выйти замуж, то последствия ответа, данного под воздействием стресса, могут сказываться долгие годы.
Кратковременный стресс ослабляет самоконтроль, и человек становится более рисковым
Ученые из Университета Ратгерса проверяли, как люди распоряжаются деньгами после того, как испытают умеренный стресс. В лабораториях для этого заставляют подопытных держать руку в ледяной воде пару минут. Экзекуция гарантированно вызывает выброс кортизола. Этого и добиваются исследователи, которые тут же усаживают несчастных добровольцев, едва успевших вытереть мокрые руки, решать какие-нибудь каверзные задачки. И оказалось, что если заставить людей после холодового шока выбирать между двумя возможностями: с высокой вероятностью потерять небольшую сумму денег или с низкой – заметно более крупную, они чаще выбирают второй путь. При этом в противоположных тестах, когда предлагается с низкой вероятностью получить большую сумму и с высокой – маленькую, люди, испытавшие стресс от ледяной воды, предпочитают гарантированно получить небольшую денежку [28]. Такое поведение называется эффектом зеркального отражения (по-английски reflection effect), и впервые его описали знаменитые психологи Дэниэл Канеман и Амос Тверски40. Суть эффекта в том, что отношение людей к одному и тому же вероятностному предложению радикально отличается, если сформулировать его как обещающее какой-то выигрыш или же как сулящее проигрыш. Человек чаще выбирает варианты, которые в перспективе могут принести значительные потери, – если сохраняется хотя бы небольшая возможность успеха. Но если ситуация обещает разные по размеру выигрыши, то человек скорее согласится на менее ценный, но зато более вероятный. Другими словами, решение в ситуации, которая грозит потерями, зеркально отличается от выбора, который человек сделает в обстановке, обещающей выигрыш.
Зеркальный эффект может спасти или погубить сотни жизней – в зависимости от того, как его применяют
В знаменитой статье 1981 года "Формулировка решений и психология выбора" (The Framing of Decisions and the Psychology of Choice) Канеман и Тверски приводят такой пример. Предположим, в Азии появилась новая опасная болезнь, которая, по оценкам врачей, унесет жизни 600 человек. Правительство США рассматривает две программы борьбы с этой болезнью. Если будет одобрена программа А, 200 человек будут гарантированно спасены. При выборе программы Б с вероятностью 1/3 будут спасены 600 человек, но с вероятностью 2/3 не выживет никто.Что выберет правительство, если ему представят на рассмотрение такие стратегии? Оказывается, решение зависит от того, каким образом медики расскажут об имеющихся возможностях. Если они сделают это так, как описано выше, т. е. в форме ситуации, обещающей разные по значимости выигрыши, – то чиновники предпочтут избежать риска, и с вероятностью примерно 72 % выберут вариант А: меньший, но гарантированный выигрыш (цифра взята не с потолка, Канеман и Тверски выяснили ее в экспериментах с добровольцами). Но если сформулировать альтернативу как выбор между двумя проигрышами, решение будет совершенно иным. Итак: при выборе программы А гарантированно умирают 400 человек, при выборе Б с вероятностью 1/3 не умрет никто, с вероятностью 2/3 погибнут 600 человек. Добровольцы, которым ученые предлагали такой расклад, в 78 % случаев склонялись к более рискованному, но зато обещающему больший выигрыш пути и выбрали программу Б [29].В 1981 году этот пример был умозрительным, но сегодня он вполне актуален: в Азии регулярно происходят вспышки "животных" гриппов, в Африке случилась самая масштабная в истории эпидемия лихорадки Эбола, в Южной Америке неожиданно распространился вирус Зика. И программы А и Б из учебных кейсов превратились в настоящие лекарства: скажем, лекарство А не слишком эффективно, но зато проверено, а лекарство Б выглядит многообещающим, но еще не прошло полноценных испытаний.
Канеман и Тверски вывели зависимость, которой подчиняются наши решения. Если расположить ее на оси выбора, где слева находятся потери, а справа – выигрыши, то зависимость будет иметь форму латинской буквы S. В районе нулевой точки (нейтральный результат) кривая идет круче, т. е. субъективно потерять 500 рублей вместо 100 гораздо болезненнее, чем потерять 1500 рублей вместо 1100. С выигрышем то же самое. При этом левая часть кривой (восприятие потерь) идет заметно круче правой, т. е. боль от утраты чего-то сильнее радости от приобретения того же самого. Канеман и Тверски связывают излишнюю чувствительность людей к проигрышам с так называемым страхом потери (по-английски – loss aversion) – нашим категорическим нежеланием расставаться с чем угодно. Эволюционно страх потери вполне объясним: если ты прямо сейчас лишишься тушки зайца, то точно останешься без тушки, т. е. голодным. Если тебе предлагают пойти куда-то и получить тушку, то вовсе не факт, что она там будет, поэтому вероятность поесть остается под вопросом. Перспектива утратить что-то вызывает яростный протест миндалины: люди, у которых эта область повреждена, страха потери не испытывают [30].
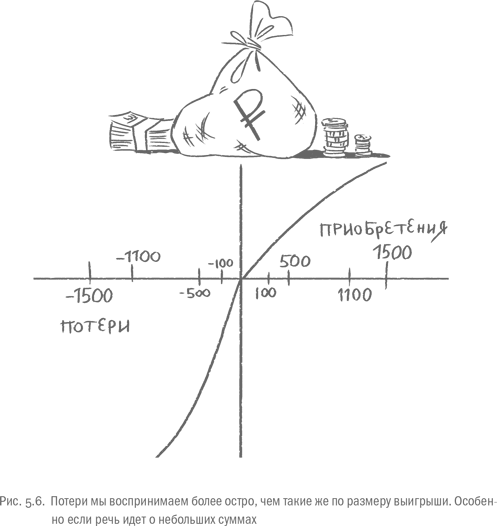
Исследователи из Университета Ратгерса, заставлявшие добровольцев держать руку в ледяной воде, показали, что в состоянии стресса эффект зеркального отражения усиливается. Кортизол снимает блоки, при помощи которых ПФК сдерживает миндалину, и она проявляет себя по полной. Так что старый совет "Утро вечера мудренее" оправдан с нейробиологической точки зрения. Можно сколько угодно пытаться "собраться" и "взять себя в руки", но в момент, когда вы находитесь под воздействием стрессора, мыслить рационально очень сложно: активность ПФК снижена, и бал правит далекая от рациональности миндалина. Более того, на МРТ хорошо видно, что острый стресс особенно сильно подавляет работу дорсолатеральной части ПФК, нашего внутреннего командора Спока, отвечающего за максимальную рационализацию. Продиктованный эмоциями выбор часто оказывается неправильным, это дополнительно усиливает стресс, заставляя надпочечники выбрасывать в кровь новые порции кортизола, который не дает Споку исправить ситуацию. Человек нервничает еще больше, продолжая снова и снова принимать неправильные решения. Выход из замкнутого круга – заранее подготовиться к ожидаемой стрессовой ситуации и продумать, как вы будете поступать.
Невозможность контролировать стресс ухудшает способность людей сдерживать себя
В классическом опыте 1969 года психологи под руководством Дэвида Гласса из Техасского университета в Остине заставляли женщин выполнять несложные задания в шумном помещении. Одна группа испытуемых работала в постоянном шуме, а в комнате, где сидели оставшиеся участницы, громкие звуки раздавались внезапно. Как только женщины заканчивали, им предлагали искать ошибки в текстах и решать головоломки, которые были заведомо нерешаемыми – Гласс и коллеги намеренно добивались, чтобы тест был максимально фрустрирующим. Женщины, которые в первой части эксперимента сидели в комнате, где громкий шум возникал неожиданно, существенно хуже выполнили первое задание и тяжелее переживали, что не справились со вторым [31]. Стресс повлиял как на способность решать задачи, требующие самоконтроля, так и на пресловутую "стрессоустойчивость", без упоминания которой сегодня не обходится ни одно резюме.
Кстати, когда Гласс разрешил участницам нажимать на специальную кнопку, якобы выключающую звуки (на самом деле это был муляж), если выносить шум будет совсем невмоготу, они гораздо лучше справились со всеми заданиями. Причем ни одна из участниц на кнопку так и не нажала. То есть даже иллюзия, что ты можешь влиять на ситуацию и убрать раздражающий фактор, снижает "обезволивающее" влияние стресса. Примерно тот же эффект – повышенную чувствительность к неудачам и неспособность долго работать над задачей, если она не получается сразу, – вызывает вынужденное пребывание в переполненных помещениях [32], так что нынешний общественный транспорт, особенно метро, где одновременно и шумно, и многолюдно, – определенно не лучшая альтернатива личному автомобилю, что бы ни утверждали городские власти.
У людей с "плохими" вариантами "генов силы воли" острый стресс влияет на самоконтроль заметно сильнее
Хотя в стрессовой ситуации у всех людей запускаются одни и те же физиологические механизмы, поведенческая реакция – в том числе способность держать в узде свои порывы – может заметно различаться. То, насколько сильно человек растеряет силу воли под воздействием стресса, зависит от многих факторов. Если этот человек не выспался, утомлен и к тому же голоден, у него может попросту не хватить глюкозных ресурсов, чтобы противостоять соблазну наорать на капризничающего малыша. Но помимо внешних факторов потеря самоконтроля при стрессе очень во многом определяется внутренними компонентами – а именно генами. Люди с "неудачными" вариантами "генов самоконтроля", о которых мы говорили в главе 4, в стрессовых ситуациях ведут себя более импульсивно, чем обладатели "правильных" версий. Это неудивительно: многие из таких генов влияют как раз на работу лимбической системы и в том числе миндалины. При стрессе к ней переходит максимум полномочий, и "нехорошие" гены получают шанс проявить себя на всю катушку.
В одном из исследований ученые говорили добровольцам, что сейчас им придется выступить перед несколькими сотрудниками с речью о своей самой непривлекательной части тела. Рассказ будут записывать на камеру, а потом анализировать. На подготовку к выступлению участникам дали пять минут и оставили в комнате, где стояла подключенная к сети и готовая к работе камера – чтобы разбудить воображение и усилить стресс. Пока несчастные мучительно соображали, что же им говорить, испытуемые из другой группы наслаждалась успокаивающей музыкой. Через пять минут экспериментатор объявил, что по техническим причинам речь записывать не будут, поэтому можно сразу переходить к следующим заданиям – стандартным лабораторным тестам, в которых оценивалась склонность выбирать маленькую награду, но прямо сейчас, или приз побольше, но с задержкой. Кроме того, исследователи смотрели, как сильно участники, которым велели сортировать карточки с цифрами на три кучки, ускорятся, если за хороший результат пообещать им деньги. Этот параметр называется чувствительностью к вознаграждению, и он очевидным образом связан с активностью лимбической системы.
Оказалось, что люди с двумя "плохими" вариантами гена DRD2, который кодирует один из типов дофаминовых рецепторов, после подготовки к неприятному и стыдному выступлению становились намного более чувствительны к вознаграждению и предпочитали не ждать большую награду, а довольствоваться маленькой, зато сразу. Реакции носителей "нехороших" копий DRD2, слушавших музыку, не отличались от реакций людей с другими вариантами генов дофаминовых рецепторов, неважно, были ли они спокойны или пережили стресс [33]. Другими словами, средний по силе лабораторный стресс повлиял только на самоконтроль носителей двух "плохих" копий. Люди с другими генотипами пережили его без потерь – по крайней мере, без потерь силы воли. В реальной жизни носители двух "неправильных" аллелей DRD2 рискуют наломать дров в ситуациях, которые для остальных людей будут просто неприятным эпизодом. Скажем, если по дороге на работу носитель двух "плохих" копий DRD2 чудом увернулся от встречного автомобиля, высоки шансы, что на переговорах о зарплате он согласится на меньшую сумму, потому что она появится на карточке уже вечером, а дискуссии о дальнейшей прибавке надо вести еще некоторое время. Ну или за обедом он съест три пирожных – они дают нам чувство удовольствия, а после стресса такой человек к нему особенно чувствителен. В вентральном стриатуме обладателей "плохих" копий DRD2 рецепторов типа 2 меньше, чем у других людей, поэтому им в принципе требуется больше дофаминовой стимуляции, а стресс эту нужду дополнительно усиливает.
Те же авторы выяснили, что эффект знаменитого полиморфизма DRD2/ANKK1 A1 – того самого, который сначала принимали за вариант гена DRD2, а потом выяснили, что он относится к соседнему гену, не зависит от стресса. Носители этого варианта были одинаково импульсивны независимо от того, готовились ли к речи о своих недостатках или слушали музыку [34]. Эти результаты еще раз доказывают, что несдержанность может обусловливаться несколькими физиологическими механизмами, которые в разной степени модулируются стрессом. Поэтому два импульсивных человека в одной и той же нервной ситуации могут повести себя совершенно по-разному: один полностью потеряет самообладание, а второй будет действовать лишь чуть-чуть поспешнее обычного.
Хронический стресс, пусть и несильный, губительно сказывается на нашей способности контролировать порывы
Итак, даже относительно несерьезный повод понервничать способен подорвать нашу способность сдерживать порывы. Выделяющийся при стрессе кортизол тормозит ПФК и мешает ей контролировать миндалину. Результат – чрезмерно эмоциональные действия, которые, может, и позволяют справиться с текущими неприятностями (скажем, у вас сломался ноутбук, вы психанули и взяли кредит, чтобы немедленно купить новый), но идут вразрез с долгосрочными планами (теперь ближайшие полгода вам придется экономить на еде, чтобы выплачивать огромные проценты). А если вам еще и не повезло с "генами самоконтроля", малейшее потрясение может приводить к катастрофическим для кошелька, фигуры и жизненных планов последствиям. Но если никаких значимых событий, которые могут вывести вас из равновесия, не происходит? Так, мелкие неприятности, пусть и каждый день: сосед по лестничной клетке постоянно курит в общем тамбуре, на работе противно жужжит кондиционер, коллеги за соседним столом целыми днями громко обсуждают всякую ерунду, сын-подросток не моет за собой посуду, к тому же оставляя ее где попало. Казалось бы, это досадные пустяки, которые хоть и раздражают, но вряд ли способны серьезно повлиять на наши решения. Однако многочисленные исследования показывают, что это не так, и хронический стресс, пусть даже и вызванный "несерьезными" причинами ("Шумно в офисе? Да радуйся, что у тебя вообще есть работа!"), губителен для самоконтроля не меньше, чем действительно сильные потрясения.
Если вы не можете влиять на свою жизнь, способно ли это убить вас?
Психологи уверяют, что люди, лишенные возможности противостоять сыплющимся на них стрессовым воздействиям и в целом принимать решения о своей жизни, находятся в большой опасности. Если все идет по худшему сценарию, развивается так называемая выученная беспомощность – состояние, когда человек даже не пытается бороться за свои права и не делает попыток изменить ситуацию. Обычно выученную беспомощность иллюстрируют опытом с собаками, которых били током в запертых клетках. После нескольких дней экзекуции клетки открыли, но собаки не вылезали – они безучастно лежали в углу и вообще мало реагировали на внешние раздражители. У людей более мягкие варианты выученной беспомощности могут развиться в домах престарелых, военных училищах, тюрьмах и других местах, где все решения принимает начальство. В 1976 году психологи Джудит Родин из Йеля и Эллен Лангер из Гарварда объяснили обитателям одного из домов престарелых, что они по-прежнему вольны принимать решения касательно самих себя, и даже подарили по цветку, за которым ухаживали исключительно сами старички. Следующие 1,5 года (столько длилось наблюдение) эти бабушки и дедушки были здоровее и чувствовали себя намного более счастливыми, чем те, за кого все решал персонал. Более того, за 18 месяцев эксперимента умерло 30 % старичков из контрольной, т. е. несамостоятельной, группы. Среди тех, кому дали возможность самим принимать решения о свой жизни – пусть и небольшие, этот мир покинули только 15 % [35].Эта работа давным-давно стала классической – только самые ленивые авторы не цитировали ее в статьях и научно-популярных книжках про выученную беспомощность. К сожалению, интерпретаторы часто упрощают выводы исследования до примитивного "возможность поливать цветочек увеличивает шансы стариков прожить дольше". Сами Родин и Лангер куда менее категоричны в выводах, более того, они подчеркивают, что важен не цветок или кошка, а возможность принимать решения о собственной жизни. При этом количество таких решений и степень ответственности не должны быть чрезмерными. Ну и самое главное, приведенной в работе статистики (меньше сотни участников) явно недостаточно, чтобы делать однозначные выводы, особенно такие категоричные. Но теория все равно красивая – более того, позднейшие исследования доказывают, что невозможность влиять на собственную жизнь радикально снижает удовольствие от нее [36]. Даже если вы не в доме престарелых.
Хронический неустранимый стресс очень быстро истощает наши способности к самоконтролю. Когда исследователи сравнили школьников, живущих рядом с аэропортом Хитроу в Лондоне и в относительно тихих районах, выяснилось, что первые в целом хуже успевают – и, главное, раньше сдаются, если у них что-то не получается [37]. Ученые обнаружили, что за год наблюдений дети так и не смогли приспособиться к постоянному шуму от садящихся и взлетающих самолетов – несмотря на то, что школьники слышали рев двигателей тысячи раз, их организм реагировал на внезапный звук точно так же, как в первый день. В другом похожем исследовании было показано, что дети, живущие рядом с аэропортом, отличаются от сверстников повышенной неусидчивостью и гиперактивностью. В целом те, кто регулярно "наслаждается" шумом самолетов или машин на автостраде под окнами, ведут себя заметно хуже детей, растущих в тишине [38]. В огромном количестве масштабных популяционных исследований была выявлена связь между хроническим стрессом и риском наркотической зависимости – крайнего проявления проблем с самоконтролем [39 и ссылки внутри]. Особенно сильно хронический стресс влияет на детей и подростков: длительное насилие, как физическое или сексуальное, так и психологическое, заметно увеличивает шансы молодых людей начать употреблять запрещенные вещества. Но иногда стрессовое воздействие не выглядит таким уж страшным: скажем, развод родителей, холодность или отсутствие одного из них. Тем не менее исследования показывают, что даже такие вроде бы обычные ситуации подрывают самоконтроль, потому что они есть не что иное, как длительный и неустранимый стресс [40 и ссылки внутри]. Более того, каждый стрессовый фактор влияет на силу воли независимо: чем больше неприятных воздействий, в том числе длительных, тем выше риск тех или иных расстройств самоконтроля.
Шкала оценки психологического стресса PSM 25
Небольшой опросник, разработанный канадскими исследователями Луизой Лемир, Рэжаном Тессье и Лиз Фийон позволяет быстро оценить, насколько остро человек реагирует на стрессовые факторы, которые присутствуют в его жизни. Шкала PSM 25 оценивает, как сильно стресс сказывается на соматических (то есть телесных), поведенческих и эмоциональных реакциях. Ниже приведена русскоязычная версия шкалы [41].Инструкция. Дайте оценку вашему общему состоянию. Напротив каждого высказывания обведите число от 1 до 8, которое наиболее четко выражает ваше состояние в последние 4–5 дней.
Числа означают:1 – никогда;2 – крайне редко;3 – очень редко;4 – редко;5 – иногда;6 – часто;7 – очень часто;8 – постоянно.

Обработка методики и интерпретация результата. Подсчитайте сумму баллов по всем вопросам. Чем она больше, тем выше уровень стресса.
Шкала оценок:• меньше 99 баллов – низкий уровень стресса, свидетельствует о состоянии психологической адаптированности к нагрузкам;• 100–125 баллов – средний уровень стресса;• больше 125 баллов – уровень стресса выше среднего;• больше 155 баллов – очень высокий уровень стресса, свидетельствует о состоянии дезадаптации и психического дискомфорта, необходимости применения широкого спектра средств и методов для снижения нервно-психической напряженности, психологической разгрузки.
Интерпретация: Высокий уровень стресса – состояние выраженной нервно-психической напряженности, негативных эмоциональных переживаний, дезадаптации и психического дискомфорта. Наиболее характерны проявления стресса в субъективных переживаниях, поведении и нарушении физиологических функций:• Ощущение потери контроля над собой.• Дезорганизация продуктивности деятельности (рассеянность, принятие ошибочных решений, снижение работоспособности).• Вялость, апатия, повышенная утомляемость.• Расстройства сна (в том числе более долгое засыпание, раннее пробуждение).• Нарушения в эмоциональной сфере (раздражительность, снижение настроения, придирчивость, необоснованная критичность).• Нарушение аппетита.• Увеличение количества выпиваемого алкоголя.• Увеличение потребления психоактивных средств (успокаивающих или стимулирующих).• Расстройство половой функции.• Переживание психического дискомфорта и жалобы со стороны нервнопсихической сферы.• Нарушение продуктивности познавательных функций (снижение внимания, памяти, мыслительных процессов и др.).• Наличие физического дискомфорта и неприятных соматических ощущений (головная боль, боли в мышцах, спине, изжога, повышение давления).
Cтрессовая симптоматика может проявляться в следующих изменениях психического состояния.• В эмоциональной сфере – чувство эмоционального подъема или, наоборот, обострение тревоги, апатии, депрессии, эмоционального дискомфорта.• В когнитивной сфере – восприятие угрозы, опасности, оценка ситуации как неопределенной.• В мотивационной сфере – мобилизация сил или, напротив, капитуляция (избегание, уход от стресс-факторов), потеря мотивации и интересов.• В поведенческой сфере – изменение активности, привычных темпов деятельности, часто появление "зажатости" в исполнительных движениях.
Общее для этих изменений – сдвиг интенсивности процессов в соответствующей сфере в сторону увеличения или уменьшения.
Хронический стресс ломает механизмы, которые регулируют самоконтроль
Окончательного понимания, почему хронический стресс так сильно портит силу воли, у ученых пока нет. Но, похоже, дело в том, что при ответе на стресс организм задействует те же нейрофизиологические механизмы, которые вовлечены в регуляцию самоконтроля. Когда стрессовый фактор "работает" долго, организм не может расслабиться и нажать на тормоз парасимпатической нервной системы. В итоге в мозгу все время повышена концентрация кортизола, который активирует кортикомезолимбический тракт – как вы помните, именно вдоль него расположены зоны мозга, отвечающие за удовольствие и силу воли. Постоянное воздействие гормона стресса приводит к тому, что дофаминергические нейроны кортикомезолимбического тракта перестраивают свою работу, чтобы как-то существовать в режиме ненормальной активности.
Более того, у обезьян, которых выращивали в одиночных клетках, количество дофаминовых рецепторов было заметно ниже нормы. После того как животных вернули в социум (т. е. убрали стрессирующее воздействие изоляции), у доминантных зверей количество дофаминовых рецепторов резко увеличилось. А вот у обезьян, которые не сумели приспособиться и заняли подчиненную позицию, плотность рецепторов так и осталась низкой. Доминантные особи, в полном соответствии со своим положением, регулярно обижали и притесняли подчиненных, превращая их жизнь в сплошной стресс. Как вы помните, у людей сниженное количество рецепторов часто приводит к расстройствам самоконтроля и всевозможным зависимостям. У обезьян все точно так же: когда добрые исследователи подсовывали затюканным и униженным подчиненным особям кокаин, те моментально начали "торчать" [42]. Доминантные животные тоже не брезговали наркотиком, но употребляли его гораздо меньше и никогда не становились наркоманами.
У находящихся под воздействием хронического стресса животных обнаруживается еще одна важная особенность: их дофаминовая система становится гиперреактивной [43]. Стимул, который в норме заставляет дофаминергические нейроны выбрасывать, условно, сто молекул нейромедиатора, у постоянно стрессированных зверей приводит к выбросу трехсот. Неудивительно, что в таком состоянии животные легко подсаживаются на "вещества". Из-за сниженной плотности рецепторов им в целом не хватает удовольствия от жизни, а гиперреактивность дофаминовой системы делает эффект от каждой дозы куда более ощутимым. Животные с нормальной плотностью рецепторов, которые работают в обычном режиме, не нуждаются в дополнительной подпитке системы поощрения, поэтому для них риск всевозможных расстройств самоконтроля ниже. На людях подобных опытов не проводилось, но можно предположить, что хронический стресс действует на мозг человека примерно так же. Природа изобрела механизмы стресса очень давно, и они работают похожим образом что у крыс, что у людей. При этом постоянно высокие концентрации кортизола влияют как на древние, так и на относительно новые зоны мозга вроде неокортекса. Как мы говорили в главе 3, новая кора появилась у млекопитающих, но в полную силу вошла у приматов, и особенно у Homo sapiens. От других животных человека отличает невероятно разросшаяся "самая умная" часть неокортекса – префронтальная кора. И стресс, если он действует достаточно долго, ощутимо портит ее работу.
Более того, хронический стресс физически меняет структуру необходимых для проявления силы воли областей мозга. Миндалина крыс, которых каждый день запихивали в тесные клетки (один из самых популярных способов вызывать стресс у экспериментальных животных), заметно прирастала новыми дендритами – отростками нейронов, при помощи которых они связываются с соседями [44]. При этом в их медиальной ПФК количество дендритов падало41. Меньше дендритов – меньше скорость обмена информацией и активность ПФК. "Упрощение" префронтальной коры и рост влияния миндалины отчетливо проявлялись в поведении: крысы, которых постоянно мучили, заметно хуже справлялись с заданиями, требующими долго фиксировать внимание на какой-то одной задаче, т. е. сдерживать порыв отвлечься [45]. Когда ученые переставали регулярно мучить животных, строение части измененных стрессом зон возвращалось к норме. Однако чем старше были грызуны, тем хуже восстанавливался их мозг. Наименее пластичной с возрастом становится префронтальная кора [46]. Таким образом, стресс, если он долго не проходит, в буквальном смысле лишает организм способности противостоять соблазнам и планировать свою жизнь – ломая инструмент, при помощи которого мозг это делает.
Еще одна способность, которая страдает, когда организм постоянно находится под воздействием стрессора, – это способность запоминать новую и извлекать из долговременной памяти старую информацию. У крыс, которых ежедневно на два часа бросали в заполненную водой клетку, уже через месяц заметно ухудшалась рабочая память. Как вы помните, для того, чтобы контролировать свои порывы, нужно одновременно удерживать в мыслях довольно много соображений (хотя если ты крыса, то эти соображения не оформляются в слова), а чем меньше объем рабочей памяти, тем сложнее это делать. Когда ученые посмотрели, что творится в головах стрессированных крыс, оказалось, что в их префронтальной коре заметно снизился дофаминовый трафик. Когда крыс мучили водяными клетками всего неделю, количество циркулирующего в ПФК дофамина, наоборот, увеличивалось. То есть острый стресс проявляется в избыточном выбросе нейромедиатора, который снижается, когда стрессовое воздействие исчезает. Если дофаминовый наплыв не проходит долгое время, рецепторы изо всех сил пытаются подстроиться под новые условия: при хроническом стрессе они все время активированы но не справляются с потоком нейромедиатора [47]. Кроме того, у крыс, которых в течение трех недель на три часа в день отсаживали из общего вольера в крошечную клетку, изменялась структура гиппокампа – главного "ответственного" за память. У части нейронов отмирали дендриты. Итог – проблемы с обучением и запоминанием [48].
Способен ли гиппокамп восстанавливать свою структуру после того, как длительный стресс заканчивается, пока неясно. Однако результаты небольшого исследования на людях указывают, что ответ на этот вопрос скорее "нет". Ученые сравнили анатомию мозга женщин, которые постоянно переживают из-за чего-то, с теми, кто считал, что в их жизни все спокойно. И оказалось, что у первых значительно меньше объем гиппокампа и орбитофронтальной коры42 – той самой, которая намертво переплетена с вентромедиальной ПФК, мозговым "фильтром", сдерживающим порывы лимбической системы [49]. Так что вполне вероятно, после десяти лет нелюбимой работы или опостылевшего брака вам будет существенно сложнее одновременно рассматривать много доводов "за" и "против" чего-то. А значит, вы будете чаще совершать поступки, выгодные сейчас, но вредные в будущем – например, смотреть сериалы вместо того, чтобы ходить в спортзал, или все время откладывать занятия английским, хотя он необходим для продвижения по службе.
Наконец, стресс изменяет схему выброса глутамата – основного активатора мозга. Когда организм сталкивается с острым стрессом, количество глутамата в лимбической системе, гиппокампе и ПФК быстро растет – там происходит мощный выброс нейромедиатора. Если нервирующее воздействие долго не исчезает, то, по до конца не ясным причинам, концентрация глутамата в ПФК, наоборот, падает [50].
Итак, жизнь в постоянном напряжении не просто дискомфортна. Она серьезно изменяет работу и даже структуру мозга, и это состояние не лечится популярным народным методом "Отдохни – и все пройдет". Не исключено, что некоторые изменения сохранятся на всю жизнь, и изрядная их часть уменьшает наши возможности контролировать порывы.
Хронический стресс сбивает тонкие настройки регуляции организма
Наш организм – совершенная система, которая замечательно приспосабливается к изменениям окружающей среды. Для того чтобы внезапные перепады внешних параметров не нарушали тонкие функции организма, большинство процессов в наших телах регулируются по принципу отрицательной обратной связи. Если какое-то действие начинает происходить слишком активно, включаются механизмы, которые его приглушают. Эта кнопка безопасности срабатывает и при длительном воздействии стрессовых факторов: когда педаль газа гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) нажата слишком долго, организм пытается снизить вредное воздействие стрессового ответа и уменьшает количество рецепторов к глюкокортикоидам (вырабатываемые корой надпочечников стероидные гормоны, к которым относится и кортизол; активно вовлечены в стрессовый ответ), в том числе в префронтальной коре [51]. Но так как стрессовый фактор не исчезает (скажем, вы продолжаете работать на той же нервной работе или жить с партнером, с которым постоянно ругаетесь), мера, которая призвана спасти участвующие в стрессовом ответе системы от истощения, вызывает разрушительный эффект. Кратковременная активация ГГНС помогает организму собраться, чтобы противостоять повреждающему фактору. Слишком длительная активация разрушает организм, который не может все время работать в экстренном режиме. Но, ослабляя ГГНС, организм лишает себя защиты собственно от стрессового воздействия. Если напряжение не проходит очень долго, механизм регуляции по принципу обратной связи ломается, и тогда стрессовый ответ окончательно выходит из-под контроля. Живя под воздействием хронического стресса, мы попадаем в цугцванг, когда все выходы из ситуации – держать ГГНС активной, выключить ее или отключить обратную связь – плохи. Все, кроме одного: изменить ситуацию и убрать из жизни вредный фактор.
Наш организм эволюционно не приспособлен к длительному стрессу
В этом месте знакомый с основами эволюционной теории читатель может спросить: "Как вышло, что столь разрушительная реакция организма на длительный стресс в принципе сохранилась? Люди с такой непродуктивной физиологией должны были давно вымереть". Возражение логичное, но в данном случае неприменимое. Наш организм отлично приспособлен к ответу на кратковременный стресс, потому что он был обычным делом на протяжении миллионолетней истории наших предков. Нападения тигров и врагов из другого племени, стычки с собственными соплеменниками, голод из-за того, что мужчины не смогли убить мамонта, резкое похолодание, затопление родной пещеры и тому подобные события случались довольно часто. Но каждое из них длилось не очень долго – от нескольких минут до нескольких недель. Наши предки не ездили в метро два раза в день по 40 минут, не изнывали десятилетиями на опостылевшей работе, не терпели ненавистного супруга, "потому что развод травмирует детей". Длительный стресс появился в жизни человека, по меркам эволюции, совсем недавно: каких-нибудь несколько тысяч лет назад. За столь короткий срок вид Homo sapiens не мог успеть перестроить свои физиологические особенности. Кроме того, длительный стресс убивает нас довольно медленно, оставляя возможность размножиться и передать детям "вредные" гены, которые обеспечивают реализацию стрессовых реакций43. Иными словами, даже если наши далекие предки все же страдали от хронического стресса, эволюцию это не интересовало. Логика проста: если организм в состоянии завести и вырастить достаточное количество детей, значит, его физиология достаточно хороша и менять ее не нужно. А невыносимые страдания организма эволюцию не интересуют.
Работ, в которых бы сравнивался базовый уровень кортизола у племен, сохранивших доисторический образ жизни, и современных людей, мне найти не удалось. Но можно предположить, что у наших предков гормона стресса в среднем было меньше, чем у нас. Уровень кортизола подскакивал на охоте или во время драк, но эти события случались не так уж часто. Например, бушмены из пустыни Калахари тратят на интенсивные и потенциально опасные занятия вроде охоты в среднем около четырех часов в день, а остальное время занимаются рутинным трудом по хозяйству или отдыхают. Учитывая, что каменные орудия, с которыми можно охотиться на крупных зверей, Homo habilis изобрели около 3 млн лет назад, а сельское хозяйство, радикально изменившее традиционный уклад жизни, появилось примерно 12 тысяч лет назад, 99,9 % времени существования человечества наши предки жили примерно как калахарские бушмены. А промышленная революция, давшая нам вредные для здоровья заводы, душные офисы и автомобили с пробками, и вовсе случилась 200 лет назад. Поэтому не стоит удивляться, что наш организм так плохо реагирует на длительный стресс.
В условиях хронического стресса генетическая память о постоянном голоде заставляет нас непрерывно есть
На самом деле у организма есть способ бороться с хроническим стрессом. Точнее, с одним видом хронического стресса, а именно голоданием. На всем протяжении истории человечества нехватка пищи была обычным делом, и поколение за поколением выживали преимущественно те представители рода Homo, чей организм был лучше приспособлен к длительному недоеданию. Голод – мощный триггер, который запускает стрессовый ответ, в том числе увеличивает концентрацию кортизола. Через несколько дней вынужденной диеты гипоталамус наших предков начинал в больших количествах производить вещество под названием нейропептид Y. Эта коротенькая молекула обладает мощным анксиолитическим, т. е. противострессовым эффектом, но одновременно вызывает чувство голода и снижает активность всех систем организма. То есть нейропептид Y, с одной стороны, затормаживал голодающего пещерного человека, чтобы он перестал бегать и попусту расходовать энергию, но с другой – подстегивал чувство голода, не давая ему забыть, что нужно срочно раздобыть что-нибудь съестное. Крысы, которым вводили нейропептид Y, становились очень спокойными и совсем не нервничали, когда их вынимали из теплых клеток и оставляли на открытом пространстве. Обычно такая манипуляция вызывает у животных настоящую панику [52]. Правда, такие крысы начинали поедать все, что попадалось им на глаза, толстея в два раза за несколько недель [53]. Стремясь уберечь хозяина от будущего голода, нейропептид Y еще и заставляет организм откладывать полученные наконец калории на животе [54].Стимулом к выбросу нейропептида Y служит длительное повышение концентрации кортизола, причиной чего у обитателей пещер, не в последнюю очередь был голод. Когда наши предки, подстегиваемые нейропептидом Y, находили орехи или ловили какую-нибудь косулю, голод отступал и уровень кортизола падал. У современных людей высокий уровень гормона стресса – едва ли не норма, но причина этого состояния вовсе не в отсутствии еды. Однако воспитанный многолетней нехваткой пищи организм не знает об этом и пытается спасти от стресса офисных сотрудников, выделяя нейропептид Y. Итог: постоянно нервничающие жители мегаполисов все время хотят есть и поглощают чудовищное количество калорий. Расползающаяся талия заставляет их нервничать еще больше, старательный гипоталамус "успокаивает" несчастных нейропептидом Y, есть хочется все сильнее, на очередном ремне кончаются дырки, от расстройства человек идет в кондитерскую – и так до бесконечности. Выход все тот же: избавить себя от постоянного стресса. Любые другие меры вроде спортзала или липосакции способны лишь устранить симптомы, но коварный нейропептид Y по-прежнему будет заставлять вас хотеть есть и страдать.
У людей с "неправильными" вариантами "генов самоконтроля" разрушительные эффекты стресса еще более выражены
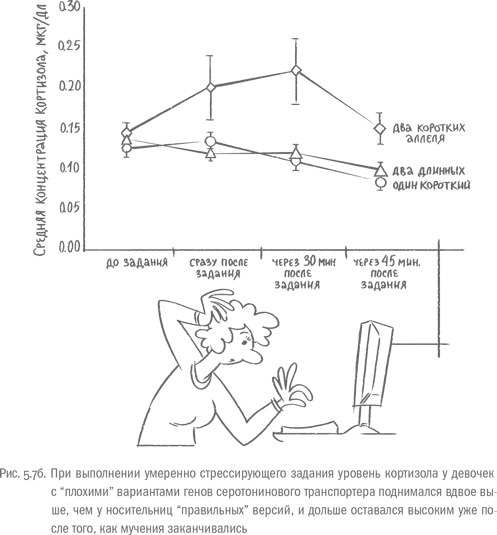
Длительный стресс расшатывает важнейшие системы организма у всех людей. Но один и тот же фактор, скажем, постоянные конфликты на работе, одного человека доведет до больницы за пару месяцев, а другой сможет более или менее нормально функционировать несколько лет. То, насколько выраженной у человека будет реакция на стресс, и, соответственно, как сильно она навредит организму, если затянется, зависит от генов. И оказалось, что на интенсивность стрессового ответа очень мощно влияют варианты "генов самоконтроля", о которых мы говорили в главе 4. Например, небольшой участок под названием 5-HTTLPR, который регулирует активность гена транспортера серотонина – тот самый, что отличается по длине у разных людей. После того как девочки, в ДНК которых было два "плохих" (коротких) варианта этого гена, выполняли умеренно стрессирующее задание в лаборатории44, уровень кортизола у них подскакивал вдвое по сравнению с участницами, несущими длинные варианты. После окончания экзекуции у обладательниц длинных версий 5-HTTLPR уровень кортизола быстрее возвращался к норме, чем у носительниц коротких вариантов [55].
Короткие варианты серотонинового транспортера повышают риск всевозможных хронических болячек у безработных женщин [56]. Длительная безработица – мощный стрессовый фактор, но обладательницы "плохих" версий 5-HTTLPR из-за повышенного уровня кортизола и в целом более сильной реакции на эту, безусловно, нервную ситуацию рискуют довольно быстро обзавестись еще и проблемами со здоровьем. Недомогания разной степени тяжести дополнительно усиливают стресс, и разрушительная спираль раскручивается все быстрее. Еще одно типичное следствие умеренных, но постоянных стрессовых воздействий (т. е. обычной жизни) у носителей коротких версий серотонинового транспортера – депрессия [57]. Люди, у которых есть те или иные проблемы с метаболизмом серотонина, и так больше подвержены этому заболеванию, но хронический стресс служит мощным триггером. Самоконтроль при длительном стрессовом воздействии у носителей двух коротких версий 5-HTTLPR страдает вдвойне: этот генотип сам по себе ослабляет силу воли, а при стрессе наши возможности держать в узде порывы особенно ухудшаются. К тому же в норме серотонин усиливает регуляцию по принципу отрицательной обратной связи при кратковременной активации ГГНС. Поэтому неудивительно, что при длительном стрессе расстройства серотониновой системы дают такой впечатляющий эффект: раскручивание разрушительного стрессового ответа ничем не сдерживается.
Еще один "ген самоконтроля", который делает воздействие хронического стресса более опасным, – это ген моноаминоксидазы А (МАОА), фермента, уничтожающего "лишние" нейромедиаторы класса моноаминов, в том числе дофамин, серотонин и адреналин. Мы обсуждали, что мужчины с малоактивной версией МАОА отличаются повышенной агрессивностью, особенно если в детстве они подвергались физическому или психологическому насилию. Ген МАОА "сидит" на X-хромосоме, поэтому у девочек с дефектной версией есть "страховочный" вариант. Но оказалось, что обладатели малоактивного фермента отличаются от мужчин с нормальной версией не только в ситуациях, провоцирующих агрессию. При длительном стрессе, вызванном, например, уходом за тяжелобольными родственниками, они хуже спят и чаще страдают от хронических болезней и депрессий, которые, к тому же, быстрее развиваются. Даже рак и сердечно-сосудистые проблемы у носителей малоактивной версии MAOA в такой ситуации наблюдаются чаще. При этом уровень кортизола у мужчин – носителей "плохой" версии заметно ниже, чем у обладателей нормального варианта. Кроме того, у них сбит суточный цикл этого гормона.
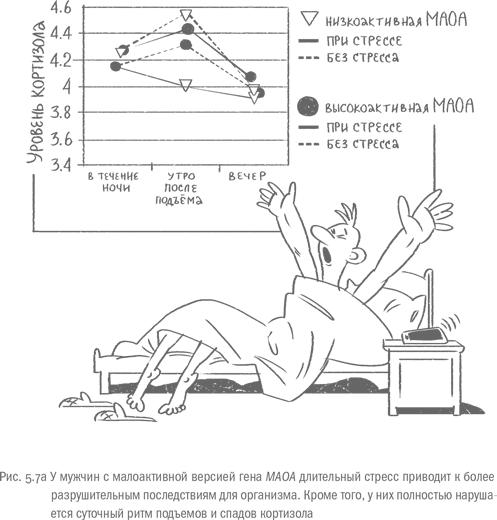
В спокойные времена уровень кортизола выходит на максимум утром, примерно через 30минут после пробуждения. В течение дня и ночи концентрация гормона стресса снижается, чтобы опять подскочить после звонка будильника. Кратковременный стресс вызывает внеплановый скачок кортизола, но затем все возвращается к норме. При длительном стрессе общий уровень кортизола возрастает, однако его динамика остается примерно той же: утреннее повышение, а затем – плавное снижение. У мужчин с малоактивным геном MAOA, которые вынуждены месяцами заботиться о больных родственниках, нет утреннего пика кортизола. Наивысшие показатели по этому гормону наблюдаются ночью, но и они заметно уступают пику носителей "правильной" версии гена. Авторы исследования, которые обнаружили эту аномальную динамику, полагают, что при длительном стрессе ГГНС обладателей малоактивного фермента истощается и выходит из строя. Моноамины регулируют многие параметры ответа на стресс, и при несвоевременной утилизации этих нейромедиаторов начальная встряска ГГНС может оказаться чрезмерной. В первые недели стресса организм носителей малоактивной моноаминоксидазы А реагирует на стресс излишне бурно, и если стрессовое воздействие продолжается, "перегревшаяся" ГГНС отключается. Итог – многочисленные болячки, которые поражают лишенный защиты организм [58].
Другие "гены самоконтроля" тоже могут не лучшим образом проявить себя при стрессе. Например, те из них, что управляют метаболизмом тормозного нейромедиатора ГАМК. В одной из работ было показано, что определенные варианты генов рецептора к ГАМК увеличивают риск наркотической зависимости у людей, которые в детстве пережили крайний вариант стресса – физическое или жестокое психологическое насилие. Другие варианты тех же генов, наоборот, служили защитой: их носители реже становились наркоманами, даже если детьми подверглись насилию [59]. "Неправильные" гены рецепторов к ГАМК – фактор риска для силы воли и у людей, которые выросли без серьезных потрясений [60]. Детская травма срабатывает как триггер, который "срывает чеку" и превращает просто "нехорошие гены" в бомбу, которая разрывает самоконтроль в клочья.
Вычислить все гены, разные варианты которых влияют на интенсивность и длительность стрессового ответа, пока невозможно: для таких исследований нужны гигантские выборки, плюс важно учитывать влияние факторов окружающей среды, многие из которых неизвестны. Но существующие работы показывают, что вклад генотипа и неблагоприятных воздействий среды, особенно в раннем детстве, могут заметно влиять, например, на такой ключевой фактор стрессового ответа, как базовый уровень кортизола [61 и ссылки внутри].
Восприятие стрессирующих событий как особенно тяжелых увеличивает вред, который наносит организму хронический стресс
На самом деле все еще сложнее, и хитрое переплетение GxE дополнительно модифицируется субъективным восприятием тех или иных событий. Хотя базовый ответ на потенциально опасное событие в большой степени предопределен генетически, "долгоиграющие" последствия хронического стресса зависят от того, насколько тяжелой человек считает сложившуюся ситуацию. В 2012 году ученые из Висконсинского университета в Мэдисоне проанализировали данные масштабного многолетнего исследования здоровья американцев, в котором в числе прочих показателей оценивались уровень хронического стресса и степень восприятия неприятных событий как особенно тяжелых и вредящих здоровью. Специалисты проанализировали ответы сотен тысяч человек – уникальное с точки зрения выборки исследование. Оказалось, что длительный стресс сам по себе не увеличивал риск преждевременной смерти45. Но если люди, долго живущие в состоянии стресса, сообщали, что считают такую ситуацию опасной для здоровья, риск умереть раньше срока для них повышался на страшные 43 % [62].
Авторы связывают такое колоссальное повышение рисков с общим восприятием жизни у людей, которые особенно сильно беспокоятся, что стресс подрывает их здоровье. Чаще всего такие люди – пессимисты, а пессимизм, как и другие типы темперамента, здорово зависит от генов. Всех генетических предпосылок, которые определяют, будут ли происходящие события восприниматься в основном как негативные или как позитивные, ученые пока не знают. Но некоторых виновных они отыскали, и удивительным образом (на самом деле нет) со многими из них мы как следует познакомились в предыдущих главах.
"Гены самоконтроля" отчасти определяют, насколько тяжелым будет казаться человеку стресс
Например, даже один "плохой" (т. е. короткий) вариант серотонинового транспортера (полиморфизм 5-HTTLPR) может существенно сдвинуть личностные показатели на шкале пессимизм – оптимизм в сторону пессимизма. Обладатели одной или двух коротких версий чаще носителей длинных вариантов беспокоятся по пустякам, в целом склонны видеть мир в черном свете и считать, что стакан скорее наполовину пуст [63]. Правда, в некоторых других исследованиях обнаружить корреляцию между разными версиями гена серотонинового транспортера и темпераментом не удалось. Это не странно: темперамент – очень сложная характеристика, и было бы наивно ожидать, что она определяется каким-то одним или даже несколькими полиморфизмами. Но если разобрать типичные качества пессимиста (они определяются при помощи специальных личностных опросников), окажется, что многие из них перекликаются с типичными качествами невротика и/или человека с повышенной тревожностью. Например, создатель одного из самых популярных личностных опросников – трехфакторного опросника Tridimensional Personality Questionnaire Клод Роберт Клонингер, сопоставляя ответы множества людей, выяснил, что испытуемые, которые набирают много баллов по шкале "избегание вреда", чаще всего пессимисты, которые страшатся будущего [64]. А это и другие "невротические" качества, как мы обсуждали в предыдущих главах, завязаны на работу серотониновой и дофаминовой систем. Скажем, то же "избегание вреда" заметно более выражено у людей с "нетрадиционными" вариантами гена рецептора серотонина типа 3 HTR3A [65]. Миндалина носителей таких версий гена работает заметно активнее, чем у обладателей более популярной разновидности, что приводит к более сильному эмоциональному ответу на любые события [66]. И эмоции эти в первую очередь отрицательные, так как главная специализация миндалины – негативные чувства, особенно страх.
Во многом именно из-за чрезмерно активной миндалины (а, скорее всего, и других нейрофизиологических причин, которые ученые пока не обнаружили) склонные к пессимизму люди чаще оценивают происходящие с ними неприятности как нечто ужасное. Такое видение ситуации усугубляет негативное воздействие стресса, а значит, работа ПФК последовательно угнетается, зато миндалина получает все бо́льшую свободу. Очередной порочный круг планомерно разрушает здоровье и ухудшает способность контролировать порывы. Поддавшись импульсу, человек чаще совершает неправильные, пусть и приятные сейчас, поступки, но последствия таких действий заставляют ужасаться и еще больше нервничать. Возможно, именно из-за этой гадкой закономерности работы нашего мозга родилось представление о том, что оптимистам всегда везет и вообще они здоровее. Похоже, они действительно здоровее, особенно когда живут в состоянии длительного стресса. И под давлением у них лучше получается держать в узде сиюминутные стремления.
Личностный опросник, определяющий, пессимист вы или оптимист
Было бы логично разместить в этом месте тест, определяющий, каких черт в вашем характере больше, оптимистичных или пессимистичных. В интернете можно найти множество простых тестов, но их результаты нельзя считать достоверными, так как оптимизм и пессимизм связаны с другими чертами личности и оценить их отдельно невозможно. Самый востребованный у исследователей опросник – MMPI, или Миннесотский многоаспектный личностный опросник – состоит из 566 вопросов (причем они разные для мужчин и женщин). Хорошая новость в том, что в сети есть сокращенные варианты MMPI, которые позволяют относительно быстро оценить основные черты личности. Однако для того, чтобы составить полную картину, стоит пройти оригинальную версию теста у профессионального психолога.
Стресс, который случился в "нужное" время, может радикально ухудшить самоконтроль
Итак, стресс, как острый, так и хронический, очень сильно влияет на нашу способность контролировать свои желания. При остром стрессе временно подавляется работа ПФК, и падкая на соблазны лимбическая система получает полную свободу. Хронический стресс изменяет работу и даже архитектуру мозга так, что лимбическая система постоянно берет верх. Но, оказывается, все еще сложнее, и "антиволевой" эффект стресса зависит от времени, когда происходили тяжелые события: в детстве или в зрелом возрасте. Учитывая все то, о чем мы говорили выше, нетрудно догадаться, что очень сильный острый или умеренно сильный хронический стресс, который случился, когда человек был ребенком, влияют на самоконтроль намного сильнее, чем неприятности, свалившиеся на взрослого.
Для силы воли ребенка чрезвычайно опасен стресс, который испытала его мама во время беременности
Более того, в безволии мальчика или девочки может быть виноват стресс, который пережила их мама, вынашивая ребенка. Эксперименты на животных показывают, что единичные или повторяющие стрессовые ситуации во время беременности, как и положено, активируют гипоталамо-гипофизарно-надпочечниковую систему (ГГНС) и увеличивают выработку глюкокортикоидов (у крыс, "человеческого" кортизола нет) [67]. Глюкокортикоиды проникают сквозь плаценту и "взвинчивают" ГГНС плода, заставляя ее стимулировать выброс собственных глюкокортикоидов. Причем ГГНС эмбриона работала на повышенных оборотах даже тогда, когда экспериментаторы оставляли крыс в покое и давали им спокойно доносить беременность [68]. Другими словами, если мама сильно переживает, то ее нерожденный ребенок в утробе тоже начинает нервничать – на физиологическом уровне, хотя понятия не имеет, что происходит снаружи.
Активация ГГНС эмбриона – не единственное последствие избытка гормонов стресса в крови беременной. Глюкокортикоиды необходимы организму не только для того, чтобы реагировать на потенциально опасные события. Эти гормоны помогают созревать некоторым тканям и органам, в частности, без них не могут правильно формироваться легкие. По этой причине глюкокортикоиды часто прописывают беременным с риском преждевременных родов, причем нередко врачи назначают сразу несколько курсов, чтобы досрочно появившийся на свет младенец мог нормально дышать. Однако в последние годы ученые, работающие с животными, выяснили, что повышенная концентрация глюкокортикоидов в крови матери изменяет нормальный путь развития мозга. Причем влияют как эндогенные, т. е. спровоцированные стрессом глюкокортикоиды, так и содержащие их препараты. У эмбрионов крысят, матери которых получали синтетические глюкокортикоиды, нейроны позже обычного оформлялись до взрослого состояния, нервные пути дольше оставались без миелинового покрытия, "строительство" глиальных клеток и сосудов запаздывало по сравнению с нормальным расписанием. Все вместе эти изменения приводили к тому, что у детенышей иначе формировался мозг и в целом хуже образовывались новые нервные клетки [69].
Наконец, в гиппокампе таких крысят было меньше рецепторов к различным гормонам стресса. В норме гиппокамп снижает реакцию организма на стресс по все тому же принципу отрицательной обратной связи: если глюкокортикоидов слишком много и они оккупируют вакантные места на большом количестве рецепторов, он "понимает", что ГГНС чересчур разошлась и ее нужно притормозить. Когда гиппокамп обеднен рецепторами, для того, чтобы его "разбудить", нужно существенно больше гормонов стресса. Таким образом, если в гиппокампе мало рецепторов к гормонам стресса, гипоталамо-гипофизарно-надпочечниковая система получает невиданную свободу, а организм – постоянно повышенную концентрацию глюкокортикоидов. На любое потенциально опасное воздействие перевозбужденная ГГНС крысят отвечала повышенным выбросом кортикостерона – аналога кортизола у грызунов. То, что все эти эффекты – именно результат работы гормонов стресса, было доказано в опытах на крысах с удаленными надпочечниками. Даже если во время беременности таких крыс регулярно запирали в крошечную клетку, у крысят не было обычных для детенышей стрессированных мам нарушений. Но если крысам с удаленными надпочечниками перед тем, как засунуть их в "тюрьму", вводили глюкокортикоиды, крысята вели себя так же, как отпрыски обычных запуганных экспериментаторами крыс [70]. То есть были излишне эмоциональны и чересчур остро отвечали на любой стресс.
Среди многочисленных изменений, которые происходят в организме детеныша в ответ на воздействие материнских гормонов стресса, стоит отметить вот что: в миндалине крысят растет количество кортиколиберина. Как вы помните, этот гормон гипоталамуса, который сокращенно называют КРГ, запускает в гипофизе синтез адренокортикотропного гормона (АКТГ). А уже он заставляет надпочечники выбрасывать кортизол и другие глюкокортикоиды. Другими словами, КРГ – это такой спусковой крючок развития стрессового ответа, и его синтезирует не только гипоталамус, но и миндалина. В главном регионе мозга, который отвечает за эмоции, много рецепторов к КРГ и окончаний кортиколибериновых нервных путей, по которым гормон проникает сюда. Штатная комплектация мозга предусматривает, что работа миндалины при стрессе регулируется в том числе при помощи кортиколиберина: чем его больше, тем эмоциональнее мы переживаем происходящее. Ученые полагают, что гиперпродукция КРГ в миндалине детенышей, чьи матери во время беременности подвергались стрессу, – одна из причин их повышенной эмоциональности вообще и при стрессе в частности [71]. В нервных ситуациях кортиколиберин дополнительно стимулирует миндалину, с которой и так при стрессе снимаются тормоза. Кроме того, крысята, рожденные от стрессированных матерей, хуже учатся; особенно это проявляется в зрелом возрасте. Как полагают ученые, такая особенность связана с тем, что в ответ на стресс в гиппокампе эмбриона – области, отвечающей за память, хуже образуются новые нейроны.
Наконец, крысята матерей, которые нервничали во время беременности, склонны к импульсивности и легко впадают во всевозможные зависимости, даже несмотря на то что они крысы [72]. Причины зависимости – спровоцированные глюкокортикоидами нарушения в дофаминовой системе. В прилежащем ядре, важнейшей части системы поощрения, крысят, матери которых переживали хронический стресс, часть дофаминовых рецепторов связывала нейромедиатор лучше, а другая часть – хуже, чем в норме [73]. У детенышей макак-резусов, чьих беременных матерей пять раз в неделю доставали из уютных вольеров и сажали в темную клетку, где включали колонки, орущие с громкостью пескоструйного аппарата, несколько отделов мозга были заметно гуще покрыты транспортерами дофамина DAT (помните, в главе 4 мы выяснили, что генетически обусловленные изменения в работе этого белка – одна из типичных причин слабоволия). Например, в вентральном стриатуме, который также входит в систему поощрения и "поставляет" дофамин во все остальные ее части, количество транспортеров вырастало на 15 % [74]. Стресс во время беременности влияет и на вторую ключевую для силы воли систему – серотониновую. В многочисленных исследованиях было показано, что у крысят и мышат, рожденных от матерей, которых всячески тормошили, когда они были в положении, серотониновые рецепторы распределены иначе, чем обычно, а их "хватка" отличается от нормальной [75]. Наконец, у животных, которые пережили стресс в утробе матери, хуже работает триптофангидроксилаза – фермент, производящий серотонин из аминокислоты триптофана [76]. Меньше серотонина – меньше самоконтроля, выше склонность к депрессиям и другим расстройствам, связанным с недостатком радости в форме нейромедиатора.
Материнский стресс влияет на самоконтроль будущего ребенка и у людей
Как вы помните, общая беда всех исследований на человеке – невозможность провести такие же точные и скрупулезные эксперименты, как на животных. Тем более что очень часто в таких экспериментах приходится вскрывать подопытным голову. А напрямую переносить результаты, полученные на мозге крыс или даже шимпанзе, на Homo sapiens можно только с оговорками: все же наш мозг слишком отличается. А в случае с пренатальным стрессом – так ученые называют стресс, который эмбрион переживает, находясь в матке, – ситуация осложняется еще большим количеством этических запретов. Тем не менее кое-какие выводы сделал уже наблюдательный Гиппократ: он отмечал, что будущей маме очень важно быть спокойной, иначе у ребенка будут проблемы. А в Китае тысячу лет назад создали специальный "санаторий" для беременных ровно для того, чтобы ничто не могло их потревожить. По оценкам современных ученых, стресс, который мама перенесла, вынашивая ребенка, "дает" почти 15 % всех его эмоциональных проблем [77].
И данные, которые все же удалось собрать – исключительно гуманными и неинвазивными методами, указывают на возможный механизм этого эффекта. Если мама во время беременности сталкивается с сильным и/или постоянным стрессом, мозг ее ребенка будет работать не совсем так, как мозг малыша, мама которого во время беременности не переживала стресс. Кроме того, он будет меньше по размерам [78], а сам малыш, если его посадить за стол с зефиркой, с большой вероятностью съест ее, не дожидаясь экспериментатора со второй вкусняшкой. То есть он будет хуже сдерживать сиюминутные желания.
Кажется странным, но при беременности гипоталамо-гипофизарно-надпочечниковая система (ГГНС) куда активнее, чем в обычном состоянии [79]. Более того, чем больше срок беременности, тем выше в крови женщины концентрация кортизола: к третьему триместру она возрастает втрое [80]! ГГНС дополнительно стимулируется плацентой, которая во втором и третьем триместре в больших количествах выделяет кортиколиберин (КРГ). Чем больше в крови кортизола, тем активнее плацента выбрасывает КРГ, раскручивая тем самым спираль на этот раз положительной обратной связи. Однако после того как беременность переваливает через экватор, экстремально высокие концентрации кортизола начинают подавлять ГГНС – это адаптивная реакция организма, которая не дает ему убить себя чрезмерным откликом на стресс. При этом плод губительного воздействия кортизола не ощущает: фермент плаценты под названием 11-бета-гидроксистероиддегидрогеназа типа 2, или сокращенно 11β-HSD2 в режиме онлайн превращает опасный кортизол в безвредный кортизон. Если беременность протекает спокойно, 11β-HSD2перерабатывает до 90 % всего кортизола. Но если мама сталкивается со стрессом, защитный фермент перестает справляться, и эмбрион получает кортизоловый "передоз". Более того, чем больше мама нервничает, скажем, из-за того, что боится потерять работу после декрета, тем сильнее падает активность 11β-HSD2 [81]. Иначе говоря, для младенца опасно не столько само стрессовое воздействие, сколько реакция мамы на него – до определенных пределов ее вполне можно контролировать46.
Самое явное последствие материнского стресса – сдвиг базовой линии активности гипоталамо-гипофизарно-надпочечниковой системы ребенка. Дети, мамы которых нервничали во время беременности или лечились глюкокортикоидами, реагируют на стресс более бурно, чем их сверстники, рожденные спокойными матерями. ГГНС таких детей выбрасывает больше гормонов в ответ на тот же стимул, причем этот эффект сохраняется как минимум до 10-летнего возраста, а скорее всего, и пожизненно [82]. То есть в одной и той же ситуации – скажем, при конфликте с одноклассниками или переезде в другой город – дети со "сдвинутой" ГГНС будут испытывать более сильный стресс, чем другие. Это не пустые предположения: в 2005 году ученые измеряли уровень кортизола в слюне пятилетних малышей в первый день в школе после каникул (исследование проводили в Нидерландах, где в этом возрасте дети уже идут в школу). Исследователи сравнили детей спокойных матерей и детей мам, которые сильно нервничали, когда были в положении. У сыновей и дочерей последних уровень гормона стресса в слюне был заметно выше [83]. Регулярные "впрыски" кортизола приводят ко всем тем эффектам, о которых мы говорили: расстройствам памяти и внимания из-за воздействия на гипоталамус и проблемам с самоконтролем из-за угнетения префронтальной коры и активации миндалины. А раздраженные родительские советы вроде "Соберись, ничего страшного не происходит!" только добавляют малышу стресса.
Последствия пренатального стресса зависят от генов младенца
Выходит, если по каким-то причинам, часто не зависящим от будущей мамы, во время беременности она нервничает, у ребенка обязательно будут проблемы с самоконтролем? Похоже, что нет: как мы обсуждали выше, самоконтроль – сложный признак, который определяется как влиянием среды, так и генами. Из-за того что взаимодействия генотипа и среды, они же GxE, очень запутанны, однозначно прогнозировать, как тот или иной фактор повлияет на силу воли ребенка, невозможно или, по крайней мере, очень сложно. Да, сам по себе пренатальный стресс – предиктор того, что с силой воли могут быть проблемы. Но не все люди, родившиеся у нервных матерей, не в состоянии укротить свои порывы, а среди тех, кому это удается плохо, есть просто несдержанные в желаниях, а есть те, кто попадает в тяжелые зависимости – от алкоголя, наркотиков, игр или сладкого. Ученые неоднократно пытались выяснить, какая смесь факторов среды и генотипа окажется наиболее гремучей, и первым делом проверили те самые "плохие" варианты генов, о которых мы говорили в главе 4. В число подозреваемых, разумеется, попал ген SLC6A4, кодирующий серотониновый траспортер 5-HTT. Напомню, что при помощи этого белка организм регулирует, как долго будет действовать серотонин, возвращая молекулы нейромедиатора обратно в нейроны, которые его выделили. В гене SLC6A4 есть область 5-HTTLPR, состоящая из повторяющихся участков ДНК, и если таких повторов недостаточно, транспортера синтезируется меньше, чем положено. Мозг людей с одной или двумя укороченными версиями SLC6A4 постоянно недополучает серотонин, так как имеющиеся белки-транспортеры попросту не справляются с тем, чтобы вовремя вернуть все выброшенные молекулы для повторного использования.
В 2010 году ученые из Университета Британской Колумбии в Канаде исследовали полторы тысячи семей с полугодовалыми детьми. Выяснив у родителей, как хорошо малыши умеют регулировать эмоции (да-да, разницу в способности управлять эмоциями можно выявить даже в таком нежном возрасте – для этого существуют специальные опросники), исследователи взяли у детей образцы слюны и определили, сколько копий укороченной версии гена SLC6A4 несет каждый ребенок. Параллельно специалисты узнали, нервничала ли мама малыша во время беременности. Выяснилось, что хуже всех справляются с эмоциями мальчики и девочки с двумя "плохими" (короткими) копиями 5-HTTLPR, чьи матери во время беременности беспокоились и испытывали стресс. На втором месте оказались дети нервных мам с одним "плохим" вариантом гена SLC6A4. Если у ребенка обе версии гена серотонинового транспортера были длинными, существенного влияния материнского беспокойства на способность контролировать эмоции ученые не обнаружили [84]. Все бы хорошо, но три года спустя исследователи из нескольких британских университетов попытались повторить эту работу, на этот раз почти на четырех тысячах детей. И не обнаружили корреляции между количеством "плохих" копий 5-HTTLPR и эмоциональной несдержанностью [85].
Тот факт, что два вполне надежных и масштабных исследования прямо противоречат друг другу, скорее всего, означает, что ученые в своих работах упускают другие факторы среды или генотипа, которые могут усиливать или ослаблять влияние материнского беспокойства. Например, какой-то ген, обладатели которого становятся стойкими к неблагоприятному воздействию стресса независимо от того, есть ли у них "кривая" версия серотонинового транспортера. Это простой случай, но вполне может быть, что влияние неизвестного гена пропорционально суммируется с эффектом "неправильных" вариантов SLC6A4. Если у ребенка есть одна короткая копия серотонинового транспортера и такой таинственный ген, он будет хорошо управлять своими эмоциями. При двух копиях "плохой" версии и одной – неизвестного гена будет делать это хуже, а при сочетании двух "плохих" вариантов 5-HTTLPR и двух "правильных" версий еще не открытого гена снова будет отлично контролировать эмоциональные вспышки. Очевидно, что шанс обнаружить такую сложную корреляцию есть, только если точно знать, что искать. И работать с очень большими, даже огромными выборками – только так получится набрать нужное количество всех возможных сочетаний. А если дополнительно влияющих генов не один, а два или три, выявить все возможные комбинации и вовсе нереально.
Для другого "гена безволия", DRD4, "плохие" версии которого нередко встречается у людей с ослабленным самоконтролем, результаты чуть более определенные. DRD4 – один из типов дофаминовых рецепторов, т. е. это белок, который торчит на поверхности клеток и ловит молекулы дофамина. Если рецепторов мало, они слишком сильно или, наоборот, слишком слабо удерживают нейромедиатор, у человека меняется отношение к приятным вещам. В недавнем исследовании авторы проверяли, нет ли связи между пренатальным стрессом, "плохим" вариантом гена дофаминового рецептора DRD4-7R и антисоциальным, чрезмерно агрессивным поведением у подростков. Напомню, агрессия рассматривается как одна из форм недостаточного самоконтроля: агрессивные люди не в силах сдерживать желание ударить или оскорбить кого-то, даже если знают, что вспышка гнева закончится вызовом полиции или увольнением. Распространенный тип агрессивного поведения, когда подросток все время дерзит, спорит по любому поводу, не слушается, легко раздражается и выходит из себя, называют оппозиционным вызывающим расстройством (ОВР)47. И оказалось, что хотя бы отчасти в таком поведении виновата мама – причем виновата неосознанно. Если она сильно нервничала во время беременности, а ребенок несет одну или две копии DRD4-7R, вероятность, что у него разовьется ОВР, выше, чем для детей с нормальными вариантами дофаминового рецептора. Причем две копии DRD4-7R значительно повышают вероятность, что ОВР будет протекать особенно тяжело. У носителей двух копий "хорошего" варианта того же гена, который обозначают DRD4-4R, стресс in utero (т. е. в матке) не увеличивал шансы неприятных последствий для психики. Даже если мама, вынашивая ребенка, постоянно о чем-то беспокоилась, риск развития ОВР для таких детей был таким же, как для малышей со спокойными мамами [86]. Повышенная агрессивность сохраняется у детей с DRD4-7R как минимум до 15 лет [87]. Дальше, вероятно, тоже, но пока ученые не исследовали детей более старшего возраста.
Таким образом, гены ребенка опосредуют материнский стресс, смягчая или усугубляя его. В результате одинаковое по силе воздействие на женщину – скажем, развод во время беременности – может приводить к очень разным физиологическим эффектам и, соответственно, разным последствиям для самоконтроля малыша. Но и это еще не все: как мы уже говорили, реакция матери на одно и то же воздействие тоже во многом определяется генами. Женщина, ГГНС которой "спроектирована" так, что сильнее реагирует на любой стимул, будет в принципе нервничать больше, чем женщина с менее возбудимой ГГНС. А значит, ее ребенок, находясь в матке, получит больше глюкокортикоидов – со всеми вытекающими последствиями. Выше мы уже обсуждали, что "неудачные" варианты гена серотонинового транспортера SLC6A4 заставляют организм излишне остро реагировать на стресс. По сравнению с обладателями нормальных версий гена носители одного или двух коротких вариантов намного сильнее беспокоятся и нервничают из-за одних и тех же событий [88]. В одном из опытов ученые подвергали стрессу беременных крыс, у части которых был "выключен" крысиный аналог SLC6A4, – такие крысы считаются неплохой моделью, чтобы изучать поведение людей, несущих короткие версии SLC6A4. У крысят, рожденных от матерей с неработающим геном серотонинового транспортера, были выраженные сложности с поведением. Потомки крыс с неповрежденным геном вели себя нормально, хотя их матерям точно так же наливали воду в подстилку, пугали запахом лисы, заставляли слушать постоянный громкий шум, не давали двигаться и все время меняли клетки – в общем, создавали тотальный стресс [89].
На людях убедительных экспериментов, которые бы доказывали, что гены матери, опосредующие ее реакцию на стресс, влияют на самоконтроль ребенка, пока не проводилось. Но по отдельности обе половинки этой схемы (1 – определенные гены делают организм более склонным остро реагировать на стресс, и 2 – пренатальный стресс плохо сказывается на силе воли ребенка, особенно если он несет "плохие" варианты некоторых генов) были подтверждены много раз. Так что можно предположить, что такие гены у будущей мамы – возможный фактор риска для силы воли ребенка.
Курение матери в сочетании с "плохими" генами может влиять на самоконтроль
Есть еще один фактор, который не подпадает под строгое определение стресса, но "работает" у беременных похожим образом. Этот фактор – курение. Об опасности сигарет для здоровья младенца написаны тонны литературы, но здесь я хочу рассмотреть лишь конкретное следствие: как курение будущей матери влияет на самоконтроль ребенка, и есть ли гены, которые это влияние могут усилить. Оказывается, привычка будущей мамы выкурить сигаретку-другую и самоконтроль ее ребенка связаны напрямую. Это было показано в большом количестве работ, в которых изучали детей с синдромом дефицита внимания и гиперактивности (СДВГ). Это расстройство – крайний вариант нарушения самоконтроля, который часто встречается у детей. Насколько именно часто, сказать сложно, потому что легкие формы СДВГ могут оставаться недиагностированными: родители просто считают, что у них очень рассеянный и беспокойный ребенок, и не обращаются к специалистам. По статистике, диагноз СДВГ получают от 4 до 12 % детей, и, по разным оценкам, у 10–60 % (!) таких детей почти все симптомы сохраняются во взрослой жизни [90]. Так что неспособность сосредоточиться, побороть желание закурить или съесть шоколадку, вечные опоздания и срывы дедлайнов вполне могут быть проявлениями того самого СДВГ, который не был обнаружен в детстве.
Конечно, для того чтобы всерьез говорить о диагнозе, нужен врач. Но СДВГ – это симптомокомплекс, т. е. диагноз ставится, если набирается нужное количество проявлений. Граница, отделяющая болезнь от не-болезни, проведена условно: какого-то одного аллеля или признака, которые бы однозначно определяли, что у ребенка СДВГ, не существует. Это всегда набор нарушений, и даже если у человека есть только часть симптомов, нельзя исключать, что причины этих проявлений те же, что у людей с "настоящим" СДВГ. Просто у "недобравшего" сработали не все триггеры или есть компенсаторные механизмы, которые не дают в полной мере проявиться симптоматике СДВГ. Поэтому хотя бы отчасти исследования, касающиеся синдрома дефицита внимания и гиперактивности, приложимы к "обычным" проблемам самоконтроля, так как механизмы нарушений у этих двух состояний во многом пересекаются.
Итак, что же обнаружили ученые, которые искали связь между сигаретами и СДВГ? Во-первых, они подтвердили, что курение во время беременности увеличивает риск развития СДВГ. А во-вторых, у детей, которые несли две копии одного из "нехороших" вариантов гена дофаминового рецептора типа 4 – DRD4-7R, симптомы заболевания были заметно более выражены [91]. В другой работе авторы показали, что у обладателей "плохой" версии транспортера дофамина DAT1 (ген SLC6A3), если их матери, будучи беременными, курили, риск развития СДВГ в три раза выше, чем у детей с "хорошим" аллелем, чьи мамы не курят. Для носителей аллеля DRD4-7R риск СДВГ тоже повышен в три раза – при условии, что мать курила во время беременности. Дети курящих мам, в чьих генах есть и "безвольная" версия SLC6A3, и DRD4-7R, рискуют больше всех. Для них вероятность СДВГ по сравнению с неносителями, матери которых не баловались сигаретами, вынашивая ребенка, возрастает аж в девять раз [92]. Если говорить об отдельных нарушениях самоконтроля, которые входят в общий список для диагностики СДВГ, но могут проявляться и сами по себе, то тут картина еще более впечатляющая. Если будущая мама курит, то у ребенка с двумя "плохими" аллелями DRD4-7R в среднем будет восемь таких признаков, а у малыша с теми же аллелями, но некурящей мамой – только пять. Похожая ситуация у детей с двумя "неправильными" версиями SLC6A3 (ген транспортера DAT1): у отпрысков курящих мам – семь признаков, некурящих – четыре.
Исследования СДВГ в перспективе могут помочь в создании терапии этого расстройства, поэтому на такие работы выделяют много денег. Изучение самоконтроля самого по себе для фармакологии не так перспективно, поэтому грантов в этой области значительно меньше. А значит, меньше работ по "чистому" самоконтролю. Но кое-какие изыскания все же проводятся. И они тоже показали, что курение мамы во время беременности заметно повышает вероятность, что у ребенка будут сложности с силой воли [93]. Особенно если у него есть проблемные аллели вроде варианта дофаминового рецептора DRD2/ANKK1 A1 [94]. Более того, на способность малыша контролировать свои порывы влияет даже пассивное курение мамы. Сама беременная может не прикасаться к сигаретам, но если она часто находится в прокуренном помещении или среди курящих, то новорожденный с высокой вероятностью не будет чемпионом силы воли. Причем достоверные отличия сохраняются между детьми пассивных курильщиц и женщин, которые во время беременности избегали сигаретного дыма, как минимум до 15 лет [95]. Наверняка они никуда не исчезают и позже, просто у авторов работы были данные детей только до этого возраста.
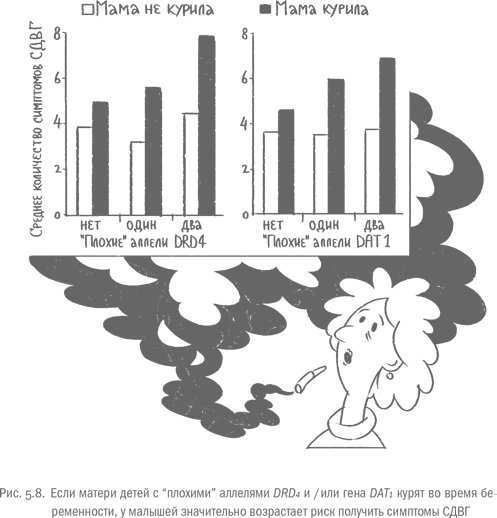
Как именно табак влияет на механизмы, определяющие способность к самоконтролю, пока неясно. Известно, что из-за содержащихся в дыме токсинов у ребенка не до конца или не совсем правильно развиваются некоторые отделы мозга: лобные доли детей, чьи матери не бросили вредную привычку во время беременности, меньше, чем у детей некурящих мам [96]. Недоразвитость отдельных частей мозга, например ПФК, и сама по себе фактор риска для самоконтроля. А если к этому добавить вредное действие DRD4-7R, 5-HTTLPR и других полиморфизмов, то риск получить проблемы с силой воли возрастает еще сильнее.
Работ, в которых изучается воздействие на самоконтроль других популярных токсических веществ, а именно алкоголя и наркотиков, почти нет. Причина здесь не в том, что спиртное и наркотики не влияют на силу воли: каждый, кто видел окончательно спившегося алкоголика или сторчавшегося наркомана, знает, что влияют, и еще как. Просто воздействие этих веществ настолько сильно и поражает такое количество функций, что выделять отдельно самоконтроль нет смысла – это все равно что пытаться оценивать, изменяется ли работа отдельных микросхем в телевизоре после того, как его разбили молотком. Большие дозы алкоголя и наркотиков выводят из строя весь мозг сразу, а оценить влияние малых доз очень сложно: здесь вступают в игру индивидуальные отличия и компенсаторные механизмы, так что дозы, опасные для одних детей, на других не окажут катастрофического влияния. Заранее узнать, насколько стоек ребенок к токсинам, пока невозможно, так что лучше не рисковать и хотя бы во время беременности воздерживаться от потенциально вредных воздействий.
Повреждающие факторы – от стресса до никотина – изменяют работу генов, задействуя эпигенетические механизмы
Выше я много раз говорила, что пока ученые не до конца понимают, как именно стресс и другие факторы влияют на силу воли. Достоверно подтвержден один механизм – активация ГГНС, как у плода, если нервничает мама, так и у зрелого организма, если переживает ребенок или взрослый. Но, очевидно, есть и другие механизмы. Так, исследователи почти не сомневаются, что стресс портит силу воли (и не только ее) эмбриона и новорожденного посредством могучего инструмента под названием эпигенетическая – то есть надгеномная – регуляция. Впервые термин предложил британский биолог Конрад Уоддингтон в 1942 году. Ученый работал с мухами и знал, что, если обработать куколок парами эфира, взрослые мухи вырастут уродцами с измененным телом (вместо жужжалец на нем появятся зачатки второй пары крыльев). Чтобы проверить, сохраняется ли это изменение в поколениях, Уоддингтон скрещивал таких мух друг с другом. Потомков "неправильных" насекомых ученый тоже обрабатывал эфиром, затем отбирал потомков с недокрыльями и снова скрещивал их. Уоддингтон повторил эти манипуляции с несколькими поколениями мух, а затем убрал из опыта эфир. К удивлению исследователя, мухи "отращивали" дополнительную пару крыльев даже без обработки токсичными парами. Изменение, которое было вызвано внешним воздействием и, очевидно, не изменяло ДНК (ученый травил эфиром уже вылупившихся куколок, гены которых не были повреждены), каким-то образом проявилось и передалось в череде поколений [97]. Уоддингтон назвал диковинный способ наследования "мягким" – в противовес обычному "жесткому", когда новые признаки сохраняются благодаря изменениям в генах, т. е. мутациям. Термин "эпигенетика" прижился, хотя позже выяснилось, что у мух Уоддингтона проявилось не "классическое" эпигенетическое наследование, о котором мы поговорим ниже.
В 1940-е годы ученые не знали, где именно и как хранится наследственная информация: американцы Альфред Херши и Марта Чейз провели знаменитый эксперимент, в котором было однозначно показано, что носитель такой информации – ДНК, только в 1952 году48. Но уже тогда было ясно, что, воздействуя на взрослый организм или даже на эмбрион, невозможно прицельно изменить этот носитель так, чтобы он передал потомкам новый признак49. После экспериментов Уоддингтона и его последователей выяснилось, к большому огорчению тех, кто любит получать простые ответы на сложные вопросы, что наследование всевозможных характеристик – намного более запутанный и многогранный процесс, чем полагали генетики. Энтузиасты проекта "Геном человека" были уверены: как только ученые получат в свое распоряжение полную последовательность ДНК, они быстро разберутся, как закрепляются и реализуются разные признаки. После расшифровки стало ясно, что быстро разобраться не получится – слишком многого мы пока не понимаем. А тут еще возникла эпигенетика, которая по сложности вполне может соперничать с генетическим наследованием.
Эпигенетические модификации не меняют ДНК, но указывают ферментам, как именно считывать записанную в ней информацию
Эпигенетические механизмы заставляют ферменты по- разному считывать те или иные гены, расставляя на них всевозможные "пометки" – химические модификации. Сегодня ученые знают множество способов такой маркировки: начиная с 1980-х годов ежегодно издаются сотни и тысячи работ по эпигенетике. Лучше всего изучено так называемое метилирование ДНК – навешивание метильных остатков (химическая формула – CH3) на некоторые генетические "буквы". Чаще всего "буквы", на которые ставятся метки, расположены на особых участках в начале генов под названием промоторы. Промотор – это как бы предисловие к гену, в котором сообщается, как именно его следует читать. На промоторы же "садятся" ферменты, расшифровывающие записанную в гене информацию. Обнаружив на промоторе метильные группы, ферменты "понимают" что считывать этот ген не нужно. В итоге внешне он остается не поврежденным, однако на деле не работает. Кстати, многие "мутации безволия", о которых мы говорили выше, находятся как раз в промоторах.
Другой вариант эпигенетической модификации затрагивает не саму ДНК, а специальные белки-гистоны, на которые намотана длинная молекула дезоксирибонуклеиновой кислоты (иначе она попросту не поместится в крошечном клеточном ядре, да еще и намертво запутается). Различные химические метки на гистонах, скажем, ацетильные или фосфогруппы, определяют, смогут ли ферменты считать записанную в гене информацию. Некоторые из меток ослабляют взаимодействие ДНК с гистонами, другие же, наоборот, усиливают. Если какой-нибудь ген слишком плотно притянут к гистону, ферменты не могут оттащить его и добраться до записанной информации, так что ген остается неактивным. Если же связь ДНК с гистонами слабая, ферментам удобно "сесть" на ген и прочитать его50.
Эпигенетические механизмы позволяют быстро – т. е. в течение жизни конкретного организма – отвечать на внешние воздействия. "Классический" же эволюционный способ приспосабливаться к меняющимся условиям среды, т. е. мутации, требует нескольких поколений (а зачастую и нескольких десятков). Эпигенетика – это система быстрого реагирования, благодаря которой живое существо может адаптироваться к изменившимся условиям, не меняя ДНК51. Например, у детенышей серых полевок, которые рождаются осенью, шерсть заметно гуще, чем у мышат, рожденных весной [98]. Разница в толщине меха – результат работы эпигенетических регуляторов. Они "подправляют" режим считывания генов, которые кодируют белки, контролирующие развитие шерстяного покрова. Сигналом для таких регуляторов служит концентрация в крови матери гормона мелатонина: он вырабатывается железой под названием эпифиз и регулирует суточные и сезонные ритмы. Чем короче световой день, тем больше мелатонина. Если мелатонина много, значит, наступает зима, и нужно обеспечить детеныша густым мехом. Когда концентрация мелатонина мала, ферменты "понимают", что приближается жаркое лето и мышонку нужна вентиляция. Прерийные полевки пошли еще дальше: у этих грызунов эпигенетика определяет, кого они будут любить всю жизнь. После спаривания в прилежащем ядре зверьков активируются особые ферменты. Они модифицируют гистоны в генах рецепторов к гормонам окситоцину и вазопрессину – считается, что именно они во многом отвечают за чувство привязанности. Гистоны отходят от ДНК, гены начинают активно считываться, в мозгу растет количество рецепторов, на рецепторы садятся гормоны – и новая неразлучная пара готова [99].
Не только мыши, но и каждый, кто читает эту книгу (как и все остальные люди), – результат работы эпигенетических механизмов. Разные клетки нашего тела выполняют совершенно различные функции – кардиомиоцит даже внешне не похож на нейрон, и оба они отличаются от фибробласта52. При этом все клетки нашего тела несут один и тот же набор генов – точно такой же, как в яйцеклетке, которая дала начало всему организму. Но в клетках печени работают одни гены, а в клетках сердца – совсем другие. Именно эпигенетические метки, проставленные в нужных местах, заставляют работать только те участки ДНК, которые необходимы для жизни конкретного типа клеток.
Эпигенетические метки на ДНК или гистонах позволяют оперативно отрегулировать работу тех или иных систем в ответ на внешние воздействия: такая быстрая адаптация повышает шансы существа на выживание. Более того, новые метки могут передаваться потомкам. В прошлом Земля была довольно спокойным местом: чаще всего условия радикально менялись на временных отрезках протяженностью в тысячи и миллионы лет, и детеныши появлялись на свет и жили в той же среде, что родители. Поэтому эпигенетическая адаптация, которая появилась у папы или мамы, с высокой вероятностью была полезна и детям. Homo sapiens сделал жизнь на планете непредсказуемой: в последние столетия все меняется с фантастической скоростью, и адаптации, которые облегчали существование родителям, детям только мешают. Поэтому сегодня многие эпигенетические "подкрутки" приносят человеку массу проблем. В том числе и проблем с самоконтролем.
Эпигенетические механизмы могут изменить строение мозга, чтобы подстроить его работу под текущие условия
Стресс – мощнейший фактор, который легко может убить организм. Кроме того, раз есть стресс, значит, есть и внешняя опасность, которая его вызвала. И если предполагается, что детеныш будет расти в условиях стресса, необходимо подготовить его к такой тяжелой жизни. На самом деле, конечно, никто специально не готовит эмбрионы к будущему. Просто детеныши, которые лучше отвечали на стресс, с большей вероятностью оставляли потомство, и в череде поколений закрепились инструкции, как регулировать работу эпигенетических механизмов при стрессе. И если непосредственные эффекты стресса объясняются активацией гипоталамо-гипофизарно-надпочечниковой системы, то за долгосрочные последствия хотя бы в части случаев ответственна эпигенетика. Очень наглядные доказательства, как организм заранее корректирует свою работу, чтобы лучше приспособиться к условиям будущей жизни, были получены на крысах. Заботясь о новорожденных крысятах, самки вылизывают их и чистят шерстку (когда она появляется). Ученые заметили, что детеныши крыс, матери которых в первую неделю после родов делали это часто и подолгу, вырастают более спокойными, чем крысята, чьи мамы не слишком заботились о них. Различия касались не только поведения: ГГНС крысят, выращенных халатными мамашами, была заметно более активной и возбудимой, чем у детенышей внимательных самок. Но если сразу после рождения крысят меняли местами – т. е. детенышей заботливых мам подкладывали крысам-лентяйкам, а крысят, рожденных у холодных матерей, отдавали ласковой "мачехе", картина менялась ровно на противоположную. Неродные крысята у плохих мам вырастали нервными, со "вздрюченной" ГГНС, а у хороших – спокойными, с не слишком активной гипоталамо-гипофизарно-надпочечниковой системой.
Таким образом, повышенная возбудимость крысят была не генетически заложенной чертой, а следствием маминого поведения в первые дни после родов [100 и ссылки внутри]. Недостаток заботы – безусловный стресс для новорожденного, который как бы намекает, что в случае опасности никто не будет защищать его, поэтому нужно быть в состоянии дать отпор самому. Отпор – это постоянная готовность драться или убегать, т. е. повышенная возбудимость гипоталамо-гипофизарно-надпочечниковой системы. Долгое время было неясно, почему ГГНС выращенных равнодушными матерями крысят постоянно находится на взводе. После того, как исследователи узнали про эпигенетику, возникли подозрения, что реакция таких детенышей на стресс изменяется благодаря каким-то пометкам на ДНК. И в 2004 году ученые нашли эти "пометки": выяснилось, что у легковозбудимых крысят промотор гена глюкокортикоидных рецепторов обильно "утыкан" метильными группами [100]. Такая метка – сигнал ферментам, что считывать ген не нужно, поэтому в мозгу детенышей, которые росли у безалаберных матерей, меньше рецепторов к глюкокортикоидам, чем у крысят, о которых в раннем детстве заботились. Выше мы уже обсуждали, что чем меньше рецепторов, тем хуже организм умеет регулировать возбуждение ГГНС по механизму отрицательной обратной связи. Крысы с вечно возбужденной ГГНС постоянно находятся в стрессе, а это состояние пагубно для самоконтроля.
На людях, как обычно, подобных экспериментов провести нельзя, но тот факт, что малыши, которые в раннем детстве пережили стресс, вырастают более возбудимыми, а их ГГНС все время на взводе, доказан неоднократно [101]. Такие дети хуже учатся и чаще демонстрируют "трудное" поведение. Как мы обсуждали выше, обе эти особенности связаны со слабым самоконтролем. Когда мы говорим о стрессе применительно к детям, в голове обычно возникают картины разной степени катастрофичности: от смерти родителей до физического насилия. Эти факторы, безусловно, являются стрессом, но наблюдения показывают, что для пожизненного возбуждения ГГНС достаточно куда более скромных воздействий. Только что родившийся ребенок совершенно беззащитен, и, чтобы выжить, он критически нуждается в заботливом взрослом – прежде всего в матери. Равнодушная, безучастная или, еще хуже, впавшая в послеродовую депрессию мать – очень сильный стресс для младенца, ведь нет никакой гарантии, что в случае опасности такая мать в принципе будет его спасать. Разумеется, младенец не думает о ситуации, в которой он растет, именно так – по крайней мере, до тех пор, пока не научится использовать для описания своих чувств слова. Но его мозг реагирует на отсутствие заботы совершенно однозначно: он активирует стрессовый ответ. Постоянно повышенный уровень кортизола включает эпигенетические механизмы, которые фиксируют полученную информацию: "Мы оказались в среде, где нет защиты. Чтобы выжить, нужно постоянно быть начеку. Для этого необходима все время включенная ГГНС".
Похоже, в первые годы жизни эти механизмы особенно важны: вспомним, что младенцы появляются на свет лишь с частично созревшим мозгом, который "допиливается" вплоть до конца полового созревания. В какую сторону "пилить", организм определяет, руководствуясь сигналами извне, – находясь в утробе, он просто не мог получить необходимую информацию. Улавливая всевозможные сигналы из окружающей среды, организм "размечает" огромное количество генов. В одном из немногочисленных исследований на людях авторы сравнили количество метильных "довесков" в 140 генах подростков, причем часть из них в раннем детстве испытывали стресс или росли в семье, где в стрессе был кто-то из родителей. У подвергавшихся стрессу подростков более четверти изученных генов оказались в той или иной степени метилированы, т. е. помечены как ненужные в текущих условиях. Причем некоторые из "выключенных" генов отвечают не за реакцию на стресс, а за формирование мозга в целом. Таким образом, стресс в раннем возрасте – в том числе и "опосредованный", т. е. полученный из-за того, что чрезмерно нервничал кто-то из родителей, – способен изменить инструкции по формированию мозга. Причем в раннем детстве и на мальчиков, и на девочек больше влияет материнский стресс, а вот ближе к подростковому возрасту на эпигенетическую регуляцию девочек начинает усиленно влиять стресс отцов [102].
Диета влияет на активность метилирования, но как именно – предсказать невозможно
Многие люди, узнав, что метилирование некоторых генов может иметь негативные последствия, ищут способы уменьшить активность этого процесса. И быстро обнаруживают в интернете, что этого можно добиться, изменив диету. Метильные группы, которые навешиваются на гены, организм добывает из еды, в которой много метионина. "Значит, исключив источники метионина, я остановлю метилирование" – решает человек и берется за дело. И действительно, опыты показывают, что на безметиониновой диете степень метилирования резко падает. Но падает она по всему геному в целом, а не выборочно. Например, ограничительные метильные метки исчезают с генов, которые способствуют быстрому делению клеток и в норме заблокированы. Закономерный итог – всевозможные опухоли [103]. Специалисты исследуют, как можно влиять на статус метилирования "извне" организма, и, возможно, когда-нибудь мы научимся снимать только конкретные метильные метки. Но пока этого понимания нет, опасные эксперименты на себе лучше не проводить.
Эффективность эпигенетических настроек зависит от того, какие варианты определенных генов есть у человека
Определенные гены, которые организм эпигенетически "помечает" в ответ на стресс, "прицельно" влияют на самоконтроль. У мышей, которых в подростковом возрасте постоянно доставали из общей клетки и сажали в тесную "одиночку", метильными метками покрывался промотор гена тирозингидроксилазы – фермента, который синтезирует молекулы – предшественники дофамина, норадреналина и адреналина. Как вы помните, недостаток дофамина – одна из важнейших причин проблем с самоконтролем. Но стресс включал эпигенетические механизмы не у всех мышей: ген тирозингидроксилазы метилировался только у животных, которые несли "рисковые" аллели определенных генов, ответственных за формирование мозга. То есть эффект GxE проявляется и тут: среда изменяет развитие организма при помощи эпигенетических механизмов, если он несет генетические предпосылки к таким изменениям [104].
На работу эпингенетических регуляторов влияет и один из наших любимых "генов самоконтроля" – ген серотонинового транспортера SLC6A4. В ответ на стресс в раннем возрасте, как острый, так и хронический, у людей с короткими ("плохими") аллелями промотор этого гена метилировался заметно сильнее, чем у носителей длинных ("хороших") версий [105]. При этом у носителей коротких версий в ответ на стресс чаще развиваются депрессия и прочие нарушения, связанные с нехваткой серотонина. Как именно взаимодействуют разные аллели тех или иных генов и эпигенетическая машинерия, пока совершенно непонятно. Хотя эпигенетику изучают уже 30 лет, она все еще остается terra incognita. С одной стороны, это огорчает, но с другой – вселяет надежду. Не исключено, что когда мы все-таки разберемся с эпигенетическими механизмами, то получим ответы на многие вопросы, на которые "классическая" генетика ответить не может.
Эпигенетические изменения сохраняются в поколениях
Метки, которые организм ставит на разные гены, пытаясь наилучшим образом приспособиться к условиям среды, в которые он попал, часто сохраняются на всю жизнь53. Более того, они передаются дальше по цепочке поколений. Мыши и крысы, которые в раннем детстве подвергались хроническому стрессу (в том числе некоторых животных разлучали с матерью), передавали "стрессовые" эпигенетические пометки своим потомкам. И хотя ученые никак не портили жизнь детям и внукам стрессированных животных, они вели себя так, будто сами испытывали стресс. Есть и другие данные, показывающие, что определенные эпигенетические метки, вызванные стрессом в раннем детстве, наследуются из поколения в поколение [106], [107]. Как именно передаются подобные метки, ученые пока не знают: долгое время исследователи были уверены, что в зиготе, т. е. оплодотворенной яйцеклетке, все эпигенетические настройки "стираются". Оказалось, что это не так, т. е. эпигенетика регулирует физиологию не только конкретного организма, а сразу нескольких поколений.
У человека засечь "долгоиграющие" эпигенетические эффекты сложно – хотя бы потому, что людей нельзя скрещивать в контролируемых условиях. Но несколько ярких примеров ученым все же удалось обнаружить, хотя важно сразу оговориться, что выборки в этих исследованиях очень скромные. Специалисты исследовали детей евреев, которые пережили холокост. Они обнаружили, что у тех, кто прошел концлагеря, и их потомков один из генов, контролирующих ответ на стресс (FKBP5), метилирован иначе, чем у евреев из контрольной группы, которые не переживали такой колоссальный стресс. Самое интересное, что метильные метки унаследовались "наоборот": если у бывших заключенных промотор FKBP5 был гиперметилирован, то у их детей на нем "не хватало" меток. Авторы предполагают, что смена паттерна метилирования может быть адаптивной реакцией [108].
В другой работе исследователи анализировали ДНК женщин-тутси с посттравматическим стрессовым расстройством (ПТСР), которые во время геноцида этой народности в Руанде в 1994году были беременны. С 6 апреля по 18 июля было убито, по разным данным, от 500 тысяч до 1миллиона тутси. Ученые обнаружили, что у выживших женщин с ПТСР и их детей гиперметилирован промотор одного из генов рецептора к глюкокортикоидам. Причем дети, у которых ген был обильно покрыт метильными метками, тоже страдали от ПТСР различной степени тяжести. ПТСР возникает, когда стрессовый ответ человека выведен из строя. Ученые пока не до конца понимают, что именно ломается, но в нескольких работах была показана связь ПТСР как с недостатком, так и с избытком гормонов стресса. У контрольной группы женщин-тутси и их детей, которые избежали геноцида и даже не видели тех чудовищных событий, ген глюкокортикоидного рецептора был метилирован не больше обычного. Не было у них и симптомов, характерных для ПТСР и других психических расстройств (как и СДВГ, посттравматическое стрессовое расстройство – это не конкретная болезнь, а симптомокомплекс). Авторы полагают, что у женщин, переживших геноцид, сработали эпигенетические механизмы, которые отключили до крайности перевозбужденную ГГНС, инактивировав ген глюкокортикоидного рецептора. Такая мера помогает не "сжечь" организм прямо сейчас слишком сильной реакцией на стресс, но чревата последствиями в виде ПТСР. Эти настройки передались и детям, хотя они и не переживали травму [109].
К обеим этим работам есть вопросы. Они касаются и размера выборки, и самой методики, в том числе постановки контролей. В исследованиях, которые проводятся, что называется, по факту, избежать таких недочетов невозможно. Сам механизм эпигенетического наследования был подтвержден на животных моделях, и пока нет оснований считать, что он почему-либо отключился у человека. Но до тех пор, пока этот факт не будет строго подтвержден, мы можем говорить о наследственной передаче эпигенетических стрессовых настроек у Homo sapiens только как о гипотезе, пусть и очень многообещающей.
Полные отцы могут передавать эпигенетические "маркеры лишнего веса" своим детям
Исследований, демонстрирующих наследование эпигенетических меток у людей, очень мало, но некоторые из тех, что есть, не могут не впечатлять. В 2015 году ученые из Дании сравнили ДНК сперматозоидов худых и полных мужчин и обнаружили, что у них по-разному метилированы более 9 тысяч генов. Многие из этих генов непосредственно контролируют пищевое поведение и чувство насыщения – например, ген MCR4, о котором мы говорили в главе 4. Ученые не проверяли, сохраняется ли этот паттерн метилирования в ДНК детей, но тот факт, что сперматозоиды несут "меченую" ДНК, косвенно указывает, что это возможно. Cамый интересный результат исследователи получили, когда несколько из участвовавших в опыте мужчин решились на шунтирование желудка – хирургическую операцию, в ходе которой врач разделяет желудок на большой и малый отсеки, а затем подводит к малому петлю тонкой кишки. После операции человек физически не может много есть, кроме того, пища хуже усваивается, так как уменьшенный желудок не в состоянии как следует обработать ее. В итоге вес начинает уходить очень быстро. Уже через неделю после операции в ДНК сперматозоидов появилось больше 1500 эпигенетических изменений. Через год, когда мужчины похудели и стабильно удерживали новый вес, количество изменений выросло почти до 4 тысяч, и опять многие из них затрагивали гены, связанные с аппетитом и чувством насыщения [110].То есть лишний вес и регулярное поступление в организм больших объемов еды могут запускать эпигенетические механизмы, которые меняют инструкции по прочтению генов – чтобы лучше приспособить организм к новым условиям, а именно к небывалому для древних людей количеству съестного. И если изменения действительно сохраняются у потомков, это можно трактовать как послание: "Сынок/дочка! Ешь как можно больше – когда еще удастся жить в эпоху такого изобилия!" Привет из нашего голодного прошлого, который делает и без того полную стрессов жизнь современного человека еще более невыносимой.
"Плохие" варианты генов в определенных условиях могут обеспечивать своим носителям эволюционное преимущество
"Плохие" варианты тех или иных генов, в том числе "генов самоконтроля", существенно увеличивают шансы, что у человека будут всевозможные проблемы с силой воли – особенно если работе таких генов "помогут" факторы среды. Безвольные люди в среднем менее успешны, чем волевые, т. е. хуже приспособлены к жизни. А значит, они должны были оставлять меньше потомства, ведь детей нужно не только родить, но еще и вырастить. Для тех, у кого есть проблемы с самоконтролем, много лет заниматься тяжелым трудом, который часто не приносит удовлетворения, – задача сложновыполнимая. И тем не менее "плохие" аллели очень распространены – более того, у жителей некоторых регионов их заметно больше, чем у других. Такая неоднородность свидетельствует, что "вредные" варианты оказываются таковыми лишь в определенных условиях. В других обстоятельствах они, наоборот, могут обеспечить своим обладателям преимущество, или, по крайней мере, их действие не будет настолько скверным.
Например, два коротких ("плохих") аллеля гена серотонинового транспортера 5-HTT (ген SLC6A4) защищают своих носителей от депрессии – но только если они выросли в благополучной семье и в детстве не сталкивались с серьезным стрессом [111]. В ситуации острого стресса обладатели двух "неправильных" вариантов гена серотонинового транспортера меньше рискуют получить посттравматическое стрессовое расстройство – но опять же в определенных условиях. Например, после разрушительного урагана во Флориде в 2004 году люди с двумя короткими аллелями SLC6A4, живущие в спокойных районах с низкой преступностью, страдали от ПТСР реже, чем обладатели других генотипов. Если же носитель двух коротких аллелей проживал в бедном районе, где постоянно кого-то грабили и убивали, риск ПТСР для него был выше, чем в среднем по популяции [112]. С чем связана такая разница, пока неясно, но не исключено, что здесь тоже "виновато" трудное детство. Дети из бедных и опасных районов чаще испытывают стресс – как из-за хулиганов, так и из-за собственных родителей, которые часто выпивают или просто не занимаются с детьми, потому что озабочены тем, как заработать денег. Другие исследования подтверждают флоридскую закономерность: обладатели хотя бы одной короткой версии гена серотонинового транспортера меньше остальных людей подвержены депрессиям и другим психологическим расстройствам во взрослом возрасте – но только если в детстве они не подвергались стрессам. То есть короткий вариант гена – не обязательно зло. Этот ген дарит своим носителям способность более пластично реагировать на внешние воздействия. Но в зависимости от того, что это за воздействия, повышенная гибкость реакции может обернуться как достоинством, так и недостатком [113].
Похожая картина наблюдается с геном мужской агрессивности, который кодирует моноаминоксидазу А – MAOA. Выше мы много раз обсуждали, что носители малоактивной формы этого фермента чаще ведут себя крайне несдержанно и совершают жестокие преступления в том случае, если в детстве сами подвергались насилию. Но мальчики с малоактивной формой MAOA, детство которых было спокойным, ведут себя гораздо лучше мальчиков с активной формой: меньше хулиганят, хамят, дерутся и т. д. [114]. То есть носители "проблемных" версий "генов самоконтроля", если им повезло с родителями и вообще детство было спокойным, в некоторых ситуациях могут оказаться более приспособленными или даже выигрывать у обладателей "правильных" вариантов в целом, например, за счет большей мягкости и гибкости. Поэтому пул "безвольных" генов сохраняется.
Еще более экзотическую гипотезу, почему "плохие" гены сохраняются, особенно у некоторых народностей, выдвинули новосибирские ученые, много лет сравнивавшие популяции тувинцев и русских. У тувинцев, как и других азиатских этносов, "плохой" аллель серотонинового транспортера встречается с частотой 70 %, а у русских частота не превышает 30 %. Носители одного и особенно двух коротких аллелей более импульсивны и лучше справляются с задачами, требующими быстрых действий в условиях недостатка времени, – например, они лучше охотятся [115]. Соответственно, в условиях, когда охота является главным способом добывать пропитание, носители двух коротких аллелей получают преимущество перед более обстоятельными, но зато медлительными обладателями длинных аллелей. Именно в таких условиях тысячелетиями жили кочевники-тувинцы.
С другой стороны, в традиционной тувинской культуре у мужчин не принято демонстрировать страх и тревожность – в отличие от более "модернистской" современной российской культуры. При этом короткий аллель SLC6A4 обычно коррелирует как раз с высокой тревожностью: женщины-тувинки и русские обоего пола с двумя "нехорошими" вариантами набирали в тестах на тревожность больше всего баллов. Те же авторы показали, что тувинцы-мужчины с двумя короткими аллелями гена серотонинового транспортера усиленно подавляют проявления тревожности и демонстрируют нарочито храброе, безрассудное поведение. При этом в тестах на имплицитное, т. е. подсознательное чувство тревоги мужчины-тувинцы с двумя короткими аллелями обгоняют всех остальных [116]. Другими словами, генотип, который у европейцев считается "плохим" для самоконтроля, заставляет мужчин-тувинцев усиленно проявлять его, по крайней мере в некоторых ситуациях. Эти данные говорят о том, что генетическая предрасположенность к тому или иному поведению может очень сильно видоизменяться под влиянием среды.
Резюме
В этой главе мы разобрали самое сложное, что бывает при исследовании любой черты, зависящей от генов не на 100 %, – как условия среды могут модифицировать ее и влиять на степень выраженности. Переплетение генетических и средовых факторов порой настолько сложно, что отделить одно от другого невозможно. Именно по этой причине один человек с "плохими" вариантами "генов самоконтроля" не может сопротивляться соблазнам и легко впадает в зависимости, а другой с точно такими же генами более или менее сдерживает свои порывы. И наоборот: влияние всех стимулов извне опосредуется нашими генами: какой-нибудь фактор может полностью сломать самоконтроль одного человека и лишь незначительно ухудшить его у другого.
На выраженность дурного эффекта "неправильных" аллелей влияет множество факторов, но важнейший из них – стресс. Острый стресс лишь временно ослабляет нашу способность контролировать себя, подавляя префронтальную кору и давая свободу миндалине. Хронический стресс способен навсегда лишить нас волевого стержня: он делает организм гиперчувствительным к дальнейшим стрессам и даже меняет архитектуру мозга. Хуже всего, если мы сталкиваемся со стрессом в раннем детстве: в этом случае механизмы ответа на стресс могут радикально изменить строение и работу мозга. Как минимум в некоторых случаях внешние факторы изменяют нашу физиологию, проставляя особые эпигенетические "метки" на ДНК. Ориентируясь на них, ферменты иначе считывают записанную в генах информацию. Не исключено, что такие "метки" могут передаваться детям, и в этом случае даже при "хороших" генах их самоконтроль может регулярно сбоить.
Назад: Доход семьи
Дальше: Литература

