Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 68 Патогенные актиномицеты и нокардии
Дальше: Глава 70 Патогенные грибы
Глава 69
Патогенные спирохеты и спириллы
Спирохеты
В новой классификации (Берги-2001) спирохеты выделены в новый тип Spirochaetes с единственным одноименным классом и единственным порядком Spirochaetales c тремя семействами – Spirochaetaceae (роды Borrelia, Cristispira, Spirochaeta, Treponema и др.), Serpulinaceae (роды Serpulina и Brachyspira) и Leptospiraceae (роды Leptospira и Leptonema). Для человека патогенны боррелии, трепонемы и лептоспиры.
Спирохеты (греч. speira – завиток, chaite – волосы) – спиралевидной формы подвижные бактерии размером 0,1 – 3,0 × 5 – 250 мкм; одноклеточные, возможно, за исключением Spirochaeta plicatilis. Все спирохеты грамотрицательны.
Центральной структурой клетки (см. рис. 111.6) является протоплазматический цилиндр, в котором содержатся цитоплазма, нуклеоид, рибосомы 70S и различные комплексы ферментов. Протоплазматический цилиндр окружен комплексом цитоплазматическая мембрана + клеточная стенка, содержащая пептидогликан. Протоплазматический цилиндр имеет постоянную спиралевидную форму, благодаря пептидогликану, образуя первичные завитки. Их число, тип, шаг, высота, угол наклона варьируют у разных видов и играют важную систематическую роль. Вторичные завитки у спирохет образуются в результате изгиба всего тела. Вокруг спиралевидного цитоплазматического цилиндра располагается периплазматический жгутик (жгутики). Один конец каждого жгутика прикреплен к одному из полюсов протоплазматического цилиндра, а другой – к последнему примерно посередине клетки. Общее количество периплазматических жгутиков на клетку варьирует от двух до ста и более. Во всех случаях половина из них прикреплена к одному полюсу, а другая половина – к другому полюсу. Периплазматические жгутики спиралевидно обвивают протоплазматический цилиндр. Их совокупность образует так называемую осевую нить. Поверх жгутиков (осевой нити) располагается многослойная наружная мембрана, которую часто называют наружной оболочкой спирохеты. Наружная мембрана полностью окружает спиралевидный протоплазматический цилиндр, так что жгутик окружен наружной мембраной и расположен между ней и цилиндром; поэтому он и получил название периплазматического жгутика, или эндожгутика. Он является важным компонентом аппарата подвижности спирохет. Основные отличия периплазматических жгутиков от экзоцеллюлярных жгутиков других бактерий в том, что они, во-первых, постоянно обвиваются вокруг тела клетки (ее протоплазматического цилиндра) и, во-вторых, полностью расположены внутри клетки, будучи окружены наружной мембраной. Вследствие этого подвижность спирохет отличается от подвижности других бактерий, у которых она осуществляется в жидкой среде за счет вращения жгутиков в направлении по часовой или против часовой стрелки, в зависимости от хемотаксических сигналов. Спирохеты обладают тремя основными типами движения в жидкой среде: вращательным вокруг своей оси, поступательным и сгибательным. Клетки спирохет сохраняют подвижность в среде с относительно высокой вязкостью, при которой другие жгутиковые бактерии утрачивают подвижность.

Рис. 111. Морфология актиномицетов и спирохет:
1 – актиномицеты; 2 – друза патогенного актиномицета; 3 – боррелии; 4 – трепонемы; 5 – лептоспиры; 6 – схематическое строение спирохеты. Объяснение в тексте
По типу дыхания спирохеты – анаэробы, факультативные анаэробы, микроаэрофилы и аэробы. Хемоорганотрофы. Источниками углерода и энергии для них служат углеводы, аминокислоты, жирные кислоты. Встречаются в природе как свободноживущие в воде и почве или паразитирующие в организме животных и человека. Различные виды непатогенных или условно-патогенных спирохет постоянно присутствуют в полости рта человека.
Содержание Г + Ц в ДНК спирохет варьирует от 32 до 66 мол %.
Размножаются спирохеты путем бинарного деления. Подобно другим бактериям, они обладают механизмами, позволяющими им переживать неблагоприятные условия. Под влиянием антибиотиков или иных факторов спирохеты претерпевают различные морфологические изменения: они могут превращаться в цисты (свертываются в клубок, выделяют слизь, которая, уплотняясь, образует оболочку цисты), коккоподобные тельца, гранулы, пузырьки, везикулы и сходные структуры и сохраняться в таком виде. При устранении неблагоприятных факторов эти структуры способны восстанавливаться в извитые подвижные спирохеты.
Боррелии – возбудители возвратных тифов
Возвратный тиф – трансмиссивное заболевание, характеризующееся общей интоксикацией, волнообразной лихорадкой, различной степени поражением печени и селезенки, иногда желтухой, менингитом, поражением других органов. Возбудитель эпидемического возвратного тифа – Borrelia recurrentis – был обнаружен в 1868 г. О. Обермейером в крови больного; в 1874 г. Г. Минх и в 1881 г. И. И. Мечников в опытах на себе доказали заразность крови больных возвратным тифом.
B. recurrentis – нитевидный спирально изогнутый микроорганизм размерами 0,2 – 0,5 × 3 – 20 мкм, имеющий 3 – 8, иногда до 10 – 12 завитков, концы возбудителя заострены (рис. 111.3). Завитки неравномерные, могут быть глубокими и мелкими, расстояние между ними варьирует от 2 до 4 мкм. Боррелии очень подвижны: могут совершать сгибательные, вращательные, поступательные движения. На каждом конце клетка содержит 7 – 30 фибрилл, которые обвиваются вокруг тела и частично перекрываются в середине организма с фибриллами, начинающимися от другого конца. Таким образом формируется осевая нить.
Данные о химическом составе боррелий скудные. Известно, что некоторые из них содержат лецитин, холестерол и некоторые другие неидентифицированные липиды. В клеточной стенке боррелий имеются мураминовая кислота и L-орнитин, так же как у представителей родов Treponema и Spirochaeta. Род Leptospira, наоборот, лишен L-орнитина, но содержит диаминопимелиновую кислоту, которая отсутствует у других родов спирохет. Спор и капсул не образуют.
Боррелии удлиняются и размножаются поперечным делением. Они грамнегативны, хорошо окрашиваются различными красителями и легко наблюдаемы в сравнении с другими спирохетами, которые тоньше и поэтому видны с трудом. По Романовскому – Гимзе красятся в сине-фиолетовый цвет. Боррелии, растущие in vitro, – микроаэрофилы, растут при 20 – 37 °C (оптимум 28 – 30 °C) и рН 7,2 – 7,4 на специальных средах, содержащих кровь, сыворотку или ткани животного происхождения. Хорошо размножаются в куриных эмбрионах. При выращивании боррелий на средах или в эмбрионах их патогенность для животных быстро утрачивается. Биохимические свойства боррелий практически не изучены. Известно, что глюкоза усваивается ими гликолитическим путем с образованием молочной кислоты. Для многих боррелий существенными факторами роста являются длинноцепочечные жирные кислоты, и установлено, что лизолецитин гидролизуется фосфолипазой В на альфа-глицерофосфорилхолин и одну жирную кислоту. Альфа-глицерофосфорилхолин затем расщепляется на холин и альфа-глицерофосфат под действием специфической диэстеразы. Кислая фосфатаза расщепляет альфа-глицерофосфат под действием специфической диэстеразы до глицерина и неорганического фосфата.
Имеются данные, что во время заболевания антигенная структура боррелий может меняться. Продуцируемые в начале заболевания антитела действуют как селективный фактор, в результате чего в организме сохраняются только варианты, имеющие антигенные отличия.
Таксономия боррелий разработана недостаточно глубоко. В основе деления боррелий на виды лежат учет вида их переносчика и географическое распространение (табл. 53). Cуществующую в настоящее время некоторую путаницу в названиях боррелий можно объяснить тем, что выделенные в различных регионах мира от разных хозяев и разных переносчиков боррелии при более подробном изучении оказываются антигенными вариантами одного и того же вида.
Таблица 53
Классификация боррелий
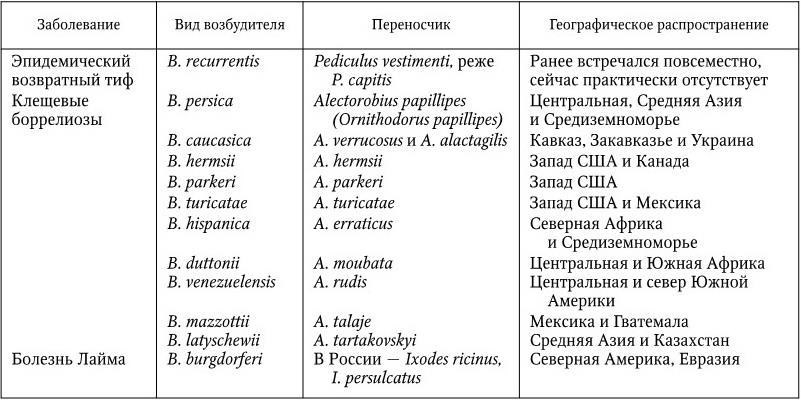
Патогенность боррелий связана с эндотоксином, освобождающимся при разрушении возбудителя под действием антител. Рецидивирующий характер заболевания связан с размножением таких антигенных вариантов, против которых макроорганизм еще не имеет антител. Полное выздоровление после 3 – 10 рецидивов наступает тогда, когда в организме появляются антитела ко всем соответствующим антигенным вариантам возбудителя.
Во внешней среде боррелии мало устойчивы: при температуре 50 °C погибают в течение 20 – 30 мин. В питательных средах в зависимости от температуры могут сохраняться от нескольких дней до нескольких месяцев. В крови при низкой температуре (4 °C) могут также сохраняться несколько месяцев.
Эпидемиология. Боррелии, патогенные для человека, переносятся платяными, реже головными, вшами (при эпидемическом возвратном тифе), аргасовыми клещами рода Alectorobius (прежнее название рода – Ornithodorus) при эндемическом возвратном тифе, иксодовыми клещами при болезни Лайма. При эпидемическом возвратном тифе источником инфекции является человек, особенно заразный в период лихорадочного приступа. Вошь становится заразной через 4 дня, а спирохеты сохраняются в организме вшей в течение 28 дней после сосания крови больного. Заражение человека происходит через поврежденную при укусе вшей кожу или через расчесы при втирании в них гемолимфы раздавленной вши, содержащей B. recurrentis. При эндемическом возвратном тифе источником инфекции являются животные – грызуны, хищники, обитающие в степях, пустынях и полупустынях, а также сами клещи-переносчики, у которых может наблюдаться трансовариальная передача возбудителя из поколения в поколение. Многие клещи приспособились к обитанию вблизи жилья человека, что приводит к возникновению антропургических (греч. anthropurgia – человеческая деятельность) очагов клещевого возвратного тифа.
Патогенез и клиника. Инкубационный период – 3 – 10 дней. Через кожу боррелии попадают в лимфатическую систему, захватываются клетками системы мононуклеарных фагоцитов, где и размножаются. Затем они поступают в кровь, что клинически проявляется ознобом, лихорадкой. Через несколько дней вырабатываются антитела, вызывающие гибель большей части спирохет, они перестают обнаруживаться в крови, и лихорадка прекращается. Гибель спирохет сопровождается освобождением эндотоксина, вызывающего интоксикацию, а также действующего на клетки эндотелия сосудов, в результате чего появляются геморрагические инфаркты во внутренних органах (печень, селезенка). Возможно наличие признаков менингита. Первый лихорадочный приступ продолжается 3 – 7 дней, затем сменяется периодом нормальной температуры, длящимся 4 – 10 дней. Потом развивается 2-й приступ лихорадки. Обычно наблюдается 3 таких приступа, редко количество их достигает 7 – 10, причем их интенсивность и продолжительность снижаются, а продолжительность периодов нормальной температуры увеличивается. Главное отличие клиники клещевого возвратного тифа от эпидемического – наличие первичного аффекта в месте укуса клеща. Сначала появляется розовое пятно, затем узелок с геморрагическим ободком. Кроме того, отмечается большее число приступов лихорадки и их меньшая продолжительность. Боррелии – возбудители клещевого возвратного тифа – могут быть обнаружены в крови больного как во время лихорадки, так и при нормальной температуре.
Иммунитет после перенесенной инфекции обычно непродолжительный.
Лабораторная диагностика. Основной метод диагностики возвратного тифа – микроскопический. Материалом для исследования служит кровь больного, взятая в лихорадочный период; в период ремиссии можно брать костный мозг. Препараты-
мазки окрашивают по Романовскому – Гимзе и под микроскопом обнаруживают на фоне клеточных элементов крови располагающиеся внеклеточно сине-фиолетового цвета боррелии (см. рис. 111.3). Иногда для диагностики возвратных тифов используют заражение белых мышей или молодых крыс. Через 2 – 4 дня для выявления спирохет используют кровь, взятую из хвостовой вены. Морские свинки не чувствительны к возбудителю эпидемического возвратного тифа, но чувствительны к другим патогенным боррелиям. Серологические реакции (лизиса, связывания комплемента, нагрузки боррелий тромбоцитами и др.) для диагностики используют редко.
Специфическая профилактика и лечение. Специфическая профилактика возвратных тифов не разработана, неспецифическая – предусматривает борьбу со вшивостью и предохранение от укусов клещей. Лечение проводится антибиотиками (тетрациклины, левомицетин, иногда пенициллины).
Болезнь Лайма
Болезнь Лайма (от названия города Лайм в штате Коннектикут, США, где впервые было описано заболевание) относится к группе иксодовых клещевых боррелиозов (ИКБ) – хронических рецидивирующих трансмиссивных природно-очаговых инфекций, поражающих ЦНС, сердечно-сосудистую и суставную системы, а также кожу. Заболевания этой группы называются также хронической мигрирующей эритемой.
Спирохетозную природу болезни Лайма установил в 1981 г. У. Бургдорфер, в честь которого возбудитель и получил название Borrelia burgdorferi. К настоящему времени установлено, что иксодовые клещевые боррелиозы вызывает целая группа близких видов боррелий, объединенных под названием B. burgdorferi sensu lato (т. е. в широком смысле), в которой различают более 10 самостоятельных видов. Пять из них циркулируют на территории России и других стран Европы: B. afzelii, B. garinii, B. lusitaniae, B. burgdorferi sensu stricto (т. е. в узком смысле, или собственно боррелия Бургдорфера – возбудитель истинной болезни Лайма) и B. valaisiana. Патогенность последней не доказана. Природные очаги ИКБ обнаружены во многих странах. По широте распространения и уровню заболеваемости ИКБ занимают одно из ведущих мест в мире среди природно-очаговых инфекций и представляют большую опасность для здоровья людей, поскольку болезнь часто приводит к длительной утрате трудоспособности и инвалидности. Очаги ИКБ в Евразии совпадают с ареалами основных переносчиков возбудителей – иксодовых клещей Ixodes ricinus в Европе и I. persulcatus – в Европе и Азии. Эти виды клещей служат также важнейшими резервуарами и переносчиками вируса клещевого энцефалита и некоторых видов эрлихий. Прокормителями этих клещей, а следовательно, и резервуарами возбудителей ИКБ, служит широкий круг поражаемых ими хозяев (птицы, грызуны, олени, собаки, лошади, другие домашние и дикие животные). Очаги ИКБ выявлены к 2000 г. на 50 административных территориях России. В Санкт-Петербурге регистрируется 250 случаев ИКБ в год (5 случаев на 100 000 жителей). В Пермской области уровень заболеваемости в 4 – 5 раз превышает средние показатели по стране.
Генетическая особенность B. burgdorferi состоит в наличии у нее как линейной, так и кольцевой ДНК, что сообщил в 1999 г. У. Бургдорфер. По другим данным, обнаружена также линейная плазмида, кодирующая синтез белков наружной мембраны, с которыми связаны патогенные свойства возбудителя. Заражение ИКБ происходит через укусы клещей. Со слюной клеща боррелии проникают в кожу в месте укуса, где часто, но не всегда, развивается первичная эритема диаметром от 3 – 5 до 15 – 20 см, центр которой бледнее периферии. После лимфогенной или гематогенной диссеминации возбудителя поражается кожа (вторичная эритема), развиваются невриты черепно-мозговых нервов, менингит, энцефалит, кардиты, артриты, акродерматит. При заражении возбудителем нейроборрелиоза (B. garinii) эритема может отсутствовать.
Для первичного обнаружения живых боррелий у клещей используют метод темнопольной микроскопии, который, с целью идентификации возбудителя, должен быть дополнен более точными методами диагностики, включая ЦПР. Из крови, ликвора или тканей больного боррелии выделяются с трудом. Для обнаружения IgM (ранние стадии заболевания) и IgG (спустя несколько месяцев) используют непрямую реакцию иммунофлуоресценции и ИФМ со специфическим антигеном.
Специфическая профилактика не разработана. Для лечения используют тетрациклины и бета-лактамные антибиотики.
Бледная трепонема – возбудитель сифилиса
Сифилис – циклически протекающее венерическое заболевание человека, вызываемое бледной спирохетой; I стадия проявляется твердым шанкром (фр. chancre – язва), II стадия – поражением стенки сосудов и различными сыпями, III – гуммами в различных органах с поражением нервной системы. Гумма (лат. gummi – камедь) – хронический инфильтрат в виде узла, склонный к распаду и изъязвлению. Сифилитическая гумма (син.: сифилитическая гранулема, сифилид гуммозный, сифилома третичная) – безболезненная полушаровидная гумма, являющаяся проявлением третичного активного сифилиса. Возбудитель – Treponema pallidum – был открыт в 1905 г. Ф. Шаудином и Э. Гофманом.
T. pallidum – микроорганизм спиралевидной формы, размерами 0,09 – 0,18 × 6 – 20 мкм. Число завитков спирали от 8 до 12, завитки равномерны, расположены друг от друга на одинаковом расстоянии около 1 мкм, высота по направлению к концам уменьшается. В электронном микроскопе имеет вид змеи или дождевого червя. На обоих концах трепонемы расположены блефаропласты с прикрепленными к ним жгутиками, число которых варьирует от двух до нескольких, они образуют осевую нить, закрученную вокруг протоплазматического цилиндра спирохеты. При неблагоприятных условиях может образовывать цисты. В организме животных может возникать мукополисахаридной природы капсулоподобный чехол.
Трепонема плохо окрашивается анилиновыми красителями, в связи с чем возбудитель сифилиса и получил название бледной спирохеты. Восстанавливает нитрат серебра в металлическое серебро, которое откладывается на поверхности микроба и делает его видимым в тканях: при окраске по Морозову трепонемы выглядят коричневыми или почти черными. При окраске по Романовскому – Гимзе приобретают бледно-розовый цвет.
Трепонемы обычно размножаются поперечным делением, при этом разделившиеся клетки могут в течение некоторого времени прилегать друг к другу. Время деления – около 30 ч.
Живые трепонемы очень подвижны, совершают движения вокруг собственной продольной оси, а также сгибательное, волнообразное и поступательное движение.
До настоящего времени пока нет такого метода, при котором бы удавалось стабильно получать культуры трепонем. Патогенные для человека бледные трепонемы никогда не удавалось культивировать на искусственных питательных средах, в куриных эмбрионах или культурах клеток. Те разновидности их штаммов, которые растут в анаэробных условиях, являются, вероятно, сапрофитными спирохетами, близкими к возбудителю сифилиса. Физиология их остается мало изученной. Трепонемы относятся к хемоорганотрофам, не имеют каталазы и оксидазы, могут сбраживать углеводы. Они растут на очень богатых средах, содержащих до 11 аминокислот, витамины, соли, сывороточный альбумин. Наилучшим способом выращивания патогенных спирохет является заражение кролика в яичко (экспериментальный орхит). Высказано предположение о существовании у T. pallidum жизненного цикла, включающего, помимо спиралевидной формы, зернистую стадию и стадию кистоподобных сферических тел. Именно зернистые формы этих микроорганизмов способны проходить через бактериальные фильтры.
Антигены трепонем плохо изучены. Установлено, что в составе трепонем имеются белковые, полисахаридные и липидные комплексы. Антигенный состав культуральных и тканевых трепонем настолько близок, что антигены, приготовленные из культуральных трепонем, можно использовать для РСК при диагностике сифилиса. В организме человека трепонемы стимулируют выработку антител, которые вызывают иммобилизацию и гибель живых подвижных трепонем, связывают комплемент в присутствии суспензии T. pallidum или родственных спирохет, а также выявляются в непрямой РИФ.
Возбудитель сифилиса не образует экзотоксинов. К внешним воздействиям бледные трепонемы относительно малоустойчивы. Быстро погибают при высушивании и при повышенных температурах (при 55 °C в течение 15 мин). В 0,3 – 0,5 % растворе HCl моментально утрачивают свою подвижность; так же быстро утрачивают ее и погибают в присутствии препаратов мышьяка, висмута, ртути. В цельной крови или в сыворотке при 4 °C сохраняют жизнеспособность в течение 24 ч, что следует учитывать при переливании крови.
Эпидемиология. Сифилис – типичное венерическое заболевание. Источник инфекции – больной человек, обычно заразен в течение 3 – 5 лет; больные с поздними формами сифилиса не заразны. Заражение в подавляющем большинстве случаев происходит при различных видах половых и бытовых контактов, редко трансплацентарным путем от больной матери ребенку (врожденный сифилис) или как профессиональное заражение контактным путем у медицинского персонала. В естественных условиях сифилисом болеет только человек, в эксперименте возможно заражение обезьян, хомячков и кроликов. У обезьян в месте введения трепонем развивается твердый шанкр, у кроликов и хомячков инфекция протекает бессимптомно.
Патогенез и клиника. Инкубационный период при приобретенном сифилисе варьирует от 2 до 10 нед., обычно 20 – 28 дней. Входными воротами инфекции чаще всего являются слизистые оболочки половых органов, реже – полости рта, а также поврежденная кожа. В месте внедрения возбудитель размножается, формируется первичная сифилома (твердый шанкр) – эрозия или язва с уплотненным основанием. Далее возбудитель попадает в лимфатическую систему, развивается лимфангоит и регионарный лимфаденит. Это типичная клиника первичного сифилиса, который продолжается 1,5 – 2 мес. Потом эти признаки исчезают. Вторичный период сифилиса связан с генерализацией процесса, когда увеличиваются многие лимфатические узлы, а на коже и слизистых оболочках появляются высыпания; могут наблюдаться поражения внутренних органов и нервной системы. Различают вторичный свежий и вторичный рецидивирующий сифилис. При каждом последующем рецидиве интенсивность сыпи становится все менее выраженной, а периоды между рецидивами увеличиваются. В элементах сыпи содержится большое количество живых трепонем, в этот период больной наиболее заразен. Продолжительность вторичного сифилиса – до 4 лет и более. Далее болезнь вступает в длительный бессимптомный период, по прошествии которого, через несколько лет, развивается третичный сифилис. При этом наблюдаются грубые органические поражения внутренних органов, сердечно-сосудистой системы, ЦНС, костей, формируются гуммы, сопровождающиеся распадом ткани и дегенеративными изменениями. Характерной клинической особенностью сифилиса является отсутствие каких-либо субъективных жалоб со стороны больного (боль, зуд, жжение и т. д.).
Иммунитет. Против сифилиса ни естественного, ни искусственного иммунитета не возникает; есть только инфекционный иммунитет, и пока он существует, человек практически не восприимчив к новому заражению. Инфекционный иммунитет развивается через 10 – 11 дней после появления твердого шанкра (шанкерный иммунитет), в этот период повторное заражение или не наблюдается, или новый образовавшийся шанкр протекает абортивно (суперинфекция). В дальнейшем при суперинфицировании характер возникающих поражений соответствует стадии болезни в момент повторного заражения. Суперинфекция объясняется временным ослаблением или «срывом» инфекционного иммунитета. От суперинфекции необходимо отличать реинфекцию, т. е. новое, повторное заражение человека, ранее болевшего сифилисом (излечившегося) и, следовательно, утратившего инфекционный иммунитет. Описаны случаи даже трехкратного заболевания сифилисом. Инкубационный период у таких больных короче, чаще развиваются множественные язвенные шанкры с лимфаденитом, серологические реакции становятся положительными раньше. Во вторичном периоде папулы на коже нередко эрозируются. Это объясняется тем, что при сифилисе развивается реакция гиперчувствительности замедленного типа, после излечения в организме длительно сохраняются сенсибилизированные лимфоциты. Инфекционный иммунитет имеет нестерильный характер и обусловлен гуморальными факторами: в сыворотке больного обнаруживаются иммуноглобулины классов G, A и М.
Лабораторная диагностика. Для диагностики сифилиса оптимален комплексный подход, предполагающий одновременное использование нескольких методов. Их традиционно подразделяют на прямые, позволяющие доказать наличие возбудителя в исследуемом материале (заражение животных, различные виды микроскопии и молекулярно-генетические методы детекции ДНК T. pallidum – ПЦР и ДНК-зондирование), и непрямые – серологические тесты для выявления антител. В свою очередь, серологические тесты представлены нетрепонемными и трепонемными.
Исследуемым материалом для обнаружения трепонем в прямых методах является отделяемое твердого шанкра или его пунктат, пунктат лимфатического узла, соскоб из розеолы, ликвор. Лучше всего в нативном материале возбудитель выявляется темнопольной (см. рис. 111.4) или фазово-контрастной микроскопией, что позволяет наблюдать разные типы движения живого возбудителя. Если уже начато лечение антибиотиками, возбудителя в патологическом материале обнаружить невозможно. При необходимости проводят прямую (или непрямую) РИФ или окрашивают препарат по Романовскому – Гимзе. Эти методы используют только для ранней диагностики сифилиса.
Серологические тесты можно использовать на различных стадиях заболевания, кроме серонегативного первичного сифилиса. Обычно применяют комплекс серологических реакций. К нетрепонемным тестам с визуальным определением результатов относятся: реакция связывания комплемента (реакция Вассермана = РСКк = RW) с кардиолипиновым антигеном сердечной мышцы быка (перекрестно реагирующий антиген), реакция микропреципитации (МР, или РМП) – микрореакция с плазмой и инактивированной сывороткой; RPR – тест быстрых плазменных реагинов, и другие реакции. Специалисты считают, что для массового обследования лучше всего применять два теста: RPR и РПГА или ИФА, так как RPR более чувствителен при первичном сифилисе, РПГА – на более поздних стадиях заболевания, а ИФА – на всех стадиях. К нетрепонемным тестам с микроскопическим считыванием результатов относятся VDRL-тест и USR-тест. Нетрепонемные тесты используют в качестве отборочных (скрининговых), так как они могут давать ложноположительные результаты. В трепонемных тестах используют антигены трепонемного происхождения. Их применяют для подтверждения результатов нетрепонемных тестов (ложноположительны?) при клиническом, эпидемиологическом и анамнестическом подозрении на сифилис, для диагностики скрытых и поздних форм, для ретроспективного диагноза. К трепонемным тестам относят: РСКт (РСК с трепонемным антигеном), РИБТ (или РИТ) – реакция иммобилизации бледных трепонем, РИФ (одна из лучших реакций), РПГА, ИФА, иммуноблотинг.
Специфическая профилактика и лечение. Специфическая профилактика не разработана. Неспецифическая профилактика предусматривает воздержание от случайных половых связей, раннее выявление больных, особенно со скрытой формой заболевания, и их своевременное и эффективное лечение. Для лечения сифилиса используют антибиотики: пенициллин и его производные (водорастворимые и дюрантные формы), иногда эритромицин. Используют также препараты висмута, мышьяка, ртути.
Другие трепонематозы
Возбудителями этих заболеваний являются трепонемы, неотличимые от T. pallidum — T. pertenue, T. carateum, T. bejel. При этих заболеваниях наблюдаются положительные биологические реакции на сифилис; перекрестный иммунитет установлен как в опытах на животных, так и у человека. Эти заболевания не являются венерическими, передача возбудителя обычно происходит контактным путем. Ни один из возбудителей трепонематозов не растет на искусственных питательных средах. В настоящее время известны четыре трепонематоза: сифилис, фрамбезия, пинта и беджел, хотя самостоятельность последнего оспаривается, многие авторы считают его тождественным сифилису. Все эти заболевания вызываются родственными трепонемами. О близком родстве возбудителей свидетельствуют не только их принадлежность к одному роду, сходство патогенеза и клиники заболеваний, но также биологическая и иммунологическая близость трепонем, в связи с чем серологические реакции при сифилисе применяются и для диагностики других трепонематозов, а методы их лечения почти одинаковы.
Фрамбезия – эндемическое заболевание, встречающееся в странах с жарким и влажным тропическим климатом. Возбудитель – T. pertenue – по своим морфологическим, культуральным, тинкториальным свойствам и подвижности неотличим от бледной трепонемы. Болеют преимущественно дети до 15 лет, передача инфекции происходит путем прямого контакта. Первичный очаг – изъязвляющаяся папула – локализуется обычно на конечностях. Типично образование рубцов на месте поражений кожи и разрушение костей; осложнения со стороны внутренних органов и ЦНС наблюдаются крайне редко. Трансплацентарной передачи инфекции не бывает.
Пинта – заболевание эндемично среди населения всех возрастов в Мексике, Центральной и Южной Америке, на Филиппинах и некоторых островах Тихого океана. Болеют преимущественно лица с темным цветом кожи. Первичный очаг – неизъязвляющаяся папула – возникает в месте внедрения возбудителя, которым является T. carateum. Через несколько месяцев на коже появляется плоский гиперпигментированный участок, впоследствии развиваются депигментация и гиперкератоз. На более поздних стадиях могут развиваться поражения сердечно-сосудистой и нервной систем. Иногда передача возбудителя может осуществляться при помощи мух рода Hippelates.
Беджел распространен преимущественно в странах Аравийского полуострова, изредка встречается в Африке, Юго-Восточной Азии. Возбудитель – T. bejel – практически идентичен бледной трепонеме. Чаще болеют дети, и заболевание характеризуется поражениями кожи и слизистых оболочек, позднее иногда развиваются поражения, очень сходные с гуммозными проявлениями сифилиса.
Лептоспиры – возбудители лептоспирозов
Лептоспироз – природно-очаговое инфекционное заболевание, характеризующееся поражением капилляров, почек, печени, мышц, сердечно-сосудистой и нервной систем, сопровождающееся или не сопровождающееся желтухой.
Возбудитель лептоспироза впервые был описан и изучен Р. Инадо и У. Идо в 1915 г. и назван Leptospira icterohaemorrhagiae. Позднее были открыты другие лептоспиры.
Лептоспиры имеют вид плотно закрученной пружины, состоящей из 12 – 18 завитков (завитки первого порядка). Осевую нить образуют два или большее число периплазматических жгутиков, каждый из которых одним своим концом прикреплен к одному из полюсов протоплазматического цилиндра, и они редко перекрываются в центральной части клетки. Средняя длина лептоспир от 7 до 15 мкм, но может варьировать от 3 до 30 мкм. Диаметр лептоспир 0,07 – 0,14 мкм, амплитуда первичного завитка около 0,25 мкм. Мелкие завитки спирали тесно примыкают друг к другу (в среднем на 9 мкм 18 завитков), что придает лептоспирам при темнопольной микроскопии вид нитки жемчуга (см. рис. 111, 5) или гирлянды роз, они могут выглядеть и как цепочки мелких кокков. Один конец лептоспиры, а иногда и оба могут быть загнуты в виде крючка (завитки второго порядка), образуя С– или S-образные структуры. Живые лептоспиры очень подвижны, совершают вращательные, скользящие и маятникообразные движения. Спор и капсул не образуют.
Анилиновые красители воспринимают с трудом, по Романовскому – Гимзе окрашиваются в бледно-розовый цвет. Легко импрегнируются серебром.
Патогенные лептоспиры хорошо растут в аэробных условиях на жидких и полужидких средах, обязательно содержащих 5 – 10 % кроличьей сыворотки. Оптимальная температура роста 28 – 30 °C, но могут расти в пределах от 22 до 37 °C. Оптимальная для роста рН 7,1 – 7,4. Растут лептоспиры сравнительно медленно, рост обнаруживается не ранее 5 – 8 сут. В полужидких средах образуются колонии округлой формы диаметром 1 – 3 мм. В молодых культурах в области наиболее пышного роста в 1,5 – 2 см от поверхности наблюдается легкое помутнение в виде кольца. В жидких средах культуры прозрачны, не имеют запаха, при пышном росте определяется опалесценция, заметная в проходящем свете при легком встряхивании пробирки. Рост лептоспир в культурах контролируют с помощью микроскопии в темном поле.
Лептоспиры получают энергию путем окисления длинноцепочечных (не менее 14 атомов углерода) жирных кислот и не могут использовать в качестве источников энергии аминокислоты или углеводы. Основным источником азота для них являются соли аммония. В воде, особенно при щелочной реакции среды, лептоспиры могут сохранять жизнеспособность в течение нескольких недель.
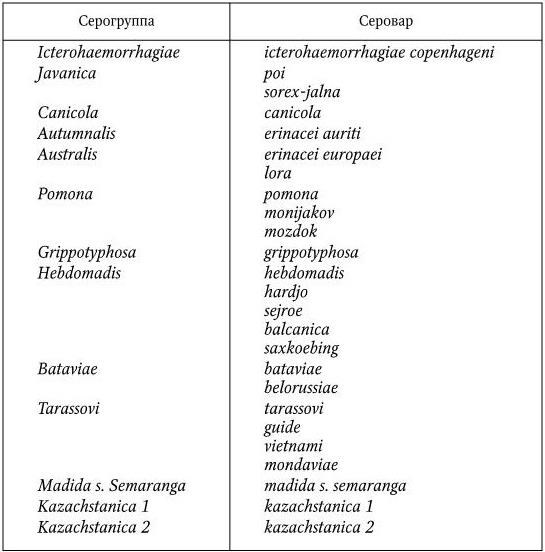
Все патогенные лептоспиры объединены в один вид – Leptospira interrogans, в который входят различные серологические варианты. Известно более 200 сероваров, объединенных в 38 серогрупп. На территории СНГ выделены 27 сероваров, относящихся к 13 серогруппам (табл. 54). Основные штаммы лептоспир, выделенные от животных и человека в разных странах, имеют сходную антигенную структуру и при постановке серологических реакций дают положительные перекрестные результаты. Поэтому для специфической серологической диагностики необходимо использовать количественное определение антител к различным сероварам лептоспир. Из многих штаммов лептоспир выделен антиген липополисахаридной природы, дающий групповые реакции.
Таблица 54
Лептоспиры, выделенные от людей и животных в СНГ
Основным фактором патогенности лептоспир является эндотоксин, выделяющийся при разрушении возбудителя и вызывающий общую интоксикацию, а также кровоизлияния за счет повышения проницаемости сосудов, разрушения эндотелия и выпотевания крови из сосудов в ткани.
Лептоспиры устойчивы в окружающей среде, сохраняются в воде открытых водоемов до 30 дней и более, во влажной почве – до 270 дней, на пищевых продуктах – от нескольких часов до нескольких дней. Дольше сохраняются во влажной среде при рН 7,0 – 7,4 и при низких температурах. Погибают при высушивании и действии прямых солнечных лучей. При кипячении гибнут мгновенно, быстро инактивируются дезинфицирующими веществами в рабочих концентрациях.
Эпидемиология. Различают природные и антропоургические очаги лептоспироза. Источниками инфекции в природных очагах являются грызуны, насекомоядные, парнокопытные, хищные млекопитающие многих видов, реже птицы. Наибольшее значение имеют мыши, полевки, ондатры. В антропоургических очагах источники инфекции – крупный и мелкий рогатый скот, лошади, свиньи, собаки, домовые мыши и крысы. У животных лептоспироз может протекать бессимптомно, а лептоспиры могут выделяться с мочой в течение нескольких месяцев. Заражение людей происходит при купании и использовании для бытовых нужд воды из открытых водоемов, инфицированных мочой больных животных, при контакте с сырьем, употреблении продуктов, содержащих живые лептоспиры. Больные лептоспирозом люди не опасны для окружающих. Заболевание носит сезонный характер (пик – июль – август). Наиболее частыми в России возбудителями лептоспироза являются L. pomona, L. monijakov, L. grippotyphosa, L. tarassovi, L. canicola, L. icterohaemorrhagiae.
Патогенез и клиника. Возбудитель проникает в организм через слизистые оболочки и поврежденную кожу; с током крови попадает в печень, почки, селезенку, проникает через гематоэнцефалический барьер в ЦНС; в тканях этих органов лептоспиры размножаются. Затем они опять поступают в кровь, обусловливая генерализацию инфекции, лихорадку и интоксикацию. Бывают желтушные и безжелтушные формы лептоспироза. Инкубационный период в среднем 7 – 10 дней. Начало заболевания острое: озноб, высокая температура, характерны головная и мышечная боли, особенно в икроножных мышцах. Возможны сыпь, диспептические явления, признаки менингита. Позже или почти сразу начинают нарастать явления почечной (при безжелтушной форме) или почечно-печеночной (при желтушной форме) недостаточности. Летальность составляет 3 – 4 %.
Иммунитет. После перенесенной лептоспирозной инфекции формируется длительный стойкий иммунитет, имеющий типоспецифический характер. Во время болезни появляются агглютинины, комплементсвязывающие антитела и лизины. Сыворотка переболевших лептоспирозом людей защищает лабораторных животных от гибели при заражении их заведомо смертельной дозой возбудителя.
Лабораторная диагностика. Для диагностики лептоспироза используют микроскопический, бактериологический, серологический и биологический методы. Для микроскопии в начале заболевания (на фоне лихорадки) в качестве исследуемого материала используют кровь, при явлениях менингита – ликвор, в более поздние сроки заболевания (с 10 – 12-го дня) – центрифугат мочи. Эффективнее всего лептоспиры обнаруживаются в «раздавленной» капле при темнопольной микроскопии, реже препараты красят по Романовскому – Гимзе или методом серебрения в фиксированном состоянии. Для выделения чистой культуры тот же материал засевают на жидкие и полужидкие питательные среды. Идентифицируют лептоспиры при помощи реакции агглютинации с типовыми сыворотками. При биологическом методе заражают свежей плазмой или мочой больного молодых кроликов или хомячков, которые при внутрибрюшинном заражении погибают через 10 – 14 дней, во многих органах обнаруживаются геморрагические очаги, содержащие лептоспиры. Эти исследования должны проводиться только в специализированных лабораториях. Для обнаружения специфических антител проводят исследование парных сывороток крови больного в реакциях микроагглютинации и лизиса. Для постановки реакции микроагглютинации используют живые культуры лептоспир; агглютинацию выявляют при микроскопии. Перекрестная адсорбция сывороток позволяет производить определение типоспецифических антител. При использовании живых лептоспир вслед за агглютинацией может произойти их лизис. Применяют также РПГА, в которой используют диагностикум из эритроцитов с адсорбированными на них лептоспирами.
Специфическая профилактика и лечение. Вакцинация проводится по эпидемиологическим показаниям. Для этой цели в России недавно предложена в дополнение к вакцине А. А. Варфоломеевой и Г. Н. Ковальского более эффективная и менее реактогенная концентрированная инактивированная стандартизованная поливалентная вакцина. Она содержит антигены наиболее распространенных в стране серогрупп лептоспир. Для специфического лечения применяют гамма-глобулин из крови гипериммунизированных волов, содержащий антитела к различным сероварам лептоспир. В качестве этиотропных препаратов эффективны также антибиотики (пенициллин, тетрациклины).
Патогенные спириллы
Единственной патогенной для человека спириллой является Spirillum minus, представитель рода Spirillum, который вместе с родом Campylobacter и другими 17 родами по классификации Берги-9 отнесен в группу аэробных (или микроаэрофильных) подвижных, вибриоидных грамотрицательных бактерий. S. minus – толстая изогнутая палочка размером 0,2 – 0,5 × 3 – 5 мкм с 2 – 3 изгибами, имеет биполярно расположенные жгутики (одиночные или множественные), грамотрицательна. По мнению ряда авторов, целесообразно S. minus включить в род Campylobacter. Аэроб или микроаэрофил, на искусственных средах не растет. Хемоорганотроф. Является естественным паразитом ротовой полости, иногда крови крыс. Патогенен также для морских свинок и мышей. Биологические свойства и факторы патогенности мало изучены.
У человека S. minus вызывает болезнь сод]оку (лихорадка укуса крыс). Заражение происходит при укусе крыс и приводит к развитию местного очага поражения с последующим вовлечением в процесс регионарных лимфатических узлов, появлению высыпаний на коже и лихорадки рецидивирующего типа. Летальность до 10 %. Диагностика основана на обнаружении возбудителя в патологическом материале при микроскопии в темном поле или на заражении чувствительных животных кровью больного, взятой во время лихорадки.
В настоящее время содоку встречается крайне редко.

