Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 63 Листерии, легионеллы и вызываемые ими болезни
Дальше: Глава 65 Микобактериозы
Глава 64
Патогенные анаэробы
В отличие от аэробов и факультативных анаэробов, строгие (облигатные) анаэробы живут только в условиях либо полного отсутствия кислорода, либо при незначительном его содержании. Однако они столь же широко распространены в природе, как и первые. Естественной средой их обитания являются почва, особенно ее глубокие слои, ил различных водоемов, сточные воды, кишечный тракт млекопитающих животных, птиц, рыб и человека. Анаэробы встречаются всюду, где есть органические или неорганические вещества и нет кислорода. Им принадлежит важная роль в процессах круговорота веществ в природе, в особенности азота и углерода, так как они обусловливают процессы соответственно гниения и брожения. Вместе с тем строгие анаэробы составляют основную массу нормальной микрофлоры кишечника человека и млекопитающих животных, играют важную роль в обеспечении их видового иммунитета и поддержании нормальной жизнедеятельности.
Строгие анаэробы можно разбить на 2 основные группы – спорообразующие и не образующие спор. Первую группу относят к роду Clostridium (класс Clostridia)а не образующие спор грамотрицательные бактерии – к родам Bacteroides (класс Bacteroidetes), Fusobacterium, Porphyromonas, Prevotella, Selenomonas. Грамположительные не образующие спор бактерии относят к роду Bifidobacterium (класс Actinobacteria) и Lactobacillus (класс Bacilli). Существуют другие анаэробы и среди грамположительных семейства Micrococcaceae и Streptococcaceae), и грамотрицательных (род Veilonella, класс Cloctridia) кокков.
К строгим анаэробам относятся также метанообразующие (Methanobacteriaceae) и некоторые другие бактерии. В патологии человека и животных основную роль играют анаэробные спорообразующие бактерии, относящиеся к роду Clostridium, а также неспорообразующие бактерии, принадлежащие к родам Bacteroides, Fusobacterium, Campylobacter и Helicobacter.
Клостридии
Бактерии рода Clostridium образуют овальные или круглые споры, располагающиеся субтерминально, центрально или терминально. Как правило, споры имеют диаметр больше диаметра вегетативной клетки, поэтому палочка со спорой приобретает сходство с веретеном, отсюда и произошло название рода Clostridium (веретеноподобные). Клостридии чрезвычайно широко распространены в природе. Естественной средой их обитания служит кишечник травоядных животных и человека, а также почва, куда они поступают с испражнениями. В кишечнике человека и животных клостридии появляются вскоре после рождения. Удобренная навозом земля полей, пастбищ, огородов и садов всегда содержит споры клостридий, которые при благоприятных условиях могут прорастать, а клостридии – размножаться (в летнее время и при наличии в почве необходимых питательных веществ). Для некоторых видов клостридий именно почва, содержащая органические вещества, является естественной средой обитания. Проникнув вместе с кормом и пищей, загрязненными почвой, в кишечник животных и человека, клостридии обычно не вызывают заболевания. Патогенные клостридии вызывают заболевание в тех случаях, когда они проникают в раны, т. е. являются возбудителями раневых инфекций – газовой гангрены и столбняка; или когда они попадают в пищевые продукты, размножаются в них, выделяют экзотоксины и вызывают пищевые токсикоинфекции (например, ботулизм). В иных случаях клостридиальная инфекция может иметь эндогенную природу, например, псевдомембранозный колит возникает как следствие нерациональной антибиотикотерапии, в результате которой в кишечнике начинает интенсивно размножаться Clostridium difficile, вызывая эту тяжелую болезнь.
Ключевые признаки рода Clostridium: крупные палочки с закругленными концами, обычно подвижные, с перитрихиальными жгутиками, иногда неподвижные. Они образуют овоидные или круглые споры, которые расширяют клетку; грамположительны, по крайней мере, в течение ранней стадии роста; хемоорганотрофы, не восстанавливают сульфаты. Некоторые виды обладают сахаролитическими, другие – протеолитическими свойствами; некоторые виды – обоими, некоторые – ни теми, ни другими. Ферментируют глюкозу и другие углеводы с образованием кислоты и газа, некоторые штаммы не ферментируют глюкозу. Большинство штаммов является строгими анаэробами, хотя некоторые могут расти в присутствии воздуха. Некоторые виды фиксируют азот; каталазы обычно не образуют, а когда она есть, то в небольшом количестве. Содержание Г + Ц в ДНК варьирует в пределах 23 – 43 мол %.
Род Clostridium включает большое количество видов. Для удобства идентификации род поделен на четыре группы по локализации спор и способности разжижать желатин.
I. Споры располагаются субтерминально:

Виды, требующие специальных условий роста, выделены в группу V (виды 57 – 61).
По крайней мере еще 36 видов клостридий были выделены из клинического материала от людей и 24 вида – от больных животных. Однако лишь для немногих доказана патогенность для человека и животных. К их числу относятся следующие виды: C. tetani – споры располагаются терминально, гидролизуют желатин – группа IV; C. botulinum, C. perfringens, C. novyi, C. septicum, C. sordellii, C. histolyticum, C. difficile, C. sporogenes (расположение спор субтерминальное, желатин гидролизуют, относятся к группе II). Основные различия между этими видами представлены в табл. 47.
Таблица 47
Дифференциальная характеристика некоторых видов клостридий
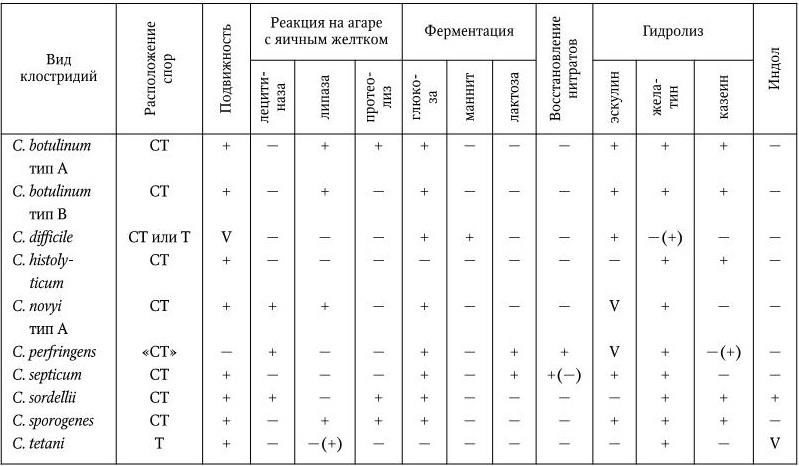
Примечание. СТ – субтерминальное; «СТ» – субтерминальные споры редко; Т – терминальное; (+) – тест положительный; ( – ) – тест отрицательный; V – тест вариабельный; (+)( – ) – реакция проявляется у 11 – 25 % изученных штаммов.
Микробиология газовой гангрены
Газовая гангрена – тяжелая раневая инфекция, для которой характерны глубокая общая интоксикация и прогрессирующее омертвение тканей, сопровождающееся их отеком и газообразованием. В литературе известно несколько десятков названий этой болезни, общепризнанными являются «газовая гангрена» и «анаэробная инфекция». Заболевание известно с древних времен. Первое описание сделал в 1562 г. А. Паре под названием «госпитальная гангрена». Классическое описание симптомов газовой гангрены дал в 1864 г. Н. И. Пирогов. Он же отметил связь этой болезни с войной и произвел анализ условий, способствующих ее возникновению и распространению. Газовая гангрена является полимикробной инфекцией. К ее возбудителям относят: C. perfringens, C. novyi, C. septicum, C. histolyticum, C. sordellii, C. difficile и C. sporogenes. Первое место в этиологии газовой гангрены принадлежит C. perfringens, второе – C. novyi, однако нередко анаэробы – возбудители газовой гангрены – обнаруживаются в ранах в стойких ассоциациях не только друг с другом, но и с аэробными гноеродными кокками и гнилостными анаэробными бактериями. Различные сочетания возбудителей газовой гангрены с аэробными и анаэробными гноеродными и гнилостными бактериями могут значительно усугубить тяжесть течения анаэробной инфекции.
Основные свойства возбудителей газовой гангрены. Clostridium perfringens открыт в 1892 г. М. Уэлчем и Г. Натталом. Нормальный обитатель кишечника человека и животных, в почве в виде спор сохраняется годами и обнаруживается почти в 100 % ее образцов. Представляет собой толстую неподвижную грамположительную палочку со слегка закругленными концами, длиной 3,0 – 9,0 мкм и диаметром 0,9 – 1,3 мкм. Споры овальные, располагаются субтерминально или, чаще, центрально, образуются лучше в щелочной среде. В материале из ран и на среде с сывороткой образуют капсулу. Температурный оптимум для роста 45 °C, растет в диапазоне 20 – 50 °C. Содержание Г + Ц в ДНК – 24 – 27 мол %.
На жидких средах C. perfringens быстро растет, вызывая помутнение и энергичную ферментацию глюкозы с образованием кислоты и газа; ферментирует также лактозу, мальтозу и сахарозу, но не ферментирует маннит; молоко створаживает через 3 – 5 ч с образованием рыхлого сгустка и с отделением прозрачной сыворотки; разжижает желатин; на кровяном агаре образует колонии диаметром 2 – 5 мм с зоной гемолиза и приподнятым центром. В столбике агара образуются дисковидные колонии.
C. perfringens обладает высокой инвазивностью и сильной токсигенностью. Первая связана со способностью возбудителя вырабатывать гиалуронидазу и другие ферменты, которые оказывают также и разрушающее действие на клетки соединительной ткани и мышцы. Главным фактором патогенности C. perfringens является вырабатываемый им сложного состава экзотоксин. Гемотоксическое, некротоксическое, нейротоксическое, лейкотоксическое и летальное действия связаны с различными компонентами экзотоксина. Отдельные штаммы C. perfringens синтезируют экзотоксины разного состава и разной антигенной специфичности, в соответствии с которой различают 6 серологических типов этого возбудителя: A, B, C, D, E, F.
Серотип А – один из главных возбудителей газовой гангрены у людей. Его токсин содержит не менее 6 компонентов: альфа, эта, тэта, каппа, мю, ню (α, η, θ, χ, μ, ν), главным из которых является альфа-лецитиназа С. Способность других серотипов C. perfringens вызывать газовую гангрену зависит также во многом от продукции ими различных компонентов экзотоксина, в том числе альфа-, бета-, тэта-, эпсилон– и др.
При заражении животных C. perfringens наблюдается обширное отслоение кожных покровов, распад мышечной ткани, кровянистый экссудат, пузырьки газа в подкожной клетчатке; мышцы дряблые, серого цвета, имеют вид вареного мяса. Некоторые серотипы C. perfringens (A, C, D, F) являются виновниками пищевых токсикоинфекций и тяжелых энтеритов, в патогенезе которых установлена ведущая роль некротоксинов и энтеротоксинов. Они продуцируются наиболее активно во время споруляции клостридий. C. perfringens типа D вырабатывает энтеротоксин в виде неактивного протоксина, активацию которого осуществляет протеаза.
Clostridium novyi открыт в 1894 г. Ф. Нови. Грамположительная полиморфная толстая палочка с закругленными концами, диаметром 0,8 – 1,4 мкм и длиной 1,6 – 2,5 мкм, нередко располагается в виде цепочек из 2 – 5 клеток. Капсулы не образует, подвижный перитрих (серотип С неподвижен). Споры овальные или круглые, располагаются субтерминально, редко – центрально. Наиболее строгий анаэроб, на жидких средах растет в виде легкого помутнения, дает большой осадок, наблюдается умеренная ферментация глюкозы с образованием газа. Молоко свертывает медленно, желатин разжижает. На кровяном агаре она образует серые бугристые колонии с приподнятым центром, отходящими отростками и зоной гемолиза;
в столбике с агаром дает хлопьевидные колонии; ферментирует глюкозу, мальтозу, не ферментирует лактозу. Патогенность C. novyi обусловлена его способностью продуцировать очень сильный экзотоксин сложного состава, вызывающий при заражении животных характерный бесцветный или розового цвета отек желеобразной консистенции. Токсин обладает также гемолитическим и летальным свойствами. Различают 3 основных типа C. novyi – A, B и C. Тип А продуцирует альфа-, гамма-, дельта-, эпсилон-экзотоксины, с которыми связана его способность вызывать заболевание у людей. Оптимальная температура для роста 40 – 45 °C. Содержание Г + Ц в ДНК – 23 мол %. Тип В продуцирует альфа-, бета-, дзэта– и эта-токсины. Оптимальная температура для роста C. novyi 37 °C, растет в диапазоне 25 – 45 °C. Он вызывает газовую гангрену у людей и заболевания животных. Тип С продуцирует небольшое количество гамма-токсина. Температурный оптимум для роста 45 °C. Выделен при остеомиелите у буйволов.
Clostridium septicum выделен в 1877 г. Л. Пастером и Ж. Жубером из трупа коровы. Вызванные возбудителем изменения Л. Пастер рассматривал как септицемию, в связи с чем он и был назван вначале Vibrio septique. C. septicum – тонкая длинная полиморфная палочка диаметром 1,1 – 1,6 мкм, длиной 3,1 – 14,1 мкм, нередко образует нити длиной до 50 мкм, грамположительна, перитрих, капсулы не образует. Споры овальные, располагаются субтерминально или центрально, образуются быстро, уже через 24 ч. На жидкой среде вызывает помутнение, молоко свертывает медленно, гидролизует желатин, ферментирует глюкозу, лактозу, мальтозу с образованием кислоты и газа, не ферментирует маннит и сахарозу. На кровяном агаре колонии окружены зоной гемолиза и имеют тонкие многочисленные отростки; в столбике агара колонии имеют вид пушинок с уплотненным центром.
C. septicum патогенна для человека и домашних животных. Продуцируемый экзотоксин обладает некротическим, гемолитическим и летальным действием. При заражении животных вызывает кровянисто-серозный отек, мышцы имеют темнокрасный цвет, в подкожной клетчатке и в мышцах – пузырьки газа.
Clostridium histolyticum открыт в 1916 г. М. Вейнбергом и Е. Сегеном. Прямая палочка длиной 1,6 – 3,1 мкм, диаметром 0,6 – 1,0 мкм, подвижна (перитрих), капсул не образует, споры овальные, располагаются субтерминально, углеводы не ферментирует. Молоко быстро пептонизирует. На жидких средах дает общее помутнение.
Колонии в столбике агара компактные, мохнатые, неправильной формы. На кровяном агаре колонии мелкие, прозрачные, как капельки росы, с узкой зоной гемолиза. C. histolyticum обладает сильными протеолитическими ферментами, быстро разжижает желатин; при заражении животных происходит протеолиз мягких тканей с обнажением костей и отпаданием конечностей. Продуцируемый экзотоксин при внутривенном введении животным вызывает быструю смерть. C. histolyticum в природе распространен сравнительно мало, встречается в почве, в сточных водах, иногда в кишечнике человека.
Clostridium sordellii обнаружен в 1922 г. Р. Сорделли. Прямая грамположительная толстая палочка диаметром 1,1 – 1,6 мкм, длиной 3,1 – 4,5 мкм, иногда образует цепочки из 3 – 4 клеток, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально или центрально; обладает сильными протеолитическими свойствами, быстро разжижает желатин; ферментирует глюкозу, левулезу, мальтозу с образованием кислоты и газа, медленно свертывает молоко. Температурный оптимум для роста 37 °C. Содержание Г + Ц в ДНК – 26 мол %.
Clostridium sporogenes открыт в 1908 г. И. И. Мечниковым. Прямая палочка диаметром 0,3 – 0,4 мкм и длиной 1,4 – 6,6 мкм, грамположительна, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально. Рост на жидкой среде с глюкозой сопровождается помутнением и энергичным газообразованием. На плотных средах колонии диаметром 2 – 6 мм имеют характерную форму, напоминающую голову Медузы, полупрозрачные, с матовой поверхностью. Оптимальная температура для роста 30 – 40 °C, диапазон роста 25 – 45 °C. Содержание Г + Ц в ДНК – 26 мол %. C. sporogenes обладает сильными протеолитическими свойствами, вызывает в ранах протеолиз мертвых тканей, обусловливая гнилостный запах.
Clostridium difficile впервые был описан в 1935 г. И. Холлом и Е. О’Тулом как представитель нормальной микрофлоры кишечника. Он обнаруживается у 3 % здоровых людей. Позднее был выделен из огнестрельных ран, при газовой гангрене, из различных абсцессов, плевральной жидкости, при неспецифических уретритах. Кроме того, установлена его этиологическая роль при антибиотико-ассоциированных псевдомембранозных колитах. С. difficile – палочка длиной 3,1 – 6,4 мкм, диаметром 1,3 – 1,6 мкм, грамположительна, подвижна (перитрих), капсулы не образует, споры овальные, располагаются субтерминально. Оптимальная для роста температура 30 – 37 °C (диапазон роста 25 – 45 °C). Содержание Г + Ц в ДНК – 28 мол %. Колонии на плотных средах круглые, диаметром 3 – 5 мм, с ровными краями, слегка выпуклые, серовато-белого цвета с матовой поверхностью. На питательном бульоне C. difficile дает умеренный рост с ферментацией или без ферментации глюкозы, на дне зернистый осадок; молоко не створаживает; на кровяном агаре большинство штаммов не дает гемолиза.
Основным фактором патогенности Clostridium difficile служит токсический комплекс, состоящий как минимум из двух токсинов: энтеротоксина (A) и цитотоксина (B). Комплекс в различных биологических тест-системах показывает диареегенную, цитотоксическую и летальную активность. Clostridium difficile является возбудителем псевдомембранозного колита в 90 – 100 % случаев. Для диагностики этого заболевания прибегают как к выделению возбудителя из испражнений, так и к обнаружению токсина. Токсин обнаруживают по его цитопатическому действию (ЦД), проявляемому на различных культурах клеток. Его специфичность устанавливают по реакции нейтрализации ЦД антитоксической сывороткой. Для обнаружения и идентификации токсина (токсинов) может быть использована ПЦР.
Особенности патогенеза газовой гангрены. Газовая гангрена – это своеобразный патологический процесс, который дает различные клинические проявления в зависимости от места локализации. Различают следующие формы этой болезни: анаэробная инфекция мягких тканей конечностей и туловища; анаэробная инфекция мозга; послеродовая или послеабортная анаэробная инфекция; анаэробная инфекция органов брюшной полости и брюшины; анаэробная инфекция органов грудной полости и анаэробный остеомиелит. Все они характеризуются единством патогенеза. Анаэробная инфекция в отличие от гнойных заболеваний, вызываемых аэробными бактериями, протекает без ярко выраженного воспаления. Для нее характерны: прогрессирующий некроз тканей, отек, газообразование в тканях и отравление организма токсинами возбудителя и продуктами распада тканей. Газовая гангрена встречается как в мирное, так и, в особенности, в военное время. Во время Великой Отечественной войны 1941 – 1945 гг. она наблюдалась у 1 – 14 % раненых. В военное время чаще всего наблюдается газовая гангрена мягких тканей конечностей, особенно нижних. Надо иметь в виду, что патогенные анаэробы очень часто обнаруживаются в ранах, но для развития анаэробной инфекции необходимы определенные условия. Клостридии – некропаразиты, благоприятной средой для их размножения служат мертвые или поврежденные ткани. Поэтому наиболее опасны тяжелые повреждения с обширной раневой поверхностью, нарушением кровообращения, гематомами, размозжением мышц, раздроблением костей, образованием слепых ходов и т. п. Попадая в такие раны, клостридии начинают быстро размножаться в глубине поврежденной ткани (анаэробные условия) и выделять экзотоксины. Обладая высокой инвазивностью, они проникают и в здоровую ткань, вначале повреждая ее, а затем и некротизируя своими токсинами и ферментами. Особенно бурно процесс протекает в мышечной ткани, содержащей гликоген и являющейся хорошей питательной средой для клостридий. В патогенном действии клостридий и их токсинов различают две стадии:
1. Образование отека. Вследствие действия токсина повышается проницаемость кровеносных сосудов для плазмы и клеток крови. Развитие отека приводит к сдавливанию ткани; кроме того, с отечной жидкостью поступает токсин. Все это приводит к повреждению тканей и делает их доступными для размножения клостридий.
2. Развитие газовой гангрены, т. е. некроз мышечной и соединительной тканей. Газообразование является результатом ферментативной активности клостридий, а некроз – следствием некротоксического действия токсинов и ферментов. Токсины не только действуют местно, но и вызывают сильнейшую общую интоксикацию (нейротоксическое действие). К специфической бактериальной интоксикации присоединяется отравление продуктами тканевого разложения. Чем больше зона поражения, тем сильнее и разнообразнее интоксикация организма. Таким образом, клиника газовой гангрены определяется общим и местным действием токсинов и ферментов клостридий, а также отравлением продуктами тканевого распада.
Инкубационный период длится от нескольких часов до 5 дней, иногда дольше. В зависимости от свойств и ассоциации клостридий, вызвавших анаэробную инфекцию, клиника ее может быть разной: эмфизематозная, токсическая (отечная), смешанная и т. п. Анаэробная инфекция продолжается 5 – 6 дней, и эти дни решают исход заболевания. Летальность во время первой мировой войны достигала 60 %.
Постинфекционный и поствакцинальный иммунитет в основном опосредуется антитоксинами. Роль антимикробных антител второстепенна. Продолжительность и напряженность иммунитета после перенесенной инфекции изучены недостаточно.
Лабораторная диагностика. Материалом для исследования служат кусочки пораженных тканей (некротизированная и пограничные с ней участки) и отечная жидкость. Кроме того, исследованию в случае необходимости подвергают перевязочный и шовный материал (шелк, кетгут), одежду, образцы почвы; при пищевых интоксикациях, вызванных клостридиями, – испражнения и продукты. Микробиологическая диагностика заключается в выделении из исследуемого материала возбудителя и его идентификации, основанной на изучении морфологических, культуральных, биохимических свойств и определении токсигенности. Исследование состоит из нескольких этапов:
1) бактериоскопия отделяемого раны или экссудата;
2) выделение возбудителя и его идентификация;
3) заражение белых мышей исследуемым материалом, фильтратом бульонной культуры или кровью больных для обнаружения токсина;
4) идентификация токсина клостридий с помощью реакций нейтрализации специфическими антитоксическими сыворотками в биологических пробах на белых мышах или культурах клеток (C. difficile).
Для выделения клостридий используют следующие среды: А. Жидкие накопительные (казеиновые или мясные, содержащие 1 % глюкозы и кусочки печени, перед посевом кипятят и заливают вазелиновым маслом для создания анаэробных условий), молоко. Б. Плотные – кровяной агар Цейсслера (15 % дефибринированной крови + 2 % глюкозы); кровяной агар с бензидином (колонии C. novyi на такой среде чернеют на воздухе); cреда Вильсона – Блера в длинных стеклянных трубочках (C. perfringens в такой среде уже через 3 – 4 ч вызывает почернение в месте своего размножения за счет образования сернистого железа из Na2S и FeCl3 и бурное газообразование за счет ферментации глюкозы); среда Виллиса – Хоббса (содержит, кроме питательного агара, лактозу, индикатор, яичный желток и обезжиренное молоко). На этой среде колонии C. perfringens окрашены в цвет индикатора (ферментируют лактозу), имеют ореол опалесценции (наличие лецитиназы); колонии C. novyi бесцветные (не ферментируют лактозу), окружены зоной опалесценции (лецитиназа); колонии C. septicum окрашены в красный цвет (ферментируют лактозу), но не имеют зоны опалесценции; колонии C. histolyticum – бесцветны, окружены зоной просветления; колонии C. sordellii, C. sporogenes и C. difficile – бесцветные (не ферментируют лактозу), но колонии C. sordellii имеют ореол опалесценции (имеют лецитиназу).
Материал для исследования делят на две части. Одну часть засевают на плотные дифференциально-диагностические (Виллиса – Хоббса и др.) и жидкие среды без прогревания, а другую – после прогревания при 80 °C 15 мин и при 100 °C (5 мин, 10 мин, 20 мин) засевают в жидкие мясные или казеиновые среды и инкубируют при 37 °C от 16 ч до 15 сут. (для прогретых проб). Выросшие культуры, содержащие массу грамположительных палочек, пересевают на плотные дифференциально-диагностические среды (Виллиса – Хоббса, Вильсона – Блера и др.) для получения изолированных колоний, а затем чистых культур и их идентификации.
При посеве исходного материала на дифференциально-диагностические среды после инкубации при 37 °C в течение 1 – 7 сут. колонии, вызвавшие соответствующие изменения на одной из этих сред и состоящие из грамположительных палочек, пересевают на мясные или казеиновые среды для дальнейшей идентификации. Для ускоренной диагностики газовой гангрены О. А. Комковой предложен следующий метод: посев производится в столбик полужидкого агара, к которому добавляется антитоксическая сыворотка. В такой среде с гомологичной антитоксической сывороткой клостридии вместо диффузного помутнения образуют изолированные колонии, а в препаратах-мазках из них имеют вид стрептобацилл (располагаются цепочками).
Лечение и профилактика. Главный метод предупреждения газовой гангрены – своевременная и правильная хирургическая обработка ран. В случае особо тяжелых ранений, которые могут повлечь развитие газовой гангрены, больному с профилактической целью вводят по 10 000 МЕ антитоксических сывороток против наиболее частых возбудителей – C. perfringens, C. novyi и C. septicum. С лечебной целью вводят те же сыворотки по 50 000 МЕ. При отсутствии эффекта сыворотки вводят повторно. Серотерапия должна обязательно сочетаться с эффективной антибиотикотерапией и соответствующим общеукрепляющим лечением.
Специфическая профилактика. Для создания искусственного иммунитета против анаэробной инфекции созданы препараты из различных анатоксинов, однако широкого применения они не получили.
Микробиология столбняка
Столбняк – острая токсическая раневая инфекция, характеризующаяся поражением нейротоксином двигательных клеток спинного и головного мозга, которое проявляется в виде судорог поперечнополосатой мускулатуры.
Столбняком болеют люди и различные виды сельскохозяйственных животных. Наиболее восприимчивы к нему в естественных условиях лошади и мелкий рогатый скот. Возбудитель столбняка – Clostridium tetani – был открыт в 1883 г. Н. Д. Монастырским и в 1884 г. А. Николайером. Оба они сообщили о своих открытиях в 1885 г. В чистой культуре возбудитель был получен в 1889 г. С. Китазато. C. tetani – прямая палочка длиной 2,4 – 5,0 мкм, диаметром 0,5 – 1,1 мкм, иногда образующая длинные нити. Большинство штаммов подвижно (перитрихи). Споры круглые, располагаются терминально, придавая возбудителю вид булавки или барабанной палочки (см. цв. вкл., рис. 105). Грамположительна, но в старых культурах становится грамотрицательной. Капсулы не образует. Содержание Г + Ц в ДНК – 25 мол %. Оптимальная температура для роста 37 °C (диапазон роста 14 – 45 °C). На питательном бульоне (среде Китта – Тароцци) рост медленный с равномерным помутнением и редким газообразованием (сахаролитическими свойствами не обладает, лишь редкие штаммы ферментируют глюкозу). Культура издает своеобразный неприятный запах выгребной ямы. На кровяном агаре колонии размером 4 – 6 мм, круглые, плоские, с неровными краями, полупрозрачные, серые, нередко в виде переплетающихся нитей, напоминающих паучков; вокруг колоний – зона гемолиза. В столбике агара колонии в виде комочков ваты. C. tetani обладает слабыми протеолитическими свойствами, медленно гидролизует желатин, молоко свертывает к 4 – 7-му дню в виде мелких хлопьев, затем наступает его пептонизация; не образует индола, восстанавливает нитраты в нитриты.
Антигенное строение. Возбудитель столбняка имеет О– и Н-антигены. По Н-антигену различают более 10 серотипов, однако все они образуют одинаковый экзотоксин.
Факторы патогенности. Главным фактором патогенности C. tetani, определяющим патогенез и клинику столбняка, является вырабатываемый им сильнейший экзотоксин. Смертельная доза его для человека составляет менее 2 нг/кг массы тела. Экзотоксин состоит из двух фракций – тетаноспазмина (нейротоксина) и тетанолизина (разрушает эритроциты).
Тетанолизин выделяется из клеток с первых дней развития культуры с помощью механизма активного транспорта. Тетаноспазмин через клеточную стенку клостридий не проходит, а выделяется в культуральную жидкость лишь при распаде микробных клеток, главным образом в фазе их ускоренной гибели, поэтому он накапливается в бульонной культуре к 5 – 7-му дню инкубации.
Тетаноспазмин синтезируется внутриклеточно в виде неактивного протоксина – одноцепочечного полипептида, имеющего м. м. 150 кД. Превращение протоксина в активный нейротоксин происходит после лизиса микробной клетки и осуществляется бактериальной протеазой, которая разрезает полипептид на две части. Активный внеклеточный нейротоксин («разрезанный» токсин) состоит из двух связанных между собой дисульфидными связями цепей: легкой – L (около 50 кД) и тяжелой – Н (около 100 кД). Н-цепь, по-видимому, выполняет акцепторную роль рецепторами для токсина являются три– и дисиалоганглиозиды мембран аксонных окончаний. Предполагается, что по аналогии с дифтерийным экзотоксином, состоящим также из Н– и L-цепей, которые образуются при разрезании исходной полипептидной цепи токсина, L-цепь обладает какими-то ферментативными свойствами, опосредующими биологическую активность нейротоксина. Взятые сами по себе L– и Н-цепи не токсичны, но после реассоциации молекулы токсина его токсичность восстанавливается. Мишенью токсина служит везикулоассоциированный мембранный белок синаптобревин.
Непосредственно из крови в центральную нервную систему из-за наличия гематоэнцефалического барьера столбнячный токсин проникнуть не может. Он специфически связывается с нервными клетками в области их мионевральных синапсов. Его взаимодействие с нервной клеткой происходит через четыре стадии: 1) связывание с рецептором; 2) связывание с мембранами нервных клеток, которое заключается в том, что вначале токсин фиксируется ганглиозидом, а затем комплекс токсин + ганглиозид латерально перемещается к белковому рецептору и связывается с ним; 3) энергозависимый процесс проникновения токсина в цитозоль клетки, осуществляемый опосредованным рецептором эндоцитозом; 4) продвижение по аксону со скоростью ≈ 1 см/ч. Продвижение токсина вверх по спинному или продолговатому мозгу может происходить от нейрона к нейрону только в области синапсов, так как оболочка нейронов практически непроницаема для молекул токсина. Кроме того, нейроны изолированы друг от друга клетками глии. Токсин накапливается в центральной нервной системе в основном в двигательных зонах спинного и головного мозга, за исключением переднего мозга и мозжечка. Конечный результат действия столбнячного токсина заключается в том, что он блокирует синаптическую передачу: тормозит освобождение таких медиаторов, как глицин, ацетилхолин, норадреналин, γ-аминомасляная кислота, и вызывает нервно-мышечную патологию. Возможно также, что повреждаются и иные, а не только синаптические структуры.
Тетанолизин – мембранотропный токсин, он разрушает эритроциты и, возможно, другие клетки. Штаммы C. tetani отличаются выраженной гетерогенностью по признаку гемолитической активности. Роль тетанолизина в патогенезе столбняка до сих пор не имеет однозначного объяснения. Однако, вызывая гемолиз и подавляя фагоцитоз, тетанолизин, несомненно, способствует распространению возбудителя в организме и продукции им токсинов.
Резистентность. Вегетативные формы C. tetani не отличаются особой устойчивостью. При кипячении они разрушаются в течение 5 мин. Напротив, споры C. tetani обладают исключительно высокой резистентностью к различным физическим и химическим воздействиям. Для их разрушения требуется кипячение в течение 1 – 3 ч;
автоклавирование при температуре 120 °C они переносят до 40 мин. Споры не чувствительны к низким температурам, к рассеянному солнечному свету. 1 % раствор сулемы, формалина, 5 % раствор фенола уничтожают их через 12 – 14 ч, они практически не чувствительны к химиотерапевтическим препаратам. В высушенном состоянии споры cохраняют жизнеспособность несколько десятков лет, в почве сохраняются длительное время, а при благоприятных условиях могут в ней прорастать и размножаться. Поэтому почва, особенно загрязненная испражнениями животных и человека, является неиссякаемым резервуаром C. tetani и постоянным потенциальным источником заражения людей и животных столбняком.
Особенности эпидемиологии. Возбудитель столбняка распространен повсеместно в почве и других объектах внешней среды на различных территориях Земного шара, поэтому проблема столбняка имеет глобальное значение. Больной столбняком человек неконтагиозен – передачи возбудителя столбняка от больного не происходит. Основным путем заражения столбняком является проникновение возбудителя через поврежденные кожные покровы и слизистые оболочки. Местом входных ворот служат различные раны: огнестрельные, колотые, резаные, занозы, потертости, ожоги, обморожения, травмированные родовые пути (послеродовый или послеабортный столбняк), операционные раны при инфицировании их руками, инструментами или перевязочным материалом и т. п. Иногда травма настолько ничтожна, что входные ворота остаются необнаруженными (криптогенный столбняк). Особенно серьезную глобальную проблему представляет столбняк новорожденных (tetanus neonatorum). Он связан с тем, что в целом ряде развивающихся стран при обработке пуповины применяют такие традиционные методы (при родах на дому), как использование золы, земли, глины, навоза, помета птиц, порошков, приготовленных из различных растительных продуктов и других субстратов, которые часто содержат споры C. tetani. Попадая через пупочный канатик, они и служат причиной столбняка новорожденных. Летальность при этой форме столбняка составляет в среднем 85 % и достигает максимальных значений на 6 – 8-й день жизни больного ребенка. По оценке ВОЗ, в 1980-х гг. ХХ в. ежегодно в развивающихся странах от столбняка новорожденных умирало более 1 млн детей, а общее число случаев столбняка в них составляло более 2,5 млн.
Патогенез и клиника. Столбняк представляет собой классическую токсическую инфекцию, патогенез и клиника которой обусловлены действием экзотоксина возбудителя. При заражении лабораторных животных чистым токсином развивается такая же болезнь, как и при инфицировании возбудителем. В клинической картине столбняка ведущими симптомами являются: 1) тоническое сокращение поперечнополосатой мускулатуры и 2) повышенная рефлекторная возбудимость от внешних раздражений. Картина столбняка у человека и крупных животных отличается от таковой у мелких лабораторных животных – белых мышей и морских свинок. Инкубационный период после заражения белых мышей в среднем составляет 24 – 36 ч, а морских свинок – 48 ч. Заболевание у них развивается по типу восходящего столбняка (tetanus ascendens): при подкожном заражении в область задних конечностей у них отмечаются сначала местные явления (нога держится в вытянутом положении, при движении беспомощно волочится, хвост изогнут и ригидный), потом спастические сокращения охватывают мускулатуру одноименной половины туловища, а затем противоположную, и животное погибает при явлениях общего столбняка.
В противоположность этому у человека и крупных животных последовательность поражения мышечных групп не связана с местом локализации входных ворот, болезнь протекает по типу нисходящего столбняка (tetanus descendens).
Инкубационный период при столбняке у человека составляет в среднем 6 – 14 дней, но может варьировать от 1 – 3 дней до месяца и более, и чем короче инкубационный период, тем тяжелее протекает болезнь. Раньше всего наступает спазм жевательной мускулатуры (тризм) и затылочных мышц. Затем поражаются мышцы лица, – у больного появляется вынужденная («сардоническая») улыбка. Далее наступает спазм мускулатуры туловища и конечностей. Вследствие того что спастическое сокращение разгибательной мускулатуры спины выражено сильнее, чем сгибательных мышц живота, больной лежит, опираясь только на затылок и таз. В связи с повышенной рефлекторной возбудимостью пораженных токсином двигательных центров малейшее раздражение вызывает тетанические (клонические) судороги по-
перечно-полосатой мускулатуры, в результате чего тело приобретает «столбообразное состояние» с выгибанием позвоночника дугой (опистотонус). Больной находится в ясном сознании. Смерть наступает от паралича сердца либо от асфиксии вследствие поражения мышц гортани, межреберных мышц и диафрагмы. Повышение температуры бывает не всегда. При столбняке новорожденных первым симптомом является отказ ребенка от груди в связи с сокращением челюстных мышц, затем у ребенка возникает типичная «поза лягушонка»: он лежит на спине с запрокинутой головой, с согнутыми и подтянутыми к туловищу ногами, на лице – страдальческое выражение. При послеоперационном и послеабортном столбняке нередко наблюдается молниеносное течение заболевания, при котором смерть наступает от паралича дыхательного центра или сердечной недостаточности раньше, чем успевают развиться характерные симптомы болезни. Летальность при этих формах и столбняке новорожденных наиболее высока – до 90 %.
Постинфекционный иммунитет стойкий и длительный, опосредуется главным образом, судя по эффективности искусственной иммунизации, антитоксинами, клетками иммунной памяти и повышением фагоцитарной активности.
Лабораторная диагностика. При типичной клинической картине лабораторную диагностику можно не проводить. Необходимость в ней возникает при спорных и неясных случаях, а также в случаях, когда требуется подтверждение диагноза после операций, абортов, родов на дому без медицинской помощи, при обследовании перевязочного и шовного материала, образцов почвы и т. п. Бактериологическая диагностика столбняка заключается в выделении и идентификации возбудителя и в обнаружении его токсина в исследуемом материале. Для исследования берут от больных кусочки ткани из мест проникновения возбудителя в организм, экссудат, инородное тело, тампоны из раны. При послеродовом или послеабортном столбняке исследуют выделения и ткани из влагалища и матки, при столбняке новорожденных – выделения из пупочного канатика. При исследовании умерших берут материал из раны, воспалительных очагов, старых рубцов, а также кровь, печень, селезенку и легкие, куда возбудитель может быть занесен кровью.
Микробиологическая диагностика включает в себя следующие этапы:
1) бактериоскопия исходного материала;
2) посев для выделения возбудителя и его идентификации;
3) обнаружение столбнячного токсина.
Выделение C. tetani из патологического материала или других образцов проводят по обычной для строгих анаэробов схеме, используя различные плотные и жидкие среды, а идентификацию – на основе морфологических, культуральных, биохимических и токсигенных свойств. Специально для выделения C. tetani П. Филдсом предложен следующий метод: исследуемый материал засевают в каплю конденсационной жидкости на дне пробирки с косячком из кровяного или сывороточного агара. Обычно через 18 – 24 ч инкубации при температуре 37 °C в анаэробных условиях C. tetani благодаря своему ползучему росту, обусловленному жгутиками, образуют тонкую пленку по всей скошенной поверхности среды. Для получения чистой культуры производят 3 – 5 таких пересевов.
Наиболее простым и эффективным методом микробиологической диагностики столбняка является биологическая проба на белых мышах. С этой целью исследуемый материал (растертые в физиологическом растворе кусочки некротизированной ткани, гной и иной материал) или фильтрат изучаемой культуры делят на две фракции. Одну из них смешивают с антитоксической сывороткой и оставляют смесь при комнатной температуре на 40 мин (для нейтрализации токсина). После этого заражают белых мышей нативным материалом и смесью его с антитоксической сывороткой. При наличии в нативном материале столбнячного токсина опытные мыши погибают; контрольные мыши, которым вводят смесь нативного материала с антитоксином, остаются живыми. Для обнаружения столбнячного токсина может быть использована РПГА с антительным эритроцитарным диагностикумом.
Лечение. Для специфического лечения столбняка применяют противостолбнячную антитоксическую сыворотку, получаемую путем гипериммунизации лошадей столбнячным анатоксином и токсином. Сыворотка применяется в дозе 350 МЕ/кг веса больного. Сыворотку вводят после десенсибилизации внутримышечно (или внутривенно, это должно быть указано в инструкции). Лечение начинают при появлении первых симптомов столбняка, сыворотку вводят повторно до исчезновения рефлекторных судорог. Получен иммунохимически чистый столбнячный антитоксин, который, благодаря более высокой удельной активности и более длительной персистенции в организме, обеспечивает терапевтический эффект лучше, чем антитоксическая сыворотка, очищенная методом Диаферм-3. Хороший терапевтический эффект дает и гомологичный иммуноглобулин, т. е. иммуноглобулин людей, иммунизированных против столбняка. Серотерапию необходимо сочетать с антибиотикотерапией (пенициллины, цефалоспорины).
Специфическая профилактика столбняка включает два вида мероприятий.
1. Проведение плановой активной иммунизации детей и взрослых против столбняка.
2. Экстренная иммунопрофилактика в связи с травмами.
Активная иммунизация населения. Ее начинают с детей 3 – 5-месячного возраста столбнячным анатоксином, чистым или в комбинации с другими иммунопрепаратами, чаще всего в виде вакцины АКДС (анатоксины столбняка, дифтерии и убитые коклюшные палочки) по соответствующей схеме, а затем через каждые 5 – 10 лет проводят ревакцинацию. Прививки по этой схеме обеспечивают иммунитет против столбняка на протяжении всей жизни и избавляют от необходимости вводить при травмах антитоксическую сыворотку. По расширенной программе иммунизации (РПИ) ВОЗ все дети на первом году жизни должны быть обязательно привиты против столбняка и ряда других инфекций, а столбняк новорожденных должен был быть ликвидирован к 1995 г. благодаря иммунизации женщин детородного возраста, в первую очередь беременных, в развивающихся странах столбнячным анатоксином (2 – 3 прививки).
Экстренная иммунопрофилактика столбняка производится при травмах и, в зависимости от предшествующих прививок анатоксином, осуществляется в виде либо пассивной иммунизации (вводится однократно 3000 МЕ антитоксической сыворотки); либо активно-пассивной иммунизации (вводится столбнячный анатоксин и через 30 мин другим шприцем и в другой участок тела 3000 МЕ сыворотки или 950 МЕ гомологичного иммуноглобулина); либо экстренной ревакцинации столбнячным анатоксином. Пассивная серопрофилактика ненадежна, так как защитный уровень введенного антитоксина (0,01 МЕ/мл крови) сохраняется меньше, чем может быть срок инкубационного периода при столбняке.
Лица, которые прошли полный курс иммунизации против столбняка любым препаратом, содержащим столбнячный анатоксин, при травмах подлежат только экстренной ревакцинации анатоксином без одновременного введения антитоксической сыворотки или гомологичного иммуноглобулина. Лицам, которые не получили полного курса иммунизации против столбняка или вообще не прививались против него, при травмах проводят активно-пассивную профилактику.
Микробиология ботулизма
Ботулизм – тяжелая форма пищевой токсикоинфекции, связанная с употреблением продуктов, зараженных Clostridium botulinum, и характеризующаяся специфическим поражением центральной нервной системы.
Возбудитель болезни был впервые обнаружен в 1896 г. Э. ван Эрменгемом в остатках колбасы (лат. botulus – колбаса), а также в селезенке и толстой кишке людей, погибших от ботулизма. Это открытие было подтверждено С. В. Констансовым, который выделил C. botulinum из красной рыбы, послужившей причиной отравления.
C. botulinum – довольно крупные полиморфные палочки с закругленными концами, длиной 4 – 9 мкм, диаметром 0,5 – 1,5 мкм, иногда образуются укороченные формы; располагаются беспорядочно, иногда парами или в виде коротких цепочек; в старых культурах могут образовывать длинные нити; грамположительны, подвижны, имеют перитрихиальные жгутики. Капсулы не образуют, споры овальные, располагаются субтерминально, придавая палочке форму, напоминающую теннисную ракетку (рис. 106). Споры в культурах появляются через 24 – 48 ч от начала инкубации. C. botulinum не размножается в продуктах при кислой реакции (рН 3,0 – 4,0) и при концентрации NaCl выше 10 %.
C. botulinum образует 8 типов токсинов: A, B, C1, C2, D, E, F, G, различающихся по антигенной специфичности. Соответственно различают 8 типов возбудителя, одним из важных признаков которых является наличие или отсутствие протеолитических свойств. Эти свойства определяются по способности гидролизовать казеин и продуцировать H2S. В соответствии с этим различают протеолитическую группу, к которой относятся все штаммы типа А и часть штаммов B и F, и непротеолитическую группу, к которой относят все штаммы типа Е и некоторые штаммы типов B и F. Возбудители типов С и D занимают промежуточное положение между этими группами, так как часть из них продуцирует протеолитические ферменты, но многие штаммы С и D не образуют их (табл. 48). Серотип G отличается от всех других серотипов тем, что он, обладая протеолитическими свойствами, не ферментирует углеводы.

Рис. 106. Clostridium botulinum
Чистая культура
Таблица 48
Дифференциальные признаки протеолитических и непротеолитических штаммов C. botulinum

Примечание. (+) – признак положительный; ( – ) – признак отрицательный; надстрочный знак ( – ) – некоторые штаммы желатин не гидролизуют. а Этот серотип выделен в самостоятельный вид C. argentinense.
Некоторые особенности различных типов C. botulinum. Тип А и протеолитические штаммы типов B, C, D и F – прямые или слегка изогнутые палочки длиной 4,4 – 8,6 мкм, диаметром 0,8 – 1,3 мкм, подвижны (перитрихи). Споры овальные, субтерминальные. Обильно растут на питательном бульоне. На кровяном агаре с 0,5 – 1,0 % глюкозы образуют гладкие или шероховатые колонии диаметром 3 – 8 мм, окруженные зоной гемолиза. В начале роста колонии очень мелкие, блестящие, в виде капелек росы. Затем они увеличиваются, становятся сероватыми с ровными или неровными краями. В агаре столбиком колонии дискообразные или в виде «пушинок». Молоко пептонизируют. Температурный оптимум для роста 30 – 40 °C. Содержание Г + Ц в ДНК – 26 – 28 мол %.
Тип Е и непротеолитические штаммы типов В и F. Прямые палочки, диаметр 0,3 – 0,7 мкм, длина 3,4 – 7,5 мкм; грамположительны, но в старых культурах становятся грамотрицательными, подвижны (перитрихи). Споры овальные, субтерминальные. Обильный рост на среде Китта – Тароцци с газообразованием. Колонии на кровяном агаре 1 – 3 мм в диаметре, с неровными краями, матовой поверхностью, мозаичной структурой, с зоной гемолиза. Некоторые штаммы типа Е не гидролизуют желатин. Молоко свертывают, но не пептонизируют. Температурный оптимум для роста 25 – 37 °C. Содержание Г + Ц в ДНК составляет 26 – 28 мол %.
Непротеолитические штаммы типов C и D. Прямые палочки, диаметр 0,5 – 0,7 мкм, длина 3,4 – 7,9 мкм, подвижные (перитрихи), споры овальные, субтерминальные; желатин гидролизуют, молоко не свертывают и не пептонизируют; рост на среде Китта – Тароцци с умеренным газообразованием. На кровяном агаре колонии круглые, с неровными краями, слегка приподняты, гладкие, серовато-белого цвета, полупрозрачные, окружены зоной гемолиза. Температурный оптимум для роста 30 – 37 °C, содержание Г + Ц в ДНК – 26 – 28 мол %.
Тип G. Прямые палочки, диаметр 1,3 – 1,9 мкм, длина 1,6 – 9,4 мкм, подвижны (перитрихи), споры овальные, субтерминальные, грамположительны. На кровяном агаре колонии круглые, диаметром 0,5 – 1,5 мм, с ровными краями, приподнятые, полупрозрачные, серые, гладкие, с блестящей поверхностью; на среде Китта – Тароцци рост умеренный, без ферментации глюкозы; молоко пептонизируют медленно. Температурный оптимум для роста 30 – 37 °C. Обнаружен в почве. Случаи заболевания людей, вызванных этим типом, не известны.
Резистентность. Длительное сохранение C. botulinum в природе и в различных пищевых продуктах связано с их спорообразованием. Споры сохраняются в почве долгое время, а при благоприятных условиях в летнее время могут прорастать и размножаться. Они хорошо переносят низкие температуры (не погибают даже при –190 °C). В высушенном состоянии сохраняют жизнеспособность десятилетиями. Споры устойчивы и к нагреванию (особенно типа А). Споры типов А и В переносят кипячение в течение 5 ч, при температуре 105 °C погибают через 1 – 2 ч, при 120 °C – через 20 – 30 мин. Встречаются штаммы, споры которых переносят температуру 120 °C в течение нескольких часов. Споры C. botulinum устойчивы ко многим бактерицидным веществам: 20 % раствор формалина убивает их через 24 ч; этиловый спирт – через 2 мес.; 10 %-ная HCl убивает их лишь через 1 ч.
Токсины C. botulinum также весьма устойчивы к действию физических и химических факторов. Они не разрушаются протеолитическими ферментами кишечного тракта. В кислой среде (рН 3,5 – 6,8) они более устойчивы, чем в нейтральной или щелочной среде, разрушаются от действия 2 – 3 %-ной щелочи, но высокие концентрации NaCl в пищевых продуктах их не разрушают; в консервах токсины сохраняются длительное время. Токсины C. botulinum обладают и определенной термоустойчивостью: при 58 °C разрушаются через 3 ч; при 80 °C – через 30 мин; а при 100 °C – в течение нескольких минут. Наиболее устойчивы токсины типа С, менее устойчивы токсины типов D и E, а токсины типов А и В занимают промежуточное положение. Устойчивость токсинов к высокой температуре зависит от вида продукта, его рН и других условий. В частности, при наличии жиров, высокой концентрации сахарозы устойчивость токсинов к высокой температуре возрастает.
Факторы патогенности. Главный фактор патогенности возбудителя ботулизма – экзотоксины. Хотя они отличаются по антигенным свойствам, их биологическая активность одинакова. Все они – варианты одного нейротоксина. Антигенная специфичность и летальная активность определяются различными детерминантами экзотоксина. Токсины всех типов продуцируются в виде токсических белковых комплексов (прогениторных токсинов). В зависимости от молекулярной массы и структуры эти комплексы делят соответственно константам седиментации на 3 группы: 12S– (300 кД), 16S– (500 кД) и 19S– (900 кД) токсины. Недавно у типов А и В обнаружены сверхтоксичные сверхкомплексы токсинов.
12S-токсины (М-токсины) состоят из молекулы нейротоксина, ассоциированной с молекулой нетоксического белка, который не обладает гемагглютинирующими свойствами. 16S-токсины (L-токсины) – структуры, состоящие из М-комплекса и нетоксического белка, который отличается от белка М-комплекса и обладает гемагглютинирующими свойствами. 19S-токсины (LL-токсины) – наиболее крупные структуры, включаюшие в себя нейротоксин и нетоксический белок со свойствами гемагглютинина.
Клостридии ботулизма типа А могут продуцировать токсические комплексы трех вариантов: M, L и LL, типов B, C и D – в виде L– и M-токсинов, а типов E и F – только в виде М-токсинов. Таким образом, одна и та же культура C. botulinum может продуцировать несколько типов токсических комплексов. Функции нетоксических негемагглютинирующих, как и гемагглютинирующих белков (их идентифицировано три типа: 15 кД, 35 кД и 70 кД), пока не установлены. Нейротоксические компоненты любого серотипа ботулинических токсинов и любого типа токсического комплекса имеют сходную структуру и биологические свойства. Они синтезируются в виде единой полипептидной цепи с м. м. 150 кД (7S-токсин), которая не обладает значительной токсической активностью. Эта полипептидная цепь превращается в активный нейротоксин только после ее разрезания бактериальной протеазой или протеазами кишечного тракта человека. В результате точечного гидролиза возникает структура, состоящая из двух связанных между собой дисульфидными связями цепей – тяжелой, с м. м. 100 кД (Н-цепь), и легкой, с м. м. 50 кД (L-цепь). Н-цепь ответственна за прикрепление нейротоксина к рецепторам мембраны клеток, а L-цепь осуществляет специфическое блокирующее действие нейротоксина на холинергическую передачу возбуждения в синапсах. Токсины типов С1 и С2 отличаются друг от друга не только серологически, но еще и тем, что токсина С2 вегетативные формы культур не образуют. Он образуется лишь в период спорообразования, а его активация обеспечивается микробной протеазой.
Способность возбудителя ботулизма продуцировать протеолитические ферменты играет важную роль в токсинообразовании. Протеолитические группы возбудителей обеспечивают активацию протоксинов своими эндогенными протеазами, а активация нейротоксинов, продуцируемых непротеолитическими вариантами серотипов C. botulinum, осуществляется экзогенным путем, т. е. с помощью протеаз желудочнокишечного тракта при заражении или in vitro – трипсином.
Помимо выраженной нейротоксической активности, различные типы C. botulinum обладают лейкотоксической, гемолитической и лецитиназной активностью. Особенность лейкотоксина заключается в том, что он подавляет фагоцитоз без разрушения лейкоцитов. Различные сроки накопления в культуральной среде лейкотоксинов, гемотоксинов и лецитиназы при инкубации C. botulinum указывают на то, что они имеют, по-видимому, разную химическую природу.
Локус генов токсических комплексов содержит гены нейротоксинов (bont), гены нетоксического негемагглютинирующего белка (ntnh), гены гемагглютининов (ha+ или ha—) и ген botR, продукт которого выполняет роль позитивного регулятора.
Особенности эпидемиологии. Естественной средой обитания C. botulinum является почва, откуда они попадают в воду, на пищевые продукты, фураж, в кишечник человека, млекопитающих, птиц и рыб, где размножаются. В ряде стран мира (США, Канада и др.) ботулизм существует в виде природных очагов: в местах, где почва, растения и вода содержат много C. botulinum, неоднократно наблюдалась массовая гибель диких водоплавающих птиц и иных животных (ондатры, лягушки и др.), играющих важную роль в эпидемиологии ботулизма. Установлено носительство C. botulinum в кишечнике у лошадей, рогатого скота, свиней, кур, грызунов. Загрязняя своими испражнениями продукты, фураж, почву, они способствуют широкому обсеменению клостридиями окружающей среды.
Заражение красной и частиковой рыбы возбудителем ботулизма может быть эндогенным – из их кишечника, и экзогенным – из внешней среды (при неправильных транспортировке и хранении).
Все сельскохозяйственные продукты, загрязненные почвой, испражнениями человека и животных, могут быть заражены возбудителями ботулизма и стать причиной заболевания человека.
Ботулизм встречается во всех регионах Земного шара, но чаще регистрируется в странах, где население употребляет большое количество различных консервированных продуктов. В каждой стране источником отравления служат консервы, пользующиеся наибольшим спросом: в Германии, Франции и других европейских странах – мясные консервы, колбаса, ветчина и т. п.; в США – растительные консервы; в России – рыба и рыбные консервы. Ботулизм не контагиозен. Заболевание наступает лишь при употреблении пищи, содержащей возбудителя и его токсины. Поскольку C. botulinum – строгий анаэроб, наилучшие условия для его размножения и продукции токсина создаются в консервированных продуктах, куда споры могут попасть с частичками почвы. Они могут выдерживать термическую обработку консервов, а затем прорастать и продуцировать токсин, чему способствует длительное хранение консервов. Заболеваемость ботулизмом невысока, он встречается чаще как спорадическое заболевание. Однако известны и групповые вспышки, например вспышка в 1933 г. в городе Днепропетровске, когда в результате отравления кабачковой икрой заболело 230 человек, 26 из них умерли. Крайне редко заражение происходит при ранениях.
Особенности патогенеза и клиники. Ботулизм протекает как токсикоинфекция. Организм поражается не только токсином, содержащимся в пищевом продукте, но и токсином, который образуется в пищеварительном тракте и тканях в связи с проникновением туда возбудителя. Люди чрезвычайно чувствительны к ботулиническим токсинам типов A, B, C, E и F. Заболевания наблюдались даже тогда, когда человек брал в рот зараженный продукт, но не проглатывал его. Смертельная доза токсина для человека составляет 1 нг/кг массы тела. Ботулинический токсин быстро всасывается в желудке и кишечнике, проникает в кровь и избирательно действует на ядра продолговатого мозга и ганглиозные клетки спинного мозга. Следует отметить, что, попадая в пищеварительный тракт человека или животного, клостридии ботулизма размножаются, проникают в кровь и оттуда во все органы, продуцируя при этом токсины. Инкубационный период у людей варьирует от двух часов до 10 дней, но чаще всего он составляет 18 – 24 ч. Чем больше инфицирующая доза, тем короче инкубационный период и тем тяжелее протекает заболевание.
Клиническая картина ботулизма обычно складывается из сочетания различных мионеврологических синдромов, из которых раньше всего проявляется офтальмоплегический: у больного нарушается аккомодация, неравномерно расширяются зрачки, появляется косоглазие, двоение в глазах, опущение век, а иногда и слепота. Эти симптомы связаны с поражением глазодвигательных нервов. Затем присоединяется парез мускулатуры языка (афония), глотание затрудняется, мышцы шеи, туловища и кишечника ослабевают (парезы, запоры, метеоризм), наблюдается выделение густой тягучей слизи. Температура может быть нормальной, иногда повышается. Сознание сохраняется. Как правило, никаких острых явлений воспаления со стороны желудочно-кишечного тракта не отмечается. В заключительной стадии болезни основную роль играет расстройство дыхания, смерть наступает от паралича дыхания и сердца. Летальность составляет 35 – 85 %.
Постинфекционный иммунитет. Перенесенное заболевание, очевидно, оставляет типоспецифический антитоксический иммунитет, перекрестный иммунитет не формируется. Продолжительность и напряженность постинфекционного иммунитета и роль в нем антимикробных антител и фагоцитов изучены недостаточно.
Лабораторная диагностика. Материалом для исследования служат: от больного – промывные воды желудка, испражнения, кровь, моча, рвотные массы; от трупа – содержимое желудка, тонких и толстых кишок, лимфатические узлы, а также головной и спинной мозг. Исследованию подвергают и продукт, послуживший причиной отравления. Исследования проводят с целью обнаружения и идентификации C. botulinum или, чаще всего, с целью обнаружения ботулинического токсина и установления его серотипа. Для выделения культуры C. botulinum материал засевают на плотные среды и накопительную среду Китта – Тароцци (часть пробирок при этом прогревают при температуре 85 °C в течение 20 мин для уничтожения неспорогенных бактерий). Из жидких культур после инкубирования делают посевы на плотные среды с целью получения изолированных колоний, а затем и чистых культур, которые идентифицируют по морфологическим, культуральным, биохимическим и токсигенным свойствам. Для обнаружения ботулинического токсина в исследуемом материале или в фильтрате полученной культуры можно использовать следующие три способа.
1. Биологическая проба на мышах. Для этого берут не менее 5 мышей. Одну из них заражают только исследуемым материалом, а каждую из остальных четырех – смесью материала с 200 АЕ антитоксической сыворотки соответствующего типа – А, В, С и Е. Смесь при комнатной температуре выдерживают 40 мин для нейтрализации токсина антитоксином. При наличии в исследуемом материале ботулинического токсина погибают все мыши, кроме той, которой была введена смесь материала с антитоксической сывороткой, нейтрализовавшей действие гомологичного типа токсина.
2. Использование РПГА с антительным диагностикумом, т. е. эритроцитами, сенсибилизированными антитоксинами соответствующих типов.
3. Высокочувствительный и специфический метод обнаружения ботулинического токсина основан на его способности подавлять активность фагоцитов. В присутствии соответствующей антитоксической сыворотки лейкотоксическое свойство токсина нейтрализуется.
Лечение. Наиболее эффективным методом лечения ботулизма является раннее применение антитоксических сывороток. Пока не установлен тип токсина, вызвавшего ботулизм, больному вводят внутримышечно по 10 000 МЕ антитоксической сыворотки типов А, С и Е и 5000 МЕ сыворотки типа В (всего 35 000 МЕ). В первые сутки сыворотку вводят повторно через каждые 5 – 10 ч, в тяжелых случаях – внутривенно. Всем лицам, которые употребляли пищу, ставшую причиной отравления, но не заболели, с профилактической целью вводится антитоксическая сыворотка по 2000 МЕ тех же типов. После установления типа токсина вводят только гомологичную антисыворотку. С целью стимулирования выработки активного иммунитета больному вводят также анатоксины типов А, В, С и Е, а после определения типа токсина только гомологичный анатоксин. Промыванием желудка и дачей слабительного добиваются скорейшего удаления токсина и возбудителя из кишечника. Серотерапию дополняют антибиотикотерапией, а также симптоматическим и общеукрепляющим лечением.
Профилактика. Для создания искусственного антитоксического иммунитета против ботулизма получены анатоксины, однако широкого применения они не нашли. В основе профилактики ботулизма лежит строгое соблюдение санитарно-гигиенического режима при обработке продуктов на предприятиях пищевой промышленности, особенно связанных с изготовлением консервов, ветчины, колбас, а также при копчении, солении рыбы и приготовлении из нее балыков. Изготовленные консервы после термической обработки должны подвергаться термостатному контролю (их выдерживают в термостате при 37 °C в течение определенного времени): клостридии, сохранившиеся в консервах, вызывают бомбаж (вздутие) банок, а содержимое их издает запах прогорклого масла. Такие консервы подлежат изъятию и тщательному бактериологическому исследованию. Для соления рыбы необходимо использовать крепкие солевые растворы – тузлуки, содержащие 10 – 12 % NaCl. Особенно опасными могут быть консервы домашнего приготовления, прежде всего грибные, изготовленные без соблюдения необходимого режима.
Патогенные бактероиды, превотелла и фузобактерии
Эту группу возбудителей ранее часто под общим названием «бактероиды» относили к одному семейству Bacteroidaceae. Теперь в составе этого семейства остался лишь род Bacteroides. Bacteroides melaninogenicus перенесен в род Prevotella, выделенный в семейство Prevotellaceae, а вид этот стал называться Prevotella melaninogenica. Род Fusobacterium также выделен в отдельное семейство Fusobacteriaceae, которое отнесено даже к другому типу – Fusobacteria. Бактероиды, превотелла и фузобактерии – анаэробные грамотрицательные прямые и изогнутые палочки, широко распространенные в природе. Основной средой их обитания являются слизистые оболочки ротовой полости, желудочно-кишечного тракта, мочеполовых путей человека и животных. При определенных условиях эти бактерии могут стать причиной гнойно-воспалительных заболеваний различной локализации: аппендицита, перитонита, сепсиса, парапроктита, гангрены отдельных органов, раневой инфекции и т. п. Очень часто эти процессы вызываются бактероидами, превотеллой и фузобактериями (аспорогенная анаэробная микрофлора) в ассоциации с другими микроорганизмами (факультативные анаэробы и облигатные спорогенные анаэробы). Особенностью течения заболевания при такой микст-инфекции являются быстрота развития процесса, некротизация тканей, признаки выраженной интоксикации, трудности диагностики и лечения. Все это – следствие синергизма, когда патогенные свойства различных микроорганизмов взаимно усиливаются. Довольно редко бактероиды, превотелла и фузобактерии выделяются из патологического материала в чистой культуре, обычно рост наблюдается в ассоциации с другими бактериями. В чистой культуре эти возбудители чаще выделяются посевом крови при сепсисе и посевом спинномозговой жидкости – при менингите.
Важным условием для развития инфекции, вызываемой бактероидами, превотеллой или фузобактериями, служит наличие предрасполагающих факторов, приводящих к снижению уровня кислорода или окислительно-восстановительного потенциала в тканях. Такими факторами могут быть травма, спазмы и сужения сосудов, некроз, сопутствующие инфекции, вызванные другими бактериями. Общими предрасполагающими факторами следует считать также хирургические вмешательства (особенно при операциях на кишечнике или в полости рта), лейкозы, злокачественные новообразования, диабет, артериосклероз, алкоголизм, использование антибиотиков, иммунодепрессантов и кортикостероидов, рентгеновское и гамма-облучение.
Род Bacteroides включает 26 видов облигатных анаэробов, большинство из которых может быть причиной заболеваний человека. По морфологии это прямые или слегка изогнутые палочки размером 0,5 – 0,8 × 1 – 2 мкм, могут располагаться поодиночке, парами или короткими цепочками из 3 – 4 клеток, грамотрицательны, спор не образуют, некоторые виды образуют капсулы, некоторые – подвижны (перитрихи). По последним двум свойствам и требовательности к питательным средам и особенностям роста все виды можно условно разделить на 3 группы (по Prevot, 1966). 1. Неподвижные, иногда образующие капсулы бактероиды (B. fragilis и другие виды). Представители именно этой группы, а также Prevotella melaninogenica чаще всего бывают причиной заболеваний человека. 2. Неподвижные, образующие капсулу, нуждающиеся при росте на средах в нативной сыворотке или асцитической жидкости. 3. Подвижные, не образующие капсул, образующие газ или не образующие газа при ферментации.
B. fragilis растет медленно (5 – 7 сут.) на плотных и жидких средах, добавление свежей крови или сыворотки необязательно, но значительно ускоряет рост. Колонии на кровяном агаре появляются на 3 – 5-й день, их диаметр меньше 1 мм, гемолиза нет. На мясном бульоне через 48 ч B. fragilis дает диффузное помутнение; ферментирует некоторые сахара с образованием кислоты и небольшого количества газа; желатин не разжижает, индола и сероводорода не образует. Имеется несколько подвидов этого микроба. Содержание Г + Ц в ДНК составляет 40,5 – 42,0 мол %.
Род Prevotella включает 24 вида, в том числе P. melaninogenica (= Bacteroides melaninogenicus). Этот вид хорошо растет на кровяном агаре, образуя гладкие или шероховатые колонии диаметром 1 – 3 мм, иногда наблюдается гемолиз. Культура обычно имеет неприятный гнилостный запах. Для роста требуется гемин и витамин К. На кровяном агаре образует черный пигмент, представляющий собой комплекс гематина с бактериальным протеином; пигментирован обычно центр колонии. Непостоянно ферментирует некоторые углеводы с образованием кислоты и газа.
Оптимальная температура роста бактероидов и превотеллы 37 °C при рН 7,6 – 7,8. Рост некоторых видов стимулируется не только кровью, но и добавлением в среду глюкозы, цистеина, иногда желчи.
Биохимические свойства (протеолитические и сахаролитические) зависят, прежде всего, от вида и подвида бактероида и превотеллы и могут быть использованы для дифференциации выделенной культуры. Для этих же целей используют определение конечных кислых продуктов брожения на специальной среде (пептонно-дрожжевой бульон с глюкозой), которыми могут быть летучие и нелетучие органические кислоты (пропионовая, уксусная, бутиловая, янтарная, молочная и др.).
В антигенном отношении бактероиды и превотеллы неоднородны, их серологическая классификация пока только уточняется. Установлено, что, например, у вида B. fragilis имеется свыше 20 сероваров, у B. melaninogenicus – 4 сероварианта. Факторами патогенности бактероидов являются некоторые ферменты (нейраминидаза, нуклеазы, фибринолизин). Капсульный полисахарид у B. fragilis способен подавлять фагоцитоз. У других бактероидов и превотелл в качестве факторов патогенности выступают белки наружной мембраны и липополисахарид клеточной стенки. При септицемии и тяжелых воспалительных процессах, вызванных бактероидами и превотеллами, в сыворотке крови больных в довольно высоких титрах появляются антитела, сохраняющиеся в течение нескольких месяцев. Они могут быть обнаружены в реакциях агглютинации, преципитации в геле, РПГА.
Единственным эффективным методом диагностики заболеваний, вызванных бактероидами и превотеллами, является бактериологический. Материал для посева – кровь, мокрота, гной из абсцессов и других полостей, испражнения – засевают на специальные питательные среды; инкубируют в анаэробных условиях при 37 °C. Следует учитывать, что многие штаммы анаэробов чрезвычайно чувствительны к кислороду и при последующих пересевах быстро теряют жизнеспособность. Идентификация патогенных бактероидов основана на изучении культуральных, биохимических признаков, толерантности к кислороду и СО2 и некоторых других свойств. Специфическая профилактика не разработана. Лечение антибиотиками проводят в соответствии с индивидуальной чувствительностью конкретного штамма-возбудителя при изучении выделенной чистой культуры. Хороший эффект дает сочетание антибиотиков с метронидазолом.
Род Fusobacterium включает 16 видов, многие из которых являются естественными обитателями организма теплокровных животных и человека. Наиболее частыми возбудителями воспалительно-некротических заболеваний человека (устаревшее название заболевания – некробациллез) являются два вида – F. necrophоrum и F. nucleatum.
Эти бактерии грамнегативны, чрезвычайно склонны к полиморфизму. Чаще имеют вид прямых или слегка изогнутых веретенообразных палочек с заостренными концами размером 0,5 – 1,5 × 2 – 3 мкм, но в чистой культуре могут встречаться нитевидные формы до 80 – 100 мкм и ветвящиеся формы. В старых культурах преобладают короткие палочки, которые на средах бывают значительно толще, чем в патологическом материале. Бактерии неподвижны, спор и капсул не образуют; по Леффлеру и разведенным фуксином красятся неравномерно: слабо окрашенные участки бывают значительно толще, чем хорошо окрашенные, и располагаются на одинаковом расстоянии по длине микроба, имитируя присутствие спор.
Температурный оптимум для их роста 37 °C, рН 7,6. Фузобактерии хорошо растут на мясных жидких средах, печеночном бульоне, сердечно-мозговом бульоне с глюкозой под вазелиновым маслом. Рост сопровождается помутнением среды, образованием газа и запаха, напоминающего сыр, добавление к среде бычьей сыворотки или асцитической жидкости значительно ускоряет рост. В строго анаэробных условиях на сывороточном агаре фузобактерии образуют маленькие, круглые с ровными или неровными краями, непрозрачные, грязновато-белые с желтоватым центром колонии. На кровяных средах обычно вызывают гемолиз.
Желатин и свернутую сыворотку не разжижают, обычно не восстанавливают нитраты в нитриты. Как правило, выделяют индол и сероводород, не растут в присутствии желчи и желчных солей.
Биохимические свойства могут быть использованы для дифференциально-диагностических целей: в зависимости от вида фузобактерии могут или не могут ферментировать глюкозу, левулезу, маннозу, гидролизовать эскулин и крахмал, выделять липазу, образовывать летучие органические кислоты на пептонно-дрожжевом бульоне с глюкозой. Антигенное строение фузобактерий, как и постинфекционный иммунитет, мало изучены. Патогенные свойства связаны с эндотоксином – липополисахаридом клеточной стенки, а также с ферментами агрессии и защиты: плазмокоагулазой, фибринолизином, нуклеазами. Некоторые штаммы вырабатывают гемотоксин; такие штаммы обладают значительной вирулентностью и иногда могут вызвать внутрилабораторное заражение.
Фузобактерии при температуре 65 °C погибают в течение 15 мин, при кипячении – моментально. При высушивании на воздухе погибают через 24 – 48 ч. Рабочие растворы дезинфицирующих веществ убивают их в течение 10 – 20 мин. В испражнениях животных и человека фузобактерии могут сохраняться до 30 – 50 сут.
При лабораторной диагностике заболеваний, вызванных фузобактериями, можно использовать микроскопический, бактериологический и биологический методы. Микроскопический метод применяют для диагностики поражений кожи и слизистых оболочек. Материал для приготовления мазка берут на границе живой и некротизированной ткани, мазок фиксируют и окрашивают по Граму, Леффлеру или водным фуксином. Возбудитель имеет вид зернистоокрашенных длинных нитей и палочек. Для бактериологического исследования берут гной из язв на поверхности тела или из полостей при поражении внутренних органов, трупный материал. Посев чаще всего делают на кровяной агар, инкубируют в анаэробных условиях. Чистую культуру идентифицируют по биохимическим свойствам. Биологический метод используют параллельно с бактериологическим и чаще применяют при работе с сильно загрязненным посторонней флорой патологическим материалом. Белым мышам материал вводят у основания хвоста, где развивается некроз, и они погибают на 8 – 10-е сут.; при посеве материала, взятого на границе живой и пораженной ткани, легко можно выделить возбудителя. Кроликов заражают подкожно в область брюшных мышц или под кожу уха и внутривенно. Некротический процесс захватывает большие участки кожи, где на 4 – 5-е сутки можно легко обнаружить возбудителя или выделить чистую культуру.
Специфическая профилактика не разработана. Лечение проводят антибиотиками, к которым данный штамм чувствителен, в сочетании с парентеральным введением метронидазола (метрогила).

