Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 41 Иммунопрофилактика и иммунотерапия
Дальше: Часть шестая ВИРУСЫ И ВЫЗЫВАЕМЫЕ ИМИ ЗАБОЛЕВАНИЯ
Глава 42
Реакции иммунной сыворотки (серологические реакции)
Взаимодействие антигена с антителом проявляется в форме различных иммунологических, или серологических (лат. serum – сыворотка), реакций. В связи с их высокой чувствительностью и специфичностью они нашли широкое диагностическое применение.
Серологические реакции применяют с одинаковым успехом для двух целей. Вопервых, по известному антигену (диагностикуму) определяют в исследуемой сыворотке наличие и количественное содержание специфических к данному антигену антител. Последнее устанавливают путем титрования сыворотки. Титром иммунной сыворотки называют то ее максимальное разведение, которое еще дает положительную реакцию. Во-вторых, с помощью известного антитела, т. е. диагностической иммунной сыворотки, определяют наличие в исследуемом материале специфического микробного антигена или осуществляют серологическую идентификацию выделенного возбудителя.
С диагностической целью используют следующие серологические реакции:
1. Реакция агглютинации в ее различных вариантах.
2. Реакция преципитации и ее различные модификации.
3. Реакции иммунофлуоресценции (РИФ) в прямом и непрямом вариантах.
4. Реакции, протекающие с участием комплемента.
5. Реакции, протекающие с участием фагоцитов.
6. Реакции иммуносорбентного анализа твердой фазы.
7. Реакции нейтрализации биологической активности возбудителя или токсинов.
Реакция агглютинации
Агглютинация (лат. agglutinatio – склеивание) – склеивание (соединение) антигеннесущих корпускулярных частиц (цельные клетки, частицы латекса и др.) молекулами специфических антител в присутствии электролитов, которое заканчивается образованием видимых невооруженным глазом хлопьев или осадка (агглютината). Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевидный осадок, безжгутиковые и бескапсульные – мелкозернистый, капсульные – тяжистый. Различают агглютинацию прямую, при которой во взаимодействии со специфическими антителами непосредственно участвуют собственные антигены бактериальной или любой другой клетки, например эритроцитов; и непрямую, или пассивную, при которой бактериальные клетки или эритроциты, или частицы латекса являются носителями не собственных, а сорбированных на них чужих антигенов (или антител) для выявления специфических к ним антител (или антигенов). В реакции агглютинации участвуют главным образом антитела, относящиеся к классам IgG и IgM. Она протекает в две фазы: вначале происходит специфическое взаимодействие активного центра антител с детерминантом антигена, эта стадия может происходить в отсутствие электролитов и не сопровождается видимыми изменениями реагирующей системы. Для второй стадии – образования агглютината – необходимо наличие электролитов, которые снижают электрический заряд комплексов антиген + антитело и ускоряют процесс их склеивания. Эта фаза заканчивается образованием агглютината.
Реакции агглютинации ставят либо на стеклянных, либо на гладких картонных пластинках, либо в стерильных агглютинационных пробирках. Реакции агглютинации (прямые и пассивные) на стекле обычно применяют в качестве ускоренного метода обнаружения специфических антител в сыворотке больного (например, при бруцеллезе) или для серологической идентификации возбудителя. В последнем случае обычно используют хорошо очищенные (адсорбированные) диагностические сыворотки, содержащие только монорецепторные антитела или их набор к различным антигенам. Несомненным достоинством реакции агглютинации на стекле является простота ее постановки и то, что она протекает несколько минут или даже секунд, так как оба компонента в ней используются в концентрированном виде. Однако она имеет лишь качественное значение и менее чувствительна, чем пробирочная. Развернутая реакция агглютинации в пробирках дает более точные результаты, ибо она позволяет определить количественное содержание антител в сыворотке (установить ее титр) и при необходимости зарегистрировать факт нарастания титра антител, что имеет диагностическое значение. Для постановки реакции в агглютинационные пробирки вносят определенным образом разведенную 0,85 % раствором NaCl сыворотку и равный объем (обычно 0,5 мл) суспензии стандартного диагностикума (или исследуемой культуры), содержащего в 1 мл 1 млрд бактерий. Учет результатов реакции агглютинации производят предварительно через 2 ч инкубации пробирок при температуре 37 °C и окончательно через 20 – 24 ч по двум признакам: наличию и величине осадка и степени прозрачности надосадочной жидкости. Оценку осуществляют по четырехкрестной системе. Реакция обязательно сопровождается контролем сыворотки и антигена. В тех случаях, когда развернутую реакцию агглютинации в пробирке ставят для серологической идентификации возбудителя, она имеет диагностическое значение, если реакция оценена как положительная при разведении диагностической сыворотки не менее половины ее титра.
Необходимо учесть, что при смешивании растворов гомологичных антигенов и антител не всегда наблюдаются видимые проявления реакции агглютинации. Осадок образуется только при некоторых оптимальных соотношениях обоих компонентов реакции. Вне этих пределов, при значительном избытке антигена или антител, реакции не наблюдается. Это явление получило название «феномена прозоны». Оно наблюдается как при реакции агглютинации, так и при реакции преципитации. Появление прозоны в иммунных реакциях объясняется тем, что участвующие в них антигены, как правило, являются полидетерминантными, а молекулы антител IgG имеют два активных центра. При избытке антител поверхность каждой частицы антигена покрывается молекулами антител так, что не остается свободных детерминантных групп, поэтому второй, несвязанный активный центр антител не может взаимодействовать с другой антигенной частицей и связывать их друг с другом. Образование видимого агглютината или преципитата подавляется также при избытке антигена, когда не остается ни одного свободного активного центра антител, и поэтому комплексы антиген + антитело + антиген не могут более укрупняться.
Варианты ускоренных реакций агглютинации. Реакция пассивной гемагглютинации и ее варианты
Классическая реакция агглютинации предусматривает использование корпускулярных антигенов. Однако в ней могут участвовать и растворимые антигены. Чтобы это стало возможным, такие антигены адсорбируют на иммунологически инертных частицах. В качестве носителя можно использовать частицы латекса или бентонита, однако в настоящее время наиболее часто применяют эритроциты животных или человека, улучшая их адсорбирующие свойства обработкой растворами танина, формалина или бензидина. Эритроциты, адсорбировавшие на себе антиген, называются сенсибилизированными данным антигеном, а иммунная реакция, в которой они участвуют, – реакцией непрямой, или пассивной, гемагглютинации (РНГА, или РПГА), так как эритроциты участвуют в ней пассивно.
РПГА ставят в специальных полистироловых пластинках с луночками, имеющими полусферическое дно. При использовании ее для серологической диагностики в этих луночках готовят двукратные разведения в физиологическом растворе исследуемой сыворотки и затем добавляют к ней в качестве диагностикума взвесь сенсибилизированных эритроцитов. Учет результатов проводят через 2 ч инкубации при температуре 37 °C по четырехкрестной системе. При положительной реакции агглютинировавшиеся эритроциты оседают на дно луночки и равномерно покрывают его в виде перевернутого зонтика. При отрицательной реакции эритроциты тоже оседают, жидкость становится прозрачной, осадок выглядит как маленький диск в центре луночки. Титром сыворотки в РПГА считается последнее ее разведение, которое еще дает ярко выраженную гемагглютинацию без значительных признаков наличия диска.
РПГА может применяться также в качестве ускоренного метода бактериологической диагностики для обнаружения непосредственно в исследуемом материале неизвестных бактерий, вирусов, токсинов, например возбудителей чумы, стафилококковых энтеротоксинов и др. При таком варианте постановки РПГА в роли известного компонента реакции используют эритроциты, адсорбировавшие антитела известной специфичности – антительный эритроцитарный диагностикум. Если исследуемый материал содержит достаточное количество известного антигена, РПГА будет положительна.
Вариантами использования РПГА являются: реакция нейтрализации антигена (РНАг), реакция нейтрализации антител (РНАт), реакция торможения пассивной гемагглютинации (РТПГА). Для этих реакций используют антигенные и антительные эритроцитарные диагностикумы. Можно использовать одновременно две взаимно контролирующие однонаправленные реакции, например РПГА с антигенным диагностикумом и РНАг с антительным эритроцитарным диагностикумом.
Реакция нейтрализации антител (РНАт) заключается в том, что суспензию, содержащую искомый антиген, смешивают со специфической иммунной сывороткой, содержащей известные антитела, в соответствующих объемах и инкубируют при температуре 37 °C в течение двух часов. После этого добавляют антигенный эритроцитарный диагностикум. Смесь встряхивают и оставляют при комнатной температуре. Результаты учитывают через 3 – 4 ч и окончательно – через 18 – 24 ч. Если в исследуемом материале имеется антиген, он свяжет антитела (нейтрализует их), и поэтому гемагглютинации не произойдет.
По такому же принципу ставят реакцию нейтрализации антигена (РНАг). Только в этом случае в исследуемом материале обнаруживают антитела. Специфический антиген, добавленный к такому исследуемому материалу, будет связываться с антителами, содержащимися в нем, т. е. произойдет нейтрализация антигена антителами, и поэтому гемагглютинации при добавлении антительного эритроцитарного диагностикума не произойдет.
Реакция коагглютинации. Является одним из вариантов пассивной, т. е. опосредованной клетками-носителями антител, ускоренной реакции агглютинации на стекле. В основу этой реакции положено уникальное свойство золотистого стафилококка, имеющего в составе своей клеточной стенки белок А, связываться с Fc-фрагментами IgG и IgM. При этом активные центры антител остаются свободными и могут взаимодействовать со специфическими детерминантами антигенов. На предметное стекло наносят каплю 2 %-ной взвеси стафилококков, сенсибилизированных соответствующими антителами, и добавляют каплю взвеси исследуемых бактерий. При соответствии антигена антителам через 30 – 60 с происходит четкая агглютинация нагруженных антителами стафилококков.
Реакция латекс-агглютинации (ЛАГ). Носителем антител в этой диагностической системе являются мелкие стандартные частички латекса. Реакцию выполняют микрометодом в лунках на стекле. Основным условием успешной постановки ЛАГ является строгое соблюдение количественных соотношений компонентов системы: к 50 мкл исследуемого материала добавляют 10 мкл латекс-препарата, сенсибилизированного антителами. Специфичность ЛАГ контролируют с помощью трех контрольных тестов, содержащихся в коммерческих тест-системах: заведомо положительная реакция, заведомо отрицательная реакция и контроль качества латекс-суспензии по ЛАГ-несенсибилизированным (не несущим антител) латексам с исследуемым материалом. В нашей стране в качестве носителей специфических антител используют полистироловые монодисперсные латексы с разным диаметром частиц (0,3; 0,66; 0,75; 0,8 мкм). ЛАГ используют для быстрого обнаружения микроорганизмов или их антигенов в исследуемом материале.
Иммуномагнитное обнаружение антигенов. Один из вариантов ускоренной реакции агглютинации на стекле связан с применением супермагнитных полимерных частиц, покрытых специфическими антителами. Одна такая частица связывает до 107– 108 клеток микроорганизмов, благодаря чему чувствительность данного метода достигает 5 КОЕ/мл. Иммуномагнитное обнаружение микроорганизмов можно применять в комплексе с ЦПР.
Реакция агрегат-гемагглютинации (РАГА). Позволяет быстро обнаружить в крови больных как свободно циркулирующие антигены (антигенемия), так и антигены, связанные с антителами, – циркулирующие иммунные комплексы (ЦИК). Для РАГА используют эритроциты, сенсибилизированные соответствующими антителами. Добавление сыворотки крови больного, в которой содержатся антигены, к сенсибилизированным эритроцитам, на которых фиксированы антитела, приводит к склеиванию (агглютинации) эритроцитов и иммунных комплексов.
Антиглобулиновая проба Кумбса (реакция Р. Кумбса). При помощи реакций прямой и пассивной агглютинации определяют полные (двухвалентные) антитела. Неполные (моновалентные, блокирующие) антитела не выявляются этими методами, так как, соединяясь с антигеном, блокируют его, но не могут вызвать агрегации антигена в крупные конгломераты. Неполными (блокирующими) называют антитела, у которых функционирует только один активный центр; второй активный центр по неизвестной причине не срабатывает. Для выявления неполных антител используют специальную реакцию Кумбса (рис. 72). В реакции участвуют: сыворотка больного, в которой определяют неполные антитела, корпускулярный антиген-диагностикум, антиглобулиновая сыворотка, содержащая антитела к человеческому глобулину. Реакция протекает в два этапа.
1. Взаимодействие антигена с неполными антителами. Видимых проявлений при этом нет. Первый этап заканчивают отмывкой антигена от остатков сыворотки больного.
2. Взаимодействие антиглобулиновой сыворотки, полученной в результате иммунизации животного человеческим глобулином, с неполными антителами, адсорбированными на антигене. В силу того что антиглобулиновые антитела двухвалентны, они связывают два одновалентных антитела отдельных комплексов АГ + неполное антитело, что приводит к их склеиванию и появлению видимого осадка.
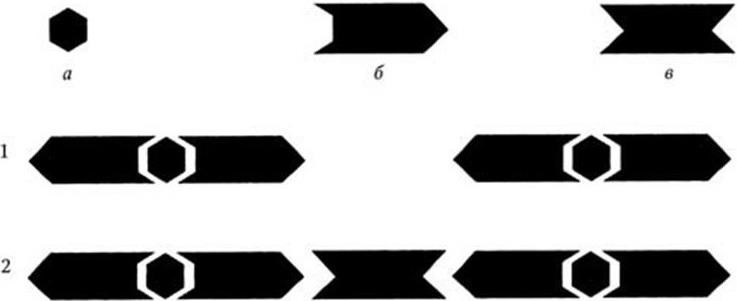
Рис. 72. Антиглобулиновая проба Кумбса для выявления неполных (моновалентных) антител:
а – антиген; б – неполное антитело; в – антитело против моновалентного антитела (антиглобулин). 1. Соединение неполных антител с антигенами (агглютинации не происходит). 2. Добавление антиглобулиновой сыворотки приводит к агглютинации антигенов, блокированных неполными антителами
Антиглобулиновую пробу Кумбса применяют, например, при серологической диагностике бруцеллеза, при анализе групп крови, в диагностике аутоиммунных заболеваний и др.
Реакция преципитации и ее варианты
Реакции агглютинации и преципитации очень близки по своей сути. Различия между ними зависят главным образом от величины частиц антигена. Преципитацией называют процесс, когда происходит агрегация антител с растворимыми антигенами; если же антиген представлен корпускулами, специфическая агрегация таких антигенов описывается как агглютинация.
Появление преципитата при реакции антиген – антитело определяется не только возникновением решетки, образуемой ее участниками, но и особой ролью Fc-фрагмента иммуноглобулина, изменение конформации которого приводит к утрате этим комплексом растворимости в солевых растворах. В связи с этим в реакции преципитации используют неразведенную или слабо разведенную сыворотку.

Рис. 73. Схема определения токсигенности Corynebacterium diphtheriae
Объяснение см. в разделе «Микробиология дифтерии»
Для постановки реакции преципитации необходимы: антитела – испытуемая сыворотка больного или иммунная диагностическая сыворотка (при идентификации выделенных микробов); антиген – экстрагированный гаптен или полный гаптен соответствующих микроорганизмов; физиологический раствор как источник электролитов. Существует множество модификаций этой реакции, которые подразделяют на две группы: преципитация в жидкой среде (реакция флоккуляции и реакция кольцепреципитации) и преципитация в геле.
Реакция флоккуляции представляет собой преципитацию, при которой растворы антигенов и антител смешивают в пробирке. Учет реакции производят с помощью измерения на фотоэлектроколориметре мутности получаемой системы, что позволяет определить концентрацию исследуемого антигена.
Значительно чаще применяется качественная реакция кольцепреципитации. Для ее постановки в тонкие преципитационные пробирки наливают сначала неразведенную преципитирующую сыворотку и сверху на нее наслаивают, не допуская перемешивания, раствор антигена. В случае гомологичности антител и антигена на границе между этими растворами быстро, через 3 – 10 мин, появляется кольцо преципитата. В отличие от реакции агглютинации, титр преципитирующей сыворотки определяют с помощью разведения не сыворотки, а антигена.
Реакция преципитации в геле является одним из наиболее эффективных методов анализа растворимых антигенов. Она позволяет выявить число индивидуальных антигенов в исследуемой жидкости и провести анализ их антигенного родства. В 1946 г. Дж. Оудин предложил метод простой диффузии, по которому один из компонентов реакции преципитации, обычно сыворотка, находится в геле, а другой – антиген – наслаивается на первый в виде раствора. Антиген, диффундируя в гель, образует в нем с антителами белые линии преципитации, хорошо видимые при боковом освещении. В 1948 г. Ё. Оухтерлоню разработал еще более простой и удобный метод встречной двумерной диффузии, позволяющий проводить прямое сравнение различных антигенов и сывороток. Этот метод также является весьма ценным при исследовании перекрестных реакций (рис. 73).
Для постановки реакции по Оухтерлоню используют 1 %-ный агар, приготовленный на физиологическом растворе, который разливают в чашки Петри слоем 0,5 см. После застывания в пластинке агара вырезают луночки диаметром 5 – 6 мм – одна в центре чашки, 4 – 5 – по окружности на расстоянии 1 – 2 см от центральной. В центральную луночку наливают диагностическую преципитирующую сыворотку, а в периферические – раствор гомологичного и сравниваемых с ним антигенов. Учет результатов проводят через 24, 48 и 72 ч инкубации при комнатной температуре. Антитела и антигены диффундируют навстречу друг другу, и в участках, где создаются их эквивалентные концентрации, образуются дугообразные полосы преципитации. Если полосы преципитации, идущие от двух соседних луночек, сливаются, это указывает на наличие нескольких антигенных компонентов в исследуемой жидкости. Реакцию встречной диффузии по Оухтерлоню часто применяют для определения токсигенности бактерий, например дифтерийных (см. рис. 73).
Дальнейшим развитием метода преципитации в геле является иммуноэлектрофорез. Этим термином обозначают метод, объединяющий электрофоретическое разделение смеси антигенов и встречную диффузию по Оухтерлоню на одной и той же пластинке агарового геля. Преципитирующую сыворотку при этом наливают в канавку, вырезанную в геле параллельно направлению электрофоретического разделения. Образующиеся в результате реакции линии преципитации имеют вид дуг, вытянутых в направлении электрофоретического движения фракций антигенов. Иммуноэлектрофорез позволяет определять состав сложных смесей растворимых антигенов, содержащих до 30 компонентов, и является поэтому ценным диагностическим методом.
Реакция иммунофлуоресценции
Молекулы иммуноглобулинов способны необратимо связываться (метиться) с некоторыми химическими веществами без потери своей антительной специфичности и свойства связываться с антигеном. Для такого мечения можно использовать красители, флуоресцирующие при облучении их коротковолновым светом (ультрафиолетовым, фиолетовым, синим), например изотиоционат флуоресцеина, дающий зеленовато-желтое окрашивание, или другие флуорохромы. Использование для обнаружения антигенов меченных флуорохромами антител, т. е. реакцию иммунофлуоресценции (РИФ), предложил в 1950 г. А. Кунс. С помощью РИФ можно быстро обнаруживать даже ничтожные количества антигенов, в том числе бактериальных и вирусных, по эффекту флуоресценции комплекса антиген + антитело в люминесцентном микроскопе.
Метод иммунофлуоресценции используют в двух вариантах. Один из них получил название прямого метода РИФ, и в этом случае метят антитела, которые непосредственно участвуют в реакции с исследуемым антигеном. Второй вариант известен под названием непрямого метода РИФ. В этом случае с исследуемым антигеном вначале взаимодействуют специфические к нему антитела, а уже с ними взаимодействуют антивидовые антитела (антитела против иммуноглобулинов диагностической сыворотки), меченные флуорохромом (рис. 74). Преимуществом непрямого метода РИФ является то, что при его использовании отпадает необходимость иметь большой набор различных специфических флуоресцирующих антител, так как он основан на использовании антиглобулиновых антител. В качестве последних обычно используют сыворотку козы или барана, иммунизированных сывороткой кролика (коммерческие диагностические иммунные сыворотки чаще всего готовят путем иммунизации кроликов). Непрямой метод иммунофлуоресценции применяют не только для ускоренного обнаружения антигенов (возбудителя), но и для обнаружения антител в сыворотке крови больных. Например, для серологической диагностики токсоплазмоза токсоплазмы фиксируют на предметном стекле и обрабатывают сывороткой исследуемого больного. После ее отмывки мазок повторно обрабатывают сывороткой, содержащей меченные флуорохромом антитела против человеческого глобулина. Если в крови больного есть антитела, т. е. человек болен, в люминесцентный микроскоп будут видны светящиеся токсоплазмы.

Рис. 74. Схема прямого (а) и непрямого (б) методов иммунофлуоресценции
Серологические реакции, протекающие с участием комплемента
Реакция бактериолиза. Используется для серологической диагностики холеры. Феномен бактериолиза легко удается наблюдать in vitro. Исследуемую сыворотку наносят в последовательном двукратном разведении каплями на поверхность питательной среды, на которую предварительно засевают культуру вибриона. Чашку с посевами инкубируют при температуре 37 °C в течение 18 – 20 ч. Под влиянием имеющихся в сыворотке антител и комплемента холерные вибрионы разрушаются (лизируются), и в местах нанесения капель образуются стерильные пятна. Антитела, разрушающие или умерщвляющие вибрионы, называют вибриоцидными. Титром вибриоцидных антител считается максимальное разведение сыворотки, при котором она еще вызывает отчетливый лизис бактерий.
Реакция иммобилизации трепонем. Применяется для диагностики сифилиса. Живые трепонемы в присутствии имеющихся в исследуемой сыворотке специфических антител и комплемента теряют свою подвижность.
Реакция гемагглютинации иммунного прилипания. В основе этой реакции лежит способность комплекса антиген + антитело в присутствии комплемента адсорбироваться на эритроцитах, вызывая их склеивание. Применяется для серологической диагностики гепатита А. Характеризуется высокой чувствительностью и специфичностью, но требует использования высокоочищенного антигена и специального подбора доноров эритроцитов.
Реакция гемолиза. Литическое действие иммунной сыворотки в присутствии комплемента особенно четко проявляется в отношении эритроцитов. Если кролика иммунизировать эритроцитами другого вида животных (барана), кроличья сыворотка приобретает специфическую гемолитическую активность, т. е. способность вызывать гемолиз эритроцитов, использованных для иммунизации. Этот эффект абсолютно зависим от комплемента. Инактивация последнего путем прогревания сыворотки при температуре 56 °C приводит к утрате ею гемолитической активности. Таким образом, наличие или отсутствие активного комплемента в гемолитической сыворотке очень четко выявляется по результатам ее взаимодействия с гомологичными эритроцитами: при наличии комплемента – гемолиз, образование «лаковой крови»; при его отсутствии – гемагглютинация, эритроциты выпадают на дно пробирки, образуя осадок в виде зонтика, жидкость бесцветна.
Реакция связывания комплемента
Уникальная способность комплемента специфически связываться с различными по своей природе комплексами антиген + антитело нашла широкое применение в реакции связывания комплемента (РСК). Особое преимущество РСК состоит в том, что природа антигена, участвующего в ней (корпускулярный или растворимый), не имеет значения, так как комплемент связывается с Fc-фрагментом любого антитела, относящегося к IgG и IgM, независимо от его антительной специфичности. Кроме того, РСК очень чувствительна: она позволяет обнаружить количество антител в 10 раз меньшее, чем, например, в реакции преципитации. РСК была предложена в 1901 г. Ж. Борде и О. Жангу. В ее основе лежат два свойства комплемента:
1) способность связываться с комплексом антиген + антитело;
2) лизирование эритроцитов, использованных для получения гемолитической сыворотки.
РСК ставят в два этапа, и в ней соответственно участвуют две системы – опытная, или диагностическая, и индикаторная. Диагностическая система состоит из исследуемой (или диагностической) сыворотки, которую перед постановкой реакции прогревают при 56 °C в течение 30 мин для инактивации имеющегося в ней комплемента, и антигена. К этой системе добавляют стандартный комплемент. Его источником служит свежая или высушенная сыворотка морской свинки. Смесь инкубируют при 37 °C в течение одного часа. Если в исследуемой сыворотке имеются антитела, произойдет их взаимодействие с добавленным антигеном, и образующиеся комплексы антиген + антитело свяжут добавленный комплемент. Если же в сыворотке антитела отсутствуют, образования комплекса антиген + антитело не произойдет, и комплемент останется свободным. Никаких видимых проявлений связывания комплемента на этой стадии реакции обычно нет. Поэтому для выяснения вопроса, произошло или нет связывание комплемента, добавляют вторую, индикаторную систему (инактивированная гемолитическая сыворотка + эритроциты барана), и смесь всех компонентов РСК вновь инкубируют при 37 °C в течение 30 – 60 мин, после чего оценивают результаты реакции. В случае, если комплемент связался на первой стадии, в диагностической системе, т. е. в сыворотке больного имеются антитела, и произошло связывание комплемента комплексом антитело + + антиген, лизиса эритроцитов не будет – РСК положительна: жидкость бесцветна, на дне пробирки осадок эритроцитов. Если же в сыворотке специфические антитела отсутствуют и связывания комплемента в диагностической системе не произойдет, т. е. РСК отрицательна, то неизрасходованный в диагностической системе комплемент связывается с комплексом эритроциты + антитела индикаторной системы и произойдет гемолиз: в пробирке «лаковая кровь», осадка эритроцитов нет. Интенсивность РСК оценивают по четырехкрестной системе в зависимости от степени задержки гемолиза и наличия осадка эритроцитов. Реакция сопровождается соответствующими контролями: контроль сыворотки (без антигена) и контроль антигена (без сыворотки), так как некоторые сыворотки и некоторые антигены обладают антикомплементарным действием. Перед постановкой РСК все компоненты, участвующие в ней, за исключением исследуемой сыворотки или антигена, подвергаются тщательному титрованию. Особенно важно ввести в реакцию точную дозу комплемента, так как его нехватка или избыток могут привести к ложным результатам. Титром комплемента является то его минимальное количество, которое в присутствии рабочей дозы гемолитической сыворотки обеспечивает полное растворение эритроцитов. Для постановки основного опыта берут дозу комплемента, увеличенную на 20 – 25 % по сравнению с установленным титром. Титром гемолитической сыворотки является то ее максимальное разведение, которое, будучи смешано с равным объемом 10 % раствора комплемента, полностью гемолизирует соответствующую дозу эритроцитов в течение 1 ч при температуре 37 °C. В основной опыт берут сыворотку, разведенную до 1/3 своего титра.
Непрямая реакция гемолиза используется как ускоренный метод обнаружения специфических антител. В качестве носителя антигенов используют эритроциты. При наличии в сыворотке больного специфических антител сенсибилизированные эритроциты в присутствии комплемента лизируются.
Серологические реакции, протекающие с участием фагоцитов
Определение опсонического индекса. Антитела, стимулирующие фагоцитарную активность лейкоцитов, получили название опсонинов (греч. opsoniazo – снабжать пищей, питать), или бактериотропинов. Различают термолабильные и термостабильные опсонины, или бактериотропины. К последним относятся антитела классов IgG1, IgG3, IgM. На первом этапе опсонизации антитела прикрепляются к детерминантным группам бактерий, а затем антитела с помощью Fc-фрагментов присоединяются к Fc-рецепторам макрофагов, способствуя поглощению ими бактерий (патогенов). Опсоническая активность антител резко возрастает в присутствии термолабильных опсонинов, в том числе молекул C3b, образующихся при активации системы комплемента. Молекулы C3b, осаждаясь на поверхности бактериальных клеток, способствуют прикреплению макрофагов в этих участках (эффект «иммунного прилипания»). Таким образом, опсонины и комплемент способствуют более эффективному прикреплению чужеродных частиц к макрофагам, поглощению и перевариванию их последними, а также, очевидно, процессингу и представлению антигенов. Для количественной оценки фагоцитарной активности, обусловленной опсонинами, используют определение опсонического индекса, опсоно-фагоцитарного индекса и титра опсонинов.
Под опсоническим индексом понимают отношение фагоцитарного числа исследуемой крови к фагоцитарному числу нормальной крови. Для определения фагоцитарного числа оба образца крови смешивают со стандартным количеством соответствующих живых или убитых бактерий. После 30 мин инкубации при температуре 37 °C из каждого образца крови готовят препараты-мазки, фиксируют по способу Никифорова и окрашивают метиленовым синим. Затем под микроскопом подсчитывают общее количество бактерий, фагоцитированных, например, 50 фагоцитами, и находят фагоцитарное число. Опсонический индекс является показателем того, насколько активно стимулируется фагоцитоз опсонинами и системой комплемента.
Опсоно-фагоцитарная реакция – способ оценки активности действия опсо-
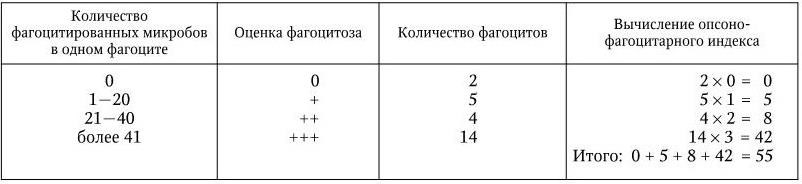
нинов сыворотки на эффективность фагоцитоза бактерий или других корпускулярных антигенов, обработанных этой сывороткой. Для определения опсоно-фагоцитарного индекса, как и при определении опсонического, готовят и окрашивают мазок из смеси исследуемой крови с бактериями. Под микроскопом в нем просматривается 25 фагоцитов, и каждый из них в зависимости от числа поглощенных ими бактерий относят к определенной группе. Конкретный пример такого подсчета представлен в табл. 17. Интенсивность фагоцитоза характеризуют цифровым показателем, представляющим собой сумму произведений, полученных путем умножения количества фагоцитов на число соответствующих им плюсов. Максимально возможный показатель равен 75 (25 × 3 = 75). Условно считают, что показатель, равный 10 – 24, соответствует слабо положительной опсоно-фагоцитарной реакции, 25 – 49 – положительной, а 50 – 75 – резко положительной. У людей, не имевших контакта с данным возбудителем, опсоно-фагоцитарный индекс обычно невелик (1 – 5).
Таблица 17
Оценка опсоно-фагоцитарной реакции (пример)
Существуют различные варианты этой реакции, но из-за громоздкости их используют относительно редко, например для диагностики бруцеллеза и некоторых других болезней.
Титр опсонинов характеризует количественно силу опсонической активности по отношению к данному возбудителю. Активность опсонинов проверяют в опытах с использованием фагоцитов здоровых людей.
Реакции иммуносорбентного анализа твердой фазы
В основе методов иммуносорбентного анализа твердой фазы лежит сорбция антител (для обнаружения неизвестного антигена) или антигенов (для обнаружения специфических антител) и специфических антител, меченных ферментом (иммуноферментный метод – ИФМ) или изотопом (радиоиммунный метод – РИМ). Чувствительность этих методов значительно превышает чувствительность традиционных иммунологических реакций, поэтому они приобрели самое широкое распространение. Эти методы могут быть использованы для диагностики практически любого инфекционного заболевания. С их помощью можно определить как антигены любого возбудителя, так и антитела к ним. Методика постановки этих реакций включает три последовательных этапа.
Обнаружение антигена с помощью ИФМ и РИМ
Первый этап – адсорбция специфических антител твердой фазой, в качестве которой обычно используют полистироловые или поливинилхлоридные поверхности лунок пластиковых микротитраторных панелей. Антитела нековалентно связываются со стенками лунок, у них сохраняются свободными активные центры, и поэтому они способны специфически реагировать с соответствующим антигеном.
Второй этап – связывание антигена из суспензии исследуемого материала за счет реакции антитело + антиген, происходящей на границе твердая фаза – жидкость. После этого луночки промывают раствором, содержащим слабый неионный детергент, для удаления из системы других, неспецифически связанных с антителами компонентов.
Третий этап – обработка твердой фазы с фиксированными на ней комплексами антитело + антиген специфическими антителами против данного антигена, но меченными либо ферментом, либо изотопом. Такие меченые антитела присоединяются к антигенам, а их избыток удаляется из системы промыванием. Таким образом, в случае присутствия в исследуемом материале искомого антигена на поверхности твердой фазы формируется комплекс: антитело + антиген + меченое антитело. Результаты реакции учитывают в зависимости от характера метки. Для иммуноферментного метода антитела метят ферментом, чаще всего пероксидазой или щелочной фосфатазой. Субстратом для пероксидазы служит H2O2 в смеси с ортофенилендиамином, используемая в виде раствора в цитратно-фосфатном буфере (рН 5,0). Добавление в опытную луночку раствора субстрата приводит к тому, что он подвергается действию пероксидазы, фиксированной на антителах; образующиеся продукты реакции имеют желтую окраску, интенсивность которой может быть определена путем фотометрирования.
Радиоиммунный метод (РИМ) предусматривает использование антител, меченных изотопом, поэтому результаты реакции оценивают путем определения радиоактивности исследуемых образцов. При положительной реакции уровень радиоактивности опытных образцов более чем в 2 раза превышает уровень радиоактивности контрольных, заведомо отрицательных образцов (рис. 75, а).
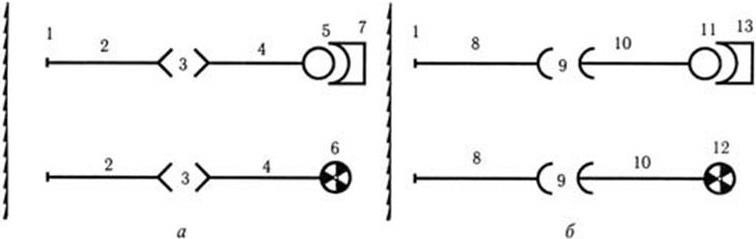
Рис. 75. Схема использования иммуноферментного и радиоиммунного методов для обнаружения антигенов (а) и антител (б):
1. Поверхность твердой фазы. 2. Специфические антитела. 3. Антиген (исследуемый материал). 4. Cпецифические к данному антигену антитела, меченные ферментом (5) или изотопом (6). 7. Субстрат для фермента. 8. Специфический антиген. 9. Исследуемая сыворотка (антитела). 10. Антивидовая сыворотка, содержащая антитела к человеческому иммуноглобулину, меченные ферментом (11) или изотопом (12). 13. Субстрат для фермента
Обнаружение специфических антител с помощью ИФМ и РИМ
Для обнаружения антител реакции также ставят в три этапа.
Первый этап – адсорбция специфических антигенов на стенках луночек. Обычно планшеты в коммерческих тест-системах уже имеют сенсибилизированные луночки, т. е. на их дне и стенках антигены уже адсорбированы.
Второй этап – добавление в луночки образцов исследуемой сыворотки для обнаружения в ней специфических антител к данному антигену. Если они имеются, то вступают во взаимодействие с антигеном и образуют комплекс антиген + + антитело.
Третий этап – после отмывания луночек в них добавляют специфические антиглобулиновые антитела (антивидовые, т. е. антитела против человеческих иммуноглобулинов), но меченные ферментом (ИФМ) либо изотопом (РИМ). Результаты реакции оценивают, как указано выше (рис. 75, б). В качестве контроля используют образцы заведомо положительные и заведомо отрицательные.
Предложены различные варианты иммуноферментного метода. Большое значение имеет вариант ИФМ, позволяющий осуществлять «захват» антител, относящихся к IgM. Этот метод позволяет более точно производить серологическую диагностику, так как основан на обнаружении специфических иммуноглобулинов IgM, которые появляются в первую очередь при встрече с возбудителем.
Реакции нейтрализации
Этот тип иммунологических реакций основан на способности антител специфически подавлять (нейтрализовать) биологическую активность возбудителя или его токсинов в различных тест-системах – организме животных, в куриных эмбрионах, культурах клеток – или каким-то иным способом. Это зависит от природы возбудителя и цели исследования. Например, для оценки эффективности иммунизации против дифтерии и столбняка определяют уровни антитоксинов в сыворотке крови привитых по их способности нейтрализовать биологическое действие определенной дозы токсина (реакция Шика). Однако реакции нейтрализации применяют и с диагностическими целями. Особенно широкое применение они получили в вирусологической практике как для серологической диагностики вирусных заболеваний, так и для идентификации вирусов. С этой целью используют реакции нейтрализации роста вирусов в культуре ткани, подавления бляшкообразования, гемадсорбции, торможения гемагглютинации (РТГА) и др.
Таблица 18
Активность антител, относящихся к различным классам иммуноглобулинов, в иммунологических реакциях
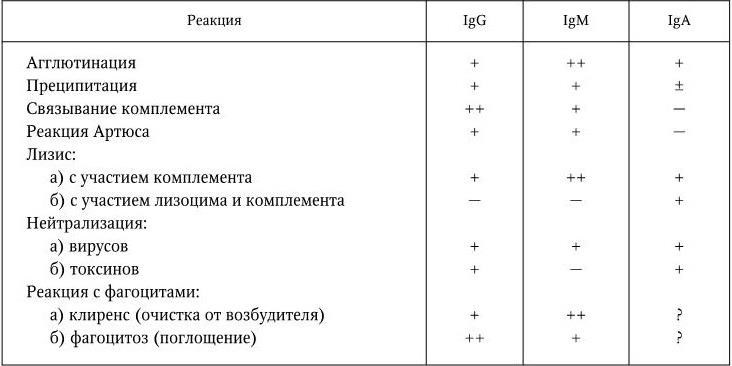
До тех пор, пока не была выяснена химическая природа антител, полагали, что каждая реакция иммунной сыворотки опосредуется особым видом антител, которые получили соответственно название агглютининов, преципитинов, опсонинов, антитоксинов и т. п. Хотя эти названия сохранились, они имеют чисто феноменологическое значение, т. е. отражают конечный результат взаимодействия антитела с антигеном. В настоящее время уже ясно, что нет специальных антител – агглютининов, преципитинов и т. д., а есть 5 классов иммуноглобулинов. Специфичность антител, относящихся к любому классу иммуноглобулинов, определяется структурой активного центра, причем антитела данной специфичности могут относиться к разным классам. Конечный исход взаимодействия антигена с антителами зависит от природы антигена (корпускулярный – агглютинация, растворимый – преципитация); от участия системы комплемента (бактериолиз, бактерицидное действие); макрофагов; от того, к какому классу иммуноглобулинов относится данное антитело; от свойств его Fc-фрагмента. Разные классы иммуноглобулинов в неодинаковой степени участвуют в различных иммунологических реакциях (табл. 18).
Например, в реакциях агглютинации наиболее активны антитела, относящиеся к IgM и IgG, в реакции связывания комплемента участвуют главным образом антитела IgG и IgM, в реакции лизиса с участием лизоцима и комплемента – только IgA.
Назад: Глава 41 Иммунопрофилактика и иммунотерапия
Дальше: Часть шестая ВИРУСЫ И ВЫЗЫВАЕМЫЕ ИМИ ЗАБОЛЕВАНИЯ

