Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 26 Система комплемента и формирование видового иммунитета
Дальше: Глава 28 Основные биологические механизмы самозащиты генома клетки
Глава 27
Иные механизмы видового иммунитета
Система интерферонов
Давно было подмечено, что если ввести в организм два вируса одновременно или с интервалом не более 24 ч, между ними наблюдается какое-то взаимодействие, проявляющееся во взаимном угнетении (интерференция). В 1957 г. Л. Айзекс и Дж. Линдеман обнаружили, что явление интерференции связано с образованием в клетках, которые были заражены вирусом, особого белка – интерферона. Установлено, что существует не один интерферон, а целая система их, в которой выделены три основных типа. Интерфероны, синтезируемые в клетках человека, различаются по своим физико-химическим свойствам; рецепторам, с помощью которых они взаимодействуют с клетками; кислоточувствительности; антигенной специфичности. Современная номенклатура интерферонов такова.
Номенклатура интерферонов
(разработана специальной комиссией ВОЗ в 1980 г.):
• Новое обозначение:
1) IFN-α; 2) IFN-β; 3) IFN-γ.
• Старое обозначение:
1) тип I (лейкоцитарный), pH 2,0 – стабильный, индуцируемый чужеродными клетками;
2) тип II (фибробластный), pH 2,0 – стабильный;
3) тип III (иммунный), pH 2,0 – лабильный, индуцируемый антигенами и митогенами.
По своей химической природе интерфероны являются гликопротеидами. Каждый из трех типов интерферонов (α, β, γ) разделяют на подтипы. Например, тип (семейство) α-интерферона включает около 20 подтипов, различающихся по биологическим свойствам и структуре. Среди них обнаружены и такие подтипы, которые утрачивают свою активность при рН 2,0, т. е. кислотолабильные. Множественность и структурная гетерогенность интерферонов, очевидно, отражают их функциональную гетерогенность, а также способность синтезироваться под влиянием различных индукторов. Молекулярная масса интерферонов варьирует от 17 до 45 кД у α– и β-интерферонов и от 20 до 80 кД у γ-интерферона; γ-интерферон продуцируют Т-лимфоциты, натуральные, или природные, киллеры, активированные макрофаги. В свою очередь он стимулирует образование молекул МНС класса II, является кофактором дифференцировки и активации В-лимфоцитов и антагонистом действия на них интерлейкина-4. Гены, контролирующие синтез интерферонов у человека, локализованы на 2, 5 и 9-й хромосомах.
В соответствии с гипотезой об индукции интерферона предполагается, что в клетках его синтез блокирован репрессором. При контакте клетки с индуктором, например вирусом, репрессор связывается, что приводит к активации оперона, контролирующего образование интерферона. Затем происходит транскрипция мРНК для интерферона и ее трансляция. Оперон для α-интерферона содержит до 12 структурных генов. Противовирусное действие интерферонов проявляется в их способности подавлять внутриклеточное размножение широкого круга ДНК– и РНК-вирусов. Интерферон не взаимодействует непосредственно с вирусом, он не препятствует адсорбции вируса на клетке и его проникновению в клетку. Антивирусное действие интерферонов не связано с синтезом какого-то нового белка, а проявляется в повышении активности ряда ключевых ферментов клеточного обмена веществ (рис. 62). Один из возможных механизмов антивирусной активности интерферона заключается в том, что он увеличивает продукцию протеинкиназы, которая фосфорилирует один из факторов инициации трансляции и ингибирует синтез белка. Другой механизм сводится к тому, что под влиянием интерферона накапливается олигоаденилатсинтетаза, приводящая к образованию 2,5-олигоадениловой кислоты. Последняя активирует клеточную эндонуклеазу, которая разрушает молекулы РНК, в том числе и мРНК. Так или иначе, под влиянием интерферона блокируется синтез вирусных макромолекул. Повидимому, в зависимости от типа рецепторов клетки, особенностей самих клеток и типов интерферонов, последние реализуют свое воздействие через активацию синтеза разных ферментных систем. Индукция синтеза интерферона происходит под воздействием самых различных факторов: ДНК– и РНК-содержащих вирусов, бактерий, риккетсий, простейших, различных микробных антигенов, а также различных синтетических соединений. Наиболее характерные черты биологического действия интерферона следующие:
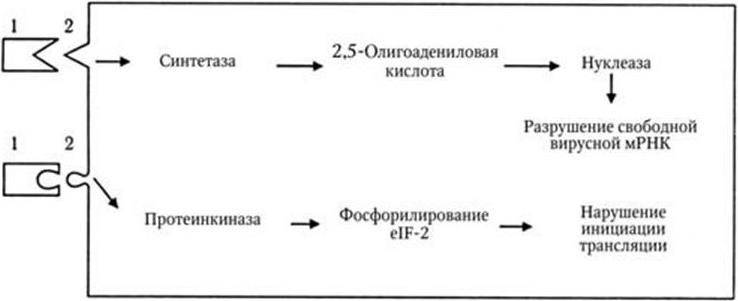
Рис. 62. Механизм действия интерферона (по А. Г. Букринской, 1986):
1 – интерферон; 2 – клеточный рецептор
1) универсальность – интерферон активен против широкого круга вирусов;
2) выраженная тканевая специфичность – он активен в гомологичных системах и практически не активен в гетерогенных тканях (поэтому для лечения человека можно использовать только интерферон человеческого происхождения), биологическая активность интерферона определяется его полипептидом, а тканеспецифичность – углеводным компонентом;
3) наличие эффекта последействия – даже после отмывания интерферона в клетках длительное время сохраняется способность подавлять размножение вирусов;
4) отсутствие какого-либо токсического эффекта – обработка интерфероном клеток не нарушает их нормальной жизнедеятельности;
5) высокая эффективность действия – даже небольшое количество интерферона (несколько десятков молекул) обладает противовирусной активностью.
Интерфероны обладают не только противовирусным, но и противобактериальным (более сильным против грамположительных бактерий и хламидий и менее сильным против других грамотрицательных бактерий) и противоопухолевым действием. Такое их действие связано прежде всего с тем, что интерфероны – мощные иммуномодуляторы. Они стимулируют гуморальный иммунитет, усиливая антителообразование, восстанавливают соотношение T-хелперы/T-супрессоры, уменьшают степень иммунодепрессии, стимулируют фагоцитоз, активность цитокинов, всех киллерных клеток и T-цитотоксических лимфоцитов и т. д. В основе такой широкой активности интерферонов лежит их способность включаться в различные метаболические процессы и регулировать их, поэтому систему интерферонов следует рассматривать как неотъемлемую составную часть общей иммунной системы. Синтез молекул интерферонов – первый ответ на получение клетками неспецифического сигнала о появлении чужеродных антигенов. Включаясь в регуляцию метаболических процессов в клетках, тканях и органах, интерфероны обеспечивают поддержание гомеостаза на всех уровнях организации от клетки до целостного организма. В связи с этим для стимуляции синтеза эндогенных интерферонов и усиления их иммуномодулирующего действия в практику лечения и профилактики вирусных и других инфекционных заболеваний, особенно таких, при которых возбудитель оказывает негативное действие на систему интерферонов, помимо собственно интерферонов все шире внедряются различные синтетические стимуляторы интерферонообразования.
Два таких препарата успешно используются: амиксин и арбидол. Амиксин – первый пероральный синтетический низкомолекулярный индуктор эндогенного интерферона. Его применяют по специальным схемам для профилактики и лечения гриппа и других острых респираторных вирусных инфекций (ОРВИ), герпетических, цитомегаловирусных и нейровирусных заболеваний, энтеральных (A, E) и парентеральных вирусных гепатитов (B, C, D, E, G, TTV) и хламидиозов. Амиксин нетоксичен и хорошо совместим с антибиотиками и средствами традиционного лечения вирусных и бактериальных болезней. Арбидол помимо интерферониндуцирующего и иммуномодулирующего обладает и прямым антивирусным действием. Он применяется для профилактики и лечения гриппа и ОРВИ у взрослых и детей по специальным схемам.
Киллерные клетки
Помимо систем макрофагов, комплемента и интерферонов, в обеспечении видового иммунитета исключительно важная роль принадлежит Т-цитотоксическим лимфоцитам, а также главной системе гистосовместимости (см. соответствующие разделы).
Роль Т-цитотоксических лимфоцитов, или Т-киллеров, заключается в том, что они по представлению антигенов главной системы гистосовместимости класса I распознают любые чужеродные антигены, например вирусные, а также собственные мутантные клетки, например раковые, атакуют и уничтожают их.
Кроме Т-цитотоксических лимфоцитов, киллерными функциями обладают обнаруженные в 1976 г. в лимфоидной ткани природные, или естественные, киллеры – клетки NK (англ. natural killer – природный убийца). Они найдены в лимфоидной ткани животных всех изученных видов, кроме кошек. Хотя NK относятся к лимфоцитам, они не обладают свойствами ни зрелых В-, ни зрелых Т-лимфоцитов и имеют свойственные только им маркеры; происходят они из клеток-предшественников костного мозга. В отличие от Т-цитотоксических лимфоцитов киллерная активность NK не зависит от представления им чужеродных антигенов молекулами МНС класса I. NK способны распознавать и лизировать различные варианты опухолевых клеток. В этом заключается важная роль их в поддержании генетического гомеостаза.
Цитотоксическим фактором природных киллеров является особый белок, который по физико-химическим и иммунологическим свойствам напоминает белок перфорин из цитолитических гранул. Этот белок в присутствии ионов Ca2+ способен быстро полимеризоваться. Образующиеся субъединицы белка встраиваются в мембрану клетки, формируя в ней канал с малым диаметром. Через канал в клетку проникает вода, клетка разбухает и лизируется.
ЗАКЛЮЧЕНИЕ К ГЛАВАМ 21 – 27
Таким образом, если естественная резистентность организма во многом определяется состоянием его различных анатомо-физиологических механизмов, перечисленных выше, то видовой иммунитет – функция высокоспециализированных иммунных систем. В результате хорошо координированного взаимодействия систем макрофагов, комплемента, интерферонов, главной системы гистосовместимости, Т-цитотоксических лимфоцитов и природных киллеров еще до приобретения специфического иммунитета обеспечивается своевременное распознавание и уничтожение всех генетически чужеродных веществ и существ (микроорганизмов и мутантных клеток), благодаря чему и сохраняется структурная и функциональная целостность организма. Вместе с тем иммунные системы служат основой для формирования приобретенного (специфического) иммунитета, и на их уровне видовой и приобретенный иммунитет стыкуются, образуя единую и наиболее эффективную систему самозащиты организма.
Назад: Глава 26 Система комплемента и формирование видового иммунитета
Дальше: Глава 28 Основные биологические механизмы самозащиты генома клетки

