Изоэвгенол

Изоэвгенол представляет собой душистое вещество, которое обуславливает запах гвоздики или запах азиатского растения иланг-иланг (Cananga odorata). Он существует в виде двух изомеров – транс- (более устойчивая и более распространенная форма, которая приведена на рисунке) и цис-изомера. Впервые был получен искусственным путем в 1891 году изомеризацией эвгенола.

Транс-изоэвгенол – бесцветные кристаллы с запахом гвоздики. Цис-изоэвгенол – жидкость с запахом гвоздики. Технический изоэвгенол состоит из 5–18 % цис-изоэвгенола и 82–95 % транс-изоэвгенола. Изоэвгенол широко используется для составления таких парфюмерных композиций, как отдушки для мыла и косметических изделий, ароматизации пищевых продуктов, ранее – для получения ванилина.
Цинеол

Цинеол (эвкалиптол, 1,8-эпокси-пара-ментан, C10H18O) при комнатной температуре представляет собой бесцветную жидкость с характерным мятно-камфорным запахом. Это соединение природного происхождения, его можно обнаружить в листьях эвкалипта и эфирном масле эвкалипта.
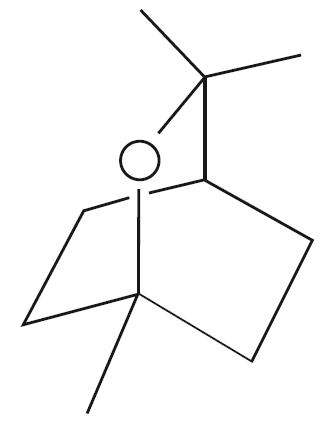
Цинеол применяется во многих областях, чаще всего – в качестве вкусоароматической добавки в зубных пастах и ополаскивателях рта, также его могут использовать при производстве некоторых сигарет или косметических и парфюмерных композиций. Ещё одна область применения цинеола – безопасные для окружающей среды репелленты, инсектициды и фунгициды.
При терапии ряда хронических заболеваний дыхательной и сердечно-сосудистой системы цинеол также может применяться как противовоспалительный препарат, он обладает и антиоксидантными свойствами. Цинеол может входить в состав и некоторых ингаляторов для лечения синусита.
Хлороформ

Хлороформ – вещество с достаточно простым строением: атом углерода, связанный с тремя атомами хлора и одним атомом водорода (CHCl3).
Это вещество было открыто в тридцатых годах XIX века аж тремя учеными, проживавшими в трёх разных странах и творившими науку независимо друг от друга. Самое интересное, что лишь один из этой троицы был химиком – Юстас Либих, титан аналитической и органической химии, второй был фармацевт Ойген Суберейн, а третий – врач Самуэль Гутри.
Возникает вопрос – зачем аптекарю и практикующему врачу было необходимо искать новые вещества? Надо вспомнить, что начало XIX века было тем периодом истории, когда только начиналось становление медицины в современном её понимании, и поэтому поиском соединений, которые можно было применять для медицинских целей, занимались все кому не лень. Естественно, что одним из важных направлений был квест по поиску анестетиков.

В течение многих лет чуть ли не единственными обезболивающими препаратами были опиум и этиловый спирт (неважно – в форме виски, чистого спирта или другого состава). В 1846 году медики смогли вздохнуть с облегчением – наркоз стали делать с применением диэтилового эфира (в просторечии – серного эфира, или просто эфира). Однако эфирный наркоз был чреват целым рядом осложнений, как например тошнота и рвота. Хлороформ начал использоваться британскими врачами как безопасная альтернатива эфиру в конце 1840-х годов. Вскоре он завоевал всеобщую популярность благодаря стечению двух замечательных обстоятельств: в 1847 году шотландский врач Джеймс Янг Симпсон описал в медицинском журнале «Ланцет» исчерпывающее руководство по применению хлороформа для анестезии, а в 1853 году королева Виктория настояла на использовании хлороформа в качестве анестетика при родах принца Леопольда.
Однако по мере распространения хлороформа в медицинской практике стало увеличиваться количество необъяснимых смертей оперированных больных. Оказалось, что хлороформ обладает меньшим по сравнению с эфиром терапевтическим индексом – разница в дозе, вызывающей анестезию, и дозе, способной инициировать сердечный приступ, оказалась для хлороформа гораздо ниже, чем для эфира.
Таким образом, от применения хлороформа в качестве наркоза потихонечку стали отказываться, отчасти и из-за того, что хлороформ демонстрировал токсические свойства – случайный пероральный прием 10 мл хлороформа мог вызвать смерть из-за сердечного приступа или паралича дыхания.

Проведенный в 1870 году анализ 80 000 операций показал, что риск смерти пациента при анестезии хлороформом составлял 1 на 2500 случаев, в то время как для эфирного наркоза риск смерти пациента составлял всего 1 к 23 000. В 1875 году британский Медицинский журнал отметил, что количество операций с эфирным наркозом вновь превысило количество операций «под хлороформом», и хлороформ стал применяться авторами детективов для описания не совсем достоверных сцен похищения (вопреки книгам и фильмам с лихо закрученным сюжетом человек не отключается через пару-тройку секунд после вдыхания паров хлороформа).
Длительное хранение хлороформа тоже может быть опасным. Окисление хлороформа кислородом воздуха приводит к образованию фосгена (COCl2). Фосген, хлорангидрид угольной кислоты, обладает удушающим действием и применялся в Первую мировую войну как боевое отравляющее вещество. Хотя при комнатной температуре фосген является газообразным веществом, он хорошо растворяется в хлороформе и при очистке последнего фосген необходимо удалять. Именно для этого при длительном хранении в хлороформ добавляют стабилизаторы, препятствующие образованию фосгена, например этанол. Правда, если для эксперимента нужен чистый хлороформ, от стабилизаторов тоже необходимо избавляться.
Несмотря на собственную токсичность и токсичность продуктов окисления, хлороформ широко применяется в промышленности. Одно из наиболее распространённых направлений его применения – сырье для производства тетрафторэтилена, ключевого вещества для получения тефлона. Хлороформ часто используется в качестве растворителя для проведения реакций – это происходит из-за того, что его реакционная способность не так уж и велика, он не огнеопасен и, конечно, смешивается в любых соотношениях со многими органическими соединениями.
Дейтерохлороформ (CDCl3), в котором легкий водород (протий) замещен на тяжелый (дейтерий), представляет собой один из самых распространенных и самых дешевых растворителей для спектроскопии ядерного магнитного резонанса (этот метод анализа, в частности, направлен на определение находящихся в различном химическом окружении атомов водорода, поэтому атомы водорода растворителя, которые, конечно же, находятся в значительном избытке, надо как-то «замаскировать», что и делается с помощью замены в растворителе «обычного» водорода на тяжелый).

Хлороформ также интересен химикам-синтетикам – он является источником дихлоркарбена, CCl2, (карбены, обладающие либо двумя неспаренными электронами, либо электронной парой, являются реакционными частицами куда более активными, чем свободные радикалы). Под действием основания от хлороформа отщепляется атом водорода и атом хлора, образующаяся при этом активная частица CCl2 может присоединяться к кратным связям с образованием трёхчленных циклов.
Но как и любое замечательное вещество, хлороформ постепенно открывает свои секреты. Недавно было выяснено, что, несмотря на огромные количества хлороформа, которые производятся промышленностью, около 90 % хлороформа в атмосфере имеют биогенное происхождение – это соединение вырабатывается водорослями и морскими организмами в процессе метаболизма. Правда непонятно, зачем это нужно морским организмам – используют ли они хлороформ для защиты от тех, кто их может съесть, или это просто способ избавления от хлора, содержащегося в морской воде.

