Сбор кала для исследования
Кал на яйца глистов
Гельминтозы – очень распространенное явление. В России чаще заражаются гельминтами, паразитирующими в кишечнике, реже – гельминтами, находящимися в стенках пищеварительного тракта и других органах.
Присутствие в организме гельминтов имеет разные клинические проявления. Наиболее частые симптомы: недомогание, тошнота, потеря аппетита или, наоборот, чувство постоянного голода, аллергические проявления и нарушения иммунной системы.
В соответствии с приказом Минздрава РФ № 1346н от 21 декабря 2012 г. «О Порядке прохождения несовершеннолетними медицинских осмотров, в том числе при поступлении в образовательные учреждения и в период обучения в них» детей в обязательном порядке исследуют на наличие гельминтов в оговоренные сроки и по индивидуальным показаниям.
При наличии жалоб на недомогание, симптомов, свидетельствующих о присутствии в организме гельминтов, проявлений аллергии, необходимо обследование на гельминты, а также одновременное проведение обследования других органов и систем.
Подготовка к анализу кала на яйца глистов
Отрицательный результат анализа в норме означает, что в кале не обнаружены яйца, глисты, личинки глистов. При положительном анализе кала на яйца глист указывают, какой именно вид гельминтов обнаружен.
Перед сдачей анализа рекомендуют соблюдать пищевой рацион, употреблять белый и черный хлеб, мясо (жаренное куском), жареный картофель, масло, сахар, гречневую и рисовую каши, квашеную капусту, салат, компот из сухофруктов, свежие яблоки. Не следует подмываться перед сдачей кала на яйца глист.
Сбор кала на яйца глист
Для сбора кала следует приобрести стерильный контейнер – это значительно облегчит сбор анализа, поскольку в контейнере предусмотрена ложечка, впаянная в крышку.
Можно использовать стеклянную банку с крышкой из-под детского питания. Предварительно ее следует хорошенько промыть, обдать кипятком и высушить.
Специальной подготовки перед сбором анализа не требуется. Необходимо, заранее помочиться, чтобы моча не попала в анализы кала. После самостоятельной дефекации кал следует собрать в контейнер, заполнив его приблизительно на 1/3. Собирают кал из трех разных мест выделенного материала. Всего его должно получиться около 1–2 чайных ложек. После этого следует плотно закрыть крышку.
На контейнере необходимо разборчиво написать Ф. И. О., дату рождения, дату и время сбора материала.
Отправить материал в лабораторию следует тотчас. На яйца глист сдавать кал нужно обязательно в теплом виде.
Рекомендуется повторить анализ трижды, так как не всегда в первый раз можно обнаружить яйца глистов. При отрицательных анализах на гельминтоз, при подозрении на него врач может назначить профилактическую терапию.
Не следует самостоятельно назначать лекарства.
Соскоб на энтеробиоз
Энтеробиоз – заболевание, вызванное острицами. Для их обнаружения берется соскоб на энтеробиоз. Проводится он в лаборатории или медицинском учреждении утром, сразу после сна.
Предварительно нельзя ходить в туалет и омывать область вокруг ануса. Медицинская сестра берет мазок с перианальных складок. Это безболезненная и довольно быстрая процедура.
Она может выполняться разными способами:
• с помощью липкой лентой по методу Грэхема;
• с использованием аппарата Рабиновича;
• с помощью предметных стекол, глицерина, специальной деревянной палочки.
Чаще пользуются аппаратом Рабиновича, который представляет собой чистый пронумерованный пенициллиновый флакон с резиновой пробкой, куда вставлена стеклянная палочка с широкой лопаточкой, обработанная клеем.
Вероятность обнаружения яиц глистов в кале составляет 10–15 %. Соскоб на энтеробиоз дает вероятность обнаружения – 50 %.
Анализы рекомендуется повторять 2–3 раза через 2–3 дня. Собранный материал транспортируют в лабораторию в течение 1 ч после его сбора. Длительное хранение может привести к недостоверным результатам.
Анализ кала на яйца глист и соскоб на энтеробиоз проводятся во всех лабораториях и поликлиниках. При положительном анализе врач назначает лечение, которое проводят всем членам семьи, а также домашним животным. Дома после проведенного лечения проводится генеральная уборка и стирка.
Правила сбора кала на стеркобилин, билирубин, панкреатическую эластазу, углеводы
Для сбора анализа можно использовать стерильный контейнер с ложечкой или стеклянную банку с крышкой из-под детского питания, предварительно хорошо промытую и высушенную.
Специальной подготовки перед сбором анализа не требуется. Необходимо, помочиться заранее. Моча в анализы попасть не должна. У маленького пациента можно взять кал с пеленки при условии, что нет примеси мочи.
После самостоятельной дефекации кал необходимо собрать в контейнер, заполнить его приблизительно на 1/3. Надо собрать кал из трех разных мест испражнений. В итоге его должно получиться около 1–2 чайных ложек. Плотно закрыть крышку.
На банке необходимо указать Ф. И. О., дату рождения, дату и время сбора материала. Если сразу нельзя отправить материал в лабораторию, его следует хранить в холодильнике.
Правила сбора кала на скрытую кровь
Для выявления кровотечения из желудочно-кишечного тракта проводят анализ кала на скрытую кровь. Кал собирают через 3 дня после проведения рентгена желудочно-кишечного тракта или клизмы, отмены слабительных, висмута, препаратов железа.
За 2 дня до сдачи анализа из рациона следует исключить мясо, свежие овощи и фрукты. Во избежание ранения десен нельзя чистить зубы зубной щеткой.
Следует заблаговременно подготовить контейнер с ложечкой-шпателем для сбора кала. Можно взять банку с крышкой из-под детского питания. Предварительно ее следует хорошо промыть, обдать кипятком и высушить.
После самостоятельной дефекации кал собирают в контейнер. В общей сложности должно получиться около 1–2 чайных ложек материала. Следует заполнять контейнер приблизительно на 1/3, затем плотно закрыть крышку.
На контейнере необходимо указать Ф. И. О., дату рождения, дату и время сбора материала. Если нельзя отправить материал в лабораторию сразу, то его надо хранить в холодильнике.
Сбор кала на простейшие
Для выявления в желудочно-кишечном тракте паразитов кал исследуют на простейшие (амебу). Следует заранее подготовить контейнер для сбора кала с ложечкой-шпателем или другую емкость с крышкой и шпателем.
После самостоятельной дефекации кал необходимо собрать в контейнер, заполнив его приблизительно на 1/3. При этом моча туда попасть не должна. Должно получиться около 1–2 чайных ложек материала. Затем следует плотно закрыть крышку.
На контейнере необходимо указать все необходимые данные: Ф. И. О., дату рождения, дату и время сбора материала. Собранный материал лучше отправлять в лабораторию в теплом виде.
При обнаружении в кале простейших, вызывающих заболевания (амеб, лямблий, балантидий), врач назначает соответствующее лечение. В норме патогенных простейших в кале не обнаруживают.
Амеба вызывает амебиаз — заболевание, при котором происходит язвенное поражение толстого кишечника. Это может привести к поражениям легких и других органов, к абсцессам печени.
Лямблии паразитируют в желчном пузыре и тонкой кишке. Их выявление подтверждает наличие лямблиоза. Лямблиоз проявляется диареей, увеличенным газообразованием (метеоризмом), периодической тошнотой.
Балантидии паразитируют в кишечнике человека и вызывают колиты (воспаления кишечника). В организм человека возбудитель попадает с водой или пищей.
При острой форме заболевания возникают симптомы общей интоксикации, лихорадка, возможны тенезмы (болезненные позывы к дефекации), признаки поражения кишечника (метеоризм, понос, боль в животе).
Отмечаются примесь крови и слизи в кале, увеличение печени, болезненность, спазмы толстого кишечника.
Анализ кала на дизгруппу
Анализ кала на дизгруппу широко используется для выявления острых и хронических кишечных инфекций, дисбиоза. При появлении симптомов кишечной инфекции такое исследование крайне необходимо.
Признаки кишечной инфекции: общая слабость, потеря аппетита, тошнота и рвота, частый жидкий стул с патологическими примесями, недомогание, боли в животе, повышение температуры тела, головные и мышечные боли.
Эти симптомы могут быть при сальмонеллезе, шигеллезе, амебиазе, ротавирусной инфекции и других кишечных инфекциях. При проведении анализа на дизгруппу можно выявить возбудителя и подобрать эффективное лечение.
Дисбактериоз кишечника (дисбиоз) проявляется следующими признаками: вздутие живота, метеоризм, чередование диареи и запоров, неприятный запах изо рта, тошнота; аллергическая реакция, которая раньше не проявлялась. Признаки дисбактериоза могут возникать после антибиотикотерапии и исчезать после применения пробиотиков.
Исследование кала на дисбактериоз
Для сбора кала используется чистая сухая стеклянная банка с крышкой или одноразовый контейнер. Кроме того, необходимо подготовить подкладное судно (следует предварительно обработать его любым дезинфицирующим средством, тщательно промыть несколько раз проточной водой и обдать кипяченой водой).
Утром перед сбором кала следует провести гигиеническую процедуру подмывания. Теплой кипяченой водой необходимо подмыть наружные половые органы и промежность, поливая воду в следующей последовательности: область лобка, наружные половые органы, промежность, область заднего прохода в направлении от уретры к заднему проходу. Вытереть насухо кожу в той же последовательности и направлении.
Кал для исследования должен собираться при самопроизвольной дефекации. При взятии кала для исследования не рекомендуется использовать слабительные средства.
В кале для анализа не должны находиться примеси мочи или менструальных выделений.
До сбора анализа следует произвести мочеиспускание в унитаз, затем совершить акт естественной дефекации в горшок или подкладное судно, затем собрать испражнения.
Забор кала для исследования анализа проводят шпателем или специальной ложечкой, которая прилагается к контейнеру. Для анализа необходимо 1—2 чайные ложки кала. Контейнер наполняют примерно на 1/3.
Если в кале есть примеси гноя, слизи или хлопьев, то для взятия материала следует выбирать эти участки. Участки с кровью брать не следует, так как в крови содержатся бактериостатические вещества, сдерживающие рост микроорганизмов в питательных средах.
Если стул водянистый, можно собрать материал с помощью пипетки. В контейнере его толщина должна быть не менее 2 см. Собранный для анализа кал доставляют в лабораторию не позднее чем через 2 ч. На контейнере разборчиво указывают Ф. И. О., дату рождения, дату и время сбора материала.
Иногда для исследования используются ректальные мазки, их берет медицинская сестра, лаборант или врач. Для их взятия используют одноразовые ректальные тампоны на стержне в стерильной упаковке.
Пациента кладут на бок, ноги подводят к животу, ягодицы разводят рукой. Медсестра вводит тампон в анальное отверстие на глубину 2–4 см. Вращательными движениями в течение нескольких секунд со стенок прямой кишки она собирает материал, вынимает тампон и кладет его в контейнер со специальной средой.
Доставить пробу в лабораторию необходимо максимум через 2 ч. При жидком стуле для забора материала можно взять одноразовый мягкий катетер: один конец его вводят в прямую кишку, а другой конец опускают в контейнер.
При проведении этого анализа:
• определяют наличие бактерий, простейших;
• проводят посев кала на питательные среды;
• проводят идентификацию возбудителя; определяют чувствительность возбудителя к лекарственным препаратам.
Результатов исследований ожидают 1–7 дней.
Для достоверности анализа кал следует сдавать при первых симптомах болезни, до начала лечения антибиотиками.
Если патогенные микроорганизмы обнаружены в кале, но никаких симптомов, характерных для кишечной инфекции у пациента нет, то можно говорить о том, что он может быть потенциальным носителем заболевания. При определенных условиях он может сам заболеть. В любом случае такой носитель опасен для окружающих.
Патогенных микроорганизмов в норме в фекалиях не должно быть. Возбудителями шигеллеза являются шигеллы, возбудители сальмонеллеза – сальмонеллы, возбудители холеры – холерные вибрионы, возбудитель амебиаза – амеба, возбудитель балантидиоза – балантидий.
При кишечных инфекциях, вызванных патогенными микроорганизмами, для выявления антигенов к этим микроорганизмам проводится дополнительная диагностика, а также анализ крови.
Кроме идентификации кишечных инфекций, анализ кала проводят для выявления дисбактериоза, определения его степени. Если условно-патогенный микроорганизм в фекалиях обнаруживается в титре более 105 КОЕ/г, полагают, что именно он стал причиной патологической симптоматики.
У здорового человека в фекалиях выявляют 15 групп микроорганизмов: эубактерии, бактероиды, энтерококки, бифидобактерии, лактобактерии, клебсиеллы, клостридии и др.
Производя оценку роста бактериальной флоры на питательных средах, можно выявить возбудителя заболевания, если:
• рост незначительный на жидкой среде, а на твердой его нет, эти бактерии не являются причиной патологического состояния;
• рост определенного вида бактерий 10 колоний на плотной среде – возможно, что они вызвали дисбактериоз;
• число колоний микрофлоры составляет 10– 100 – высокая доля вероятности, что эта микрофлора вызвала заболевание;
• численность колоний бактерий более 100 – то возбудителями болезни являются эти бактерии.
Оценка степени дисбактериоза (дисбиоза)
Дисбактериоз делят на различные стадии:
При 1 степени дисбактериоза в кишечнике происходит снижение уровня полезных для организма бактерий. Чаще всего впервые дни явных признаков заболевания не заметно. Вторая степень дисбактериоза обусловлена резким развитием патогенных микроорганизмов. В это время происходит нарушение в работе кишечника. Чувствуется боль в области живота, появляется метеоризм и расстройство стула.
При третьей степени дисбактериоза происходит поражение стенок кишечника. Изменение стула становится хроническим. Зачастую в кале можно заметить не переваренные частицы продуктов питания.
Заключительной стадией болезни является четвертая, которая обусловлена появлением острой инфекции. Организм сильно истощается, а иногда может возникать анемия. Пациент чувствует тошноту, изжогу, головную боль и неприятный запах в ротовой полости. Подобные симптомы могут возникать независимо от степени дисбактериоза.
Независимо от стадии дисбактериоза, необходимо в срочном порядке пройти обследование, чтобы доктор мог назначить терапию. В противном случае, патология у ребенка может привести к таким заболеваниям как гастрит, язва.
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР-диагностика) – методика, основанная на применении полимеразной цепной реакции, при помощи которой человека обследуют на инфекционные и наследственные заболевания.
Для ПЦР-диагностики используются ферменты, в миллионы раз увеличивающие структуру РНК и ДНК больного, чтобы образовалось такое число РНК и ДНК, при котором можно провести визуальный анализ.
В лаборатории есть база данных, в которой описано строение различных инфекционных агентов. При помощи этого метода можно увидеть возбудителя, подсчитать его количество.
Анализы ПЦР на инфекции показывают результат независимо от того, как протекает заболевание (остро или хронически). Иногда ПЦР считают обязательным анализом, и без него не ставится окончательный диагноз.
Еще до появления симптомов болезни результаты могут быть положительными. Бывают случаи, когда обычные методы в активной стадии не дают точного результата. ПЦР-диагностика особенно эффективна для выявления болезни в активной стадии.
Осуществляется проведение новых методик: ПЦР-соединение отдельных фрагментов ДНК; определение отцовства и др.
Сейчас при помощи ПЦР актуальна диагностика инфекционных процессов.
Данный вид обследования имеет следующие преимущества:
• выявляет возбудителя инфекционного процесса в анализах – для этого находят и идентифицируют ДНК или РНК инфекционного агента;
• исключает ошибочные и ложные реакции; обладает большой чувствительностью; обнаруживает даже единичные клетки возбудителя заболевания;
• уже через 4 ч после взятия материала на анализ результат ПЦР на скрытые возбудители готов;
• даже без отсутствия симптомов заболевания можно обнаружить инфекционных агентов;
• метод достоверен и эффективен.
Инфекции, определяемые методом ПЦР
С помощью ПЦР-диагностики в организме пациента определяют наличие возбудителей инфекционных заболеваний:
• микобактерии туберкулеза;
• вирус герпеса 1 и 2 типа;
• цитомегаловирус;
• хеликобактер пил ори;
• гепатиты: А, В, С, G;
• ВИЧ;
• клещевой энцефалит и боррелиоз;
• вирус Эпштейна – Барр, возбудитель инфекционного мононуклеоза;
• уреаплазмоз;
• гарднереллез, хламидиоз, микоплазмоз, трихомониаз вызывающие заболевания, которые передаются половым путем;
• листериоз.
С помощью этого метода можно обнаружить в различных биологических средах чужеродные ДНК бактерий и вирусов.
Материалом для ПЦР-исследования могут служить:
• моча;
• слюна;
• синовиальная жидкость;
• слизь;
• кровь;
• мокрота;
• эпителиальный соскоб;
• ткани плаценты.
Подготовка к ПЦР-анализу
• За 10 дней до взятия биоматериала необходимо прекратить прием лекарственных препаратов и лечебные процедуры.
• Кровь сдается на голодный желудок.
• Средняя порция мочи собирается после сна утром.
• В лабораторию доставка проводится в течение 2-3 ч.
Результаты исследования
Результат ПЦР-анализов бывает готов через 1,5 или 2 дня после сдачи. Существует метод экспресс-диагностики, при котором результат будет известен в течение нескольких часов.
Обозначаемый знаком минус отрицательный результат анализов свидетельствует о том, что следы предполагаемой инфекции не выявлены. Положительный результат, обозначающийся знаком плюс, означает, что в организме имеется искомая инфекция.
Чем больше плюсов, тем большее количество возбудителя выявлено. По результату анализа врач может подтвердить предполагаемый диагноз и назначить лечение.
Особенности условий взятия образцов биоматериалов для специальных видов исследований
В соответствии с Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», правилами применения национальных стандартов Российской Федерации – ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения» при взятии образцов для бактериологических исследований особенное внимание должно быть уделено предотвращению загрязнения. Содержимое абсцесса следует набирать через кожу, если это возможно, поскольку ее легче дезинфицировать, чем слизистые оболочки.
Жидкий материал предпочтительнее образцов на тампонах. Секрет, содержащий интерферирующие вторичные микроорганизмы, должен быть удален с поверхности открытой раны, затем образец собирают бактериологическим тампоном круговыми вращательными движениями от центра к периферии раны.
Объем пробы должен быть насколько возможно большим. Образцы для культуры крови, если возможно, следует собирать в период повышения температуры тела. При подозрении на инфекционный эндокардит следует брать не менее десяти культур крови.
Образцы для выделения и идентификации вирусов обычно собирают немедленно после появления симптомов (если возможно – в первые три дня). Для анализа используют образцы на тампонах (из носа, гортани, глаз), смывы из глотки, жидкость из пузырьков при кожных поражениях, кал, мочу и спинномозговую жидкость.
При взятии кожных образцов для микологических исследований соскобы с зон активного поражения берут с помощью скальпеля после тщательной дезинфекции участка кожи. При отложениях на волосах их образцы берут с помощью эпиляционной пипетки или остригают. При поражении ногтей берут их срезы и соскобы с нижней части ногтей.
Для обнаружения дрожжей в моче используют случайный образец мочи, для детекции дрожжей или грибков в мокроте предпочтительнее использовать ее утренний образец.
При диагностике паразитарных заболеваний исследуют кровь (для обнаружения плазмодиев, трипаносомы, лейшмании, микрофилярии), кал (для обнаружения лямблии, гельминтов), образцы тканей пораженных органов (для обнаружения Trichinella spiralis larvae, Echinococcus) или самих паразитов (артроподы: клещи, насекомые), мочу (при мочеполовом шистозомозе).
ПЦР-анализ может быть проведен в образцах: крови с ЭДТУК и цитратом, высушенной крови (на фильтровальной бумаге), костного мозга, мокроты, жидкости из полости рта, бронхиальной лаважной жидкости, спинномозговой жидкости, мочи, кала, биопсийного материала, культуре клеток, фиксированной или покрытой (парафинированной) ткани и т. д.
Важным условием получения достоверных результатов является предотвращение загрязнения образцов экзогенной дезоксирибонуклеиновой кислотой (ДНК), обычными источниками которой являются волосы и кожа людей, дверные ручки, лабораторная мебель, порошки, реагенты, термоциклер и наконечники пипеток. Идеальным средством создания чистой беспылевой среды служат настольные шкафы с ламинарным потоком профильтрованного воздуха.
Взятие образцов для молекулярно-биологических исследований лучше всего проводить в закрытые одноразовые системы, которые должны быть свободны от нуклеаз, для чего подвергаются автоклавированию в токе горячего воздуха. При использовании незакрытых систем для взятия проб следует, по меньшей мере, надевать одноразовые перчатки.
Стеклянная посуда должна обрабатываться 1 %-ным раствором диэтилпирокарбоната, который тормозит РНКазы. Оставшийся препарат следует тщательно удалить путем автоклавирования посуды и последующей ее обработки жаром при температуре 250 град. С в течение 4 ч.
Правила первичной обработки образца биоматериала
Важнейшей процедурой первичной обработки образцов биоматериалов после взятия их у пациентов является их кодирование с целью последующей надежной их идентификации. Кодирование видов образцов по характеру внесенных в них добавок закреплено с помощью разного цвета крышек пробирок, содержащих соответствующие добавки: красный/ белый – без добавок, для сыворотки, клинико-химические исследования, серология; зеленый – гепарин, для плазмы, клинико-химические исследования; фиолетовый – ЭДТА, для плазмы, гематологические исследования; голубой – цитрат натрия, для коагулологических исследований; серый – фторид натрия, для исследования глюкозы, лактата. Идентификация образцов от определенных пациентов наиболее рациональна с помощью штрих-кодов, в которых отражены идентификационные признаки пациентов: фамилия, клиническое отделение, фамилия лечащего врача и т. п. Штрих-коды изготавливают в месте взятия образца (при доставке проб из другой лаборатории маркировку допускается проводить в лаборатории, выполняющей анализ) и считывают с помощью специального устройства в клинической лаборатории. В небольших учреждениях возможно ручное кодирование пробирок нанесением на них карандашом по стеклу или фломастером условных знаков, цифр.
Другие процедуры первичной обработки образцов биоматериалов по месту их взятия зависят от общей организации лабораторного обеспечения в данном учреждении. Если процедурные кабинеты расположены в том же здании, что и лаборатория, то контейнеры с образцами следует как можно скорее доставлять в лабораторию, где и будут осуществляться все дальнейшие действия.
Пробы, содержащие инфекционные агенты, следует обрабатывать иначе, чем пробы с относительно небольшим риском инфицирования (подобно большинству проб крови, сыворотки, мочи, кала, тампонам, мазкам и фильтровальным бумажкам).
Биологический материал – кровь
При необходимости более длительного транспортирования в лабораторию образцы свернувшейся крови (обычно свертывание происходит в течение 30 мин.), предназначенные для получения сыворотки, должны быть отцентрифугированы на месте не позднее, чем через 1 ч после взятия образца. Кровь для получения сыворотки или плазмы центрифугируют в течение 10–15 мин. при ускорении 1000–1200 g (оборотов в минуту). Цитратную плазму для исследований системы свертывания крови центрифугируют в течение 15 мин. при 2000 g; для получения плазмы, свободной от тромбоцитов, центрифугирование длится 15–30 мин. при 2000–3000 g. Центрифугирование пробирок с капиллярной кровью выполняется при 6000—15000 g в течение 90 с. Обычно центрифугирование проводят при температуре 20 град. С – 22 град. С. Для отдельных аналитов может требоваться центрифугирование при температуре 4 град. С, 6 град. С. Мазки крови для дифференциального подсчета лейкоцитов должны быть подготовлены не позднее, чем через 3 ч после взятия образца.
Поскольку нуклеиновые кислоты быстро распадаются, образцы для молекулярно-биологических исследований следует быстро подвергать стабилизации путем инактивации ДНКаз и РНКаз с помощью хаотропных веществ (гуанидин-изотиоцианат-ГИТЦ) и органического растворителя, например, фенола. Конечная концентрация ГИТЦ в стабилизированной пробе должна быть не ниже чем 4 моль/л. Стабилизированный таким способом материал не должен охлаждаться во избежание кристаллизации ГИТЦ. Кровь с ЭДТАдля экстракции ДНК из лейкоцитов не требует стабилизации.
Биологический материал – кал
Вегетативные формы паразитов можно обнаружить только в свежих образцах кала в течение 40 мин. после испражнения при условии его хранения при температуре 4 град. С. Цисты стабильны. Для концентрации паразитов и их сохранения в образцах кала обычно применяют растворы мертиолят-йод-формалин и ацетат натрия-формалин.
Требования к условиям хранения и транспортирования образцов биоматериалов в клиническую лабораторию.
Условия хранения образцов биоматериалов, взятых у пациентов, определяются стабильностью в этих условиях искомых аналитов. Максимально допускаемая нестабильность, выраженная в процентном отклонении результата после хранения от исходного уровня, не должна превышать половины размера общей ошибки определения, рассчитываемой из суммы биологической и аналитической вариации данного аналита. Максимально допускаемое время хранения измеряется периодом времени, в течение которого в 95 % образцов содержание аналита сохраняется на исходном уровне.
Стабильность аналитов в различных видах образцов (крови, мочи, спинномозговой жидкости) и проб (сыворотке, плазме, осадке, мазке крови) неодинакова. Данные о стабильности проб следует учитывать и при их хранении после поступления в лабораторию. В отношении аналитов, нестабильных на свету, должны быть соблюдены соответствующие предосторожности (сбор материала в темную посуду, защита образца от прямого света).
Биологический материал – кровь
Содержание электролитов, субстратов, некоторых ферментов может не изменяться при хранении образцов сыворотки крови при температуре холодильника 4 град. С в течение до четырех дней. Гемоглобин, эритроциты стабильны в течение одного дня при хранении в закрытой пробирке. Хранение образцов плазмы крови, предназначенной для исследований свертывающей системы, в условиях комнатной температуры более 4 ч не рекомендуется.
Исследование газов крови следует проводить немедленно; при невозможности неотложного исследования – образцы в закрытых стеклянных контейнерах могут храниться в бане с ледяной водой до 2 ч.
При транспортировании в лабораторию контейнеры с образцами крови следует предохранять от тряски во избежание развития гемолиза. Температура ниже 4 град. С и выше 30 град. С может существенно изменить содержание в образце многих аналитов. Образцы цельной крови пересылке не подлежат.
Биологический материал – моча
Собранную мочу как можно быстрее доставляют в лабораторию. Длительное хранение мочи при комнатной температуре приводит к изменению физических свойств, разрушению клеток и размножению бактерий. Моча, собранная для общего анализа, может храниться не более 1,5–2,0 ч обязательно в холодильнике, применение консервантов нежелательно, но допускается, если между мочеиспусканием и исследованием проходит более 2 ч. Наиболее приемлемый способ сохранения мочи – охлаждение (можно хранить в холодильнике, но не замораживать). При охлаждении не разрушаются форменные элементы, но возможно влияние на результаты определения относительной плотности.
Биологический материал – спинномозговая жидкость
При исследовании в пределах 1 ч пробу не охлаждают. Для транспортирования проб СМЖ используют закрытые пробирки. При исследовании в пределах трех часов – хранить на льду, не замораживать, не фиксировать, не добавлять консерванты. Транспортирование следует осуществлять как можно скорее в связи с нестабильностью клеток. Для цитологических исследований следует отсылать препараты, полученные путем цитоцентрифугирования пробы СМЖ (20 мин. при 180 g), которые стабильны в течение 4–6 дней при комнатной температуре. Для длительного хранения после отделения клеток с помощью центрифугирования пробу следует быстро заморозить до минус 70 град. С в тщательно закупоренном полипропиленовом сосуде.
Доставка в лабораторию биоматериалов для микробиологического исследования
Доставка в лабораторию образца биоматериала должна длиться не более двух часов после взятия материала. Требования к транспортированию и хранению бактериологических проб приведены в таблице. Если соблюдение этих условий не может быть обеспечено, рекомендуется инокуляция во флакон для культур крови или в гемофлакон или, например, для проб мочи, использование погружных слайдов.
Таблица 50. Условия транспортирования и хранения образцов различных биоматериалов для бактериологических исследований
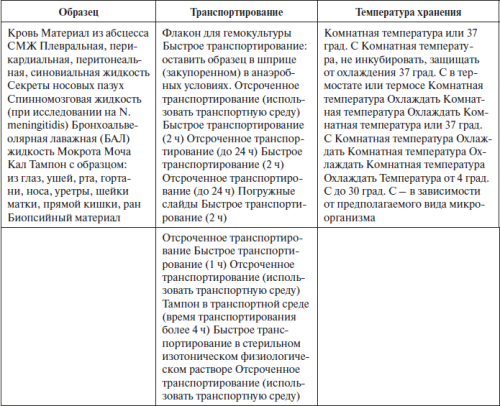
Образцы для обнаружения и идентификации вирусов должны быть доставлены в лабораторию быстро при температуре 4 град. С в отдельном контейнере. В этих условиях вирусы обычно остаются стабильными в течение 2–3 дней.
Образцы кожи, волосы и срезы ногтей для микологических исследований отсылают в лабораторию сухими в стерильных контейнерах. Случайный образец мочи для обнаружения дрожжей немедленно отсылают в лабораторию в стерильном контейнере. Также поступают с утренним образцом мокроты для обнаружения в ней дрожжеподобных и плесневых грибов.
Образцы тканей для микологических исследований, помещенные в изотонический раствор, немедленно пересылают в лабораторию. Образцы материала из влагалища, верхних дыхательных путей или кала для микологических исследований (по два тампона с каждым образцом) рекомендуется пересылать в стерильных контейнерах.
При коротком сроке транспортирования образцов для микологических исследований комнатная температура не влияет отрицательно на результаты. При транспортировании на значительные расстояния рекомендуется охлаждение образцов (для образцов на тампонах это не обязательно), чтобы предотвратить подавление бактериями медленно растущих грибов. При подозрении на заражение фикомицетами (например, Mucor) необходимо быстрое транспортирование образца без охлаждения.
В отношении большинства образцов биоматериалов для паразитологических исследований специальные условия транспортировки не обязательны. Артроподы пересылают в лабораторию в 70 %-ном спирте. В таблице приведен перечень преаналитических факторов, которые имеют значение при паразитологических исследованиях.
Таблица 51. Условия хранения и транспортирования образцов для паразитологических исследований
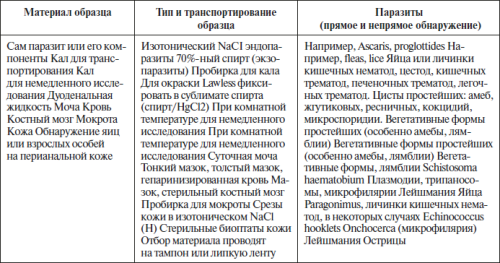
При пересылке образцов должна быть обеспечена их целостность, чтобы результат анализа был правильным и были соблюдены все требования биологической безопасности.
Нормы, регулирующие транспортировку по почте, определяются соответствующими документами. Образцы, пересылаемые по почте, должны «противостоять протеканию содержимого, ударам, изменениям давления и другим воздействиям, которые могут произойти при обычном транспортировании».
Не разрешается использовать стекло в качестве упаковочного материала при транспортировании проб во избежание поломки и возможного вреда для лиц, участвующих в транспортировании.
Рекомендуется следующая структура упаковки для биологического материала:
– внутренняя упаковка для материала пробы;
– абсорбирующий материал;
– наружная упаковка, с информацией об образце и лабораторными формами назначений анализов: коробка, сумка.
Несколько контейнеров с образцами объемом до 500 мл могут быть упакованы в один ящик из картона, дерева, подходящего пластика или металла в соответствии с правилами транспортирования биоопасных материалов. Диагностические образцы, если они не испаряются через упаковку, могут пересылаться в бандеролях.
Упаковки с инфекционными материалами должны быть помечены надписью: ДИАГНОСТИЧЕСКАЯ ПРОБА/ИНФЕКЦИОННАЯ ОПАСНОСТЬ. Ответственность за пересылку по почте инфекционных материалов несет отправитель. Оптимальные сроки доставки проб биоматериала в лабораторию приведены в табл.
При наличии в транспортной упаковке инфекционного материала необходим дополнительный вторичный контейнер для предотвращения любого протекания материала при каком-либо механическом повреждении.
Назад: Результаты копрограммы
Дальше: Приложение

