Книга: Мусорная ДНК. Путешествие в темную материю генома
Назад: А теперь зайдем с другого конца
Дальше: Глава 17. Почему «Лего» лучше, чем «Эйрфикс»
Скажите «ААААААААА»
При нормальных обстоятельствах нетранслируемые области в конце информационных РНК, кодирующих белки, обладают целым рядом функций. Одна из самых важных связана с процессом, затрагивающим все информационные РНК. «Голые» молекулы информационной РНК могут очень быстро расщепляться в клетке посредством процесса, который возник в нашем организме в ходе эволюции. Его цель — поживее избавлять нас от определенных типов вирусов. Чтобы не расщеплялись нужные молекулы и чтобы обеспечить информационным РНК достаточно долгую жизнь (они должны успеть транслироваться в белок); эти молекулы-посланницы модифицируются почти сразу же после возникновения: к концу информационной РНК добавляется множество следующих подряд нуклеотидных оснований А. Схематически это показано на рис. 16.5. На конце информационной РНК млекопитающих обычно находится около 250 нуклеотидных оснований А. Они нужны для сохранения стабильности молекулы и того, чтобы гарантировать: информационная РНК будет выведена за пределы ядра, где она произведена, и затем будет доставлена в рибосомы, где она транслируется в белок.
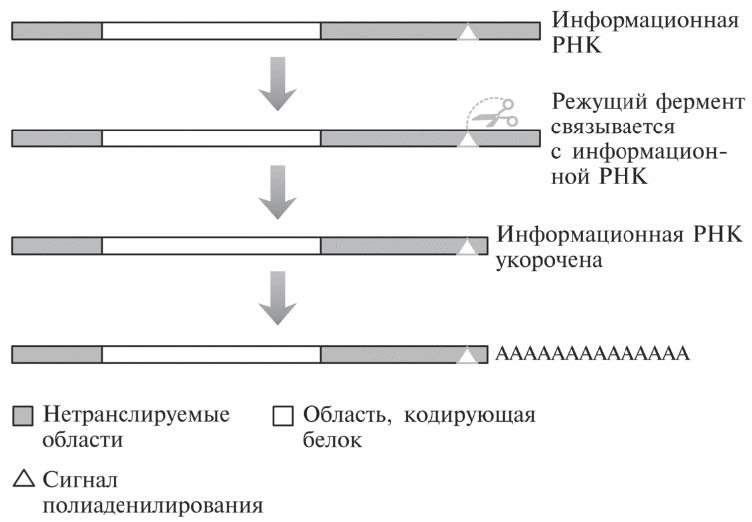
Рис. 16.5. Нуклеотидная последовательность в нетранслируемой области на конце информационной РНК привлекает фермент (обозначен ножницами), который связывается с определенным сайтом и затем отрезает молекулу чуть ближе к ее краю. Множество нуклеотидных оснований А пристраивается к этому укороченному концу молекулы информационной РНК, хотя эти основания не закодированы в исходной ДНК-последовательности.
В конце нетранслируемой области информационной РНК имеется важнейший нуклеотидный мотив (характерная нуклеотидная последовательность). На рис. 16.5 он обозначен треугольничком. Он называется сигналом полиаденилирования (основание А — аденин, поэтому добавление множества оснований А именуется полиаденилированием). Это последовательность из 6 оснований (ААУААА) среди мусора нетранслируемой области. Она служит сигналом для фермента, обрабатывающего информационную РНК (напомним, такая обработка называется процессингом). Распознав этот мотив, состоящий из 6 оснований, фермент отрезает информационную РНК чуть ближе к краю по отношению к тому месту, где располагается мотив (обычно в 10-30 основаниях от него). И затем уже другой фермент может пристроить множество оснований А к оставшейся части информационной РНК.
Тот же мотив из 6 нуклеотидных оснований часто встречается в одной той же нетранслируемой области многократно. Пока не совсем ясно, как клетка «выбирает», каким именно мотивом воспользоваться в том или ином случае. Но раз уж у нее есть выбор из множества мотивов, может иметься и множество информационных РНК, кодирующих один и тот же белок, однако содержащих нетранслируемую область разной длины непосредственно перед этими множественными основаниями А, идущими подряд. Эти информационные РНК разной длины будут обладать разной стабильностью, а значит, вырабатывать разное количество белка. Вероятно, благодаря этому организм получает дополнительную возможность осуществлять тонкую подстройку вырабатываемого количества белка21.
Существует весьма необычная и редкая генетическая болезнь, именуемая IPEX-синдромом. Это смертельное аутоиммунное заболевание, при котором организм атакует и разрушает собственные ткани. В частности, атаке подвергаются клетки, выстилающие внутреннюю поверхность кишечника, что приводит к острой диарее у младенцев и препятствует их нормальному развитию. Атаке могут подвергаться также железы, вырабатывающие гормоны, что приводит к таким болезням, как диабет первого типа (при котором организм пациента не в состоянии вырабатывать инсулин). Под ударом может оказаться и щитовидная железа, что приводит к снижению общего уровня активности организма22.
Все немногочисленные случаи проявлений IPEX-синдрома вызваны мутацией сигнала полиаденилирования. В нормальной последовательности ААУААА происходит замена одного основания, в итоге она выглядит как ААУГАА и больше не служит мишенью для режущего фермента23.
Ген, в котором происходит это изменение, кодирует белок, способный включать другие гены. Белок требуется для контролирования определенного типа иммунных клеток. В некоторых генах такое изменение одного мотива, состоящего из 6 нуклеотидных оснований, может не представлять слишком уж серьезной проблемы, поскольку в таком случае клетка воспользуется другими, нормальными последовательностями из 6 оснований, находящимися поблизости в той же нетранслируемой области. Изменение может слегка нарушать процесс тонкой настройки, но все-таки странно, что оно способно привести к такой опасной болезни, как IPEX-синдром. Проблема разрастается до такого недуга из-за того, что нетранслируемая область в данном гене больше не содержит почти никаких подходящих шестиосновных мотивов, способных действовать как сигналы полиаденилирования. Мутация в нетранслируемой области означает, что информационная РНК не разрезается должным образом, нуклеотидные основания А не добавляются, и информационная РНК в результате оказывается очень нестабильной. Поэтому клетки почти не вырабатывают нужный белок. В сущности, воздействие мутации в этом мусорном мотиве столь же губительно, как если бы оно непосредственно нарушало деятельность зоны, кодирующей белок.
Лишь сравнительно недавно, с удешевлением технологий секвенирования, ученые начали по-настоящему исследовать нетранслируемые области молекул информационной РНК, чтобы выявлять мутации, вызывающие редкие и опасные заболевания. Можно с уверенностью сказать, что в ближайшие несколько лет мы наверняка увидим множество других работ подобного рода. Мы оптимистичны в своем предсказании еще и потому, что ученые, возможно, уже выявили еще один такой пример.
Боковой амиотрофический склероз (БАС) называемый также болезнью моторных нейронов или болезнью Лу Герига, — недуг разрушительный. Он характеризуется тем, что нейроны головного и спинного мозга, контролирующие движения мышц, постепенно отмирают. Больные испытывают растущее истощение и прогрессивный паралич. Они не способны нормально говорить, глотать, дышать24. Знаменитый космолог Стивен Хокинг страдает БАС, хотя его случай не совсем типичный. Страшный диагноз ему поставили, когда Хокингу был всего 21 год, тогда как у большинства страдающих БАС первые симптомы проявляются лишь в среднем возрасте. Профессор Хокинг вот уже больше полувека живет с этим заболеванием. Но, к сожалению, большинство таких пациентов умирает в течение первых 5 лет после постановки диагноза. Впрочем, иногда болезнь можно затормозить благодаря эффективному медицинскому вмешательству.
Ученые ещё далеко не всё понимают о БАС. Менее 10% случаев можно счесть наследственными. В остальных 90% случаев какие-то вариации в ДНК, возможно, вызывают предрасположенность к заболеванию, если носитель вариации встретится с каким-то триггером среды (пока эти провоцирующие факторы выявить не удалось). Возможно, у некоторых пациентов имеется мутация, которой уже достаточно для того, чтобы вызвать недуг, даже если среди близких пациента он никого не затронул. К примеру, такая мутация могла бы возникнуть в яйцеклетках или сперматозоидах родителей пациента25.
Специалисты полагают, что один из генов, связанных с БАС, несет ответственность за 4% случаев, когда болезнь передается по наследству, и за 1% случаев, когда болезнь не обусловлена семейными факторами,26,27,28. Во всех первоначально изучавшихся случаях, связанных с этим геном, мутации наблюдались в его зонах, кодирующих белок. Теперь ученые сумели выявить 4 различных вариации в нетранслируемой области на конце данного гена. Их обнаружили у пациентов с БАС, не обладавшими никакими другими известными мутациями. Хотя вариации могут оказаться совершенно безобидными, в клетках, взятых у пациентов, выявлено аномальное распределение соответствующего белка и аномальные уровни его экспрессии. Эти находки заставляют предположить хотя бы то, что изменения в нетранслируемой области приводят к нарушениям в процессинге и трансляции самого белка, что и вызывает заболевание29.

