Книга: Мусорная ДНК. Путешествие в темную материю генома
Назад: Влияние катастрофического события
Дальше: Мы зависим от тех, кто нас захватил
Глава 11. Особое задание для мусора
Вполне возможно, что самая чудесная и притягательная особенность биологии — ее замечательная непоследовательность. Биологические системы возникали и эволюционировали потрясающе изобретательными путями, узурпируя существующие процессы, при малейшей возможности переориентируя их на выполнение других, совершенно новых задач. А значит, почти всякий раз, когда нам кажется, будто мы нащупали в природе какую-то стойкую тему, обнаруживаются исключения из правил. Более того, иногда вообще очень трудно разобраться, где норма, а где отклонение.
Возьмем мусорную ДНК и молекулы РНК, не кодирующие белки. Почти все, о чем мы говорили до сих пор, вроде бы позволяет нам вывести примерно такую гипотезу:
Когда мусорная ДНК кодирует РНК, не кодирующую белок (то есть мусорную РНК), эта РНК служит лишь своего рода подпоркой, направляющей деятельность белков в определенные участки генома.
Эта гипотеза наверняка должна согласовываться с теми ролями, которые играют в организме длинные некодирующие РНК. Они работают как застежка-липучка, расположенная между эпигенетическими белками и ДНК или гистонами. Такие белки часто действуют в комплексе, причем как минимум одним из членов комплекса зачастую оказывается фермент, то есть белок, ускоряющий химическую реакцию. Это может быть реакция, пристраивающая эпигенетические модификации к ДНК или гистонам (либо убирающая такие модификации) — или же добавляющая еще одно нуклеотидное основание к растущей молекуле информационной РНК.
Во всех этих ситуациях белок — своего рода глагол в молекулярном предложении. Это молекула действия.
При всей привлекательности такой модели у нее имеется один обидный недостаток. Встречается ситуация, где все роли перевернуты. В этой обратной ситуации белки относительно молчаливы, а вот мусорная РНК сама действует как фермент, вызывая химические изменения в другой молекуле.
Звучит странно. Есть даже искушение предположить, что это просто единичное исключение, редкая причуда природы. Пусть так. Но это, знаете ли, весьма примечательное исключение: молекулы мусорной РНК, обладающие такой функцией, составляют примерно 80% от всех молекул РНК, находящихся в клетке человека в любой момент времени1. Мы уже не одно десятилетие знаем о существовании этих необычных РНК. Тем удивительнее, что мы до сих пор придерживались столь белкоцентрического взгляда на наш геномный ландшафт.
Молекулы РНК, наделенные этой странной функцией, называются рибосомными РНК, или рРНК. Нетрудно догадаться, что в основном они располагаются в клеточных структурах, именуемых рибосомами. Эти структуры находятся не в ядре, а в цитоплазме. Рибосомы — структуры, где информация, содержащаяся в молекулах информационной РНК, конвертируется в связанные друг с другом цепочки аминокислот, в результате чего и синтезируются белковые молекулы. Если вспомнить нашу аналогию с вязанием, которую мы использовали в первых двух главах книги, рибосомы — это все те дамы-вязальщицы, которые превращают информацию, напечатанную на бумаге, в теплые носки и теплые перчатки для бойцов, сражающихся где-то за морем2.
По массе рРНК составляет около 60% общей массы рибосомы. Остальные 40% приходятся на белки. Молекулы рРНК группируются в две основные субструктуры. В одной содержится три типа рРНК и примерно 50 различных белков. В другой субструктуре лишь один тип рРНК и около 30 белков. Рибосому иногда рассматривают как единый макромолекулярный комплекс, поскольку она представляет собой весьма крупный и структурированный конгломерат из множества различных компонентов. Можно считать ее чем-то вроде большого робота, синтезирующего белки.
Когда на основе генов, кодирующих белки, вырабатываются молекулы информационной РНК, эти молекулы выводятся за пределы ядра и направляются в ту область клетки, где и расположены рибосомные роботы. Молекулы информационной РНК постепенно пропускаются через рибосому. Так генетические инструкции, которые несет информационная РНК, считываются рибосомой. В результате появляется череда аминокислот, соединенных вместе в нужном порядке. Именно рибосомная РНК осуществляет реакцию, посредством которой та или иная аминокислота соединяется со своей соседкой. В результате получается длинная и стабильная белковая молекула.
Информационная РНК пропускается сквозь одну рибосому, и в это же время другая рибосома может прикрепляться к началу того же послания, также создавая белковые цепочки. Вот почему одна молекула информационной РНК может использоваться как матрица для изготовления множества копий одного и того же белка. Этот процесс схематически показан на рис. 11.1.
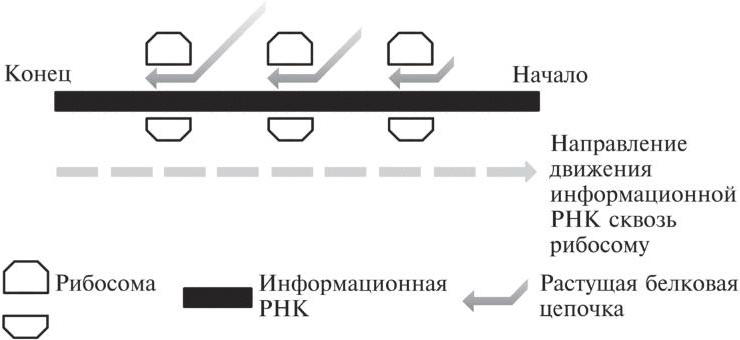
Рис. 11.1. Молекула информационной РНК движется сквозь рибосому слева направо. Рибосома при этом выстраивает белковую цепочку. Когда начало информационной РНК появляется из рибосомы, которая с ней работает, оно может встретиться с другой рибосомой. В результате одной и той же молекулой информационной РНК могут единовременно заниматься несколько рибосом. Все эти рибосомы будут синтезировать полноразмерные белки.
Аминокислоты доставляются к рибосомам другим типом мусорной РНК — транспортной РНК, или тРНК. Это довольно маленькие некодирующие РНК, их длина составляет примерно 75-95 нуклеотидных оснований3. Но они способны складываться, создавая затейливую трехмерную структуру, которую обычно называют «лист клевера». К одному концу тРНК прикреплена определенная аминокислота. На другом конце находится петелька из трех нуклеотидных оснований. Этот триплет может соединяться с определенной последовательностью молекулы РНК. В сущности, тут используются такие же правила, как и при образовании нуклеотидных пар ДНК.
Молекулы тРНК служат своего рода посредниками между нуклеотидной последовательностью, которую несет информационная РНК (а изначально — ДНК), и синтезируемым белком. Молекулы тРНК обеспечивают выстраивание аминокислот в должном порядке, благодаря чему как раз и возникает соответствующий белок. Схематически это показано на рис. 11.2. Когда две аминокислоты удерживаются рядом друг с другом на рибосоме, рибосомная РНК может провести химическую реакцию, которая присоединяет хвост одной аминокислоты к голове соседней. Так и формируется белковая цепочка.
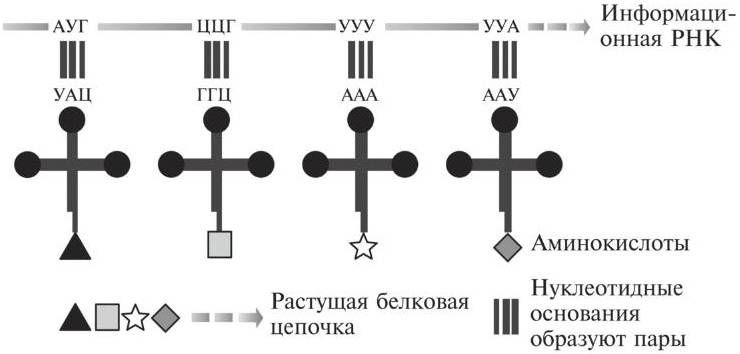
Рис. 11.2. По мере того, как информационная РНК движется сквозь рибосомы, молекулы транспортной РНК подводят нужные аминокислоты на нужные места в цепочке (на основании правил образования пар нуклеотидных оснований). Аппаратура рибосомной РНК соединяет соседние аминокислоты, образуя белковую цепочку.
Некоторые из триплетов, расположенных на информационной РНК, не соответствуют никаким триплетам транспортной РНК. Их называют стоп-сигналами. Когда рибосома считывает такой сигнал, она не может поместить тРНК в нужное место, в результате чего рибосома отсоединяется от информационной РНК, и белок прекращает расти. Это те самые элементы крыши из конструктора «Лего», о которых мы говорили в главе 7. Затем рибосома находит другую молекулу информационной РНК для трансляции ее в белок — или же возвращается к началу первой молекулы.
Хотя в основе всей этой сложнейшей процедуры лежит деятельность гигантского комплекса, в состав которого входят 4 типа рибосомной РНК и около 80 белков, процесс добавления новых аминокислот к растущему белку идет весьма быстро. Нелегко точно измерить его скорость в человеческих клетках, но вот у бактерий каждая рибосома может пристраивать аминокислоты к растущему белку со скоростью около 200 аминокислот в секунду. Возможно, процесс идет не так стремительно, как в человеческих клетках. Но эти 200 аминокислот все равно достраиваются примерно за вдесятеро меньшее время по сравнению с тем, какое понадобилось бы нам для скрепления друг с другом всего пары элементов «Лего» при строительстве нашей игрушечной башни. И не забудьте, что рибосома скрепляет друг с другом не первые попавшиеся кирпичики «Лего». Представьте, что нам нужно всякий раз выбирать лишь по 2 из 20 типов строительных блоков (существует 20 различных аминокислот) и затем скреплять такие блоки друг с другом в нужном порядке, проделывая эту операцию много раз в секунду. Непростая задача.
Наши клетки вынуждены ежесекундно производить миллионы белковых молекул, так что нам нужно, чтобы наши рибосомы действовали очень эффективно. Кроме того, для удовлетворения спроса на белки требуется очень много рибосом — до 10 миллионов миниатюрных роботов в отдельной клетке4. Чтобы создавать достаточное количество рибосом, наши клетки обзавелись множеством копий рРНК-генов. Вместо того, чтобы зависеть от процесса создания рРНК по классической схеме, когда один ген наследуется от каждого из родителей, мы наследуем около 400 рРНК-генов, распределенных по 5 различным хромосомам5. Согласитесь, огромное богатство. Благодаря этому, в частности, у нас не очень-то высока вероятность заболеваний, вызываемых мутациями этих генов. Ведь если одна из копий мутирует, всегда есть масса запасных. Поэтому наш организм, скорее всего, сумеет компенсировать дефект благодаря всем нормальным версиям гена, кодирующим ту же самую молекулу рРНК. Иное дело — мутации генов, кодирующих белки: такие гены также присутствуют в рибосомах. Мы пока не успели детально изучить функции многих из этих генов. Некоторые, судя по всему, вообще не играют важной роли в функционировании рибосом. Но есть здесь и такие гены, мутация которых все-таки вызывает заболевания.
Два наиболее известных примера — анемия Даймонда-Блекфена и синдром Тричера Коллинза. Их причиной служат наследуемые мутации двух разных генов, кодирующих белки. Следствие такой мутации в обоих случаях — уменьшение количества рибосом. Номы еще не до конца понимаем, как именно это влияет на функционирование клеток. Ведь если единственный важный фактор — снижение числа рибосом, клинические последствия будут одинаковы в обоих случаях. Однако это не так. Главный симптом анемии Даймонда-Блекфена — нарушение процессов выработки красных кровяных телец. Основные симптомы при синдроме Тричера Коллинза — деформации головы и лица, приводящие к проблемам с дыханием, глотанием и слухом6.
Поскольку нам требуется много рибосом, а значит, и много рРНК-генов, логично предположить, что нам нужно и много тРНК-генов, чтобы обеспечивать нас большим количеством молекул транспортной РНК для доставки аминокислот к рибосомам. В человеческом геноме около 500 тРНК-генов, распределенных почти по всем хромосомам7. Это дает такие же преимущества, как и наличие множества копий рРНК-генов.
Возможно, между рРНК и импринтингом существует некое странное и интригующее перекрывание. Как уже говорилось в главе 10, среди больных синдромом Прадера-Вилли есть небольшое количество пациентов, у которых заболевание затрагивает лишь одну зону мусорной ДНК. Эта зона кодирует целый набор некодирующих РНК. Такие РНК называются малыми ядрышковыми РНК. Эти некодирующие РНК мигрируют к области ядра, которая называется ядрышком и которая играет очень важную роль в биологии рибосом. Ядрышко — то место, где происходит сборка зрелых рибосом (см. рис. 11.3).
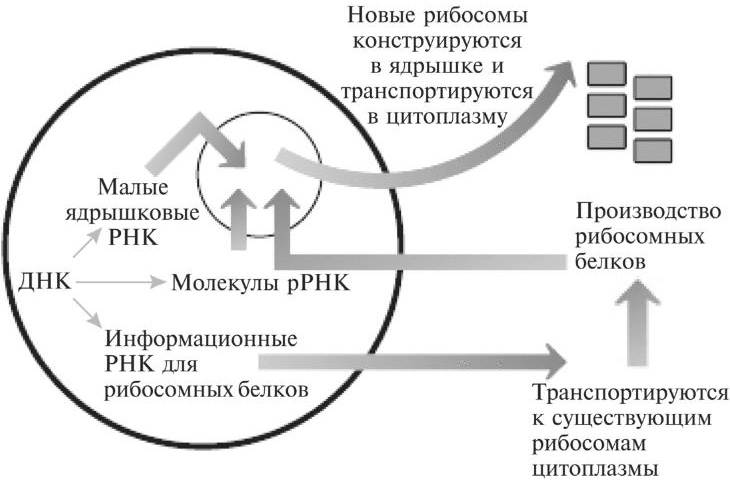
Рис. 11.3. Молекулы информационной РНК для рибосомных белков создаются в ядре и затем доставляются к существующим рибосомам цитоплазмы. Новые рибосомные белки переносятся обратно, в определенную область ядра. Там они соединяются с молекулами рибосомной РНК, создавая новые рибосомы, которые затем выводятся в цитоплазму, чтобы действовать в ней.
В ядрышке эти рРНК и белки модифицируются. Затем из них в процессе сборки создаются зрелые «нетронутые» рибосомы, которые выводятся обратно в цитоплазму. Они готовы осуществлять свои функции роботов, создающих белки. Малые ядрышковые РНК требуются для того, чтобы определенные модификации должным образом происходили в молекулах рРНК. Подобно тому, как ДНК и гистоны можно модифицировать, пристраивая к ним метильную группу, молекулы рРНК также можно метилировать. Вероятно, малые ядрышковые РНК облегчают этот процесс, находя на рРНК участки, где могут образовывать нуклеотидные пары. Опять-таки, в основе этого — связывание соответствующих нуклеотидных оснований двух нуклеиновых молекул. После того, как соединение произошло, малые ядрышковые РНК привлекают ферменты, способствующие пристраиванию метильных групп к молекулам рРНК. Вероятно, это чем-то похоже на то, как длинные некодирующие РНК привлекают ферменты, модифицирующие гистоны. Пока еще не вполне ясно, почему эти модификации важны для рРНК. Согласно одной из гипотез, они помогают стабилизировать взаимодействия между молекулами рРНК и рибосомными белками.
Есть искушение предположить, что причиной симптомов, возникающих при синдроме Прадера-Вилли, как раз и является неправильный контроль рРНК-модификаций со стороны малых ядрышковых РНК. Но пока это лишь версия. Проблема в том, что теперь мы понимаем: малые ядрышковые РНК могут также таргетировать и многие другие типы молекул РНК. Поэтому нельзя с уверенностью сказать, в каком из процессов у больных детей происходят нарушения.
Рибосомы — чрезвычайно древние образования. Их можно обнаружить в весьма примитивных организмах, к примеру, даже у бактерий — крошечных одноклеточных, в клетках которых нет ядра, а значит, ДНК у них не отделена от цитоплазмы. Специалисты по эволюционной биологии часто используют ДНК-последовательности генов, кодирующих различные рРНК, чтобы проследить, как отделялись друг от друга виды, со временем оказавшиеся на разных ветвях эволюционного древа.
Бактерии отделились от более сложных организмов примерно 2 миллиарда лет назад8. Поэтому, хотя мы все-таки обнаруживаем рРНК-гены у этих наших одноклеточных родичей (очень дальних), эти гены сильно отличаются от наших. Оказывается, это очень хорошо! Некоторые из наиболее распространенных и наиболее успешно действующих антибиотиков работают благодаря ингибированию бактериальных рибосом9. В числе этих препаратов — тетрациклин и эритромицин. Они нарушают деятельность бактериальных рибосом, но не человеческих. Мы сегодня так привыкли использовать антибиотики, что подчас забываем, какую важную роль они сыграли в развитии медицины. Начиная с момента своего триумфального появления в 1940-е годы, антибиотики сохранили жизни миллионов людей. И многих из них удалось спасти благодаря тому, что у разных видов по-разному устроено то, что пуристы назвали бы мусорной ДНК. Не правда ли, забавно?

