Книга: Ингредиенты: Химия и алхимия гастрономического творчества
Назад: Твердая, жидкая и газообразная
Дальше: Текучесть
Растворение
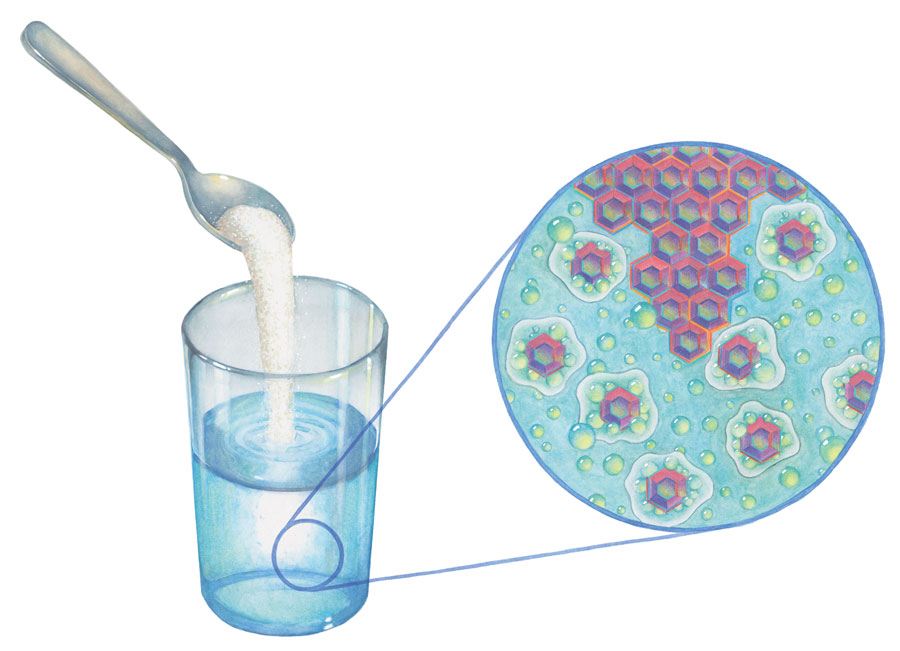
Размешайте немного сахара в стакане воды, и кристаллы исчезнут. Этот процесс кажется вполне безобидным, как будто сахар просто исчезает. На самом деле это не так. Вода набрасывается на каждый кристаллик, словно разъяренная толпа, разрывая его на части. Каждая молекула сахара отрывается от кристалла и уносится прочь группой молекул воды. Вода способна совершить это практически с любым веществом: она вырывает углеводы из фруктов и овощей, варящихся в соусе, разрушает белки в тушеном мясе, вытаскивает сахара и минералы из чайных листьев и ловит газы в газированных напитках. Однако отличительной особенностью жиров является их ненависть к воде. Благодаря нападению воды на прочие вещества мы получаем вкус, возможность хранения и изменение текстуры пищи.
Растворение – это двусторонний процесс: вода захватывает вещества, а они полностью завладевают ее вниманием. Вода и растворяющееся в ней вещество держатся вместе, пойманные в силовой «кокон». Это не традиционный парный танец; каждая молекула вещества окружена молекулами воды со всех сторон. Вокруг одной такой молекулы могут толпиться тысячи молекул воды. Это означает, что в определенный момент все молекулы воды становятся заняты и раствор превращается в насыщенный.
Растворение – это двусторонний процесс: вода захватывает вещества, а они полностью завладевают ее вниманием.
В насыщенном сахарном сиропе больше не может раствориться никакое количество сахара, если только мы не добавим еще воды или не увеличим температуру. При повышении температуры молекулы воды начинают двигаться быстрее и занимают большее пространство (см. главу о температуре). Благодаря такой повышенной подвижности горячие молекулы могут «бегать» кругами вокруг своих узников. Поэтому для контроля над ними требуется меньше молекул воды и в воде растворяется больше вещества. На кухне мы можем использовать температуру для того, чтобы поместить много веществ в небольшое количество воды, получая концентрированные сиропы, соусы, подливки, бульоны, экстракты и напитки вроде кофе или чая. Исключение из этого правила – газы. При повышении температуры они становятся еще более прыткими, чем молекулы воды, ускользают от них и вырываются в воздух. Поэтому мы и стараемся держать газированную воду, пиво или шампанское в холоде: так газы остаются растворенными и пузырьки сохраняются дольше.
Погружая кусочки пищи в воду, мы выделяем из них смесь разнообразных веществ. Точное количество веществ, которое мы можем извлечь из продукта, зависит от того, насколько хорошо он растворяется в воде при данной температуре, поэтому изменение температуры дает нам возможность создавать разные сочетания вкусов, запахов, цветов и текстур даже при использовании одних и тех же исходных ингредиентов. Почти всем нам знакома разница между холодными и горячими кофейными напитками, и мы можем применять тот же самый подход для приготовления всего, что связано с растворением продуктов в воде (а также для растворения не любящих воду веществ в жирах – см. соответствующую главу). Мы можем настаивать чай, делать глинтвейн и даже готовить бульон при разных температурах – от замерзания до кипения, получая бесчисленные вариации основной вкусовой темы.
Вода / Растворение
Вода растворяет другие вещества, окружая их молекулы. Вода и растворенное в ней вещество связаны вместе.


Назад: Твердая, жидкая и газообразная
Дальше: Текучесть

