Книга: Сами расшифровываем анализы
Назад: Глава 5 Свойства сыворотки крови (серологический анализ)
Дальше: Глава 7 Растворенные в крови газы и кислотно-щелочное равновесие
Глава 6
Биохимический состав крови
Современные технологии, компьютеризация и автоматизация многих процессов разительным образом изменили характер работы клинико-диагностических лабораторий, и особенно явно это отражается на биохимических исследованиях.
Автоанализаторы значительно ускорили и упростили выполнение практически всех видов биохимических и других видов исследований, а их подключение к компьютерам позволяет быстро обобщать серии исследований для одного пациента, хранить в памяти все полученные результаты и подготовить обоснованный ответ клиницисту.
В России начат серийный выпуск специальных наборов реагентов для автоанализаторов. Все выпускаемые в настоящее время наборы, а также стандартные, контрольные, калибровочные образцы стандартизированы и зарегистрированы в Минздравсоцразвития РФ.
Все выпускаемые наборы подвергаются тщательной проверке в ведущих лабораториях и медицинских центрах и только после этого регистрируются. Такая стандартизация позволяет сделать сопоставимыми результаты исследований, полученные в самых разных медицинских учреждениях.
Показатели белкового обмена
Как уже говорилось выше, кровь состоит из жидкой компоненты и клеток, или форменных элементов. Кровь, набранная в сухую пробирку, через несколько минут разделится на сгусток темно-красного цвета и светло-желтую жидкость над сгустком. Это и будет сыворотка крови. В отличие от сыворотки плазма крови содержит белок фибриноген. Он переходит в сгусток крови во время коагуляции, а значит, чтобы получить плазму крови, нужно добавить в цельную кровь консервирующее вещество, препятствующее коагуляции, и только потом подвергнуть ее центрифугированию.
Кровь состоит на 45 % из взвешенных в ней форменных элементов и на 55 % из плазмы.
Пожалуй, для полноты картины здесь следует напомнить читателям и о межклеточной жидкости, окружающей клетки нашего тела. Конечно, кровь несет главную нагрузку в вопросе транспортировки веществ к и от тканей тела; но фактически клетки тканей получают вещества из кровеносных сосудов через жидкость, их окружающую. Эту жидкость и называют межклеточной жидкостью.
Растворенные в этой жидкости вещества, так же как часть молекул воды, входят в клетки, и таким же образом выходят в межклеточную жидкость из клеток. Кроме того, концентрация различных веществ в межклеточной жидкости может меняться (например, кислород входит в клетки, а углекислый газ выходит). Таким же самым образом концентрация веществ, растворенных в крови, отличается в капиллярных артериях и венах. За исключением кислорода и небольшого количества углекислого газа, все другие вещества, нуждающиеся в транспорте, передаются через плазму. Плазма в большей степени, чем клетки крови, связывает две циркуляторные системы нашего тела, сердечно-сосудистую и лимфатическую. И все вещества перемещаются по организму следующим путем: из плазмы – в межклеточную жидкость – в лимфу – и назад, в плазму. Важно понять, что эти жидкости: кровь, межклеточная жидкость и лимфа – являются по существу одним и тем же, несмотря на любые различия в концентрации; главное различие между ними – местоположение (точно так же единственное различие между магмой и лавой – местоположение: магма находится под землей, а лава выходит на поверхность). Лимфатические капилляры – открытые сосуды, в стенках которых с известной периодичностью встречаются отверстия, являющиеся местами вхождения межклеточной жидкости. Лимфатическая жидкость в конечном счете соединяется с плазмой через грудной проток в подключичной вене.
В плазме содержится 92 % воды, 7 % белков и 1 % других веществ (углеводов, жиров и минеральных солей). Тот факт, что вода является таким превосходным растворителем, позволяет крови переносить много растворенных веществ. Большинство этих веществ – плазменные белки. Это высокомолекулярные соединения, способные вести себя и как кислоты, и как основания благодаря тому, что их молекулы содержат и карбоксильные (кислотные группы СООН), и аминогруппы (основные группы NH2). Благодаря этим уникальным свойствам плазменные белки способны активно взаимодействовать с самым широким спектром различных веществ, поступающих в кровь.
По форме белки делятся на глобулярные и фибриллярные. Глобулярные белки хорошо растворимы в воде, их молекула имеет шарообразную форму. Фибриллярные белки плохо растворимы в воде и отличаются удлиненной, нитеобразной формой, так что их длина, в отличие от глобулярных белков, во много раз больше диаметра. Как и у любых органических соединений, у белков можно найти и переходные формы – между глобулярной и фибриллярной.
По составу различают простые и сложные белки. Простые белки состоят только из аминокислот. Это альбумины, глобулины, протамины, гистоны (два последних вида сосредоточены в клеточных ядрах и участвуют в регулировании метаболической активности отдельных генов) и некоторые другие.
Самые маленькие из этих белков (составляющие тем не менее приблизительно 60 % от всех белков крови) – альбумины, которые играют важную роль в поддержании осмотического давления, помогая переместить больше воды из капилляров. Альбумины также участвуют в транспорте стероидных гормонов.
Приблизительно 35 % белков плазмы представлены глобулинами. Они образуют антитела (г-глобулины), которые играют важнейшую роль в борьбе с инфекцией. Два других глобулина, б– и в-, транспортируют жиры, жирорастворимые витамины и железо. Приблизительно 7 % плазменного белка составляет фибриноген, производимый печенью и являющийся важным участником процесса свертывания крови (см. предыдущую главу). Последний 1 % состоит из регулирующих белков типа проферментов, ферментов и гормонов. Учитывая, что эндокринная система бессильна без кровеносной системы, может показаться немного несправедливым, что на долю гормонов приходится так мало плазмы.
Молекулы сложных белков содержат не только аминокислоты, но и другие соединения: нуклеиновые кислоты, форфорную кислоту, углеводы и т. д. Таким образом, нуклеопротеиды, глюкопротеиды, липопротеиды, хромопротеиды, фосфопротеиды и ряд ферментов мы классифицируем как сложные белки.
Остающиеся 1,5 % плазмы представлены другими веществами: электролитами, газами, питательными веществами, регулирующими веществами, витаминами и продуктами метаболизма. Еще раз: их ужасно мало, но они, тем не менее, очень важны! Электролиты весьма разнообразны: Na+, K+, Са2+, Мg2+, Cl-, HCO3-, HPO42- и HSO42-. Ионы натрия и кальция (Na+ и Са2+), например, необходимы для сокращения мышц, а ионы бикарбоната (HCO3-) – для транспорта CO2 к легким.
Важнейшим свойством белков является их гидрофильность или способность связывать молекулы воды, образуя собственную водную оболочку и тем самым поддерживая коллоидно-осмотическое, или онкотическое давление. При резком падении содержания в крови белка онкотическое давление снижается, в кровеносном русле появляется избыточное количество «свободной» воды, которая начинает пропотевать через стенки сосудов в окружающие ткани. Так появляются онкотические отеки, т. е. отеки, зависящие от количества белка в крови.
Как уже говорилось выше, благодаря способности связываться со многими типами веществ белки плазмы крови выполняют и транспортные функции.
Кроме того, белки являются одной из буферных систем крови и поддерживают постоянство гомеостаза – кислотно-основное состояние (КОС) крови (см. ниже по тексту).
Общий белок
В сыворотке здоровых людей содержится 65–78 г/л общего белка. Это на 2–4 г/л меньше, чем в плазме крови – из-за отсутствия фибриногена. Общее количество белка может понижаться, и тогда врачи говорят о гипопротеинемии, которая наблюдается при:
• недостаточном поступлении белка в организм;
• повышенной потере белка;
• нарушении образования белка.
Альбумины
Благодаря различиям белков по аминокислотному составу и физико-химическим свойствам их можно разделить на отдельные фракции. Точнее всего такое разделение получается методом электрофореза.
У здоровых людей содержание альбумина составляет 56,5–66,8 %, б1-глобулина 3,5–6,0 %, б2-глобулина 6,9–10,5 %, в-глобулина 7,3–12,5 %, г-глобулина 12,8–19,0 %.
Показания к использования этого анализа для диагностики патологических процессов:
• острые и хронические воспаления;
• заболевания печени;
• злокачественные образования;
• парапротеинемии;
• нефротический синдром;
• нарушение обмена липидов;
• недостаток антител.
Остаточный азот
Процесс синтеза или распада белков является основным компонентом азотистого обмена в организме и также влияет на состав сыворотки крови. Для оценки состояния азотистого обмена в сыворотке определяют фракции остаточного азота. Это так называемый небелковый азот, который остается в центрифугате сыворотки крови после осаждения белков соответствующими реактивами. В его состав входит ряд азотсодержащих веществ (мочевина, аминоазот (азот аминокислот), мочевая кислота, креатинин, индикан и др.). О методах исследования этих веществ будет рассказано ниже.
В норме содержание остаточного азота колеблется в пределах 0,2–0,4 г/л. Увеличение концентрации остаточного азота больше 0,4–0,5 г/л называется азотемией и считается признаком того, что азотистые шлаки либо задерживаются в крови (из-за нарушения работы почек), либо вырабатываются с повышенной скоростью (внепочечная азотемия).
С-реактивный белок (СРБ)
С-реактивный белок, или СРБ – очень чувствительный элемент крови, быстрее других реагирующий на повреждения тканей. Наличие реактивного белка в сыворотке крови – признак воспалительного процесса, травмы, проникновения в организм чужеродных микроорганизмов – бактерий, паразитов, грибов. С-реактивный белок стимулирует защитные реакции, активизирует иммунитет.
Содержание СРБ в сыворотке крови до 0,5 мг/л считается нормой. Уже через 4–6 часов после того, как в организм проникает инфекция, развивается воспалительный процесс, который может сопровождаться отеками, а уровень СРБ начинает быстро расти. Чем острее воспалительный процесс, активнее заболевание, тем выше С-реактивный белок в сыворотке крови. Когда заболевание в хронической форме переходит в фазу ремиссии, то содержание С-реактивного белка в крови практически не обнаруживается. Когда наступает обострение, СРБ снова начинает расти. Определение СРБ используется для диагностики острых инфекционных заболеваний и опухолей. Также анализ СРБ используется для контроля над процессом лечения, эффективностью антибактериальной терапии и т. д. Биохимический анализ крови СРБ может показать рост С-реактивного белка в крови в следующих случаях:
• ревматические заболевания;
• заболевания желудочно-кишечного тракта;
• рак;
• инфаркт миокарда;
• сепсис новорожденных;
• туберкулез;
• менингит;
• послеоперационные осложнения.
Повышение СРБ происходит при приеме эстрогенов и оральных контрацептивов.
Гомоцистеин
В процессе формирования атеросклероза состояние сосудистой стенки играет не меньшую роль, чем нарушения липидного обмена. Среди факторов, повреждающих стенки сосудов, в последнее время особое внимание привлекает гомоцистеин – промежуточный продукт обмена незаменимой аминокислоты метионина. В норме гомоцистеин живет в организме очень недолго и под действием ферментов с длинными названиями превращается обратно в метионин или в следующий продукт обмена, цистатионин. Различные нарушения в организме приводят к тому, что гомоцистеин в нем накапливается и вызывает ряд патологических эффектов, в частности – поражает внутреннюю стенку артерий. В результате образуются разрывы эндотелия (внутреннего слоя сосудистой стенки), которые организм пытается заживить. Для этого он и использует холестерин и другие липиды. Возможно, образование атеросклеротических бляшек – это патологическое развитие защитной реакции, направленной на устранение дефекта в стенке сосуда, и холестерин здесь не причина, а следствие, или даже защитник целостности стенок наших сосудов. Работа ферментов, участвующих в биохимических превращениях гомоцистеина, невозможна без кофакторов («помощников») – витаминов B6, B12 и B9 (фолиевой кислоты). В этом кроется возможный подход к профилактике и лечению атеросклероза с помощью витаминов группы B, прежде всего – фолиевой кислоты. Гомоцистеиновая теория весьма убедительно объясняет причины возникновения атеросклероза. Но пока холестериновая теория остается общепринятой, врачи и пациенты вопреки фактам, здравому смыслу и биохимии организма насмерть (в прямом смысле этого слова) бьются с веществом, без которого жизнь просто невозможна.
Норма гомоцистеина составляет 5–15 мкмоль/л. При концентрации гомоцистеина в плазме крови 15–30 мкмоль/л определяется умеренная степень гомоцистеинемии, 30–100 мкмоль/л – средняя, более 100 – тяжелая. Умеренная гомоцистеинемия в возрасте до 40 лет, как правило, протекает бессимптомно, однако изменения в коронарных и мозговых артериях уже происходят. Повышение гомоцистеина на 5 мкмоль/л увеличивает риск атеросклеротического повреждения сосудов сердца на 80 % у женщин и на 60 % у мужчин.
Для максимально правильного расчета риска сосудистых осложнений необходимо применять схему: гомоцистеин + фибриноген + С-реактивный белок + расширенный комплекс исследования липидного обмена (триглицериды, холестерин ЛПВП, ЛПНП, ЛПОНП, аполипротеин-А и В, индекс атерогенности).
Мочевина сыворотки крови
Мочевина – главный компонент фракции остаточного азота (см. предыдущий раздел) – составляет в ней примерно 50 %. В норме содержание мочевины в сыворотке крови колеблется от 2,5 до 8,3 ммоль/л.
Изменение концентрации мочевины – важный диагностический признак при почечной патологии, поскольку он начинает меняться раньше, чем количество остаточного азота. Концентрация мочевины повышается при:
• почечной недостаточности;
• нефритах;
• питании с богатым содержанием белка.
Кроме того, концентрация мочевины повышается при некоторых состояниях, не связанных с патологией почек. Это может быть:
• простатит;
• непроходимость кишечника;
• ожоги;
• шок;
• всех патологиях, связанных с активным белковым распадом (опухоли, тяжелые инфекции, лихорадочные состояния, гипертиреоз).
Поскольку мочевина главным образом образуется в печени, то понятно, что при заболеваниях этого органа в первую очередь понижается и количество мочевины в крови. Уровень мочевины в крови понижается при:
• паренхиматозных желтухах;
• острой атрофии печени;
• циррозе печени.
Важное диагностическое значение имеет также мочевинный коэффициент – или процентное соотношение содержания мочевины к остаточному азоту. Если в норме, как уже говорилось, оно составляет около 50 %, то при хронических нефритах может возрасти до 90 %.
Креатинин сыворотки крови
Изменения в количестве креатинина, вырабатываемого почками, возникают только в случае далеко зашедшей патологии. В норме его концентрация практически не меняется и составляет 0,044–0,100 ммоль/л для здоровых мужчин и 0,044–0,088 ммоль/л для женщин.
Постоянное повышение уровня креатинина в крови, подобно повышенному уровню мочевины, говорит о дисфункции почек и может оцениваться как ранний признак почечной недостаточности. Также содержание креатинина повышается при патологиях, перечисленных для мочевины – за исключением простатита.
Уменьшение содержания креатинина в крови не имеет диагностического значения.
Мочевая кислота сыворотки крови
Мочевая кислота – продукт распада пуриновых оснований, входящих в состав сложных белков – нуклеопротеидов. Исследование содержания мочевой кислоты в сыворотке крови имеет важное диагностическое значение при подагре. В норме ее содержание в крови составляет для женщин 0,16–0,44 ммоль/л, у мужчин – 0,24–0,50 ммоль/л.
Гиперурикемия – повышение концентрации мочевой кислоты – выявляется при:
• подагре;
• лейкозах;
• В12-дефицитной анемии;
• некоторых острых инфекциях;
• заболеваниях печени и желчевыводящих путей;
• тяжелой форме сахарного диабета;
• экземе, псориазе и крапивнице;
• отравлении окисью углерода или метиловым спиртом.
Хотя большая часть мочевины в нашем организме образуется из эндогенных нуклеотидов, значительное их количество мы получаем с пищей. Поэтому для проведения точного анализа необходимо в течение трех дней исключить из рациона продукты с высоким содержанием пуринов (мясо, рыба, печень, почки, бобовые, грибы, шпинат).
Концентрация мочевой кислоты не используется для диагностики почечной недостаточности, т. к. не является показателем дисфункции почек.
Индикан сыворотки крови
Индикан образуется в печени при обезвреживании индола – ядовитого вещества, появляющегося в кишечнике при гниении белков. Вот почему его содержание в сыворотке крови заметно возрастает при наличии гнилостных процессов в кишечнике. Это снижает его диагностическую ценность как признака почечной недостаточности.
У здоровых людей концентрация индикана в крови равна 0,87–3,13 мкмоль/л. С учетом возможных кишечных патологий врачи условно принимают, что их следствием может быть повышение концентрации индикана до 4,7 мкмоль/л. Если анализы дают более высокие показатели, их считают признаком патологии почек.
Билирубин сыворотки крови
Билирубин образуется во всех клетках ретикулоэндотелиальной системы при распаде гемоглобина из погибших эритроцитов. Здесь вырабатывается так называемый непрямой, или свободный билирубин, циркулирующий в крови в виде комплекса с альбуминами. Он нерастворим в воде, токсичен и не проходит через почечный фильтр. Этот пигмент дает цветную реакцию со специальным реактивом только после того, как будут осаждены связанные с ним альбумины, и поэтому называется непрямым. Кровь доставляет непрямой билирубин к клеткам печени. Здесь комплекс распадается, альбумины остаются в крови, а непрямой билирубин проникает в клетки печени, где преобразуется в прямой билирубин (сразу дающий цветную реакцию) и переходит с желчью в кишечник для выведения из организма. Из кишечника часть прямого билирубина всасывается в кровоток. В итоге в норме общее содержание билирубина в крови равно 8,5–20,5 мкмоль/л, причем 70 % составляет непрямой и 30 % – прямой билирубин.
Гипербилирубинемия – повышение содержания билирубина в крови – сопровождается желтушной окраской слизистых оболочек и кожных покровов. Различают легкую форму желтухи – при концентрации билирубина в крови до 86 мкмоль/л, среднетяжелую (87–159 мкмоль/л) и тяжелую (свыше 160 мкмоль/л). Гипербилирубинемия наблюдается при:
• увеличении интенсивности гемолиза (разложения гемоглобина);
• поражениях паренхимы (ткани) печени;
• застойных явлениях в печени и желчных путях.
Интенсивность гемолиза возрастает при гемолитических анемиях, гемолитической болезни новорожденных, В12-дефицитной анемии, талассемии, обширных гематомах.
Паренхиматозные желтухи развиваются при инфекционном или вирусном гепатитах, циррозе и других заболеваниях печени.
Застойные явления могут быть вызваны внепеченочной обдурацией поджелудочной железы, желчнокаменной болезнью, новообразованиями, гельминтозами и медикаментозной терапией.
Показатели липидного (жирового) обмена
Липиды – это нерастворимые в воде низкомолекулярные вещества. В плазме крови они находятся в основном в форме липопротеинов, то есть сложных белков, и по свойствам близки к белкам.
Исследования обмена липидов, липопротеинов (ЛП) и холестерина (ХС) имеют не только сугубо диагностическое, но и социальное значение, так как позволяют судить о необходимости срочной профилактики сердечно-сосудистых заболеваний. Холестерин – это вид жира (липида), содержащийся в крови человека. Высокий уровень холестерина является фактором риска развития болезни сосудов сердца (ишемической болезни сердца, ИБС) – основной причины смерти и инвалидности в большинстве развитых стран.
ИБС чаще всего является причиной развития сердечной недостаточности. Термин «сердечная недостаточность» звучит непонятно и даже угрожающе, однако врачи используют его для описания ситуации, когда сердце не может обеспечить достаточный уровень кровоснабжения согласно меняющимся потребностям организма. Это может быть причиной появления определенных симптомов. Медицинская помощь – обычно это прием лекарств – способна улучшить работу сердца.
Точной статистики о числе пациентов с хронической сердечной недостаточностью в России нет, но, опираясь на имеющиеся в мире данные, можно предположить, что их не менее 3–3,5 млн человек. Это только пациенты со сниженной насосной функцией левого желудочка и явными симптомами сердечной недостаточности. По данным статистики, примерно столько же пациентов имеют симптомы хронической сердечной недостаточности при нормальной насосной функции сердца и вдвое больше – с бессимптомной дисфункцией левого желудочка. Так что речь идет о 12–14 млн больных в России – данных о том, сколько человек заболевает ежегодно, у нас вообще не публиковалось.
Как уже говорилось выше, слишком высокий уровень холестерина в крови может привести к сужению и закупорке артерий. Обычно ишемическая болезнь сердца развивается в результате сужения артерий, поставляющих кровь к сердцу. При сужении этих артерий происходит недостаточное поступление крови, или даже прекращение притока крови, к сердечной мышце. Данный процесс может развиться в любой части кровеносной системы. Если нарушается приток крови к мозгу, происходит инсульт; если же блокируются артерии, снабжающие кровью нижнюю часть тела, может развиться гангрена (почернение и отмирание кожи и мышц). Эти нарушения также могут ослабить главную артерию организма – аорту, вызывая расширение ее стенок (аневризму), что приводит к особенно тяжелым последствиям.
Процесс, вызывающий сужение просвета сосудов за счет формирования липидных отложений, и последующее разрастание соединительной ткани и отложение кальция в стенках сосудов, называется атеросклерозом. На ранней стадии процесса на стенках артерий откладываются полоски жира, содержащие холестерин. Это начинает происходить, когда человеку исполняется приблизительно 20 лет. Данный процесс не является нормальным, однако эти полоски жира не представляют опасности здоровью и могут исчезнуть. Однако они могут откладываться и дальше и тем самым вызвать необратимые изменения структуры стенок артерий, что ведет к разрастанию соединительной ткани, похожей на рубец, вокруг сгустка холестерина. Такие изменения происходят не у всех, но с возрастом это становится все более распространенной проблемой.
Данный процесс поражает относительно небольшие участки внутри артерии, и очень часто происходит выпячивание внутренней поверхности сосуда, когда образуются так называемые «бляшки». Холестериновые бляшки исчезают не так легко, как полоски жира. В результате появления бляшек может произойти сужение артерии, и как следствие некоторые части тела будут недостаточно снабжаться кислородом.
Кроме того, могут появиться и другие осложнения, например образование тромба в артерии. При этом артерия может быть полностью закупорена, и если данная область не снабжается кровью другими сосудами, то может произойти некроз тканей (инфаркт), приводящий к инфаркту миокарда, инсульту или гангрене.
Кровь для анализа на липиды берется из вены и только натощак, не раньше чем через 12–14 часов после последнего приема пищи. В противном случае жиры, поступившие с продуктами в кишечник, а оттуда – в периферическую кровь, исказят результат анализа, и скорее всего будет получена картина гиперлипемии (ГЛП) – повышенного содержания липидов.
Определяют 3 вида липидов:
• холестерин (ХС);
• триглицериды (ТГ);
• фосфолипиды.
Холестерин, ЛПНП, ЛПВП
Из перечисленной выше троицы самое важное диагностическое значение врачи придают холестерину. Холестерин является неотъемлемой частью абсолютно всех клеток организма и синтезируется практически во всех клетках, однако основная его масса вырабатывается в печени и поступает вместе с пищей. Сам организм в сутки вырабатывает до 1 г ХС, входящего в состав клеточных мембран и ЛП и являющегося предшественником стероидных гормонов. У практически здоровых людей 2/3 ХС плазмы содержится в виде атерогенных ЛП (липопротеинов низкой плотности, ЛПНП, способствующих развитию атеросклероза), а 1/3 – в виде антиатерогенных ЛП (липопротеинов высокой плотности, ЛПВП, препятствующих развитию атеросклероза).
В норме уровень общего холестерина крови колеблется в весьма широких пределах: 3,6–6,7 ммоль/л. У мужчин содержание ХС несколько выше, чем у женщин. Рекомендуемые значения ХС крови не превышают 5,2 ммоль/л, пограничные колеблются между 5,2–6,5 ммоль/л. Значения больше 6,5 ммоль/л считаются повышенными.
На уровень холестерина в крови здорового человека могут повлиять многие факторы: возраст, физическая или умственная нагрузка и даже воздействие внешней среды.
Повышенное содержание холестерина называется гиперхолестеринемией и оценивается врачами как признак атеросклероза кровеносных сосудов или по меньшей мере как фактор риска развития атеросклероза. В России гиперхолестеринемией страдают не менее 10 % населения. Правда, следует помнить и о том, что человек может страдать от атеросклероза, но иметь нормальный уровень холестерина в крови.
Гиперхолестеринемия отмечается при:
• первичных гиперлипемиях (ГЛП) – наследственно обусловленных дефектах метаболизма;
• вторичных ГЛП – ишемическая болезнь сердца (ИБС); заболевания печени; поражения почек, сопровождающиеся отеками; гипотиреоз; заболевания поджелудочной железы; сахарный диабет; ожирение; беременность; алкоголизм; прием ряда лекарств.
Гипохолестеринемия отмечается при:
• голодании;
• злокачественных новообразованиях;
• болезнях печени;
• заболеваниях легких (туберкулез, неспецифические пневмонии, саркоидоз органов дыхания);
• гипертиреозе;
• анемии;
• поражениях центральной нервной системы (ЦНС);
• лихорадочных состояниях;
• сыпном тифе;
• обширных ожогах;
• гнойно-воспалительных процессах в мягких тканях;
• сепсисе;
• талассемии.
Использование теста на общий ХС целесообразно для исследования пациентов с ранними факторами риска атеросклероза, с заболеваниями сосудов и сердца, гипертонией, ожирением и заядлых курильщиков.
Уровень содержания в крови ХС и ТГ являются наиболее важными показателями липидного обмена.
Триглицериды
Триглицериды (ТГ), или нейтральные жиры, – это производные глицерина и высших жирных кислот. Триглицериды – главный источник энергии для клеток. Триглицериды поступают в наш организм с пищей, синтезируются в жировой ткани, печени и кишечнике. Уровень триглицеридов в крови зависит от возраста человека. Анализ триглицеридов используют в диагностике атеросклероза и многих других заболеваний.
Таблица 6
Норма триглицеридов
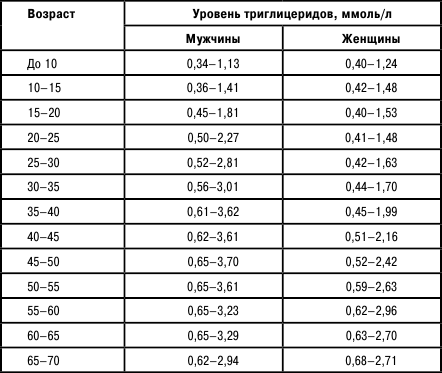
Если ТГ выше нормы, то у врача есть все основания подозревать:
ишемическую болезнь сердца, инфаркт миокарда, гипертоническую болезнь;
• атеросклероз;
• тромбоз сосудов мозга;
• хроническую почечную недостаточность;
• ожирение;
• вирусный гепатит, цирроз печени;
• подагру;
• талассемию;
• нарушение толерантности к глюкозе;
• синдром Дауна;
• заболевания печени – гепатит, цирроз;
• невротическую анорексию;
• гиперкальцемию;
• алкоголизм;
• сахарный диабет;
• гипотиреоз;
• острый и хронический панкреатит.
ТГ повышены при беременности, при приеме пероральных противозачаточных средств, препаратов половых гормонов.
Триглицериды ниже нормы наблюдаются в таких состояниях:
• хронические заболевания легких;
• инфаркт мозга;
• гипертиреоз;
• поражение паренхимы (ткани почки);
• миастения;
• травмы, ожоги;
• недостаточное питание;
• прием витамина С.
Активность ферментов сыворотки крови
Ферменты (или энзимы) – это белки специфической природы, которые синтезируются в клетках, катализируют биохимические реакции (т. е. увеличивают их скорость), происходящие в нашем организме, но сами при этом остаются неизменными. Можно без преувеличения сказать, что ни одна реакция в живых организмах не протекает без участия ферментов. Человек научился использовать ферментативные процессы еще в древности – например, в хлебопечении или виноделии.
Как и прочие белки, по молекулярному составу ферменты делятся на простые и сложные, причем сложные содержат белковый компонент (апофермент, или апоэнзим) и небелковый (кофермент, или коэнзим). Чаще всего коэнзимом является металл, витамин или его производная. По размерам коэнзим во много раз меньше, чем апоэнзим. Функциональная активность фермента определяется кофигурацией его молекулы, создающей специфическое взаимное расположение аминокислот. Это зависит от ряда факторов: вида и концентрации субстрата (объекта, на который воздействует фермент), температуры, рН среды (для каждой реакции есть свои оптимальные температура и рН), наличия и отсутствия ингибиторов (веществ, подавляющих работу ферментов). Важнейшей особенностью ферментов является их уникальная специфичность, то есть возможность взаимодействовать только с одним субстратом или с группой веществ, сходных по своему строению.
Изменение активности одних и тех же ферментов происходит при самых различных заболеваниях и, следовательно, не становится специфичным для какой-либо патологии.
Поэтому определение активности ферментов имеет диагностическое значение только при сопоставлении с изменениями других показателей и клинической картиной заболевания в целом.
На сегодняшний день подробно описано около 1000 энзимов, и из них более 50 нашли использование в клинической лабораторной диагностике.
В нашем теле у каждого органа есть свой специфический набор ферментов. Определяя их активность, можно судить и о том, как работает сам орган. Правда, в основном эта работа происходит во внутриклеточной среде, но и анализ внеклеточных составляющих (в данном случае плазмы или сыворотки крови) позволяет судить о процессах, идущих в клетках, и функциональном состоянии органов и тканей.
Определение активности ферментов в сыворотке или плазме крови стало одним из рутинных лабораторных анализов в 1954 г., когда стало ясно диагностическое значение повышенной активности аспартатаминотрансферазы (АСТ, содержится в большом количестве в миокарде и резко повышает активность при инфаркте миокарда) и аланинаминотрансферазы (АЛТ, содержится во всех паренхиматозных органах. Его активность в плазме напрямую связана с патологическими процессами в ткани печени).
Дальнейшие исследования показали, что для каждого фермента в процессе заболевания есть свое время появления в сыворотке крови, нарастание активности вплоть до определенного пика и последующая инактивация. Это связано с тем, что патологический процесс вызывает разрушение клеток, чье содержимое (в том числе и ферменты) в итоге оказывается в крови.
Так называемая длительность периода полураспада ферментов является главным фактором, определяющим период времени, когда активность фермента повышена в плазме или сыворотке крови.
Активность ферментов измеряется в моль/(с×л); мкмоль/(с×л), нмоль(с×л).
Международная единица (МЕ, UE) измеряется в мкмоль/(мин×л) и равна 16,67 нмоль/(с×л).
Относительно новая единица каталитической активности – нкатал/л – равна нмоль/(с×л).
Аспартатаминотрансфераза (АСТ, АсАТ)
АСТ (АсАТ), или аспартатаминотрансфераза, – клеточный фермент, участвующий в обмене аминокислот. АСТ содержится в тканях сердца, печени, почек, нервной ткани, скелетной мускулатуры и других органов. Благодаря высокому содержанию в тканях этих органов, анализ крови АСТ – необходимый метод диагностики заболеваний миокарда, печени и различных нарушений мускулатуры.
Норма АСТ в крови для женщин – до 31 Ед/л, для мужчин норма АсАТ – до 41 Ед/л.
Анализ крови может показать повышение концентрации АСТ при:
• инфаркте миокарда;
• вирусном, токсическом, алкогольном гепатите;
• стенокардии;
• остром панкреатите;
• раке печени;
• остром ревмокардите;
• тяжелой физической нагрузке;
• сердечной недостаточности.
АСТ повышен при травмах скелетных мышц, ожогах, тепловом ударе и вследствие кардиохирургических операций.
Анализ крови АсАТ показывает понижение уровня АсАТ в крови вследствие тяжелых заболеваний, разрыва печени и при дефиците витамина В6.
Аланинаминотрансфераза (АлАТ, АЛТ)
АлАТ (АЛТ), или аланинаминотрансфераза, – фермент печени, участвующий в обмене аминокислот. Наряду с АСТ в большом количестве содержится АЛТ в печени, почках, в сердечной мышце, скелетной мускулатуре. При разрушении клеток этих органов, вызванных различными патологическими процессами, происходит выделение АЛТ в кровь человека, и анализ покажет высокий АлАТ в крови. В здоровом организме содержание показателя АЛТ в крови незначительно.
Норма АЛТ (норма АлАТ) для женщин – до 31 Ед/л, для мужчин норма АлАТ – до 41 Ед/л.
Повышение АЛТ – признак таких серьезных заболеваний, как:
• вирусный гепатит;
• токсическое поражение печени;
• цирроз печени;
• хронический алкоголизм;
• рак печени;
• токсическое действие на печень лекарств (антибиотиков и др.);
• желтуха;
• сердечная недостаточность;
• миокардит;
• панкреатит;
• инфаркт миокарда;
• шок;
• ожоги;
• травма и некроз скелетных мышц;
• обширные инфаркты;
• сердечная недостаточность.
Биохимический анализ крови на АЛТ покажет снижение уровня АлАТ при тяжелых заболеваниях печени – некроз, цирроз (при уменьшении количества клеток, синтезирующих АЛТ). Результаты анализа крови АлАТ покажет низкое содержание аланинаминотрансферазы при дефиците витамина В6.
Щелочная фосфатаза
Щелочная фосфатаза участвует в обмене фосфорной кислоты, отщепляя ее от органических соединений и способствуя транспорту фосфора в организме. Самый высокий уровень содержания щелочной фосфатазы – в костной ткани, слизистой оболочки кишечника, в плаценте и молочной железе во время лактации. Норма щелочной фосфатазы в крови у женщин – до 240 Ед/л, у мужчин – до 270 Ед/л. Щелочная фосфатаза влияет на рост костей, поэтому у детей ее содержание выше, чем у взрослых.
Биохимический анализ крови на щелочную фосфатазу проводят для диагностики заболеваний костной системы, печени, желчевыводящих путей и почек. Повышенная щелочная фосфатаза в крови может стать поводом для врача поставить следующий диагноз:
• заболевание костной ткани, в том числе опухоли костной ткани, саркома, метастазы рака в кости;
• гиперпаратиреоз;
• миеломная болезнь;
• лимфогранулематоз с поражением костей;
• инфекционный мононуклеоз;
• рахит;
• заболевания печени (цирроз, рак, инфекционный гепатит, туберкулез);
• опухоли желчевыводящих путей;
• инфаркт легкого, инфаркт почки.
Повышение щелочной фосфатазы происходит в последнем триместре беременности, после менопаузы, при недостатке кальция и фосфатов в пище, от передозировки витамина С и как следствие приема некоторых лекарственных препаратов (оральных контрацептивов, содержащих эстроген и прогестерон, антибиотиков и других).
Уровень щелочной фосфатазы снижен при гипотиреозе, нарушениях роста кости, недостатке в пище цинка, магния, витамина В12 или С (цинга), анемии (малокровии). Прием медицинских препаратов также может вызвать понижение щелочной фосфатазы в крови. Во время беременности снижение активности щелочной фосфатазы происходит при недостаточности развития плаценты.
Холинэстераза
Холинэстераза – фермент, образующийся в печени. Холинэстераза содержится в нервной ткани, скелетных мышцах. Так называемая сывороточная холинэстераза присутствует в печени, поджелудочной железе, выделяется печенью в кровь. Определение холинэстеразы в медицине используется для диагностики возможного отравления инсектицидами и оценки функции печени. Биохимический анализ крови на холинэстеразу используется для оценки риска осложнений при хирургических вмешательствах. Норма холинэстеразы – 5300–12900 Ед/л. Содержание фермента холинэстеразы в крови человека начинает резко снижаться при тяжелых хронических заболеваниях печени, особенно при циррозе.
Низкая холинэстераза в крови – признак таких заболеваний, как:
• заболевания печени (цирроз, гепатит, метастатический рак печени);
• острое отравление инсектицидами;
• инфаркт миокарда;
• онкологические заболевания.
Понижение уровня холинэстеразы происходит на позднем сроке беременности, после хирургического вмешательства и при применении некоторых медицинских препаратов (оральных контрацептивов, анаболических стероидов, глюкокортикоидов).
Повышенная холинэстераза – симптом следующих заболеваний:
• артериальная гипертония;
• нефроз;
• рак молочной железы;
• ожирение;
• алкоголизм;
• сахарный диабет;
• столбняк;
• маниакально-депрессивный психоз;
• депрессивный невроз.
Повышение уровня холинэстеразы происходит на начальном этапе беременности.
Альфа-амилаза (диастаза)
Альфа-амилаза (диастаза) образуется в слюнных железах и поджелудочной железе. Также в поджелудочной железе образуется панкреатическая амилаза – фермент, участвующий в расщеплении крахмала и других углеводов в просвете двенадцатиперстной кишки. Амилаза, расщепляя крахмал и другие углеводы, обеспечивает переваривание углеводов пищи. Из организма амилазу выводят почки вместе с мочой. Определение активности амилазы используется в диагностике заболеваний поджелудочной железы, слюнных желез, для выяснения причин боли в животе. Норма альфа-амилазы в крови (норма диастазы) – 28–100 Ед/л. Нормы амилазы панкреатической – от 0 до 50 Ед/л.
Повышенная альфа-амилаза – симптом следующих заболеваний:
• острый, хронический панкреатит (воспаление поджелудочной железы);
• киста поджелудочной железы, камень, опухоль в протоке поджелудочной железы;
• эпидемический паротит;
• острый перитонит;
• сахарный диабет;
• заболевания желчных путей (холецистит);
• почечная недостаточность.
Уровень амилазы повышается при травме живота и как следствие прерывания беременности. Уровень панкреатической амилазы в крови возрастает в 10 раз и более выше нормы при остром панкреатите или при обострении хронического панкреатита, эпидемическом паротите. Резкое повышение уровня амилазы панкреатической может быть связано с воспалением поджелудочной железы, вследствие закупорки протока поджелудочной железы кистой, опухолью, камнем, спайками. Биохимический анализ крови амилазы покажет нулевые значения содержания амилазы при недостаточности функции поджелудочной железы, остром и хроническом гепатите. Снижение нормального уровня амилазы крови происходит при токсикозе у беременных.
Для определения фермента амилазы также используется анализ мочи.
Креатинкиназа
Креатинкиназа (креатинфосфокиназа) – фермент, содержащийся в скелетных мышцах, реже – в гладких мышцах (матке, ЖКТ) и головном мозге. Креатинкиназа обеспечивает энергией клетки мышц. В сердечной мышце – миокарде – содержится особый вид креатинкиназы – креатинкиназа МВ. При повреждении мышц наблюдается выход фермента из клеток – повышение активности креатинкиназы в крови. Поэтому определение креатинфосфокиназы и креатинкиназы МВ в крови широко применяется в ранней диагностике инфаркта миокарда. Уже через 2–4 часа после острого приступа уровень креатинкиназы МВ в крови значительно повышается. Анализ креатинкиназы МВ позволяет со 100-процентной точностью диагностировать инфаркт миокарда.
Таблица 7
Нормы креатинкиназы
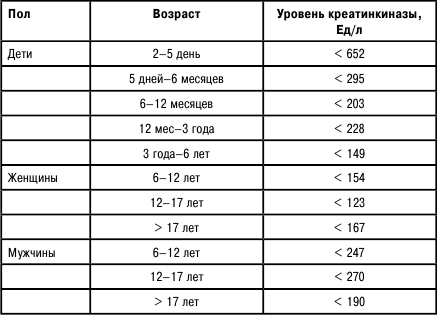
Нормы креатинкиназы МВ в крови – 0–24 Ед/л.
Повышение креатинкиназы происходит при следующих заболеваниях:
• инфаркт миокарда;
• миокардит;
• миокардиодистрофия;
• сердечная недостаточность;
• тахикардия;
• столбняк;
• гипотиреоз;
• алкогольный делирий (белая горячка);
• заболевания центральной-нервной системы (шизофрения, маниакально-депрессивный психоз, эпилепсия, черепно-мозговые травмы);
• злокачественные опухоли (рак мочевого пузыря, молочной железы, кишечника, легкого, матки, простаты, печени).
Повышение креатинфосфокиназы в крови может быть следствием хирургических операций и диагностических процедур на сердце, приема некоторых лекарственных средств (кортикостероидов, барбитуратов, наркотических средств), после тяжелой физической нагрузки. Повышение креатинкиназы также происходит при беременности. Понижение уровня креатинкиназы происходит при снижении мышечной массы и малоподвижном образе жизни.
Липаза
Липаза – фермент, синтезируемый многими органами и тканями для расщепления нейтральных жиров – триглицеридов. Особое значение в диагностике имеет липаза, вырабатываемая поджелудочной железой – панкреатическая липаза. В активной форме липаза выделяется в двенадцатиперстную кишку и тонкий кишечник, где расщепляет жиры пищи – триглицериды на глицерин и высшие жирные кислоты. При заболеваниях поджелудочной железы активность липазы значительно повышается, и липаза в большом количестве начинает выделяться в кровь. Норма липазы для взрослых – 0–190 Ед/мл. При остром панкреатите уровень липазы в крови увеличивается через несколько часов после острого приступа до 200 раз.
Определение липазы составляет основу диагностики панкреатита одновременно с анализом уровня альфа-амилазы в крови. Повышение уровня липазы может означать следующие заболевания:
• панкреатит, опухоли, кисты поджелудочной железы;
• хронические заболевания желчного пузыря, желчная колика;
• инфаркт, непроходимость кишечника, перитонит;
• костные переломы, ранения мягких тканей;
• рак молочной железы;
• почечная недостаточность;
• заболевания, сопровождающиеся нарушением обмена веществ, а особенно липидов – ожирение, сахарный диабет, подагра;
• эпидемический паротит.
Повышение липазы в крови может быть следствием приема некоторых медицинских препаратов (барбитуратов и других). Понижение уровня липазы может происходить при онкологических заболеваниях, кроме рака поджелудочной железы и при неправильном питании (избытке триглицеридов).
Гамма-глутамилтранспептидаза (ГГТ, гамма-ГТ)
Гамма-глутамилтранспептидаза – фермент, участвующий в обмене аминокислот. Основное содержание ГГТ – в печени, почках и поджелудочной железе. В крови здорового человека содержание гамма-ГТ незначительно. Для женщин норма ГГТ – до 32 Ед/л, для мужчин – до 49 Ед/л. У новорожденных норма гаммы ГТ в 2–4 раза выше, чем у взрослых. Анализ гамма-ГТ применяется в диагностике заболеваний печени и других органов желудочно-кишечного тракта. Повышение ГГТ происходит при таких заболеваниях, как:
• камни в желчном пузыре;
• острый вирусный и хронический гепатит;
• токсическое поражение печени;
• острый и хронический панкреатит;
• алкоголизм;
• заболевания поджелудочной железы (панкреатит, сахарный диабет);
• гипертиреоз (гиперфункция щитовидной железы);
• обострение хронического гломерулонефрита и пиелонефрита;
• рак поджелудочной железы;
• рак простаты;
• рак печени.
Повышение ГГТ может быть связано с приемом некоторых медицинских препаратов, эстрогенов, оральных контрацептивов.
Альдолаза (фруктозо-1,6-дифосфатальдолаза, ФДФ-А)
Фермент альдолаза играет важную роль в нашем энергетическом обмене, т. к. участвует в расшеплении молекул фосфорилированной гексозы. Его можно обнаружить во всех тканях человека, однако основное количество находится в скелетной мускулатуре, сердечной мышце и печени.
В норме у взрослого человека активность фермента в плазме крови составляет меньше 3,1 U/l, или 3–8 усл. ед.
Увеличение активности фермента наблюдается при:
• инфаркте миокарда;
• травме мышечной ткани;
• заболеваниях печени: остром (вирусном, токсическом) гепатите, отравлениях гепатотропными («печеночными») ядами, хроническом воспалительном процессе в печени;
• панкреатите;
• злокачественных новообразованиях;
• воспалении, деструкции (распаде) мышц;
• гемолитической анемии;
• инфекционном мононуклеозе;
• тяжелой пневмонии;
• шизофрении;
• большой физической нагрузке.
Сорбитолдегидрогеназа (СДГ)
Сорбитолдегидрогеназа (СДГ) – органоспецифичный фермент, который содержится в клетках печени, и поэтому повышение его активности в плазме можно считать признаком поражения печени.
В норме его ориентировочная активность составляет 1–2 ЕД/л.
Повышение активности СДГ наблюдается при:
• остром вирусном гепатите (активность СДГ возрастает в дожелтушном периоде, предшествуя повышению в сыворотке крови уровня билирубина и активности тансаминаз);
• обострении хронического гепатита;
• печеночной коме;
• обтурационной желтухе.
Простатическая кислая фосфатаза (КФ)
Простатическая кислая фосфатаза локализуется в основном в клетках эпителия предстательной железы.
Показатели нормы активности фермента в сыворотке крови – менее 4,00 U/l.
Увеличение активности пристатической кислой фосфатазы отмечается при:
• раке предстательной железы (особенно, но не всегда при метастазах);
• доброкачественной гипертрофии простаты;
• простатите;
• инфаркте предстательной железы;
• после манипуляций на простате и катетеризации;
• болезни Гоше.
Иммунохимические методы высоко специфичны для простатической кислой фосфатазы; однако, поскольку этот фермент не повышен на ранних стадиях заболевания предстательной железы, тест не рекомендуется для использования при скрининге. Он может быть применен для слежения за течением болезни.
Глюкоза-6-фосфатдегидрогеназа (Г-6-ФДГ)
Глюкоза-6-фосфатдегидрогеназа содержится главным образом в эритроцитах и демонстрирует самую высокую активность в молодых клетках. Врожденный дефект Г-6-ФДГ относится к наиболее распространенным энзимопатиям и может проявляться гемолитическими кризисами.
Показатели нормы активности фермента составляют 120–240 мЕД/млрд эритроцитов. В сыворотке активности не выявляется, а в эритроцитах она составляет 131±13 mU/109 клеток.
Дефицит фермента в эритроцитах вызывает гемолитическую анемию после приема противомалярийных препаратов, некоторых сульфаниламидов и витамина С.
Уроканиназа
Уроканиназа содержится главным образом в печени, и в норме ее активность в сыворотке крови отсутствует.
Повышение активности наблюдается при:
• циррозе печени;
• хронических гепатитах;
• токсических гепатитах.
При вирусных или токсических гепатитах активность фермента может достигать значений 5–13 нмоль/(с×л).
Содержание витаминов в сыворотке крови
Компоненты пищи, называемые витаминами, – это вещества, которые необходимы в небольших количествах для нормальной жизнедеятельности организма, но либо не вырабатываются в нем, либо вырабатываются в недостаточном количестве. Энергетическая ценность витаминов невелика. Они выполняют очень специфические функции в работе клеток. Часто они входят в состав ферментов или оказывают действие на работу той или иной системы (например, витамин С на соединительную ткань).
Некоторые витамины не содержатся в пище в готовом виде: например, витамин К синтезируется нормальной кишечной флорой, а некоторые другие витамины образуются в организме из предшественников (например, витамин А – из каротина), или так называемых провитаминов. Витамины бывают водорастворимые (витамины группы В, биотин, витамины группы фолиевой кислоты, никотиновая кислота и никотинамид, пантотеновая кислота и витамин С) и жирорастворимые (витамины А, D, Е и К), для усвоения которых необходимо употребление продуктов, содержащих жиры.
Витамин В12
Витамин В12 (или цианокобаламин, кобаламин) – уникальный витамин в организме человека, содержащий незаменимые минеральные элементы. Большое количество витамина В12 необходимо селезенке и почкам, несколько меньше поглощается мышцами. Кроме того, витамин В12 содержится в молоке матери. Характеристика витамина В12:
• витамин В12 необходим для образования и созревания эритроцитов;
• витамин В12 влияет на нервную систему, поддерживая ее в здоровом состоянии, снижает раздражительность;
• витамин В12 предотвращает появление анемии;
• цианокобаламин участвует в белковом, жировом и углеводном обмене;
• кобаламин участвует в процессе усвоения, транспорта и распада фолиевой кислоты;
• витамин В12 помогает увеличивать энергию;
• витамин В12 способствует росту и улучшению аппетита;
• витамин В12 помогает улучшить концентрацию, память и чувство равновесия.
В организме не происходит синтез витамина В12, его мы получаем с продуктами питания – источниками витамина В12. Содержат кобаламин продукты животного происхождения: печень, говядина, рыба, свинина, яйца, молоко, сыр, почки. Благополучному усвоению витамина В12 мешает одновременное употребление кислот, щелочей, воды, алкоголя, эстрогенов, снотворных таблеток. Для благополучного усвоения витамина В12 необходимо достаточное количество кальция, с которым В12 должен вступить во взаимодействие во время принятия пищи для того, чтобы он мог принести пользу для организма. Распад витамина В12 происходит очень медленно, из организма цианокобаламин выводится с желчью. При дефиците В12 в течение около 5–6 лет развивается В12 – дефицитная анемия.
Норма витамина В12: 180–900 пг/мл.
Рекомендуемая суточная доза витамина В12 для взрослых –3 мкг.
Дефицит витамина В12 приводит к серьезным, опасным для здоровья последствиям – развивается В12 – дефицитная анемия. Особенно подвержены этой разновидности анемии вегетарианцы и любители ограничительных диет, исключившие из своего рациона яйца и молочные продукты. При недостатке цианокобаламина происходят изменения в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к нарушению кроветворения, появлению симптомов неврологических расстройств (психические расстройства, полиневриты, поражение спинного мозга). В12 – дефицитная анемия может привести к заболеваниям печени, почек, заболеваниям крови, онкологическим заболеваниям, лейкозам. Дефицит витамина В12 в молоке матери приводит к мегалобластной анемии у ребенка. Недостаток витамина В12 – повод для врача поставить следующий диагноз:
• нарушение всасывания, распада и транспорта витамина В12;
• алкоголизм;
• резекция желудка, резекция тонкого кишечника;
• хронические воспалительные заболевания и аномалии тонкого кишечника, атрофический гастрит;
• болезнь Альцгеймера;
• дефицит фолиевой кислоты.
Избыток витамина B12 наблюдается при таких заболеваниях:
• заболевания печени (острый и хронический гепатит, цирроз, печеночная кома);
• острый лейкоз;
• метастазы злокачественных опухолей в печень;
• хроническая почечная недостаточность.
Фолиевая кислота
Фолиевая кислота (Folic Acid, фолацин) – водорастворимый витамин группы В. Для чего нужна фолиевая кислота?
• Фолиевая кислота необходима для нормального кроветворения; вместе с витамином В12 фолиевая кислота необходима для деления клеток, что особенно важно для тканей, которые активно делятся и дифференцируются (например, во время внутриутробного развития);
• фолацин способствует усвоению, транспорту и распаду белков, способствует соединению белковой группы и гема в гемоглобине и миоглобине;
• стимулирует пластические и регенераторные процессы во всех органах и тканях;
• фолиевая кислота необходима для усвоения сахара и аминокислот;
• важна для образования нуклеиновых кислот (РНК и ДНК), участвующих в передаче наследственных признаков;
• фолацин предупреждает развитие атеросклероза, обладает анальгетическим действием;
• улучшает выделение молока;
• обеспечивает защиту от кишечных паразитов и пищевых отравлений;
• фолиевая кислота обеспечивает здоровый вид кожи, улучшает аппетит;
• действует как профилактическое средство от язвенного стоматита.
Норма содержания фолиевой кислоты в сыворотке крови – 3–17 нг/мл.
Рекомендуемая дневная норма потребления (РНП) – суточная доза фолиевой кислоты для взрослых – 400 мкг. Во время беременности суточная норма фолиевой кислоты у женщин удваивается до 800 мкг. Источник фолиевой кислоты – микрофлора кишечника. Фолиевая кислота содержится в большом количестве в листьях зеленых растений. Отсюда этот витамин, фолиевая кислота, и получил свое название от латинского слова «фолиум» – лист. Продукты с высоким содержанием фолиевой кислоты: темно-зеленые овощи с листьями (шпинат, салат-латук, спаржа), морковь, дрожжи, печень, яичный желток, сыр, дыня, абрикосы, тыква, авокадо, бобы, цельная пшеничная и темная ржаная мука. Прием фолиевой кислоты с продуктами может быть нейтрализован при одновременном приеме эстрогенов и при тепловой обработке (варке) продуктов.
Концентрация фолиевой кислоты в сыворотке крови, ее уровень, зависит от поступления фолиевой кислоты с пищей, употребления продуктов, содержащих фолиевую кислоту. Запасы фолиевой кислоты имеются и в самом в организме – в печени, эритроцитах и лейкоцитах. Но количество фолиевой кислоты в этих органах невелико. Вследствие этого дефицит фолиевой кислоты может возникнуть уже через месяц после прекращения поступления фолиевой кислоты с продуктами питания. Уже через 4 месяца недостаток фолиевой кислоты приводит к развитию В12 – фолиеводефицитной анемии или мегалобластной анемии: развивается нарушение образования эритроцитов в костном мозге (так называемых мегалобластов). Это нарушение приводит к выходу в кровь гигантских незрелых эритроцитов и снижению гемоглобина в крови.
Кроме того, и для женщин, и для мужчин фолиевая кислота в недостаточном содержании – признак следующих серьезных нарушений:
• недостаточное питание;
• нарушение всасывания фолиевой кислоты (резекция желудка и кишечника);
• дефицит витамина В12;
• алкоголизм;
• лихорадка;
• гемолитическая анемия;
• злокачественные опухоли;
• гипертиреоз у детей;
• заболевания печени;
• анорексия.
Уровень фолиевой кислоты в сыворотке крови снижают медицинские препараты (аспирин, бисептол, противосудорожные средства, эстрогены, контрацептивы и др.). Повышение фолиевой кислоты происходит при вегетарианской диете, заболеваниях тонкого кишечника.
Беременность и фолиевая кислота. Дефицит фолиевой кислоты – самый распространенный гиповитаминоз среди беременных, новорожденных и детей раннего возраста. Причем недостаток фолиевой кислоты передается от матери к плоду или новорожденному ребенку вследствие недостаточного содержания фолиевой кислоты при беременности в организме матери и нехватке фолиевой кислоты в молоке.
Недостаточное поступление фолиевой кислоты во время беременности в организме матери может привести к различным негативным последствиям:
• выкидыш;
• частичная или полная отслойка плаценты;
• спонтанный аборт и рождение мертвого ребенка;
• врожденные пороки у плода;
• задержка умственного развития.
При недостатке фолиевой кислоты беременные сами женщины также расплачиваются различными недомоганиями:
• токсикоз;
• депрессия;
• боли в ногах;
• анемия.
Для успешного протекания беременности, сохранения здоровья матери и рождения здорового ребенка врачи назначают прием фолиевой кислоты в таблетках при планировании беременности и в течение срока вынашивания. Но принимать фолиевую кислоту нужно строго в соответствии с дозировкой, назначенной вам врачом. Передозировка фолиевой кислоты не менее опасна для здоровья, чем недостаток.
Показатели водно-солевого обмена
На долю воды приходится 60 % массы тела у мужчин и 52 % – у женщин. Водные растворы являются той средой, в которой протекают все без исключения биохимические реакции – как внутри клеток, так и во внеклеточном пространстве. Даже нерастворимые в воде вещества транспортируются в этой среде, вступая в комплексы с водорастворимыми белками. Биохимические растворы являются электролитами, в которых в виде ионов присутствуют как органические, так и неорганические вещества.
Нарушение концентрации ионов, в первую очередь натрия, калия, кальция, хлоридов и бикарбонатов, может привести к различным расстройствам обмена веществ, а в крайнем случае – даже к смерти.
Натрий (Na+)
Натрий (Na+) – основной катион внеклеточного пространства. Вместе с анионами хлора он обусловливает осмотическую активность плазмы крови и других биологических жидкостей.
Нормальная концентрация Na+ в крови здоровых людей колеблется в пределах 135–150 ммоль/л.
Повышение концентрации в крови Na+ (гипернатриемия) наблюдается при:
• ограничении приема воды;
• несахарном диабете;
• продолжительной рвоте и поносе без возмещения жидкости; недостатке калия;
• хронических заболеваниях почек;
• обильной потере воды через кожу, легкие.
Понижение концентрации в крови Na+ (гипонатриемия) наблюдается при:
• длительном применении диуретиков;
• частых поносах и рвоте;
• обширных ожогах;
• заболеваниях почек с потерей натрия;
• сахарном диабете;
• недостаточности коры надпочечников.
Калий (К+)
Калий (К+) – основной внутриклеточный катион, участвующий в поддержании осмотического давления, кислотно-основного равновесия, некоторых функций клеток, особенно нервных и мышечных. Концентрация К+ существенно влияет на работу сердечной мышцы.
Нормальная концентрация К+ в плазме – 3,60–5,40 ммоль/л. Снижение ее до уровня менее 3,50 ммоль/л (гипокалиемия) приводит к тяжелым нарушениям в организме: слабости мышц, вялым параличам, прекращению перистальтики кишечника, вздутию живота. Поддержание в норме концентрации К+ необходимо для обеспечения способности к возбудимости нервных и мышечных клеток.
Гипокалиемия наблюдается при:
• недостаточном поступлении с пищей;
• увеличении потерь при поносе, рвоте, применении калийистощающих мочегонных и стероидных препаратов;
• некоторых гормональных нарушениях;
• внутривенном введении больших количеств жидкости, не содержащей К+.
Гиперкалиемия наблюдается при:
• выраженной почечной недостаточности;
• ацидозе;
• неконтролируемом введении.
Кальций (Са2+)
Кальций (Са2+) – основной компонент костной ткани и зубов, участвует в свертывании крови, сокращении мышц, деятельности некоторых эндокринных желез. Всасывание и выведение кальция контролируют гормоны и активные метаболиты витамина D.
Около 50 % кальция плазмы находится в ионизированном виде, 45 % связано с альбумином и около 5 % – с комплексирующими ионами (фосфат, цитрат). Наибольшей физиологической активностью обладает ионизированный кальций.
В норме концентрация общего кальция в сыворотке (плазме) крови составляет 2,00–2,80 ммоль/л, ионизированного – 1,10–1,40 ммоль/л.
Увеличение концентрации кальция в крови (гиперкальциемия) наблюдается при:
• избыточном введении в организм ребенка витамина D;
• распаде клеток тканей при размягчении костей, обусловленном злокачественными образованиями;
• первичном гиперпаратиреоидизме;
• гипертиреозе;
• использовании заместительной гормонотерапии (ЗГТ); передозировке витаминов;
• хроническом энтерите.
Гипокальциемия наблюдается при:
• заболеваниях почек;
• снижении секреции в кровь гормона паращитовидной железы;
• уменьшении содержания альбумина в плазме;
• поносе;
• дефиците витамина D;
• рахите и спазмофилии;
• нарушении всасывания кальция в кишечнике;
• хронической недостаточности почек;
• циррозе печени;
• гиперплазии надпочечников;
• под влиянием противоэпилептической терапии.
Фосфор и фосфоросодержащие вещества
Фосфор – элемент, метаболизм которого напрямую связан с обменом кальция. Встречается главным образом в виде аниона РО43—. Принимает участие в обеспечении организма энергией. 80–85 % неорганического фосфора входит в состав скелета, остальное количество распределено между тканями и жидкостями организма. Фосфор принимает участие в образовании нуклеиновых кислот, нуклеотидов, фосфолипидов и других соединений. Концентрация неорганического фосфора ниже 0,30 ммоль/л ведет к нарушению энергетического обмена клеток.
В норме содержание неорганического фосфора в крови составляет 1–2 ммоль/л.
Гиперфосфатемия отмечается при:
• почечной недостаточности;
• передозировке витамина D;
• недостаточности паращитовидных желез;
• всех заболеваниях, связанных с кислородной недостаточностью.
Гипофосфатемия отмечается при:
• дефиците витамина D;
• нарушениях всасывания в кишечнике;
• рахите;
• гиперфункции паращитовидных желез.
Магний (Mg2+)
Магний (Mg2+) – второй по концентрации после калия внутриклеточный катион, входящий в состав ряда ферментов. 1/3 от всего количества магния, содержащегося в организме, находится в костях, зубах и мышцах. Магний поступает в организм с растительной пищей (хлорофилл) и мясными продуктами.
Нормальная концентрация магния в плазме – 0,65–1,10 ммоль/л.
Гипомагниемия наблюдается при:
• больших потерях воды;
• нарушениях всасывания в кишечнике;
• хроническом алкоголизме;
• беременности;
• хронической сердечной недостаточности;
• хроническом воспалении поджелудочной железы.
Недостаток магния приводит к нарушениям сердечной деятельности, повышенной возбудимости и судорогам.
Гипермагниемия наблюдается при:
• хронической почечной недостаточности;
• гипофункции щитовидной железы;
• распаде тканей.
Избыточное содержание магния может привести к вялости, сонливости, блокаде нервно-мышечной передачи.
Хлорид-ионы (Cl—)
Хлорид-ионы (Cl—) – главные внеклеточные анионы. Это основной вид анионов плазмы крови, уравновешивающий влияние катионов (в первую очередь натрия) во внеклеточной жидкости. Его содержание в крови зависит от уровня содержания карбонатов (ионов угольной кислоты): если повышается содержание карбоната, то уменьшается количество ионов хлора.
Показатели нормы содержания хлорид-ионов в плазме крови составляют 95,00–110,00 ммоль/л.
Гипохлоремия наблюдается при:
• избыточном потоотделении;
• рвоте;
• респираторном и метаболическом ацидозе;
• применении мочегонных препаратов;
• появлении отеков.
Гиперхлоремия считается признаком обезвоживания и наблюдается при:
• недостаточном поступлении жидкости;
• нарушении мочеотделения при заболеваниях почек или закупорке мочеточников;
• несахарном диабете;
• респираторном алкалозе;
• артериальной гипертензии;
• недостаточности коры надпочечников.
Железо
Железо относится к микроэлементам (т. е. к тем элементам, содержание которых в организме находится в пределах от нескольких миллиграммов до нескольких нанограммов). Несмотря на относительно малое количество, они заметно влияют на биохимические процессы и функции организма, т. к. входят в состав ферментов, комплексы белков и нуклеиновых кислот, являются катализаторами многих процессов.
Железо – постоянная составная часть гема в гемоглобине и окислительно-восстановительных ферментов в митохондриях клеток.
Лабораторными анализами определяется плазменное железо, которое в основном связано с тансферрином, ферртином и внеэритроцитарным гемоглобином.
В норме концентрация сывороточного железа у мужчин равна 14,30–25,10 мкмоль/л, у женщин – 10,70–21,50 мкмоль/л.
Снижение концентрации сывороточного железа (гипосидеремия) наблюдается при:
• железодефицитной анемии;
• острых инфекциях;
• гнойных заболеваниях;
• сепсисе;
• острых и хронических кровопотерях;
• беременности;
• нарушении всасывания железа в желудочно-кишечном тракте;
• дефиците витамина С.
Гиперсидеремия наблюдается при:
• усиленном гемолизе эритроцитов;
• некоторых видах малокровия (перницитозная анемия, талассемия);
• приеме препаратов железа;
• вирусном гепатите.
Показатели углеводного обмена
Глюкоза – основной представитель углеводов. Она является важнейшим энергетическим материалом и обеспечивает протекание в организме многих метаболических процессов. Уровень глюкозы в крови контролируется как нейроэндокринной системой, так и паренхиматозными органами (печенью, почками и др.).
Возможно, врач недавно огорчил вас неприятной новостью о том, что вы страдаете сахарным диабетом или что у вас повышен риск заболеть этой болезнью. Естественно, вы встревожены, вас начинает мучить страх и сразу возникают вопросы – как повлияет диабет на вашу жизнь? Придется ли вам до конца своих дней есть безвкусную, лишенную сахара пищу? Придется ли вам ежедневно делать себе инъекции инсулина? Грозит ли вам неминуемая ампутация? Убьет ли вас диабет?
Для большинства больных, страдающих сахарным диабетом, на все эти вопросы можно дать отрицательный ответ. Ученые разработали множество способов ранней диагностики сахарного диабета и способов держать заболевание под контролем. Пользуясь этими достижениями, вы сможете вести долгую счастливую жизнь, если будете придерживаться врачебных рекомендаций относительно диеты, физических нагрузок, мониторинга сахара крови и при необходимости схемы приема снижающих уровень сахара в крови лекарств.
В основном благодаря старению населения и увеличению числа граждан, страдающих избыточным весом, сахарный диабет стал одной из самых распространенных болезней в развитых странах. По мере старения человека и повышения его веса повышаются и ваши шансы заболеть сахарным диабетом. К сожалению, почти треть больных даже не догадываются об этом. Сахарный диабет может развиваться исподволь, в течение многих лет, не проявляя себя никакими явными симптомами.
Оставленный без лечения диабет может привести к поражению практически всех жизненно важных органов. Болезнь может оказаться смертельной. Именно поэтому надо начинать лечение диабета сразу же после установления диагноза. Изменение образа жизни и прием соответствующих лекарств позволит вам избежать или уменьшить риск развития опасных осложнений. Изменение образа жизни может предотвратить развитие явного сахарного диабета, если у вас повышен риск этой болезни.
Диабет – серьезная болезнь, но ее течение можно контролировать. Если вы примете посильное участие в этом контроле, то сможете, несмотря на болезнь, наслаждаться нормальной, здоровой жизнью.
Понимание того, как ваш организм использует сахар, поможет вам понять, что такое сахарный диабет и как он возникает.
Сахар, который называется глюкозой, поступает в кровь из двух источников – из пищи и из печени. В процессе пищеварения сахар всасывается в кровь из частичек съеденной пищи в желудке и в тонком кишечнике. Этот сахар необходим для поддержания энергетического баланса в отдельных клетках, из которых состоят мышцы и другие ткани. Однако для того, чтобы стать источником энергии, глюкоза нуждается в спутнике и помощнике, каковым является инсулин. Гормон инсулин поступает в кровь из мелких клеток в поджелудочной железе. Эти клетки называются бета-клетками. Они расположены отдельными скоплениями в толще ткани поджелудочной железы. Эти скопления называются островками. Когда вы едите, поджелудочная железа начинает вырабатывать инсулин, который и поступает в кровь. Циркулируя в крови, инсулин играет роль ключа, который отпирает для находящегося в крови сахара «двери» в клеточных мембранах, и глюкоза получает возможность поступать внутрь клеток. Обеспечивая поступление сахара в клетки, инсулин снижает его содержание в крови и предупреждает накопление в ней больших количеств глюкозы. Когда же концентрация глюкозы в крови падает, то уменьшается и секреция инсулина поджелудочной железой.
Наряду с этим печень является местом, где сахар хранится и вырабатывается. Когда в крови высок уровень инсулина, печень накапливает сахар на случай, когда клеткам в какой-то ситуации экстренно потребуется источник энергии. Когда уровень инсулина в крови низок, например, если вы долго не ели, то печень расщепляет запасы сахара (гликогена) до глюкозы и высвобождает ее в кровь, что позволяет поддерживать уровень сахара в ней в узком и безопасном диапазоне.
Помимо инсулина существуют и другие гормоны, участвующие в поддержании и регулировании уровня сахара в крови. Правда, эти так называемые контринсулярные гормоны обладают противоположным действием. В некоторых ситуациях такие гормоны, как глюкагон, адреналин, соматотропин и кортизол, противодействуют эффектам инсулина и препятствуют поступлению глюкозы в клетки. Под влиянием этих же гормонов печень выделяет глюкозу в кровь. Благодаря координированной и согласованной деятельности такой системы организм способен тонко регулировать содержание сахара в крови и поддерживать его уровень в нормальных границах.
У больных сахарным диабетом этот тонкий механизм регуляции разлаживается. Вместо того чтобы транспортироваться в клетки, глюкоза остается в крови, уровень сахара повышается, и глюкоза начинает выделяться из организма с мочой. В большинстве случаев такое положение складывается по одной из следующих причин: либо поджелудочная железа не способна вырабатывать инсулин, либо клетки не отвечают на воздействие инсулина.
На медицинской латыни сахарный диабет называют diabetes mellitus (mellitus – медовый, сладкий; прилагательное отражает повышение уровня сахара в крови и в моче).
Содержание сахара в крови
В норме содержание сахара в крови варьирует, но в весьма узких границах. Натощак уровень сахара в крови здорового человека равен 70–110 мг на 100 мл (мг%). В некоторых случаях уровень глюкозы выражают в ммоль/л, и тогда нормальными параметрами будут 4,1–5,9 ммоль/л. Такая концентрация, которая приблизительно соответствует одной чайной ложке сахара на 4 л воды, считается нормальной.
Для пересчета специалисты используют следующие коэффициенты:
• уровень глюкозы (мг%) × 0,0055 = уровень глюкозы (ммоль/л);
• уровень глюкозы (ммоль/л) × 18 = уровень глюкозы (мг%).
Если уровень сахара в вашей крови натощак постоянно равен 126 мг% или выше, то у вас диабет. Раньше диагноз сахарного диабета ставили, если уровень глюкозы крови достигал 140 мг% или выше. Но в 1997 г. ученые пришли к выводу, что при уровне 140 мг% у многих больных уже развиваются органные поражения, а значит, диабет надо лечить до развития его осложнений.
Если уровень сахара в вашей крови находится между 111 и 125 мг%, то вы страдаете нарушением толерантности к глюкозе, пограничным диабетом или предиабетом. Не следует легкомысленно относиться к предиабету. Его следует воспринимать столь же серьезно, как и истинный диабет, так как пограничный диабет означает, что вы находитесь на грани высокого риска заболеть клинически явным диабетом. Вам следует регулярно показываться врачу и принимать меры по контролю уровня сахара в крови.
Увеличение содержания глюкозы в крови (гипергликемия) наблюдается при:
• сахарном диабете;
• поражении ЦНС, вызванной травмой, опухолью головного мозга;
• тяжелых поражениях печени;
• активации щитовидной железы, гипофиза, надпочечников;
• заболеваниях поджелудочной железы;
• стрессах;
• ожогах;
• обильном приеме углеводов с пищей;
• после приема кофеина, адреналина, стрихнина, диуретина и др. препаратов;
• после диализа.
Физиологическое повышение содержания в крови углеводов после еды называется алиментарной гипергликемией. Уровень углеводов начинает расти через 10–15 мин. после еды, примерно через час достигает своего пика и возвращается к исходному или даже несколько меньшему значению через 2–2,5 часа. Кратковременная физическая нагрузка вызывает повышение концентрации глюкозы в крови, а длительная ее снижает.
Гипогликемия отмечается при:
• передозировке инсулина;
• голодании;
• гиперинсулинизме;
• инсулиноме;
• гормональной недостаточности щитовидной железы, гипофиза, надпочечников.
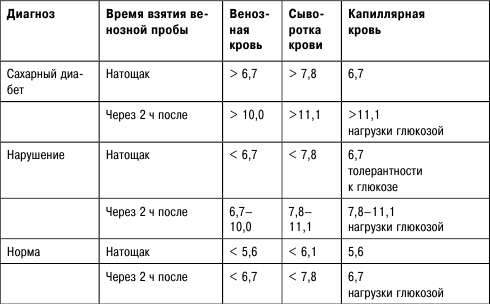
Когда концентрация глюкозы в цельной капиллярной (венозной) крови натощак превышает 7,8 ммоль/л или если при случайном определении она составляет 11,1 ммоль/л и больше, врач должен поставить диагноз сахарного диабета.
Если же диагноз не ясен, проводят тест на толерантность к глюкозе. Он заключается в следующем.
В течение трех суток обследуемый должен соблюдать привычную диету (не ограничивая себя нарочно в потреблении углеводов) и придерживаться обычного уровня физической активности (не заниматься тяжелым физическим трудом). Также во время проведения пробы нельзя ни курить, ни пить кофе. Тест следует отложить, если у пациента повышена температура.
Утром натощак у пациента берут кровь из пальца и определяют в ней концентрацию глюкозы. После этого ему предлагают выпить раствор, содержащий 75 г глюкозы в 200 мл теплой кипяченой воды или в 200 мл жидкого чая с лимоном. Глюкозу можно заменить сахаром.
Обследуемый должен выпить раствор с глюкозой не больше чем за 5 мин. Затем у него еще 2 раза берут из пальца кровь для определения уровня глюкозы: через 60 мин. и 120 мин.
Для детей сахарная проба проводится так же, только необходимо пересчитать количество глюкозы в соответствии с возрастом и весом тела. В возрасте от 1,5 до 3 лет следует давать глюкозу из расчета 2 г/кг массы тела; от 3 до 12 лет – 1,75 г/кг; после 12 лет – 1,25 г/кг, но не более 75 г.
Динамика изменения концентрации глюкозы в крови после нагрузки такова:
Таблица 8
Диагностический уровень концентрации глюкозы (ммоль/л)
Назад: Глава 5 Свойства сыворотки крови (серологический анализ)
Дальше: Глава 7 Растворенные в крови газы и кислотно-щелочное равновесие

