Изменение ландшафта
Катализаторы действуют посредством множества механизмов. Разобраться в этих механизмах помогает теория переходного состояния [4], доступно описывающая то, как катализаторы ускоряют реакции. Чтобы понять теорию переходного состояния, нужно посмотреть на проблему с другой стороны и подумать, зачем для ускорения реакций нужны катализаторы. Ответ прост: почти все химические вещества, окружающие нас, достаточно стабильны и инертны. Они не распадаются мгновенно, не вступают с другими веществами в быструю реакцию. К слову, если бы вещества именно так и поступали, их бы не было вокруг нас.
Причина стабильности привычных соединений заключается в следующем: их связи редко разрушаются вследствие неизбежного турбулентного перемещения молекул, которое всегда происходит в любом веществе. Наглядно это можно представить так: молекулы веществ, участвующие в реакции, должны преодолеть препятствия рельефа, а именно забраться на вершину холма, который находится между ними и превращением в конечный продукт (рис. 3.1). Энергию, необходимую для того, чтобы взобраться на склон этого «холма», молекулы получают в основном при нагревании. С повышением температуры атомы и молекулы начинают двигаться и совершать колебания быстрее. Подобная толкотня может разрушать химические связи между атомами в молекуле, а также способствовать созданию новых связей. Однако атомы более стабильных молекул (привычных для нашей среды) соединены достаточно крепкими связями, которые устойчивы к турбулентности окружающих молекул. Итак, химические соединения, окружающие нас, устойчивы благодаря тому, что их молекулы в основном стабильны, несмотря на их же активную толкотню.
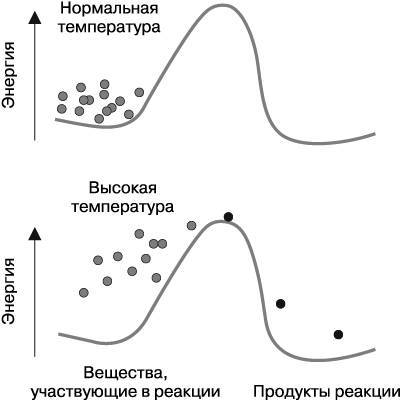
Рис. 3.1. Молекулы веществ, вступающих в реакцию (на рисунке – точки серого цвета), способны превратиться в молекулы продуктов реакции (на рисунке – точки черного цвета), но сперва они должны преодолеть энергетический «холм». При нормальной температуре молекулы не обладают достаточным количеством энергии для поднятия по склону этого «холма», однако чем выше температура, тем легче молекулы взбираются на его вершину
И все же даже стабильные молекулы разрушаются, если для разрыва связи между атомами достаточно энергии. Один из источников энергии, разрушающей молекулы, – дополнительная теплота, ускоряющая их движение. При нагревании химического соединения его внутримолекулярные связи в конце концов разрушаются. Вот почему нам так часто приходится готовить еду на плите: при нагревании ускоряются химические реакции, благодаря которым сырые ингредиенты (вещества, участвующие в реакции) превращаются в съедобные продукты.
Чтобы понять, как теплота ускоряет химические реакции, обратимся к удобному наглядному примеру. Представьте, что молекулы исходного соединения – это песчинки в левом сосуде песочных часов, лежащих на боку (рис. 3.2, а). Если оставить часы в состоянии покоя, никак на них не воздействуя, песчинки так и останутся лежать в левом сосуде до скончания веков, поскольку они не обладают достаточной энергией, чтобы преодолеть узкую горловину и попасть в правый сосуд, символизирующий конечный продукт реакции. Молекулы исходного вещества, участвующего в химической реакции, могут получить дополнительную энергию при нагревании. Они начинают двигаться и совершать колебания с более высокой скоростью, что позволяет некоторым из них превращаться в молекулы продукта реакции. Представим, будто кто-то хорошенько встряхнул наши песочные часы и некоторые молекулы-песчинки в результате попали из левого сосуда в правый, превратившись в молекулы продукта реакции (см. рис. 3.2, б).
Еще один способ превратить субстраты в продукты заключается в том, чтобы снизить энергетический барьер, который должны преодолеть молекулы исходного вещества. Именно этим и занимаются катализаторы. Они расширяют горловину песочных часов и позволяют песку из левого сосуда беспрепятственно и с минимальными усилиями проникать в правый сосуд (см. рис. 3.2, в). Таким образом, ход реакции значительно ускоряется благодаря способности катализатора менять форму энергетического ландшафта и таким образом позволять субстратам гораздо быстрее превращаться в продукты.

Рис. 3.2. Смена энергетического ландшафта: а) молекулы могут перейти из сосуда с исходным веществом в сосуд с продуктом реакции, однако им необходима дополнительная энергия для достижения переходного состояния (чтобы попасть в горловину часов); б) если приподнять левый сосуд часов, молекулы исходного вещества (субстрата) приходят в состояние с большей энергией по сравнению с продуктом, что позволяет им легко проникать в правый сосуд; в) ферменты стабилизируют переходное состояние, снижая энергетический барьер (расширяя горловину наших часов), упрощая превращение молекул субстрата в молекулы продукта реакции. На рисунке R (reactants) – вещества, участвующие в реакции; P (products) – продукты реакции
Поговорим подробнее о том, как это работает на молекулярном уровне. Для начала рассмотрим медленную реакцию, в ходе которой молекула коллагена расщепляется в отсутствие фермента коллагеназы (рис. 3.3). Как мы уже говорили, молекула коллагена представляет собой цепь из аминокислот, которые крепятся друг к другу посредством пептидной связи (на рисунке обозначена жирной линией), возникающей между атомами углерода и азота. Пептидная связь – лишь один из нескольких видов связей, благодаря которым атомы соединяются в молекулы. Она состоит из пары электронов, которую делят между собой атомы азота и углерода. Эти общие для двух атомов отрицательно заряженные электроны притягивают положительно заряженные ядра атомов с обеих сторон связи и представляют собой своего рода электронный клей, соединяющий атомы в пептидной связи.
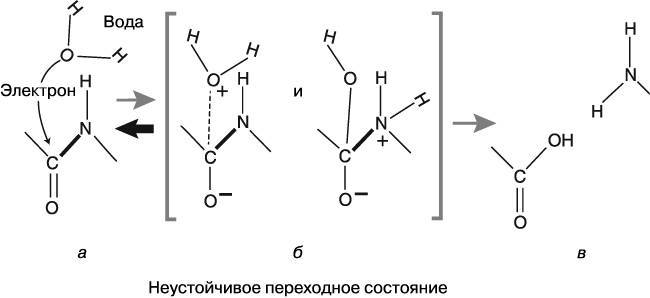
Рис. 3.3. Белки – например, коллаген (а) – состоят из цепочек аминокислот, в состав которых входят атомы углерода (С), азота (N), кислорода (О) и водорода (Н), связанные пептидными связями. Одна из этих связей обозначена на рисунке жирной линией. Взаимодействуя с водой (Н2О), пептидная связь может подвергаться гидролизу и разрушаться (в), однако реакция сначала должна пройти через неустойчивое переходное состояние, при котором возникают по крайней мере две различные структуры, способные превращаться друг в друга (б)
Пептидные связи весьма устойчивы. Чтобы разрушить их, разъединив общую электронную пару, требуется большое количество «энергии активации»: связь должна преодолеть очень высокий энергетический барьер (в нашей метафоре – холм), чтобы достичь горловины песочных часов, где начинается реакция. Обычно связь не разрушается сама по себе – ей в этом помогают находящиеся рядом молекулы воды, инициируя процесс гидролиза. Чтобы этот процесс начался, молекула воды должна весьма плотно приблизиться к пептидной связи и отдать один из своих электронов атому углерода, находящемуся в этой связи (на рис. 3.3 передача электрона обозначена пунктирной линией). Эта промежуточная стадия реакции называется переходным состоянием (отсюда теория переходного состояния). Она представляет собой неустойчивую вершину энергетического «холма», который связь должна преодолеть, чтобы разрушиться в горловине песочных часов. На рисунке видно, что электрон, полученный от молекулы воды, опустился вниз до атома кислорода, соседствующего с пептидной связью. Атом кислорода с дополнительным электроном получил отрицательный заряд. Соответственно молекула воды, отдавшая электрон, осталась в переходном состоянии с положительным зарядом.
В этом моменте ситуация усложняется. Давайте разбираться. Будем считать, что молекула воды (Н2О) положительно заряжена не потому, что потеряла один электрон, а потому, что теперь в ней есть голое ядро атома водорода – его протон, обозначенный знаком «+» на рисунке. Этот протон с положительным зарядом больше не имеет строго закрепленного за ним места внутри молекулы воды и становится делокализованным в квантово-механическом смысле (об этом мы говорили выше). Несмотря на то что этот протон почти все время остается внутри своей молекулы воды (см. рис. 3.3, б, схема слева), иногда он оказывается немного дальше, ближе к атому азота (см. рис. 3.3, в, схема справа) на другом конце пептидной связи. В таком положении наш блуждающий протон способен притянуть к себе один из электронов, образующих пептидную связь, и, таким образом, разрушить ее.
Подобное происходит нечасто. Дело в том, что переходные состояния (как, например, то, которое мы изобразили на рис. 3.3, б) очень кратковременны. Они настолько неустойчивы, что разрушаются легчайшим «толчком». Например, отрицательно заряженный электрон, который отдает молекула воды, легко возвращается назад и исходные вещества принимают прежнюю форму (на рисунке это показано жирной стрелкой). Такой сценарий гораздо более вероятен, чем реакция, в результате которой разрушается пептидная связь. Обычно пептидные связи не разрушаются. Так, в нейтральных растворах (не в кислых и не в щелочных) пептидная связь белка разрушится лишь наполовину более чем за 500 лет (этот временной отрезок называют периодом полупротекания реакции).
Разумеется, все описанное выше происходит именно так в отсутствие ферментов. Теперь нам предстоит узнать, как фермент способствует ускорению процесса гидролиза. Согласно теории переходного состояния, катализаторы ускоряют химические процессы (в том числе разрушение пептидной связи), делая переходное состояние более устойчивым и тем самым повышая вероятность формирования исходных продуктов. Катализаторы действуют различными способами. Например, положительно заряженный атом металла, находящийся вблизи связи, способен нейтрализовать отрицательно заряженный атом кислорода в переходном состоянии, стабилизируя его (в этом случае атом кислорода не будет спешить расставаться с электроном, полученным от молекулы воды). Придавая переходным состояниям устойчивость, катализаторы ускоряют реакцию, выполняя функцию расширения горловины песочных часов, в которых, как мы с вами представляли, данная реакция протекает.
Теперь пришло время выяснить, способна ли теория переходного состояния в рамках предложенной аналогии с песочными часами объяснить то, как ферменты ускоряют все остальные реакции, необходимые для поддержания жизни.

