Глава 10. Мир внутри мира
В природе существует семь базовых форм кристаллов, окрашенных во множество разных оттенков. Формы всегда привлекали людей – и как фигуры в пространстве, и как характеристики материи. Древние греки полагали, что природные элементы были сформированы как правильные геометрические тела. И сейчас нам известно, что форма кристалла может рассказать кое-что об атомах, которые его составляют; они помогают классифицировать атомы по типам. Таков мир физики нашего века, а окно в него приоткрыли кристаллы.
Из всего многообразия кристаллов самым скромным на вид считается простой бесцветный хрусталик поваренной соли. Но он же остается одним из важнейших. В течение тысячи лет добывают соль в соляной шахте Величка, расположенной возле Кракова, древней столицы Польши. Здесь с XVII века сохранились деревянные стены шахт, машины и механизмы, работавшие на лошадиной тяге. Возможно, здесь бывал алхимик Парацельс во время своих восточных странствий. Он круто изменил направление алхимии, объявив в начале XVI века, что среди элементов, составляющих человека и природу, есть соль. Она необходима для жизни, поэтому всегда имела символическое значение во всех мировых культурах. Древнеримские воины получали за службу «соленые деньги» (salt money), отсюда произошло слово salary (зарплата). Во многих романо-германских языках устаревшее и современное названия жалованья остались однокоренными словами, потому что под словом «соль» наши предки подразумевали деньги. На Ближнем Востоке до сих пор скрепляют сделку солью, по «завету соли» в Ветхом Завете.
В одном Парацельс ошибался: соль не является химическим элементом в современном смысле. Она состоит из двух элементов – натрия и хлора. Само по себе достаточно примечательно, что обычную соль составляют шипучий и желтоватый ядовитый газ. Натрий относится к щелочным металлам, хлор – к активным галогенам. Кристаллы соли всегда остаются квадратными и прозрачными, даже если мы заменим элемент одной группы на другой. Например, натрий можно заменить калием: получится хлорид калия. Аналогично, в другой группе, вместо хлора можно взять бром: получится бромид натрия. Даже если произвести двойное изменение (вместо натрия взять литий, вместо хлора – фтор, получив фторид лития), все равно кристаллы на вид будет невозможно отличить.
Почему родственные элементы проявляют сходные химические свойства? В 1860-х годах все ломали голову над этим вопросом, и несколько ученых пришли к одинаковым выводам. Эту задачу решил Дмитрий Иванович Менделеев, который посещал упомянутую нами соляную шахту Величка в 1859 году. К тому времени ему исполнилось двадцать пять лет. Скромный, бедный, очень трудолюбивый и необыкновенно одаренный молодой человек, Менделеев происходил из многодетной семьи и был самым младшим из четырнадцати детей. Его рано овдовевшая мать, беззаветно любившая своего сына, отдала все свои силы и здоровье на то, чтобы он мог учиться и реализовать в науке свои блестящие задатки.
Однако Менделеева отличала не только гениальность, но и страсть к химическим элементам. Они стали его друзьями, ученый знал каждую причуду, каждую особенность поведения любого из них. Элементы отличались по одному базовому свойству, а именно атомному весу, который был открыт Джоном Дальтоном в 1805 году. Как свойства, которые отвечали за их одинаковость или разность, могут вытекать из одной заданной константы? Этот вопрос стал основной проблемой, над решением которой он старательно бился на протяжении долгих лет. Он изготовил карточки – по числу открытых элементов – и пытался понять, как их лучше разложить. Друзья Менделеева называли эту игру «Терпение».
Менделеев написал на карточках названия химических элементов и указал атомный вес каждого из них. Затем раскладывал их в вертикальные колонки, группируя в порядке увеличения атомной массы. С самым легким элементом – водородом – он не знал, что делать, и отложил карточку в сторону. Следующим шел гелий. К счастью, во времена Менделеева он еще не был открыт, иначе гелию пришлось бы стать индивидуалистом.
Менделеев начал свою первую колонку с лития – самого легкого после водорода, за ним ученый поставил бериллий, потом бор, углерод, азот, кислород и завершил столбик фтором. Следующим по массе шел натрий, и поскольку он походил на литий, Менделеев решил начать заново и сформировать вторую колонку рядом с первой. В ту же колонку Менделеев поместил магний, алюминий, кремний, фосфор, серу и хлор. Она содержала, так же как и в первом случае, семь элементов, а хлор примыкал к фтору.
Очевидно, в последовательности атомных масс прослеживалась какая-то система. Он продолжил раскладывать карточки, ориентируясь на атомные массы. После хлора шел калий, затем кальций. Таким образом, первый ряд включал литий, натрий и калий – все щелочные металлы; а второй ряд – бериллий, магний и кальций – металлы, также обладающие сходными свойствами. То есть горизонтальные ряды были небессмыслен ны: они составляли группы. Менделеев подобрал математический ключ к классификации химических элементов. Если классифицировать элементы по атомному весу, отсчитать семь ячеек для вертикальной колонки и начать заново, то в горизонтальных рядах мы получим элементы, принадлежащие к одному классу.

Менделеева отличала не только гениальность, но и страсть к химическим элементам.
Дмитрий Иванович Менделеев
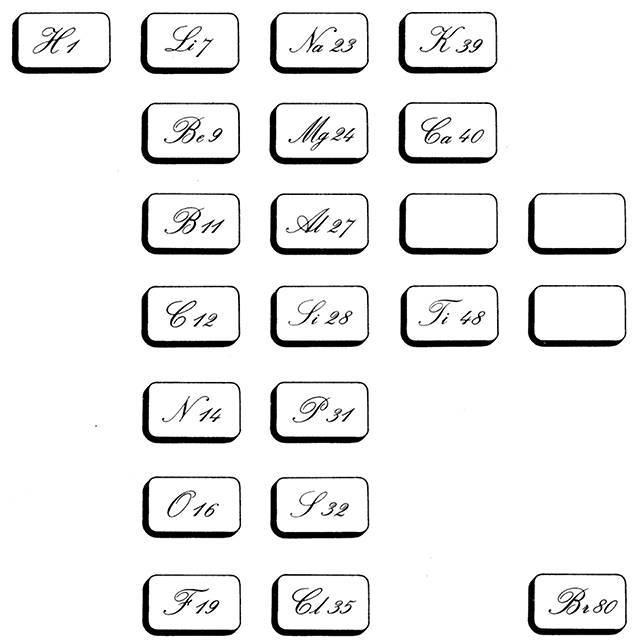
Карточки для игры «Терпение», придуманной Менделеевым. Они разложены в порядке увеличения их атомной массы; элементы образуют группы
До сих пор мы можем следовать схеме Менделеева без помех, как он и придумал ее в 1871 году, два года спустя после первого наброска. Ничего не сбивается, пока мы не доходим до третьей колонки, – и тут мы неизбежно сталкиваемся с первой проблемой. Почему неизбежно? Как вы видели на примере гелия, Менделееву не были известны все элементы. К тому времени было открыто только 63 химических элемента из 92, которые знаем мы сегодня. Первый пробел образовался в третьей ячейке третьей колонки.
Я сказал, что Менделеев наткнулся на пробел, но на самом деле это слово свидетельствует о гениальности его размышлений. На третьей ячейке третьей колонки Менделеев столкнулся с трудностью и решил ее, интерпретировав как пробел. Он сделал так, потому что титан (следующий по атомной массе химический элемент) не обладает химическими свойствами и характеристиками бора и алюминия, с которыми он должен был бы встать в один ряд. Менделеев записал в дневнике: «После кальция перед титаном я оставил пробел, потому что элемент, который должен занять это место, пока еще не открыт. Титан же я поместил в одну группу с углеродом и кремнием».
Идея отсутствующих элементов была продиктована научным вдохновением. Эти было практической реализацией того, что Фрэнсис Бэкон в общих словах сформулировал давным-давно: убеждения, что новые законы природы могут быть выведены или угаданы на основании старых. Догадка Менделеева продемонстрировала, что индукция в руках ученого – более тонкий инструмент, чем предполагали Бэкон и другие философы. В науке мы не можем продвигаться строго линейно от известных случаев к неизвестным. Скорее, мы разгадываем кроссворд: есть данные по горизонтальным осям и вертикальным, в отдельных точках они пересекаются, давая подсказки. Менделеев исследовал упорядоченные по атомной массе элементы в колонках и их сходство в рядах, чтобы увидеть пробелы в пересечениях. Он сделал практические предсказания и показал, как ученые на самом деле пользуются индукцией.
Очень хорошо: наибольший интерес представляют пустые ячейки в третьей и четвертой колонке. Я не стану продолжать рассказ о том, как строилась система, ограничусь замечанием, что если учесть промежутки и пойти вниз, то колонка оканчивается где и должна – бромом из группы галогенов. Из всех пропусков Менделеев выделил три. Первый располагался в третьей строке третьей колонки, второй и третий – в третьем и четвертом ряду четвертой колонки. Менделеев предсказал, что в скором времени на месте этих пробелов будут вписаны химические элементы с теми же свойствами, которыми обладают классы веществ в третьем и четвертом горизонтальных рядах.

Последовательность атомных масс не случайна, а систематична.
Ранний набросок Периодической системы химических элементов Менделеева, 1869 год
Самый известный из прогнозов Менделеева и последний из подтвержденных был третий, который он назвал «эка-кремний». Он описал свойства этого странного и очень важного вещества с огромной точностью за двадцать лет до его открытия в Германии. Но новый химический элемент не получил названия, предложенного Менделеевым, его стали именовать германием. Менделеев определил, что «эка-кремний будет иметь свойства, промежуточные между кремнием и оловом», что его атомная масса будет в 5,5 раза больше, чем у воды (и оказался прав!), а его оксид будет в 4,7 раза тяжелее воды (и опять же не ошибся!). Менделеев очень точно описал и другие химические свойства металла.
Предсказания Менделеева сделали его известным во всем мире, но не в России, потому что царь не одобрял его либеральных взглядов. Англичане открыли целый ряд новых элементов – гелий, неон, аргон, что упрочило его авторитет. Однако в Российскую академию наук его так и не приняли, хотя во всем мире его имя было широко известно.
Но давайте пройдем дальше. Мы установили, что классифицировать атомы можно по числу. Но все-таки не могло быть так, чтобы все свойства элемента выводились из одной цифры, его атомной массы, которая скрывает – что? Масса атома может служить мерой его сложности. А если это так, то она должна скрывать некую внутреннюю структуру, которая придает ему физическую форму и определяет его химические свойства. Конечно, такая идея была немыслима во времена, когда атом считался неделимым.
Переломный момент наступил в 1897 году, когда Джозеф Джон Томсон из Кембриджа открыл электрон. Да, у атома есть составные части, он не неделим, на что намекает перевод его названия с греческого. Электрон – малая толика его массы, вполне реальная, несущая электрический заряд. Значит, каждый элемент имеет еще одну характеристику – число электронов в атоме. И их количество в точности равно номеру позиции, которую элемент занимает в таблице Менделеева, если учесть, что водород и гелий расположены под номерами один и два. Таким образом, у лития три электрона, у бериллия – четыре и т. д. Таким образом, каждый элемент получил атомный номер, который соответствует его месту в таблице Менделеева. Внимание сместилось с атомной массы на атомный номер, а следовательно, что важно, – на атомную структуру.
С этого интеллектуального прорыва начинается современная физика и ее серьезные, «взрослые» открытия. Физика становится грандиозным коллективным трудом в науке и даже шире – грандиозным коллективным трудом в искусстве XX века.
Идея о том, что у атома есть структура – целый мир, захватила воображение художников сразу. Это видно по работам, которые начали создавать живописцы с первых же годов XX века. Например, серии полотен Умберто Боччони «Силы улицы» или картина «Динамизм велосипедиста». Современное искусство зарождалось одновременно с современной физикой, поскольку берет начало в тех же идеях.
Со времен публикации Ньютоном «Оптики» художников завораживали цветные поверхности вещей. В XX веке все изменилось. Как рентгеновский аппарат, художник смотрел на кость, скрытую плотью, и другие структуры, которые изнутри определяют общую форму предмета или тела. Такие художники, как Хуан Грис, занимались анализом структуры. Вспомните природные формы в его «Натюрморте» или человеческие формы в «Пьеро».
Художники-кубисты были без ума от кристаллов. Жорж Брак, например, воплощает в их формах селение на склоне горы в пейзаже «Дома в Эстаке», Пабло Пикассо использует этот прием для изображения женских фигур в групповом портрете «Авиньонские девицы». Начинался кубизм со знаменитого холста Пикассо «Портрет Даниэля-Генри Конвейлера». Художник отказался от традиционного изображения лица в пользу геометрии: голова натурщика разобрана на математические элементы, затем собрана, как реконструкция, сотворена заново.
Поиск скрытой структуры манил живописцев Северной Европы. Франц Марк, например, выполнил в этой манере пейзаж «Олень в лесу». Полотно художника Жана Метценже «Женщина на лошади», любимого многими учеными, купил Нильс Бор. Он был известным коллекционером живописных работ и хранил их в своем доме в Копенгагене.
Есть два четких различия между произведением искусства и научной работой. Во-первых, художник разбивает мир на фрагменты, а затем собирает их на одном холсте. Во-вторых, в процессе работы вы можете наблюдать за его мыслью. (Например, Жорж Сёра написал «Портрет молодой женщины с пуховкой» и «Ле Бек-дю-Хок. Грандкамп», ставя одну цветную точку рядом с другой – и так до тех пор, пока не возникла картина.) Ни то ни другое не применимо к научной работе. Она зачастую носит строгий аналитический характер, и процесс мышления скрыт за обезличенными формулировками.
В качестве темы для беседы я избрал Нильса Бора – одного из отцов-основателей физики XX века, поскольку в обоих отношениях он был великим художником. У него никогда не было готовых ответов. Даже лекции он начинал со слов: «Каждое предложение, которое я произношу, следует рассматривать как вопрос, а не как категорическое утверждение». Первое, что он поставил под вопрос, – строение Вселенной. И все, кто работал с ним, – начинающие и опытные исследователи – раскладывали мир на части, анализировали и заново собирали.
Начинал Нильс Бор вместе со своим однокурсником Эрнестом Резерфордом в 1910-х годах в лаборатории Томсона, выдающегося экспериментального физика. (Томсон и Резерфорд занялись наукой, следуя воле своих овдовевших матерей, впрочем, как и Менделеев). Резерфорд стал впоследствии профессором Манчестерского университета. А в 1911 году он предложил новую модель атома. Он утверждал, что основная масса атома находится в тяжелом ядре в центре, вокруг которого по орбитам кружатся электроны, как планеты вокруг Солнца. Безусловно, блестящая концепция! И какая ирония: спустя три столетия возмутительные идеи Коперника, Галилея и Ньютона вошли в научный оборот как нечто совершенно очевидное и естественное. Такое нередко бывает с гипотезами, которые опережают свое время.
Тем не менее не все с моделью Резерфорда было гладко. Если атом представляет собой маленький механизм, что обеспечивает движение в нем? Это что, маленький вечный двигатель, единственный, которым мы располагаем? Планеты, двигаясь по орбитам, постоянно теряют энергию. Следовательно, их орбиты становятся с каждым годом немного меньше, а со временем эти небесные тела непременно упадут на Солнце. Если электроны двигались бы так же, как планеты, то падали бы на ядро. Либо что-то должно предохранять их от постоянной потери энергии. Должен быть какой-то физический закон, который ограничивал бы потерю электроном энергии определенной величиной.
Этот закон Нильс Бор обнаружил в работе Макса Планка, опубликованной в Германии в 1900 году. Планк показал, что в мире, в котором материя состоит из кусочков, энергия тоже должна быть кусочками, или квантами. Сегодня это не кажется таким уж странным, но в начале XX века идея Планка была революционной. Он это отлично осознавал, поэтому однажды, как обычно отправившись с сыном на прогулку, которую академики всего мира совершают после обеда, он сказал ему: «Я совершил революционное открытие, равное по значимости идеям Ньютона». И это было именно так.
В настоящее время задача, которую решил Нильс Бор, кажется нам очень легкой: с одной стороны, он имел модель атома, описанную Резерфордом, с другой – квант, открытый Планком. Что же замечательного в том, что в 1913 году он, будучи двадцатисемилетним молодым человеком, сумел составить современное представление о структуре атома? Ничего, кроме великолепного процесса мышления, великолепной и удачной попытки синтеза. И идеи поискать доказательство в том единственном месте, где оно может быть: в спектре, где поведение атома становится наблюдаемым для нас.
Чудесная, волшебная идея Бора! Внутрь атома мы заглянуть не можем, но есть окно, целый витраж: спектр атома. Каждый элемент имеет собственный спектр, но не непрерывный, как спектр белого света в опыте Ньютона. Спектр имеет некое число ярких линий, которые характеризуют конкретный элемент. Например, у водорода три достаточно яркие линии в видимом спектре: красная, сине-зеленая и синяя. Бор считал, что эти линии – след высвобождения энергии, которая образуется, когда электрон перескакивает с одной из внешних орбит на внутреннюю.
Пока электрон в атоме водорода остается на одной орбите, он энергии не излучает. Каждый раз, когда он перемещается с внешней орбиты на внутреннюю, разность энергий орбит создает квант света. Эти кванты, испускаемые миллиардами атомов одновременно, мы видим как характерную для водорода линию. Красная линия в спектре водорода означает, что поток электронов перескакивает с третьей орбиты на вторую, сине-зеленая черта демонстрирует, что происходит переход с четвертой орбиты на вторую.
Работа Нильса Бора «О строении атомов и молекул» сразу стала классической. Структура атома обрела математическое толкование, как некогда Вселенная Ньютона, и включала квант в качестве дополнительного принципа. Ученый построил мир внутри атома, расширив законы физики, которые выстояли два века после Ньютона. Его возвращение в Копенгаген было триумфальным. Отныне этот город станет постоянным местом его работы. В 1920 году благодарные земляки построят институт, которому присвоят имя Нильса Бора. Сюда, в это солидное научное учреждение, будут съезжаться молодые ученые из Европы, Америки, Дальнего Востока, чтобы обсудить проблемы квантовой физики. В институт часто приезжал из Германии Вернер Гейзенберг. Здесь при поддержке Бора и его учеников он разработал свои самые интересные идеи. По-другому и быть не могло – Нильс Бор не позволил бы никому остановиться на полпути.
Интересно проследить этапы подтверждения боровской модели атома, поскольку они воспроизводят жизненный цикл любой научной теории. Сначала она существует только на бумаге. Для подтверждения модели берутся известные данные. Конкретно, показывается, что у спектра водорода есть линии, давно известные, расположения которых соответствуют квантовым переходам электрона с одной орбиты на другую.
Следующий этап исследований – расширенное подтверждение нового феномена. В нашем случае это линии в высокоэнергетической рентгеновской области, невидимой глазу, но образуемой таким же образом электронными скачками. Этой работой занималась в 1913 году лаборатория Резерфорда и достигла прекрасных результатов, подтвердив все предсказанное Бором. Эксперимент проводил Гарри Мозли, двадцатисемилетний очень одаренный физик, к великому сожалению, не смог сделать в науке ничего, потому что в 1914 году был призван в армию и трагически погиб в 1915 году в ходе тяжелых боев на полуострове Галлиполи (Турция). Дарданелльская операция стоила жизни многим молодым людям, например поэту Руперту Бруку. Работа Мозли, как и Менделеева, предполагала отсутствие некоторых элементов, и один из них был открыт в лаборатории Бора и назван гафнием, по латинскому названию Копенгагена. Бор объявил о своем открытии в нобелевской речи в 1922 году. Тема его выступления знаменательна, потому что в ней Бор в деталях описал то, что почти поэтически изложил в другом выступлении, а именно как понятие кванта
постепенно привело к систематической классификации видов стационарных связей электронов внутри атома, предлагая полное объяснение особенных отношений между физическими и химическими свойствами элементов, нашедших выражение в знаменитой периодической таблице Менделеева. Такая интерпретация свойств материи реализует и даже превосходит мечты пифагорейцев, создавших древний идеал сокращенной формулировки законов природы, изложенной в простых числах.
И как раз в момент, когда кажется, что все складывается как нельзя лучше, теория Бора, впрочем, как любая другая идея, достигает своих границ возможного. Она начинает чахнуть, испытывая своего рода ревматические боли. Затем вдруг приходит осознание того, что структура атома так и осталась для нас загадкой. Мы только разбили скорлупу. Но внутри есть яйцо с желтком (ядром), и мы совсем ничего о нем не знаем.
Нильс Бор был человеком, знавшим толк в созерцании и наслаждении. Полученную Нобелевскую премию он потратил на покупку дома в сельской местности. Его любовь к искусствам распространялась и на поэзию. Он говорил Гейзенбергу: «Когда дело доходит до атомов, надо переходить на язык поэзии. Поэта не волнуют описания фактов, он озабочен только созданием образа». Весьма неожиданная мысль, хотя верная: когда речь идет о невидимой материи (например, об атоме) в буквальном смысле, начинается игра образов. Иного способа поговорить о невидимом не придумано ни в природе, ни в искусстве, ни в науке.
Шагнув в мир атомов, мы оказываемся там, где наши органы чувств неприменимы. Мы можем только пытаться представить себе строение этого мира по аналогии с чем-то нам уже известным, пустив в ход воображение. Воображение опирается на личный опыт, который человек получает через органы чувств от внешнего материального и реального мира, потому что наши слова описывают только этот мир. Все остальное – невидимое – мы можем описать метафорами, сравнениями и другими фигурами речи.
После того как мы узнали, что атомы не являются конечными, неделимыми строительными блоками материи, мы можем только попытаться выстроить модели того, как эти блоки связаны между собой и как они действуют сообща. Модели призваны показать нам на аналогии, каково строение материи. Тестируя модели, мы разбираем материю на части, как будто раскалываем бриллиант, чтобы увидеть структуру кристалла.
Восхождение человека – это с каждым шагом все более богатый синтез, но каждый шаг – это попытка анализа: глубокого анализа, мира внутри мира. Когда выяснилось, что атом делим, появилось предположение, что он должен иметь неделимый центр, ядро. Потом, в 1930-х годах, модель стала нуждаться в новом уточнении, поскольку оказалось, что и ядро нельзя считать неделимой частицей реальности.
В сумерках, на шестой день Творения, согласно древнееврейским толкованиям Ветхого Завета, Бог дал человеку все необходимые для творчества инструменты. Будь создавшие те толкования мудрецы живы сегодня, они бы написали, что Бог создал нейтрон. Вот оно, в Оук-Ридже штата Теннесси – синее свечение, представляющее собой след от нейтронов: видимый палец Бога, касающегося Адама на картине Микеланджело – не дыханием, а энергией.
Однако ни к чему начинать историю с таких древних времен. Переместимся в 1930-й год. Ядро атома тогда казалось непоколебимым, каким когда-то казался и атом. Проблема заключалась в том, что его невозможно разложить: нужного количества частей не получается. Ядро несет положительный заряд (в противовес отрицательно заряженным электронам), равный атомному номеру. Но масса ядра по-разному соотносится с зарядом. Например, для самого легкого элемента (водорода) они равны, но в тяжелых элементах масса может превосходить заряд в два раза. Это было необъяснимо до тех пор, пока ученые не отказались от идеи, что все дело в электричестве.
Это глубоко укоренившееся представление разрушил Джеймс Чедвик, который в 1932 году доказал, что ядро состоит из частиц двух типов – протонов (положительно заряженных) и нейтронов (нейтральных). У всех химических элементов (за исключением водорода) обе частицы практически равны по массе. У водорода самое простое ядро – оно состоит из одного протона.
Нейтрон – новый вид исследования, своего рода пламя алхимика, потому что, не имея никакого электрического заряда, он, будучи запущен в ядра атомов без электрического возмущения, изменяет их. Современным алхимиком, который сумел воспользоваться этим новым инструментом, стал Энрико Ферми из Рима.
Энрико Ферми был весьма странной фигурой. Я в те поры не встречался с ним, потому что в 1934 году Рим находился под властью Муссолини, Берлин попал в руки Гитлера, и мне как еврею поездка в эти города была тогда категорически противопоказана. После войны мы с Ферми пересеклись в Нью-Йорке. Тогда он поразил меня глубоким и тонким умом. Пожалуй, я могу назвать его умнейшим из всех людей, с которыми мне довелось встречаться, разве что за одним исключением. Он был некрупным человеком невысокого роста, но атлетического телосложения, с энергичными и резкими движениями. Решения всегда принимал очень четкие и правильные, уверенно действуя так, словно видел все вещи досконально.
Итак, Ферми начал облучать элементы нейтронами и приступил к изучению нейтронов, содержащихся в ядре каждого элемента, и миф о трансмутации в его руках начал сбываться. Ферми замедлил движение нейронов водой и создал ядерный реактор. Произошло это в городе Оук-Ридж, штат Теннесси.
Трансмутация была многовековой мечтой человечества. Меня, человека с теоретическим складом ума, больше всего поразили 1930-е годы, когда стала проясняться эволюция природы. Поясню свою мысль подробнее. Я начал с Сотворения мира, вернемся же к нему. Согласно теологическим толкованиям архиепископа Джеймса Ашера из Арма, сделанным в 1650 году, Вселенная была создана в 4004 году до н. э. Находясь в плену догм и невежества, архиепископ ни в коем случае не допускал опровержения этой даты. Он, а вслед за ним и другие клирики называли точно год, число, день недели и даже час, которые я, к счастью, забыл. Но вопрос о возрасте нашего мира оставался, и оставался парадокс, вплоть до 1900-х годов, потому что было ясно, что Земле много, много миллионов лет, но невозможно было понять, откуда в Солнце и в звездах взялось столько энергии, чтобы они смогли существовать так долго. Конечно, у человечества уже были уравнения Эйнштейна, из которых следовало, что потеря вещества производит энергию. Но как преобразуется материя?
Итак, дверь в понимание того, в чем заключается суть энергии, нам приоткрыл Чедвик. В 1939 году Ханс Бете, работавший в Корнельском университете, впервые точно описал процесс превращения водорода в гелий в недрах Солнца, при котором потеря массы стремится к нам как щедрый энергетический дар. Я так страстно и горячо рассказываю, потому что для меня это не просто воспоминания, а важное событие. Объяснения Бете я помню так же ярко, как день собственной свадьбы, а последовавшие за открытием американского физика шаги – как рождение своих детей. Ведь впоследствии обнаружилось (и, как я полагаю, было окончательно доказано в 1957 году), что в звездах происходят процессы, при которых атомы становятся все более и более комплексными структурами. Материя эволюционирует. Само слово «эволюция» связано с Дарвином и биологией, но именно оно изменило физику в современное мне время.
Первый шаг эволюции элементов происходит в молодых звездах, таких как Солнце. Водород превращается в гелий, и этот процесс требует очень высоких температур; то, что мы видим на поверхности Солнца, – это только бури, вызванные им. (Гелий был впервые идентифицирован по спектральной линии во время солнечного затмения в 1868 году, вот почему он был назван гелием, ведь тогда он не был найден на Земле.) Итак, время от времени два ядра тяжелого водорода сталкиваются, сливаются и образуют ядро гелия.
Со временем Солнце будет состоять практически из одного гелия, тогда оно станет более горячей звездой, в которой ядра гелия будут образовывать тяжелые атомы. Углерод, например, образуется в звезде, когда три свободных ядра гелия сталкиваются в одной точке в течение менее чем одной миллионной доли миллисекунды. Каждый атом углерода в живом существе – результат такого невероятного столкновения. Помимо углерода образуется кислород, кремний, сера и другие, еще более тяжелые элементы. Наиболее стабильные элементы расположены в середине таблицы Менделеева – между железом и серебром, грубо говоря. Однако процесс построения новых элементов огибает эту группу и продолжается за ее пределами.
Если элементы образуются постепенно один за другим, то почему природа остановилась? Почему мы обнаружили только 92 элемента, последний из которых уран? Чтобы ответить на этот вопрос, мы должны создать элементы за пределами таблицы и подтвердить, что по мере того, как элементы становятся больше, они усложняются и склонны распадаться. Но создавая их, мы должны понимать, что создаем что-то потенциально взрывоопасное. Плутоний, который Ферми получил в историческом графитовом реакторе X-10, стал рукотворным элементом, который продемонстрировал это миру в полной мере. Я думаю, что до некоторой степени он является данью богу Плутону, владыке подземного мира, который дал свое имя элементу, из-за которого сорок тысяч людей умерло в Нагасаки. Снова в истории человечества одновременно увековечены и великий человек, и множество усопших.
Я должен вновь вспомнить шахту Величку, чтобы разъяснить одно историческое противоречие. Элементы постоянно образуются в звездах, и все же мы привыкли думать, что Вселенная когда-то закончится. Почему? Или каким образом? Мы исходим из наблюдения за работой машин: механизмы всегда потребляют энергии больше, чем производят. Часть теряется при трении, другая уходит из-за износа. В некоторых более сложных машинах, чем древние деревянные кабестаны Велички, энергия теряется в амортизационном устройстве или радиаторе. Одним словом, есть множество причин, по которым она ослабевает. В этом случае мы безвозвратно теряем огромный объем энергии, расходуя на полезную работу только малую ее часть. И существует еще океан энергии, который для нас в этот момент недоступен.

Первый графитовый реактор.
Экспериментальный графитовый реактор, разработанный группой под руководством Энрико Ферми, приступившей к выполнению проекта 2 декабря 1942 года на площадке для игры в сквош под футбольным стадионом Университета Чикаго
В 1850 году Рудольф Клаузиус отразил эту мысль в основном законе. Он заявил, что есть энергия, которую мы используем, и есть ее остаток, который для нас недоступен. Последний он назвал энтропией и сформулировал знаменитый второй закон термодинамики: энтропия всегда возрастает. Во Вселенной тепло утекает в своего рода озеро, недоступное для нас.
Это была хорошая идея для науки второй половины XIX века, когда тепло считалось жидкостью. Однако оно не материал. По сути, тепло представляет собой случайное движение атомов. Эту простую истину установил австрийский физик Людвиг Больцман. Он дал блестящую новую интерпретацию того, что происходит в машине, в паровом двигателе и во Вселенной.
Когда энергия ослабевает, атомы приходят в более беспорядочное состояние. А энтропия – это мера хаоса: очень глубокий вывод, следующий из новой интерпретации Больцмана. Странно, что у хаоса может быть «мера», но это вероятность конкретного состояния, определенная как количество способов, которым оно может быть собрано из атомов. Больцман выразил это в формуле:
S = K ln W,
где S – энтропия, которая должна быть пропорциональна логарифму W – вероятность заданного состояния (K – коэффициент пропорциональности, который теперь называется постоянной Больцмана).
Конечно, хаотичные состояния более вероятны, чем упорядоченные, так как почти каждая совокупность атомов будет случайной; так что, как правило, любое упорядоченное скопление распадается. Но «как правило» не означает «всегда». Неверно, что упорядоченные состояния постоянно скатываются в хаос. Статистический закон утверждает, что порядок стремится к исчезновению. Однако к статистике неприменимо слово «всегда». Она допускает, что в каких-то местах Вселенной (на Земле, на небе, в вас, во мне, в звездах, где угодно еще) установится порядок, тогда как рядом будет царить энтропия.
Очень красивая концепция! Однако остается еще один не изученный нами вопрос, который следует задать. Если мы существуем благодаря вероятности, не может ли быть так, что она слишком мала, чтобы у нас было право здесь находиться?
Обычный человек, задающий этот вопрос, как правило, рассуждает так: мое тело в данный момент состоит из множества атомов. Как безумно малая вероятность, что они собрались вместе и образовали меня! Если бы так и было, мое существование было бы практически невозможным.
Конечно, природа устроена не так. Она творит каждое свое создание постепенно, продвигаясь шаг за шагом: атомы образуют молекулы, молекулы объединяются в аминокислоты, которые формируют в белки – основу клетки. Клетки составляют прежде всего простейших существ, а затем сложных, а затем еще более сложных. Стабильные единицы, составляющие один уровень, или слой, – это сырой материал для случайных слияний, которые производят более сложные образования, у и некоторых из них есть шанс стать стабильными. Пока остается потенциал для стабильности, который не реализовался, других шансов нет. Эволюция представляет собой восхождение по лестнице – от простого к сложному, со стабилизацией на каждой ступеньке.
Это очень близкая мне тема. Я даже придумал для нее название: стратифицированная стабильность – то, что заставляет жизнь развиваться, пусть медленно и постепенно, но непрерывно, все больше и больше усложняясь. Это центральная проблема прогресса и эволюции. Теперь мы знаем, что это правило относится не только к жизни, но и к материи. Практически невозможно, чтобы в звездах образовался тяжелый элемент, например железо, или супертяжелый элемент, например уран, путем случайного соединения всех частей. Нет. В звезде водород превращается в гелий; на следующей стадии в другой звезде гелий соединяется с углеродом, с кислородом, с тяжелыми металлами; шаг за шагом мы проходим всю лестницу из 92 элементов.
Мы не можем повторить процессы, происходящие в звездах, потому что не в состоянии достичь тех огромных температур, которые необходимы для сплава большинства элементов. Однако мы уже поставили ногу на первую ступеньку лестницы и скопировали первый шаг – от водорода до гелия.
Конечно, трудно воссоздать температуру в недрах Солнца: она превышает 10 000 000 °C. Еще труднее сделать контейнер, который выдержал бы такую температуру хотя бы долю секунды. Сегодня нет таких материалов. Контейнер для газа в таком состоянии может иметь только форму магнитной ловушки. Это новая физика – физика плазмы. Ее значение в том, что это физика природы. Теперь преобразования, проводимые человеком, не идут вразрез с ней, а повторяют те же самые шаги, которые природа предпринимает относительно Солнца и других звезд.
Бессмертие и смерть – контраст, которым я хотел бы закончить эту главу. Физика XX века – это бессмертное творение. Никогда человеческое воображение не поднималось до таких высот, даже когда люди возводили пирамиды, сочиняли «Илиаду», писали баллады или строили храмы. Ученые, открывшие эти законы, стали героями нашей эпохи. Менделеев, перебиравший карточки; Томпсон, опровергнувший теорию древних греков о неделимости атома; Резерфорд, превративший идею в планетарную систему; Бор, который сделал модель рабочей; Чедвик, открывший нейтрон, и Ферми, который использовал его для изменения ядра. И во главе этой славной когорты стоят основатели принципиально новых концепций – Макс Планк, который дал энергии атомную характеристику как материи, и Людвиг Больцман, которому больше, чем кому бы то ни было, мы обязаны тем, что атом стал для нас такой же реальностью, как наш собственный мир, который мы чувствуем и осязаем.
Кто бы мог подумать, что еще в 1900 году ученые воевали между собой не на жизнь, а на смерть, решая вопрос, существует атом или нет. Великий австрийский физик, механик и философ Эрнст Мах на этот вопрос однозначно отвечал: «Нет». Его мнение разделял знаменитый немецкий химик Вильгельм Оствальд. И только один человек в этот критический момент, совпавший с рубежом столетий, настаивал на реальности атомов, опираясь на фундаментальную теорию. Это был Людвиг Больцман, памяти которого я хочу поклониться.
Больцман был вспыльчивым, необычным, тяжелым человеком, ранним последователем Дарвина, неуживчивым и конфликтным. Восхождение человечества колебалось на тонкой интеллектуальной грани, потому что если бы антиатомные доктрины возобладали, научный прогресс затормозился бы на десятилетия. И не только в физике, но и в биологии, которая зависела от нее. Больцман не просто шел наперекор другим. Он жил идеей реальности атома и умер, не отступившись от своего. В 1906 году, в возрасте шестидесяти двух лет, ученый, чувствуя себя изолированным и проигравшим, решил, что дальнейшее сопротивление бесполезно (хотя до признания его идеи оставалось совсем немного), и совершил самоубийство. Нам в память об этом великом человеке осталась его бессмертная формула:
S = K ln W,
выгравированная на могильном камне.
У меня не хватает слов, чтобы отдать должное красоте лаконичной и точной мысли гения, поэтому я посвящаю ей четыре первые строки поэмы Уильяма Блейка «Прорицания невинности»:
В одном мгновенье видеть вечность,
Огромный мир – в зерне песка,
В единой горсти – бесконечность
И небо – в чашечке цветка.

