Книга: Онтогенез. От клетки до человека
Назад: Глава 7 Судьбоносные беседы
Дальше: Глава 9 Прокладка труб
Глава 8
Внутренние путешествия
Когда дорога вся в цветах, уже не спрашивают, куда она ведет.Анатоль Франс
Те клетки, которые сформируют лицо взрослого человека, располагаются в задней части головного отдела эмбриона. Те клетки, которые станут чувствительными нервами и пигментными клетками кожи, сначала находятся в районе позвоночника. А те клетки, которые стали вашими сперматозоидами или яйцеклетками, вообще какое-то время лежали за пределами вашего тела. Эти и многие другие подобные факты подчеркивают зависимость нашего развития от способности клеток раннего эмбриона перемещаться из одного места в другое. Миграции на клеточном уровне не менее удивительны, чем великие путешествия птиц и рыб, издавна восхищавшие зоологов, а возможно, и более, если учесть, что клетки, в отличие от птиц, перемещаются в постоянно меняющейся среде и делают это с исключительной точностью, хотя у них нет ни глаз, ни мозга, ни возможности учиться у родителей.
Чтобы понять, как это возможно, давайте разделим вопрос на две части. Сначала рассмотрим сам механизм движения клеток, а затем подумаем, за счет чего они двигаются в нужном направлении.
Способность клеток к движению возникла очень давно, за сотни миллионов лет до появления многоклеточных организмов. Основы механизма клеточной подвижности были заложены одновременно с возникновением первых эукариотических клеток (бактерий), ползавших по юной Земле в поисках пищи, и остались практически неизменными по сей день. Двигатель, который позволяет клеткам ползать, состоит из нескольких взаимосвязанных механизмов. Один выталкивает переднюю часть (лидирующий край) клетки вперед, другой обеспечивает образование новых контактов между клеткой и субстратом, по которому она движется, а третий использует эти контакты для подтягивания тела клетки, чтобы оно не отставало от движущегося вперед лидирующего края. На этих механизмах стоит остановиться более подробно, так как они представляют собой замечательный пример самоорганизации простых элементов в сложные системы более высокого уровня.
Механизм, выталкивающий вперед лидирующий край клетки, основан на работе тонкой сети белковых микрофиламентов, о которых уже шла речь в главе 5. Там мы говорили о том, что эта сеть позволяет поддерживать поле механических напряжений внутри эпителиальных пластов. Микрофиламенты в основном состоят из белка актина. Отдельные молекулы актина маленькие и компактные, но они могут связываться друг с другом и образовывать длинные тонкие нити (это и есть микрофиламенты) (глава 1). Новые молекулы актина легко присоединяются к свободным концам уже существующих цепочек, но лишь медленно и неохотно образуют цепочку «с нуля». Это означает, что новые микрофиламенты редко образуются в клетке без посторонней помощи, однако уже существующие микрофиламенты, как правило, быстро удлиняются. Формированию новых нитей способствуют белки, инициирующие полимеризацию актина. В клетке несколько типов таких белков, и они используются для разных целей. Те из белков, инициирующих полимеризацию актина, которые играют важную роль в движении клетки, обладают особым свойством: они работают только тогда, когда могут присоединиться к уже существующим актиновым нитям. Как следствие, новые нити образуются в основном как ответвления существующих нитей, а эти новые нити рано или поздно тоже образуют ответвления (рис. 33).
Если бы белки, инициирующие полимеризацию актина, всегда были активны, клетка задохнулась бы в густой сети микрофиламентов. Этого не происходит, потому что эти белки, как правило, неактивны и должны активироваться другими молекулами. Некоторые из таких молекул крепятся к внутренней поверхности клеточной мембраны, поэтому белки, инициирующие полимеризацию актина, активируются только непосредственно под мембраной. Важно отметить, что они сохраняют активность лишь в течение короткого промежутка времени, а затем снова теряют ее. Это означает, что белки, инициирующие полимеризацию актина, активны в основном на внутренней поверхности клеточной мембраны и до дезактивации успевают продвинуться лишь на небольшое расстояние к центру клетки. Таким образом, новые актиновые нити образуются только в зоне, лежащей непосредственно под клеточной мембраной.
Актиновые филаменты, растущие в направлении клеточной мембраны, рано или поздно наталкиваются на нее. Именно за счет совместных усилий тысяч отдельных актиновых нитей передний край клетки и продвигается вперед. Однако белки, инициирующие полимеризацию актина, не знают, где же, собственно, у клетки должен быть передний конец. Это, в конце концов, просто крупные молекулы, и в их структуре не зашифрована никакая карта. Многие из них инициируют образование ветвей, направленных в обратную сторону, то есть вглубь клетки. Дальнейшее удлинение таких бесполезных ответвлений было бы пустой тратой сил, но у клетки есть способы его предотвратить. Центральная часть клетки содержит много так называемых кэпирующих белков, которые «ставят заглушку» на конец нити и блокируют ее рост.
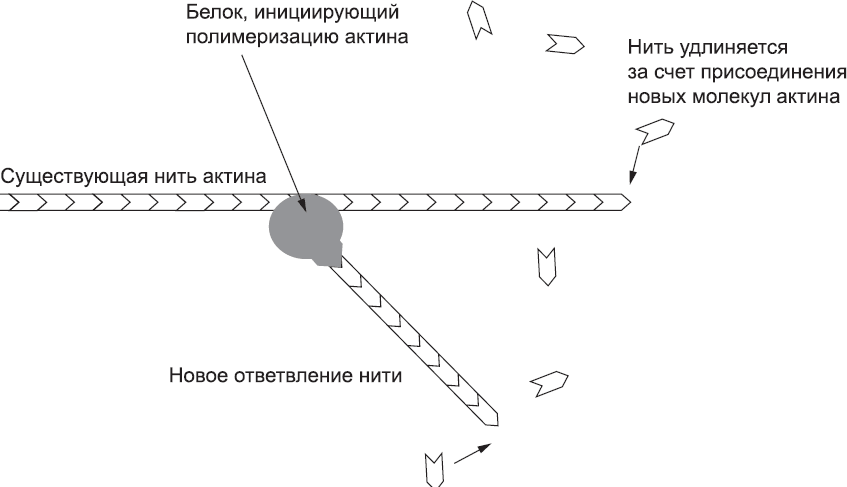
Рис. 33. Образование боковых ответвлений уже существующей актиновой нити за счет белковых комплексов, инициирующих полимеризацию актина
Если белки, инициирующие полимеризацию актина, обычно неактивны и активируются только после вовлечения прикрепленных к мембране молекул, то кэпирующие белки, наоборот, в норме активны и инактивируются молекулами мембраны. Поэтому нити, растущие по направлению к мембране, сталкиваются с кэпирующим белком в неактивном состоянии и могут свободно расти дальше, а нити, которые растут в неправильном направлении (вглубь клетки), быстро кэпируются. Таким образом, рост микрофиламентов в направлении мембраны основан на простой асимметрии среды клетки (рис. 34).
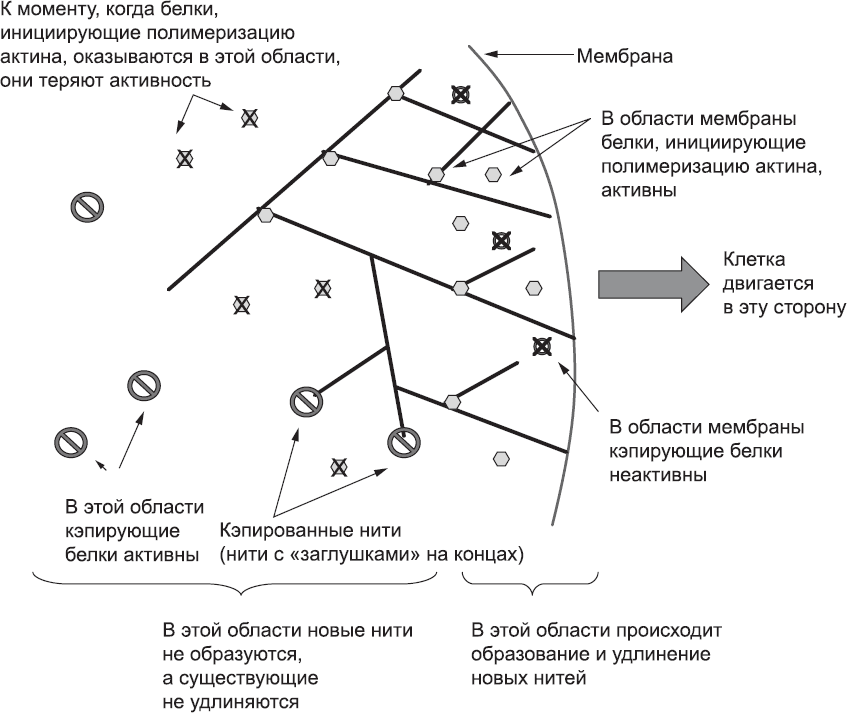
Рис. 34. Активация белков, инициирующих полимеризацию актина, и инактивация кэпирующих белков на мембране создают асимметрию среды, и в результате большинство новых микрофиламентов растет по направлению к мембране, а рост филаментов в других направлениях быстро блокируется
Согласованное действие белков на лидирующем крае клетки приводит к тому, что под давлением концов растущих актиновых нитей мембрана этого края проталкивается все дальше вперед. Согласно Третьему закону Ньютона («действию всегда есть равное и противоположно направленное противодействие»), если актиновые филаменты толкают мембрану вперед, то мембрана, в свою очередь, толкает филаменты назад. Если бы система микрофиламентов просто плавала в клетке, все попытки подтолкнуть мембрану вперед приводили бы к тому, что система «отплывала» бы назад. Чтобы этого не случилось, задний конец системы микрофиламентов должен быть закреплен на поверхности, по которой клетка двигается. Это достигается за счет комплексов адгезионных белков.
Адгезионные комплексы не только предоставляют микрофиламентам «точку опоры». Они также позволяют остальной части клетки следовать за лидирующим краем, а не оставаться где-то позади. На некотором расстоянии от разветвленной сети лидирующего края клетки актиновые нити, как правило, образуют «кабели» из множества параллельных нитей, сшитых белком миозином, который может поддерживать эти кабели в натянутом состоянии. Это точно такие же кабели, как те, которые соединяют между собой межклеточные контакты (см. главу 5). В цитоплазме лидирующего края клетки эти кабели не образуются, так как миозин там инактивируется. В остальной части клетки миозин активен, и образование кабелей из актиновых нитей возможно (рис. 35). Поэтому они тянутся от задней части лидирующего края клетки (самая передняя область, в которой они могут формироваться) назад через всю клетку. А поскольку кабели также связаны с адгезионными комплексами, их натяжение (за счет миозина) приводит к подтягиванию и продвижению основной части клетки вперед, к передним концам кабелей. Некоторый вклад в продвижение клетки вносит также укорачивание кабелей за счет разборки. Таким образом, в адгезионных комплексах действуют два вида сил: во-первых, от них отталкивается сеть актиновых нитей ведущего края, чтобы продвинуть переднюю часть клетки, а во-вторых, к ним крепятся толстые кабели, подтягивающие остальную часть клетки вперед. Эти силы даже удалось измерить экспериментально, выращивая клетки на очень тонких и эластичных поверхностях, которые заметно деформируются за счет толкания и натяжения. Адгезионные комплексы развиты сильнее всего сразу за передним краем клетки и слабеют по мере того, как клетка «перетекает» вперед. Ослабленные адгезионные комплексы, сместившиеся к заднему краю клетки, больше не крепятся к субстрату, и тогда вся клетка может переместиться вперед.
Таким образом, небольшой набор компонентов – актин и несколько белков, регулирующих его поведение, – может использовать для самоорганизации простую асимметрию клеточной среды (степень удаленности конкретной части клетки от мембраны) и создавать «двигатель», обеспечивающий перемещение клетки. Все эти белки, конечно, кодируются генами в ядре, но, помимо производства белков, ядро и гены не принимают никакого участия в создании «двигателя».
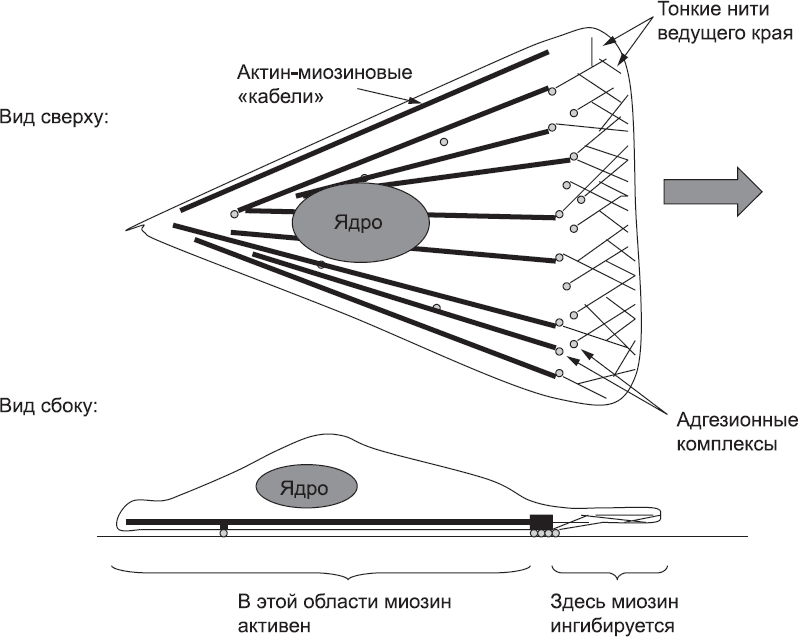
Рис. 35. Схема расположения тонких микрофиламентов у переднего края клетки, адгезионных комплексов в задней его части и актин-миозиновых «кабелей», идущих в заднем направлении
Это было прекрасно продемонстрировано в экспериментах с клетками рыб: небольшие фрагменты клеток, лишенных ядра (а значит и генов), были вполне способны к перемещению. Обеспечивает эту способность набор белков – именно набор, а не какой-то конкретный белок.
Итак, мы ответили – по крайней мере, в общих чертах – на первую часть вопроса о клеточных миграциях. Мы поняли, за счет чего клетки вообще способны к движению. Теперь нужно понять, как они могут перемещаться в определенном направлении. Клетки эмбриона используют два подхода к решению этой проблемы (либо по отдельности, либо, что бывает чаще, вместе). Один заключается в предоставлении клеткам выбора между поверхностями с разными адгезионными свойствами, а другой – в работе молекул, которые усиливают активацию белков, инициирующих полимеризацию актина, в передней части клетки.
Организацию направленного перемещения клеток за счет дифференциальной адгезии проще всего рассмотреть на примере ряда экспериментов последних десятилетий ХХ века. В лабораторных условиях клетки можно выращивать на самых разных поверхностях – от пластика до сложных биологических молекул. Адгезионные свойства этих поверхностей можно расположить в порядке возрастания просто на основании того, насколько легко или трудно смыть клетки с той или иной поверхности струей воды. Когда клетки помещают на поверхность с «мозаичной» текстурой (некоторые части обладают большей адгезией, чем другие), они беспорядочно перемещаются, пока не достигнут границы. Там клетки могут выбрать, куда им двигаться, и они выбирают поверхность с более сильной адгезией. Этому есть простое объяснение. Рассмотрим клетку, которая расположена на границе скользкой и липкой поверхностей (рис. 36). По определению, та часть, которая находится на более липкой поверхности, будет формировать больше адгезионных контактов, чем другая часть. Сеть тонких филаментов в области переднего края будет хорошо «заякорена», и лидирующий край клетки, отталкиваясь от этого якоря, будет быстро продвигаться вперед. На скользкой поверхности такого «якоря» нет, поэтому лидирующий конец будет расходовать силы на движения в обратном направлении.
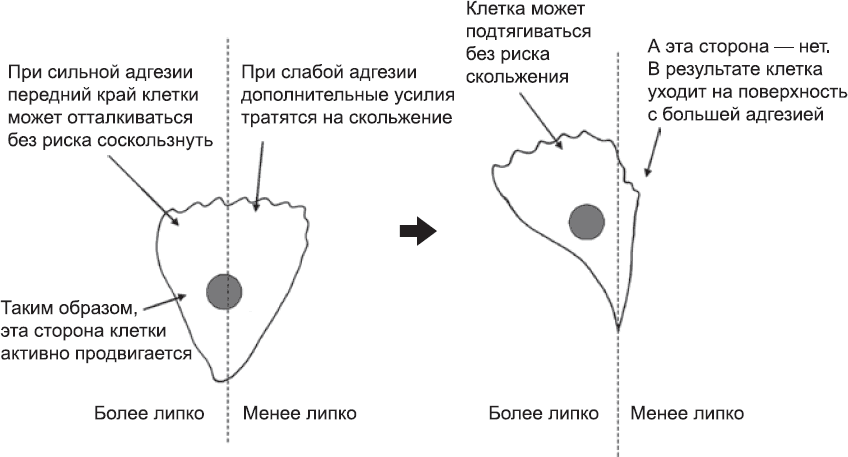
Рис. 36. Оказавшись на границе между двумя поверхностями, одна из которых благоприятствует формированию адгезионных комплексов, а другая – нет, клетка переместится на поверхность с более высокой адгезией
Актин-миозиновые «кабели», которые подтягивают основную часть тела клетки вперед, тоже будут лучше крепиться на липком субстрате, что облегчит движение тела клетки в этом направлении. Поэтому и лидирующий край клетки, и ее тело будут заведомо лучше двигаться по липкой поверхности, а значит, туда-то клетка и направится.
В течение нескольких лет ученые сомневались в том, что направленное перемещение клетки за счет адгезии основано на чисто механическом взаимодействии. Высказывались предположения, что сигналы от адгезионных комплексов стимулируют белки, инициирующие полимеризацию актина, то есть направленное перемещение происходит за счет химических процессов. Сомнения развеял один изящный эксперимент, в ходе которого исследователи поместили крошечный стеклянный шарик, покрытый молекулами с хорошей адгезией, на верхнюю поверхность лидирующего края клетки. Шарик прилип к адгезионным комплексам, и сеть актиновых филаментов лидирующего края пыталась использовать его в качестве «якоря» для отталкивания. Шарик не был ни к чему прикреплен, поэтому он просто откатывался назад, а лидирующий край клетки вперед не продвигался. На направление движения клетки это не влияло. Однако когда авторы эксперимента зафиксировали шарик при помощи тончайшей стеклянной нити, лидирующий край клетки начал быстро продвигаться вперед, и клетка стала двигаться в направлении шарика. Химические сигналы были одинаковы в обоих случаях, механическая сила появлялась только тогда, когда шарик был закреплен. Этот эксперимент убедительно показал, что направленное движение клеток в принципе может происходить только под действием механических сил в отсутствие каких-либо химических различий.
Тем не менее, хотя в ряде случаев направленное движение клеток действительно происходит чисто механическим путем, в других случаях химическая сигнализация играет очень важную роль. Некоторые молекулы на поверхности не используются для адгезии, а распознаются специальными рецепторами на клеточной мембране, которые активируют сигнальные пути внутри клетки. Некоторые рецепторы и сигнальные пути локально стимулируют активность белков, инициирующих полимеризацию актина, а значит, способствуют локальному продвижению лидирующего края клетки. Другие действуют прямо противоположным образом, подавляя продвижение лидирующего края; в этом случае клетки избегают подобных поверхностей.
Эксперименты со стеклянными шариками и мозаичными поверхностями – это любопытно, но как связана склонность клеток выбирать более липкую поверхность с клеточными миграциями в сложной внутренней среде эмбриона? Если, например, клетки просто выбирают поверхность с более сильной адгезией, то как могут разные клетки одновременно следовать разными маршрутами (которые к тому же иногда пересекаются)? Ответ на этот вопрос отчасти заключается в том, что существует множество разных типов адгезионных комплексов, и каждый из них сильнее всего связывается с определенным поверхностным белком. Например, адгезионный комплекс α6β1-интегрин связывается с поверхностным белком ламинином, а аналогичный комплекс α5β1-интегрин связывается с другим поверхностным белком – фибронектином. Разные типы клеток несут специфические комбинации адгезионных комплексов. Клетки с адгезионным комплексом α6β1-интегрином будут «считать» ламинин поверхностью с сильной адгезией, а клетки с α5β1-интегрин – не будут. Это означает, что разные типы клеток будут выбирать разные направления движения, даже если они движутся по одним и тем же поверхностям.
Неподвижные клетки развивающихся тканей эмбриона синтезируют поверхностные молекулы, такие как ламинин и фибронектин. При этом разные типы клеток секретируют поверхностные молекулы в разных сочетаниях. Это означает, что ползущая клетка воспринимает разные ткани эмбриона как местность с разнообразным и мозаичным рельефом: одни поверхности более липкие, другие – менее липкие, некоторые также несут сигнальные молекулы, привлекательные или непривлекательные для клетки. Разные типы ползущих клеток «видят» этот ландшафт по-разному в зависимости от того, какие адгезионные комплексы и рецепторы они несут, и поверхность, исключительно привлекательная для одного типа клеток, может оказаться абсолютно непривлекательной для другого типа клеток. Это еще один пример того, что смысл знака зависит от интерпретации. Полной информации об означаемом знак сам по себе не несет. Таким образом, каждый тип клеток может продвигаться по эмбриону своим путем.
Мы постоянно узнаем что-то новое о путях миграций клеток по эмбриону, однако того, что мы уже знаем, достаточно для того, чтобы проиллюстрировать только что изложенные общие принципы конкретными примерами. Каждый из описанных случаев относится к популяции клеток, которая отделяется от самой дорсальной части нервной трубки и мигрирует, распадаясь на потоки неплотно соединенных клеток, к разным частям организма. Эти клетки названы по месту их происхождения «клетки нервного гребня», и разные популяции этих клеток имеют разную судьбу. Они дают начало, во-первых, сенсорным клеткам, отвечающим за передачу спинному и головному мозгу тепловых, болевых и тактильных ощущений, а также информации о местоположении, во-вторых, вегетативной нервной системе, отвечающей за неподконтрольные сознанию функции органов, например частоту сердечных сокращений. В-третьих, клетки нервного гребня формируют основную часть надпочечной железы, которая выделяет гормоны (например, адреналин). В-четвертых, они дают начало пигментным клеткам, защищающим кожу от ультрафиолетового излучения. Разные судьбы клеток нервного гребня связаны с разными путями миграции.
Клетки нервного гребня, которые первыми отделяются от нервной трубки, обзаводятся рецепторами, обладающими высоким сродством к поверхностным белкам ламинину и фибронектину (рис. 37). Поэтому они идут по тем миграционным путям, которые содержат эти белки. Кроме того, клетки нервного гребня производят рецепторы, позволяющие опознавать молекулу под названием эфрин (см. рис. 37), но сродство к этой молекуле у них, наоборот, низкое. Много ламинина и фибронектина вырабатывается в сомитах, лежащих по бокам нервной трубки, а также в клетках нижней поверхности эктодермы, залегающей над сомитами и нервной трубкой (см. рис. 37). Многие клетки сомитов также синтезируют эфрин и, следовательно, не являются привлекательными для только что появившихся клеток нервного гребня. Все клетки задней части сомита, которая позднее сформирует костную часть позвонка, производят эфрин, а некоторые – также другие молекулы с теми же свойствами. В передней части сомита экспрессия эфрина организована несколько более сложным образом: он вырабатывается только в той части, которая лежит непосредственно под эктодермой.
Когда клетка нервного гребня покидает нервную трубку рядом с передней частью сомита, она детектирует эфрин и слева, и справа, и сзади (в задней части сомита), и спереди (в задней части предыдущего сомита). Поэтому ни в одном из этих направлений она мигрировать не может. Двигаться в дорсальном направлении она тоже не может, так как уже находится прямо на дорсальном краю эмбриона. Ей остается только одно – погрузиться вниз (в вентральном направлении) в массу клеток сомита, где много ламинина и фибронектина, а эфрина нет. Так задается направление движения клеток нервного гребня – они погружаются в неплотную ткань передней половины каждого сомита, где могут свободно передвигаться.
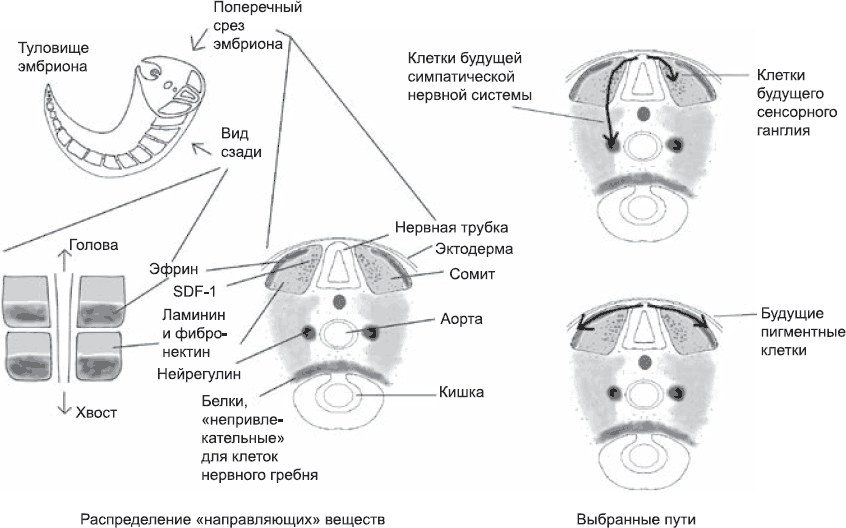
Рис. 37. Клетки нервного гребня перемещаются по определенным маршрутам, размеченным определенными молекулами (их выделяют ткани, по которым проходит маршрут)
При погружении клетки нервного гребня встречают ткани, выделяющие белок нейрегулин (см. рис. 37). Некоторые из клеток нервного гребня, погрузившихся в сомит, производят рецепторы, чувствительные к нейрегулину, и он привлекает их. Поэтому эти клетки проходят сквозь сомит и оказываются в еще более привлекательных тканях, расположенных рядом с аортой – главным кровеносным сосудом, проходящим по всей длине туловища (глава 9). Еще глубже залегают ткани, которые окружают развивающуюся кишку. Они продуцируют молекулы, непривлекательные для мигрирующих клеток. Это служит гарантией того, что клетки, двигающиеся из сомита вниз по тканям вокруг аорты, не опустятся слишком низко. Итак, клетки нервного гребня теперь находятся в привлекательной для них среде, а в нижележащих тканях им делать нечего. Поэтому они остаются в тканях рядом с аортой. Аорта выделяет белок, под действием которого клетки нервного гребня дают начало симпатической нервной системе (она управляет работой наших внутренних органов независимо от нашего сознания).
Ситуация, при которой клетки нервного гребня превращаются в нервную ткань под действием белков, образующихся в тканях «пункта назначения», представляет собой изящный метод защиты от ошибок. Если бы окончательное местоположение и начало дифференцировки мигрирующих клеток определялись внутренними факторам, например «клеточными часами», которые заставляли бы их приступать к образованию ткани после определенного времени, проведенного в странствиях, то они могли бы приступить к дифференцировке, даже не достигнув нужного места. А если бы заблудившиеся клетки, несмотря ни на что, приступали бы к образованию тканей, островки тканей могли бы образоваться в самых неподходящих местах. Понятно, что это было бы нехорошо. Зависимость начала дифференцировки от сигналов из места назначения служит гарантией того, что не достигшие цели клетки продолжают ее искать, а не приступают к дифференцировке где попало.
Если клетки нервного гребня, первыми покидающие нервную трубку, обычно движутся через сомиты к аорте, клетки, покидающие ее немного позже, чаще всего останавливаются в сомите. Покинув нервную трубку, эти клетки экспрессируют рецептор к белку SDF-1 (см. рис. 37), который продуцируют клетки сомитов. Когда эти клетки нервного гребня входят в сомит, они находят там SDF-1 и под его действием прекращают миграцию и остаются в тканях сомита. Там они собираются вместе и в конечном итоге формируют фрагмент нервной системы – сенсорный ганглий, передающий сенсорную информацию в спинной мозг.
Через некоторое время после начала только что описанных миграций от нервной трубки отделяется третья популяция клеток нервного гребня. Она непохожа на две предыдущие. Эти клетки тоже производят белки, необходимые для клеточного движения, а также рецепторы к ламинину, фибронектину и эфрину, но, кроме того, они продуцируют внутренние белки, которые заставляют их считать эфрин привлекательным. Когда клетки «третьей миграционной волны» покидают нервную трубку, оказывается, что и слева, и справа от них, в частях сомитов под эктодермой спины, есть эфрин. Поэтому они сразу направляются в эти ткани. Таким образом, они следуют по совершенно иному маршруту, чем клетки первых двух «миграционных волн», и остаются непосредственно под эктодермой эмбриона. Это важно, потому что эти клетки, как выясняется, уже вступили на путь дифференцировки и готовы стать пигментными клетками кожи.
Такая детерминация третьей популяции клеток нервного гребня поднимает один важный вопрос. В принципе популяция клеток нервного гребня может пойти по тому или иному пути двумя способами. По аналогии со старыми спорами о поведении человека можно сказать, что речь идет о выборе между «природой» и «воспитанием». Согласно теории «воспитания», ранее считавшейся справедливой, клетки изначально идентичны и приступают к дифференцировке в зависимости от окружения, в котором оказываются. В случае «природной» обусловленности изначальные различия в характере экспрессии генов («природе») клеток сообщают им верное направление, чтобы они нашли место, соответствующее их предопределенной судьбе. Теперь мы знаем, что в случае клеточной дифференцировки «природа» важнее «воспитания» – достаточно посмотреть, как клетки вырабатывают различные наборы белков, которые заставляют их по-разному интерпретировать сигналы при выборе маршрута, – хотя, как было отмечено выше, «пункт назначения» тоже играет важную роль, подавая сигнал прекратить миграцию и приступить к дифференцировке. Надо отметить, что признанная справедливой «природная» теория не помогает нам ответить на вопрос о том, как клетки нервного гребня выбирают свою дальнейшую судьбу, она просто говорит о том, что ответ надо искать на более раннем этапе, когда клетки еще не покинули нервную трубку.
Предыдущие страницы были посвящены исключительно клеткам нервного гребня туловищного отдела эмбриона. Клетки нервного гребня, начинающие свой путь из области шеи, головы и хвоста, имеют иную судьбу, а точнее, целый спектр возможных судеб. Они дают начало структурам, отвечающим за иннервацию кишки, костным элементам лица, пигментным клеткам радужной оболочки глаза, некоторым структурам уха и сердца. Эти клетки, как и те, о которых шла речь, следуют разными путями в зависимости от их будущей судьбы. Подробный рассказ о них был бы утомителен, поэтому ограничусь замечанием, что каждый из них столь же сложен, как и только что описанные пути. Это означает, что для правильной миграции клеток необходимо, чтобы они продуцировали много определенных веществ в нужное время. Генетические мутации, нарушающие нормальный синтез этих веществ (например, мутации, которые повреждают ген, кодирующий один из вовлеченных в процесс белков), вызывают врожденные дефекты развития. Эти дефекты известны под общим названием нейрокристопатии (заболевания, связанные с нервным гребнем). Например, некоторые мутации нарушают передачу сигналов, ведущих клетки нервного гребня из шейного и хвостового отдела в кишечник для создания там нервной системы. У людей с этим дефектом частично или полностью отсутствует иннервация пищеварительной системы. Пища и непереваренные остатки плохо продвигаются по пищеварительному тракту, что приводит к очень тяжелым запорам – так называемой болезни Гиршпрунга. В большинстве случаев этой болезни требуется хирургическое вмешательство в раннем детстве. Другой набор мутаций – в генах, контролирующих внутреннее состояние и дифференцировку клеток нервного гребня, вызывает синдром Ваарденбурга.,,, При этом расстройстве нарушения миграции или дифференциации клеток нервного гребня (особенно пигментных клеток) приводят к проблемам со слухом, с пигментацией радужной оболочки глаза и волос (часто встречается седая прядь на лбу) и в случае некоторых мутаций также к болезни Гиршпрунга. При образовании структур лица клеткам нервного гребня в области головы нужны определенные белки, такие как Treacle, чтобы активно размножающимся клеткам хватало строительных материалов. Мутации гена, кодирующего этот белок, приводят к нехватке основных строительных материалов, истощению и гибели многих клеток. Оставшихся клеток недостаточно для образования нормального лица, и рождается человек с синдромом Тричера—Коллинза – с лицом необычной формы, раскосыми глазами, неразвитыми щеками, маленькой нижней челюстью, опущенными веками и недоразвитыми или отсутствующими мочками ушей.
Природа генов, мутации в которых приводят к нейрокристопатии, подчеркивает один важный момент, касающийся связи между развитием, генетикой и заболеваниями. В популярных статьях и даже в некоторых научных работах нередко встречается фраза «ген такой-то болезни». Если заболевание выражается в утрате или нарушении определенной структуры, например лица, это выражение создает впечатление, что нормальный (не несущий мутацию) ген отвечает за создание этой структуры. Однако, если рассмотреть белки, кодируемые генами, мутации в которых вызывают нейрокристопатию, станет ясно, что они являются частью сложнейших многокомпонентных механизмов, выполняющих такие задачи, как управление клеточными миграциями. Эти задачи решаются для другого структурного уровня и для другого пространственного масштаба (лицо по сравнению с ними – слишком сложная и крупная структура). Белок Treacle (как бы мы ни напрягали воображение) вовсе не формирует лицо. Он всего лишь играет некоторую роль в обеспечении эффективного синтеза рибосом – молекулярных «фабрик белка» (глава 1). Эта простая биохимическая задача не имеет прямого отношения к созданию лица. Однако при нарушении работы этого белка в клетках нервного гребня головы возникает резкая нехватка рибосом, что приводит к их стрессу и гибели. Оставшихся клеток недостаточно для формирования нормального лица. Этот дефект и создает иллюзию того, что белок Treacle «отвечает» за формирование лица, в то время как на самом деле он только способствует образованию рибосом.
Общий вывод из примера с белком Treacle в равной мере справедлив и для подавляющего большинства других случаев: считать, что функция гена заключается в создании какой-то конкретной структуры тела, – это серьезное заблуждение. Если бы выдумки на генетическую тему ограничивались научной фантастикой, все было бы хорошо, но искаженное представление о том, что именно делают гены, приводит в том числе к необоснованному мнению о том, что спроектировать внешний вид организмов или их частей очень легко – достаточно поиграть с несколькими «дизайнерскими генами». На самом деле все части тела созданы сетью взаимодействующих белков, каждый из которых кодируется определенным геном. Если мы хотим узнать, как это происходит и как можно – к добру или к худу – что-то в этом изменить, то мы должны понять развитие человека не на уровне отдельных генов, а на уровне взаимодействующих сетей.
В качестве примера клеточных миграций я выбрал миграцию клеток нервного гребня, но это далеко не единственный тип мигрирующих клеток. На большие расстояния перемещаются клетки, дающие начало сперматозоидам и яйцеклеткам (глава 10), а также клетки, образующие кровеносную систему (глава 9). Огромное количество типов клеток мигрирует на короткие расстояния, организуясь в тесные группы, формирующие кости и части органов тела (глава 12). В ходе развития нервной системы небольшие группы клеток, мигрируя, создают длинные тонкие отростки (аксоны и дендриты), соединяющие нервные клетки друг с другом, а также с рецепторами и мышцами (глава 13). Защитные клетки иммунной системы способны мигрировать к очагам инфекции даже во взрослом организме (глава 17). Есть и печальные примеры: многие раковые клетки снова активируют механизмы миграции и распространяются из исходной опухоли в другие места, образуя метастазы. Существенная часть интенсивных исследований механизмов клеточного движения при нормальном развитии финансируется фондами изучения рака в надежде на то, что понимание нормальной миграции клеток поможет объяснить, как можно остановить опасный процесс метастазирования раковых клеток. Это лишь один из примеров того, как «чисто теоретические» эмбриологические исследования оказываются тесно связаны с решением насущных проблем, затрагивающих вопросы жизни и смерти конкретных людей.
Назад: Глава 7 Судьбоносные беседы
Дальше: Глава 9 Прокладка труб

