Книга: Двигатели жизни. Как бактерии сделали наш мир обитаемым
Назад: Глава 3. Мир до начала времен
Дальше: Глава 5. Суперзаряд двигателей
Глава 4. Маленькие двигатели жизни
Едва ли Роберт Гук мог предвидеть значимость сделанного им описания микроскопических клеток в тонком куске пробки, который он отрезал перочинным ножом. На протяжении более чем трех столетий, минувших с того времени, когда Гук впервые изобразил очертания структур клеток, ученые потратили много времени и усилий, чтобы понять, как же эти клетки – мельчайшая форма жизни, способная к самовоспроизведению, – функционируют. Эти усилия были направлены прежде всего на то, чтобы понять скрытые внутри клетки механизмы, позволяющие ей получать энергию, расти и размножаться. И хотя мы не знаем всех ответов, нам уже известно, что, как в кукле-матрешке, внутри отдельных контейнеров самих клеток имеются контейнеры меньшего размера, выполняющие каждый свою специфическую функцию. За неимением более простого термина я называю эти заключенные в клетках меньшие контейнеры наномеханизмами жизни. Это агрегаты, составленные главным образом из белков и нуклеиновых кислот и выполняющие необходимые функции во всех живых клетках. Я потратил немалую часть своей научной жизни, пытаясь понять, как они работают.
Понимание того, как работают эти наномеханизмы, имеет значение, поскольку их внутренняя работа позволяет нам увидеть, как основные процессы копируются и преобразуются в различных формах. Это аналогично тому, как если бы мы, взяв детали из магазина радиотоваров, собирали усилители, радиоприемники, телевизоры и любые другие устройства, какие можно придумать. В природе встречаются наномеханизмы самых разных типов. Как я уже говорил, одни из древнейших – рибосомы – возникли у предков современных микроорганизмов миллиарды лет тому назад. В пятой главе мы еще вернемся к этому первобытному миру древних микроорганизмов, но сначала давайте рассмотрим другие наномеханизмы и поймем, как они функционируют внутри клеток.
Попытка понять действие механизмов внутри живой клетки до какой-то степени аналогична попытке разобраться, как работает автомобиль, не имея представления о том, что находится под капотом. Мимо нас по улице проезжают машины, и мы понимаем, что внутри них имеются какие-то механизмы, позволяющие им двигаться. Мы можем остановить машину и вынуть ключ из зажигания – тогда машина больше не заведется. Если мы сумеем открыть капот, то, возможно, сможем разобрать находящийся там механизм и рассмотреть все его части – до последнего винтика, последней шайбы и прокладки. И если мы посмотрим еще внимательнее, то увидим, что все части собраны в исключительно точной последовательности; однако у нас нет никакой инструкции касательно того, как их собирать. Если мы не поймем, для чего какая часть предназначена, то никогда не сможем сообразить, как все эти приспособления позволяют машине ехать по дороге. Однако, рассматривая по отдельности поршень или аккумулятор, не говоря уже о компьютере, мы, вероятно, сможем получить какое-то представление о том, какую роль эта конкретная часть выполняет и каковы ее функции в общем механизме.
Параллель между попыткой понять принцип действия автомобиля и исследованием функционирования клетки, разумеется, весьма приблизительна. Клетки устроены гораздо сложнее, нежели автомобили. Автомобили не могут собирать сами себя, не воспроизводятся самостоятельно и, как ни жаль, не умеют сами себя чинить. Поэтому, наверное, не следует чересчур удивляться тому, что, хотя биологи и смогли разобрать клетку на части, чтобы посмотреть, как работают отдельные компоненты, им до сих пор так и не удалось заново собрать эти части с нуля и получить полностью работоспособный, самовоспроизводящийся организм. Нам предстоит еще долгий путь к пониманию того, что находится «под капотом» у клеток. Тем не менее на протяжении трехсот лет, прошедших с тех пор, как Гук описал базовую структуру клеток, мы далеко продвинулись вперед в распознавании многих ключевых элементов и уже начинаем догадываться, как работают эти внутриклеточные наномеханизмы. Это знание позволило нам увидеть закономерности в организации клеток на генеалогическом древе жизни. Собственно, оно дало нам возможность понять, что это вообще такое «жизнь». Однако перед тем как мы начнем детально разбирать «колесики и винтики», давайте вкратце рассмотрим, как эти элементы были обнаружены.
Идентификация отдельных элементов клетки началась в XIX веке благодаря усовершенствованию микроскопов, а также пытливому и терпеливому характеру биологов – как правило, достаточно зажиточных мужчин. В 1831 году шотландский ботаник Роберт Броун при внимательном исследовании под микроскопом выделил темное пятно в центре клетки орхидеи, а впоследствии и в пыльце. В статье, представленной им Линнеевскому обществу в Лондоне, ученый назвал эту структуру ядром (нуклеус); это была первая из идентифицированных внутриклеточных структур. В 1869 году Фридрих Мишер, швейцарский доктор, работавший в Германии, обнаружил, что найденные Броуном внутриклеточные структуры содержат любопытные молекулы, которые не являются белками, и назвал это новое вещество нуклеином. Почти столетием позже обнаружится, что эти молекулы несут информацию, необходимую для строительства новых клеток.
В последней четверти XIX и начале XX века изготовители инструментов принялись разрабатывать все более совершенные объективы и другие компоненты оптических микроскопов, позволившие ученым в буквальном смысле заглянуть внутрь крупных клеток. Еще большей наглядности удалось добиться при помощи разнообразных красителей и пигментов, избирательно окрашивавших те или иные компоненты клетки. Благодаря подобным усовершенствованиям ученые смогли прийти к довольно глубокому пониманию положения некоторых компонентов в эукариотических клетках, то есть клетках, содержащих ядро. Растения и животные по существу представляют собой организованные скопления эукариотических клеток.
Благодаря более совершенным объективам, красителям и микроскопам с еще большим увеличением в течение относительно короткого отрезка времени было сделано несколько открытий. В 1883 году еще один ботаник, немец Андреас Шимпер, обнаружил, что крахмал, окрашивающийся в присутствии йода в темно-бурый цвет, производится в растениях микроскопическими зелеными тельцами, которые он назвал хлоропластами. В 1890 году другой немец, Рихард Альтман, выяснил, что, судя по всему, в любых животных клетках присутствуют скопления маленьких частиц, которым он дал название биобласты – позднее они станут известны как митохондрии. Альтман обнаружил также, что «нуклеин» Мишера имеет кислотную природу, и переименовал это вещество в нуклеиновую кислоту. В 1897 году итальянский врач Камилло Гольджи описал еще одну структуру, получившую впоследствии название «аппарат Гольджи». Вначале ученые сочли, что эта структура является артефактом – побочным эффектом красителей, которые использовал Гольджи, и лишь в середине XX века было подтверждено, что она реально существует. Позднее было описано еще несколько крупных структур; это сделали очень терпеливые наблюдатели, работавшие с лучшими оптическими микроскопами того времени. Однако, как бы ни были хороши объективы, существуют физические ограничения того, что можно увидеть при помощи микроскопа, использующего видимый свет.
Структуры, размеры которых составляют меньше тысячной доли миллиметра (иначе говоря, микрометра), попросту очень трудно разглядеть в деталях при помощи видимого света. Диаметр человеческого волоса составляет около 100 микрометров, диаметр же большинства бактерий и других микроорганизмов – около 1–2 микрометров, а порой даже меньше. Чтобы разглядеть их невооруженным глазом, нужно выстроить в ряд около 100 таких клеток, и тогда их длина будет равна диаметру человеческого волоса. И поскольку эти микроорганизмы так малы, для нас практически невозможно различить находящиеся внутри них структуры. Есть ли там миниатюрные ядра? Митохондрии? Хлоропласты? Эта попытка визуализации внутриклеточных структур может напомнить выдвинутую ранее Левенгуком концепцию анималькулей, которых он представлял как микроскопических животных. На протяжении нескольких десятилетий научный прогресс в области изучения очень маленьких клеток или маленьких частей внутри крупных клеток оказался застопорен из-за ограничений в разрешении и увеличительной способности оптических микроскопов.
Прорыв в этом направлении произошел в 1930-х годах, когда два немецких физика, Макс Кнолль и его студент Эрнст Руска, разработали микроскоп нового типа, в котором использовались высокоэнергичные электроны – они ускорялись в вакууме и как лучи проецировались на образец, который либо поглощал их, либо пропускал, либо рассеивал. Получившееся изображение могло передавать структуры с разрешением в десятые доли микрометра, то есть с более чем в сто раз большим увеличением, чем то, какое было достижимо в оптических микроскопах. Открылся целый новый мир – мир, в котором мы впервые действительно получили возможность заглянуть клеткам «под капот».
Изучение клеток под электронным микроскопом тотчас же подтвердило существование ядер, аппаратов Гольджи, митохондрий и хлоропластов у эукариотических клеток. Однако, к удивлению ученых, оно также раскрыло, что у многих микроорганизмов эти структуры отсутствуют. Судя по всему, число матрешек среди микробов было ограничено. Организмы, внутри которых не были найдены такие автономные, заключенные в мембраны структуры, были объединены учеными в группу, получившую название прокариоты. Тем не менее детальное изучение внутреннего строения клеток открыло некоторые структуры, общие для всех клеток вне зависимости от того, имеется у них ядро или нет. Определенные элементы требовались всем.
Одними из таких универсальных элементов оказались рибосомы. Впервые они были обнаружены в 1955 году румынским биологом Джорджем Паладе, который работал в Рокфеллеровском институте (теперь университете) в Нью-Йорке. При помощи лучших из доступных в то время электронных микроскопов Паладе описал эти структуры в образцах клеток млекопитающих и птиц (и те и другие являются эукариотами). Рибосомы были похожи на очень маленькие ворсистые шарики, которые либо свободно плавали во внутриклеточной жидкости, либо группировались вдоль определенных внутренних мембран. Паладе обнаружил, что эти маленькие шарики содержат как белки, так и нуклеиновые кислоты, но роль этих крошечных компонентов клетки оставалась невыясненной еще более десяти лет. Было очевидно, однако, что та нуклеиновая кислота, которая находится в ядре, представляет собой ДНК, в то время как в рибосомах содержится рибонуклеиновая кислота – другой тип нуклеиновой кислоты с другим сахаром, рибозой, имеющей на один атом кислорода больше, чем дезоксирибоза, найденная в ДНК. Впоследствии эти маленькие шарики стали называть рибосомами, сложив вместе название «рибоза» и греческое слово «сома» (тело).
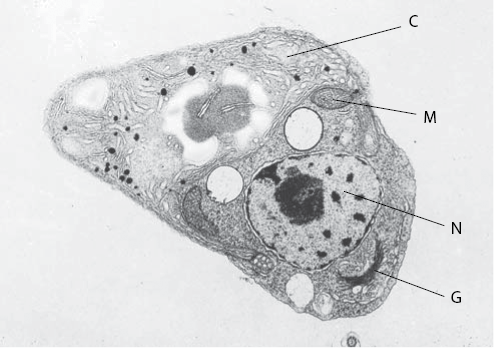
Рис. 9. Электронная микрофотография тонкого среза клетки зеленой водоросли. Этот организм является эукариотом (см. рис. 8) и, подобно всем эукариотам, содержит несколько внутриклеточных органоидов, ограниченных мембранами. В данной клетке такими органоидами являются хлоропласт (C), митохондрии (M), ядро (N) и аппарат Гольджи (G). (Оригинальная микрофотография, сделанная Майроном Ледбеттером и Полом Фальковски.)
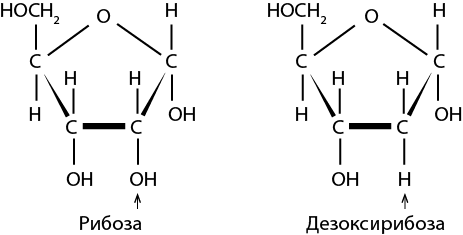
Рис. 10. Схема строения рибозы и дезоксирибозы. Первая содержится в рибонуклеиновой кислоте (РНК), вторая – в дезоксирибонуклеиновой кислоте (ДНК)
Рибосомы – это микроскопические механизмы, которые забирают информацию у последовательности ДНК посредством молекулы-посредника. Такая молекула является зеркальной, или комплементарной, к гену, который представляет собой матрицу белковой последовательности. Комплементарная цепочка РНК называется информационной, или матричной РНК. Информация, содержащаяся в информационной РНК, сообщает рибосоме, какие аминокислоты и в каком именно порядке следует химически прикрепить друг к другу. Получающиеся в результате цепочки аминокислот и становятся теми самыми белками, которые необходимы клеткам, чтобы функционировать, восстанавливать себя и создавать новые клетки.
Поскольку все основные составляющие клеток либо являются белками, либо зависят от белков в своем формировании, можно сказать, что рибосомы – абсолютно необходимые компоненты в каждой клетке. Однако это чрезвычайно сложные механизмы. Их диаметр составляет всего лишь около 20–25 нанометров (нанометр – это 1/1000 доля микрометра, который в свою очередь составляет 1/1000 долю миллиметра), ввиду чего их очень трудно увидеть даже с помощью электронного микроскопа. Перед учеными встала дилемма: как можно исследовать одну из самых основных функций клетки – производство белков, не имея возможности видеть стоящие за этим механизмы? Однако именно здесь подоспели на помощь биохимики и физики.
Биохимики специализируются на описании отдельных компонентов клеток. Их основная методика заключается в том, чтобы вытащить из клетки те или иные части и посмотреть, как они работают. Начинают биохимики обычно с того, что разрушают клетки и разделяют получившийся материал на различные компоненты. Основным инструментом для такого разделения служит центрифуга, которая раскручивает материал на высокой скорости, так что его составляющие разделяются на фракции в соответствии со своей массой: чем тяжелее частица, тем дальше в центрифужной пробирке она окажется. При помощи такой высокоскоростной центрифуги Паладе сумел отделить те самые структуры, похожие на ворсистые шарики, которые он увидел в электронный микроскоп.
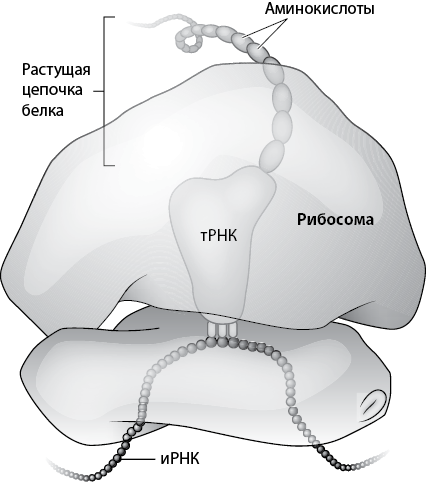
Рис. 11. Схема, иллюстрирующая функционирование рибосомы. Этот наномеханизм образует белки при помощи информационной матрицы, изначально закодированной в ДНК и перенесенной при помощи молекулы информационной РНК (иРНК). Молекула иРНК обеспечивает информацию о последовательности аминокислот, необходимой для образования конкретного белка; для каждого белка в клетке имеется собственная иРНК. Рибосома, также содержащая РНК, но образующая более крупную структуру из многих белков, «считывает» информацию с молекулы иРНК и при помощи третьей молекулы РНК с прикрепленной к ней определенной аминокислотой (транспортной РНК, тРНК) выстраивает белки, наращивая их по одной аминокислоте за раз. Белок появляется из рибосомы, чтобы занять надлежащее место внутри клетки
Однако вопрос оставался открытым: как, собственно, функционируют рибосомы? Сумев изолировать рибосомы, Паладе и его коллеги определили, что эти структуры состоят из белков и еще одного типа молекул РНК, отличного от информационной РНК. Вскоре было доказано, что эти крошечные шарики могут образовывать белки прямо в пробирке, если предоставить им необходимые компоненты. Однако даже самые лучшие электронные микроскопы не могли показать, что находится внутри изолированных Паладе рибосом. Для решения этой проблемы требовалось еще более мощное орудие распознавания.
В начале XX столетия, вскоре после открытия радиоактивности, физики обнаружили, что рентгеновские лучи, представляющие собой чрезвычайно высокоэнергетические частицы света, рассеиваются кристаллами строго определенным образом. Рентгеновское излучение гораздо более высокоэнергетичное, нежели электроны, и может отображать совсем крошечные структуры – вплоть до уровня отдельных атомов. Физики и химики сделали множество рентгеновских изображений кристаллов, слегка меняя их ориентацию, благодаря чему смогли определить расположение отдельных атомов внутри кристаллической решетки. Такой же подход впоследствии был применен для описания структуры сепарированных компонентов клетки, и вскоре после Второй мировой войны стало возможным определение расположения атомов в кристаллической решетке белков. Это была чрезвычайно скрупулезная работа: необходимо было получить и наложить друг на друга сотни рентгеновских изображений – все это в отсутствие компьютеров. При помощи обратного вычисления угла рассеяния рентгеновских лучей, прошедших через структуру, физики и химики могли судить о строении молекулы, даже если ее и нельзя было увидеть непосредственно с помощью микроскопа. Постепенно становились доступны компьютеры и рентгеновские источники повышенной мощности – такие, как синхротронные источники излучения, один из которых располагался через улицу напротив моего здания в Брукхэвенской национальной лаборатории, – и ученые описывали структуры все новых и новых белков. Эти описания содержатся в архиве химического факультета моего университета; любой человек, имеющий компьютер, может найти их в Сети.
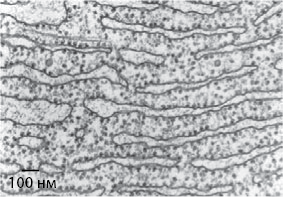
Рис. 12. Электронная микрофотография, показывающая распределение рибосом (маленькие ворсистые шарики) вдоль системы мембран (эндоплазматическая сеть) в эукариотической клетке. На подобном изображении Джордж Паладе впервые идентифицировал рибосомы, чтобы впоследствии их изолировать
Рибосомы не состоят из одного-единственного белка и не сводятся исключительно к белкам; это гораздо более сложные структуры. Самые простые рибосомы, найденные в прокариотах, содержат, помимо молекул РНК, еще около шестидесяти белков, объединенных в две группы. Сначала считалось, что будет необдуманным пытаться кристаллизовать целую рибосому и тем более получить какую-либо полезную информацию об их структуре при помощи рентгеновского излучения. Тем не менее в конце 1980-х годов двум ученым это удалось. Один из них, Гарри Ноллер, был американцем, другая, Ада Йонат, была израильским биохимиком и работала в Германии и Израиле. Работа потребовала от них немало терпения, усердия и вдохновения, однако они смогли получить первые рентгеновские изображения рибосом.
В течение двух последующих десятилетий несколько групп ученых по всему миру занимались анализом структуры этих удивительных наномеханизмов. На основании тщательнейшего исследования множества рентгеновских изображений им удалось собрать по кусочкам информацию о том, как функционируют рибосомы. Этими учеными были: Ноллер из Калифорнийского университета в Санта-Крусе, Йонат из Вейсмановского института, Томас Стейц из Йельского университета и Венкатраман (Венки) Рамакришнан, сначала работавший в Брукхэвенской национальной лаборатории (мой бывший коллега), а затем перешедший в Кембриджский университет. Трое последних в 2009 году за свои усилия были удостоены Нобелевской премии по химии.
Два основных комплекса, составляющих рибосому, взаимодействуют приблизительно так же, как работает пара рычагов. Аминокислоты переносятся к рибосоме третьей молекулой РНК – транспортной РНК. По мере того как информационная РНК скармливается рибосоме наподобие макаронины, два этих белковых комплекса движутся взад и вперед, прикрепляя одну за другой необходимые аминокислоты, чтобы собрать молекулу белка. Таким образом эта белковая фабрика «штампует» информацию, заключенную в генах. Этот замысловатый механизм работает с невероятной скоростью – за секунду к формирующейся белковой цепочке добавляются от десяти до двадцати аминокислот.
Подобные «белковые фабрики», практически идентичные друг другу, существуют во всех живых клетках. Бывают небольшие отклонения в составе РНК внутри рибосом, однако такие отклонения принято считать нейтральными мутациями, которые постоянно встречаются в природе, – это случайности, возникающие бессистемно и не влияющие на результат процесса. Подобные нейтральные мутации мы можем видеть повсюду вокруг. Отпечатки пальцев каждого из нас несколько отличаются от отпечатков пальцев других людей: там, где у одних завитки, у других можно видеть дуги, гребни или петли. Эти узоры никак не коррелируют с нашей тактильной чувствительностью. Точно так же мутации рибосомальной РНК, как представляется, не влияют на скорость, с которой рибосома производит белок, – не существует суперрибосом и рибосом-аутсайдеров (во всяком случае, мы так не думаем). Фактически строение всех рибосом настолько схоже, что их едва можно различить; тем не менее между последовательностями нуклеиновых кислот в рибосомальной РНК существуют небольшие различия. Эти различия и позволили Карлу Вёзе и Джорджу Фоксу разделить прокариоты на две большие надгруппы – бактерии и археи, которые, в свою очередь, очень сильно отличаются от эукариотов. Однако если различия в последовательностях нуклеиновых кислот в рибосомальной РНК и позволяют нам проследить эволюционную историю всех живых организмов, различия в последовательностях РНК не оказывают влияния на базовую функцию рибосомы. Все клетки производят белки абсолютно одинаковым способом.
Тем не менее производство белков – не такая простая задача. Аминокислоты сами по себе не устанавливают химических связей друг с другом. Для того чтобы такая связь установилась, требуется энергия. Откуда же берется энергия для того, чтобы производить белки? Ее вырабатывает другой комплекс наномеханизмов, расположенный в других частях клетки. Начиная с этого момента мир внутри клетки становится еще более интригующим.
Основной энергетической валютой во всех клетках является молекула, называемая аденозинтрифосфат (АТФ), одиночная молекула нуклеиновой кислоты, присутствующая как в ДНК, так и в РНК и содержащая один из сахаров и три фосфатные группы, соединенные последовательно. Когда эта молекула используется в биохимической реакции, она расщепляется на аденозиндифосфат (АДФ) и одиночный фосфат. Расщепление АТФ сопровождается выделением химической энергии, которая используется для многих целей. Одной из важнейших функций АТФ у всех организмов, а в особенности у микроорганизмов, является участие в синтезе белков. Другая функция – подвижность. Еще одна состоит в прокачке ионов, таких как протоны, натрий, калий и хлориды, сквозь мембраны. Все эти и другие функции можно проследить на протяжении всей истории развития жизни на Земле. Вследствие такой повсеместной распространенности АТФ во всех возможных клетках возникает вопрос: как клетки производят АТФ?
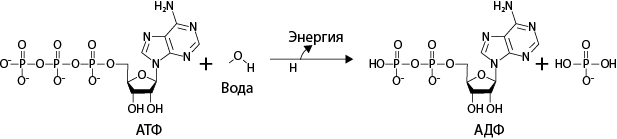
Рис. 13. Основной валютой биологической энергии на протяжении всей истории развития жизни является аденозинтрифосфат (АТФ). При соединении АТФ с водой в ферментах одна фосфатная группа может быть оторвана от молекулы, в результате чего образуется аденозиндифосфат (АДФ) и неорганический фосфат. Такая реакция высвобождает энергию, которую все клетки используют для жизни
Открытие того, как производится в клетках основная часть АТФ, было чрезвычайно дискуссионным и, однако же, одним из важнейших в истории биологии. Много лет, с тех самых пор, как Пастер открыл, что микробы могут использовать глюкозу как источник энергии в анаэробных условиях, было известно, что АТФ может производиться в клетках посредством переноса фосфатной группы некоторых небольших молекул непосредственно к АДФ, формируя АТФ. Долгое время этот процесс, называемый субстратным фосфорилированием, считался единственным источником АТФ, однако числа никак не сходились. Если при отсутствии кислорода количество АТФ, произведенного микроорганизмами, зачастую было небольшим, при наличии кислорода производилось гораздо больше АТФ, чем можно было отнести на счет фосфорилирования субстрата. Должен был иметься еще какой-то источник АТФ.
В 1950-х годах несколько эксцентричный английский биохимик Питер Митчелл, в то время работавший в Кембриджском университете, задался вопросом о том, как ионы переносятся через мембраны. Мембраны выполняют функцию барьеров, препятствующих распространению электрически заряженных атомов или молекул растворимых веществ, известных как ионы. Митчелл знал, что в случае микроорганизмов АТФ может использоваться для транспортировки ионов и других молекул внутрь клеток и наружу из клеток через клеточную мембрану. Однако один из его аспирантов показал, что у бактерий приток сахаров в клетку сопровождается потоком ионов водорода (протонов) из клетки наружу. Оба потока – и сахаров, и протонов – зависели от АТФ. Митчелл подумал, что, если реакция способна происходить в одном направлении, она может сработать и в противоположном, то есть если предоставить клетке дополнительные протоны, это приведет к созданию АТФ вместо его поглощения. Покинув Кембридж, Митчелл принялся экспериментировать вне лаборатории, в небольшом поместье в Корнуолле, которое он незадолго перед этим отреставрировал. Здесь ему пришла в голову оригинальная идея.
К этому времени было известно не только то, что описанная семьдесят лет назад Альтманом структура – митохондрия – ответственна за производство больших количеств АТФ, но также что объем этого производства зависит от присутствия кислорода. Кислород при этом превращается в воду (H2O), а это означает, что к каждому атому кислорода добавляются два атома водорода (H).
Митчелл предположил, что на границе мембран внутри митохондрий действует сила, как-то связанная с концентрацией протонов в этом органоиде. Он обнаружил, что внутри митохондрии имеется сеть мембран и что с одной стороны этих мембран протонов больше, чем с другой. При перемещении протонов со стороны с большей концентрацией на противоположную и создается АТФ. Этот процесс, который Митчелл назвал хемиосмосом, требовал, чтобы внутримитохондриальные мембраны сохраняли свою целостность.
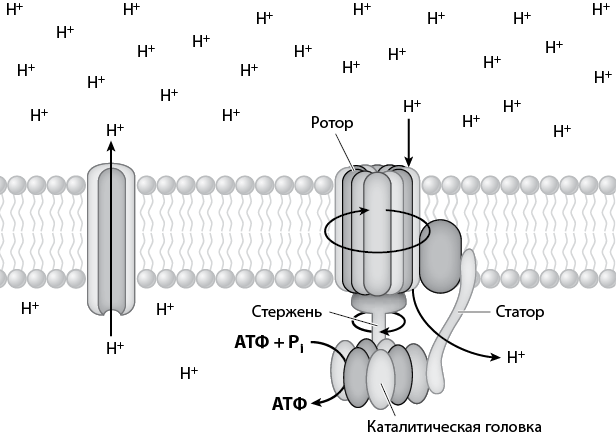
Рис. 14. Аденозинтрифосфат производится в клетках путем генерирования градиента электрического заряда на границе мембраны. У множества клеток в двух органоидах – митохондрии и хлоропласте – градиент заряда образуется благодаря разнице в концентрации протонов (ионов водорода), то есть на одной стороне мембраны протонов больше, чем на другой. По мере просачивания протонов через фактор сопряжения, встроенный в мембрану, может производиться АТФ (см. рис. 15)
Вскоре после того, как в 1961 году Митчелл опубликовал свою гипотезу, молодой исследователь из Корнелльского университета Андре Ягендорф показал, что аналогичный процесс существует в хлоропластах. Ягендорф изолировал хлоропласты из клеток листьев, после чего погрузил органоиды в кислотный раствор, держа их при этом в темноте. Хлоропласты не могли фотосинтезировать из-за отсутствия света, однако внутренняя среда органоидов стала кислой. Затем ученый, все так же в темноте, переместил хлоропласты в нейтральный раствор и показал, что вместе с потоком исходящих наружу протонов в них образуется АТФ. Понадобилось еще два десятилетия, чтобы открыть механизм этого процесса и принцип его действия, однако в 1978 году Митчелл был удостоен Нобелевской премии за свое открытие хемиосмотического процесса выработки энергии.
Фундаментальный принцип феномена, обнаруженного Митчеллом, состоит в том, что жизнь использует электрические градиенты для производства энергии, а энергию – для выработки электрических градиентов. Этот процесс аналогичен тому, как функционирует электрическая батарея. По сути, все организмы представляют собой аппараты по выработке электроэнергии – они работают благодаря перемещению ионов, какими являются и протоны, через мембрану и генерированию собственного электрического градиента. Источником протонов и электронов является водород – самый распространенный элемент во Вселенной. Для возникновения электрического градиента требуется мембрана, без которой не удалось бы достичь разницы в концентрации протонов или других ионов, а следовательно, не было бы и источника энергии для выработки АТФ. Открытие Митчелла помогло вымостить путь к пониманию того, как функционируют структуры, ответственные за выработку АТФ. Эти наномеханизмы называются факторами сопряжения.
Факторы сопряжения – это в буквальном смысле миниатюрные моторы, которые крутят мембраны. Они содержат стержень, представляющий собой группу белков, крутящих мембрану и физически вставленных в группу более крупных белков (головка), расположенную с одного конца стержня. Схематически все это напоминает микроскопическую карусель. Протоны с одной стороны мембраны прикрепляются и движутся вдоль стержня, чтобы пройти насквозь. При этом их поток физически поворачивает стержень против часовой стрелки, наподобие того как вращается мельничное колесо, когда через него течет вода. Поворачиваясь, стержень механически передвигает группу крупных белков (платформу карусели), которые связывают АДФ и фосфат. Платформа вибрирует, и приблизительно через каждые 120 градусов поворота стержня формируется новая молекула АТФ, которая выпускается в клетку для использования в других назначениях. Такой мотор может работать также и в обратном направлении: если в клетке избыток АТФ, он может перекачивать протоны (или другие ионы) через мембрану, причем АТФ преобразуется в АДФ и одиночный фосфат.
Эта базовая схема миниатюрного электромотора для производства АТФ очень древняя. Она возникла у микроорганизмов настолько давно, что мы с трудом можем воссоздать историю ее эволюции. Она встречается в природе повсюду: у всех животных она является ключевой составляющей мышц и нервов, она найдена в корнях и листьях растений, она обнаружена у микроорганизмов. Производство АТФ настолько важно для всех организмов и настолько сильно зависит от мембран, что всем организмам приходится поддерживать по разные стороны своих клеточных мембран электрический градиент. Помимо прочего, электрические градиенты играют существенную роль в транспортировке внутрь клетки необходимых питательных веществ и выводе из нее отходов жизнедеятельности. Однако электрические градиенты, производимые при работе фактора сопряжения в режиме «реверса», сопровождаются поглощением энергии.
Так или иначе, из того или иного источника, но биологические машины должны получать энергию из окружающей среды, чтобы генерировать внутриклеточную энергию, необходимую для создания электрических градиентов, – в противном случае жизнь очень быстро остановится. Энергия, дающая жизнь всему живому на Земле, в конечном счете берется от Солнца. Фотосинтез в процессе эволюции привел к возникновению наисложнейших биологических реакций в природе. Я посвятил основную часть своей научной деятельности пониманию того, как работает этот процесс. Суть этого процесса связана с еще одной группой наномеханизмов, найденной только у фотосинтезирующих организмов.
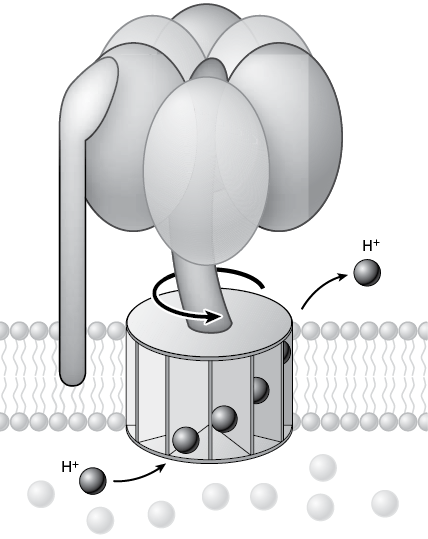
Рис. 15. Схема, показывающая основной механизм, посредством которого фактор сопряжения производит АТФ из потока протонов. Протоны проходят через стержень в мембране; по мере их продвижения стержень физически поворачивается, и «головка» наномеханизма, расположенная по другую сторону мембраны, вибрирует. Физическая осцилляция позволяет АДФ и неорганическому фосфату (см. рис. 13) прикрепиться к «головке», где они химически связываются, формируя АТФ
В фотосинтезирующих эукариотических клетках таких организмов, как водоросли и высшие растения, ответственные за этот процесс наномеханизмы обнаруживаются только в хлоропластах. Впрочем, впервые основная схема фотосинтетического процесса была открыта у бактерий, которые не расщепляют воду, но вместо этого утилизируют молекулярный водород. Независимо от того, что именно является основанием для процесса фотосинтеза, наномеханизмы, ответственные за превращение лучистой энергии в химическую, носят название реакционных центров. Как и факторы сопряжения, они состоят из групп белков, внедренных в мембраны. Эти белковые группы содержат пигменты, такие как хлорофилл, а также другие молекулы в определенных позициях, чтобы могла произойти фотобиологическая реакция. Эти белки составляют, говоря языком биохимиков, «каркас» для рабочих частей наномеханизма.
Процесс фотосинтеза в чем-то близок к волшебству. Свет поглощается, и создается химическая связь. Что делает волшебный наномеханизм, чтобы преобразовать энергию индивидуальных частиц света (фотонов) в сахар – вещество, которые мы, равно как и практически любой уважающий себя микроорганизм, станем использовать как источник энергии?
При фотосинтезе свет поглощается определенной молекулой – чаще всего это зеленый пигмент, хлорофилл. Поглощение света на определенных длинах волн (или в определенном цветовом спектре) специфическими молекулами хлорофилла приводит к химической реакции. Когда одна чрезвычайно специфическая молекула хлорофилла, встроенная в реакционный центр, поглощает энергию фотона, энергия световой частицы может оторвать от молекулы хлорофилла электрон. Приблизительно на миллиардную долю секунды молекула хлорофилла становится положительно заряженной. (Одно время у студентов были в ходу такие футболки с изображениями схематичных человечков. Один сообщал другому: «Я потерял электрон». Второй спрашивал: «Ты уверен?», а тот отвечал: «Положительно уверен!»)
В клетке не может существовать такого явления, как свободный электрон. После того как электрон высвобождается из молекулы, он должен куда-то деться. Одна возможность состоит в том, что он возвращается к той же молекуле, от которой оторвался, и это действительно происходит время от времени, но нечасто. Однако когда это все же происходит, реакционный центр испускает красный свет – в буквальном смысле начинает светиться. Но чаще всего энергии света оказывается достаточно, чтобы протолкнуть электрон к другой молекуле, которой он на самом деле не нужен, однако которая готова временно его принять. Как это работает?
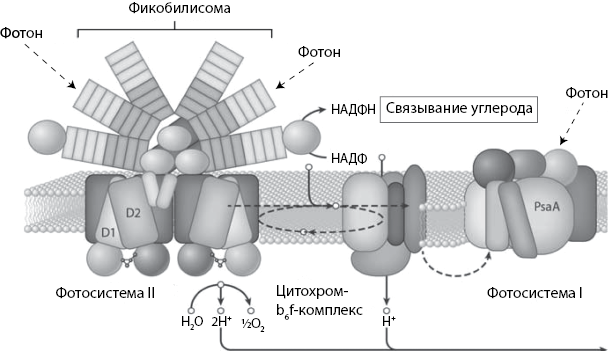
Рис. 16. Схематическая иллюстрация реакционного центра в производящем кислород организме. Это единственный биологический наномеханизм, способный расщеплять воду. Он состоит из многих белков, и его основной функцией является расщепление при помощи энергии Солнца воды на кислород, ионы водорода и электроны. Эта структура встроена в мембрану, и ионы водорода, образующиеся при реакции расщепления воды, скапливаются по одну сторону мембраны. Они проходят через фактор сопряжения (см. рис. 15) для производства АТФ, чтобы в конечном счете встретиться с электроном по другую сторону мембраны
Давайте представим на мгновение, что вы – электрон, ждущий поезда на платформе метро в час пик. На станцию приходит поезд, но он уже битком набит другими электронами. И вам становится ясно, что, будучи электроном с отрицательным зарядом, вы вовсе не желаете находиться в одном вагоне с толпой других электронов, каждый из которых тоже несет отрицательный заряд. Весь поезд прямо-таки наполнен негативной энергией. Однако когда двери открываются, человек в униформе и в белых перчатках заталкивает вас в вагон (такое действительно происходит в некоторых городах в час пик). Этот человек исполняет ту же роль, что и частица света, – заталкивает вас в среду, в которой вы не хотите находиться, в которой уже находится много других электронов. Из-за всех этих втиснутых в вагоны электронов поезд оказывается чрезвычайно отрицательно заряженным, однако когда он по мере движения подходит к другим станциям, электроны начинают выпрыгивать, привлеченные более свободными пространствами, где электронов меньше. После этого они принимаются за работу в надежде найти места с более положительной энергией. То же самое, но в самом микроскопическом масштабе, случается и в реакционных центрах. Однако там происходит и нечто еще более любопытное.
Электрон, вытолкнутый в реакционном центре из молекулы хлорофилла частицей света, оставляет после себя «дыру», и молекула оказывается положительно заряженной. Чтобы заполнить пустоту, молекула хлорофилла забирает электрон у близлежащих молекул. В случае организмов, выделяющих кислород, таких как сине-зеленые водоросли, эукариотические водоросли и все высшие растения, эти электроны поступают от четверки атомов марганца, удерживаемых специальным приспособлением с одной стороны мембраны. После того как они пожертвовали хлорофиллу свои электроны, эти атомы марганца также нуждаются в заполнении своих электронных пустот. Непосредственно рядом с собой они находят воду и, один за другим, извлекают четыре электрона из двух молекул воды, используя по очереди энергию четырех толчков, полученных от фотонов. По мере того как вода теряет электроны, от нее отделяются и протоны, и в конце концов кислород остается сам по себе и пускается на поиск новых электронов. Кислород славится своим умением находить электроны в природе, и именно поэтому мы называем молекулу, желающую отнять электроны у другой молекулы, окислителем. В фотосинтетических реакционных центрах другого типа источником электронов может быть сероводород (газ с запахом тухлых яиц), еще где-то – одна из форм ионов железа или углеводы (CH2O). В любом случае в конечном счете все источники электронов расположены вне организма, а основным применением всех этих электронов является производство сахаров.
Каким бы ни был источник, электрон неизменно направляется по одному пути, а протон – по другому. Протон, заряженный положительно, тоже может быть использован для выполнения работы. Вначале он помещается по одну сторону мембраны. Мембрана препятствует ему просто перейти на другую сторону, и в конечном счете оказывается, что по одну сторону мембраны расположено гораздо больше положительно заряженных протонов, чем по другую. По существу, это напоминает миниатюрную электрическую батарею, которая может быть использована для производства АТФ. Однако как протоны могут выполнять двойную функцию – как они могут воссоединяться с электронами, чтобы производить водород, этот элемент, необходимый для производства органических соединений? Давайте посмотрим, как работает это микроскопическое устройство.
Вспомним, что реакционные центры встроены в мембраны и что мембраны являются барьерами для свободного движения протонов и других заряженных молекул. После того как из воды или сероводорода извлекаются электроны, протоны сосредотачиваются по одну сторону мембраны. Мембрана представляет собой сплошной лист, нечто наподобие хлеба-питы с протонами, вложенными в карман вместо начинки. Проработав на солнечном свету всего несколько минут, фотосинтетические реакционные центры могут отложить внутрь этого кармана в 1000 раз больше протонов, чем находится во внешней среде; это означает, что положительный заряд по одну сторону мембраны в 1000 раз мощнее, чем по другую. Эти протоны переходят на противоположную сторону мембраны через механизм фактора сопряжения, поворачивая мотор и вырабатывая АТФ. Этот процесс происходит в каждом фотосинтезирующем организме; он является основным биологическим источником существующей в природе электрической энергии.
Однако что же происходит с протонами после того, как они проходят через фактор сопряжения и оказываются по другую сторону мембраны? Они встречаются с электронами, одновременно связываясь с другой модифицированной нуклеиновой кислотой. Эта молекула носит неблагозвучное имя никотинамидадениндинуклеотидфосфат, или НАДФ. Когда к НАДФ добавляются протон и электрон, молекула восстанавливается до НАДФН. Функция НАДФН заключается в том, чтобы транспортировать водород внутри клетки с целью его использования для производства органических соединений. Этот процесс может показаться чрезмерно усложненным, однако если бы клетка вырабатывала водород в свободном виде, этот газ, молекулы которого физически очень малы, мог бы с легкостью покинуть клетку. Путем разделения двух составляющих водорода – электрона и протона – и затем воссоединения их в составе такой крупной молекулы, как НАДФ, клетка может удерживать водород при себе. В фотосинтезирующих организмах атомы водорода, прикрепленные к НАДФН, в конечном счете используются для преобразования углекислого газа (CO2) в сахара, которые большинство прочих живых существ на этой планете используют для того, чтобы получать энергию.
Хотя это потребовало немалого терпения и некоторого везения, однако кристаллическая структура реакционного центра фотосинтезирующей бактерии, не расщепляющей воду, наконец была исследована тремя немецкими биохимиками: Хартмутом Михелем, Иоганном Дайзенхофером и Робертом Хубером. Результаты их работы, опубликованные в 1985 году в английском журнале Nature, ясно показали, как ядро из трех белков в сердцевине реакционного центра удерживает бактериальный хлорофилл и другие молекулы, образуя действующий наномеханизм. В 1988 году ученые получили Нобелевскую премию по химии. Несколько лет спустя были описаны также и кристаллические структуры реакционных центров, расщепляющих воду; сначала это сделала еще одна группа немецких исследователей, а позднее – несколько ученых в других странах. Мы можем видеть отдельные части механизма, но, к несчастью, не можем наблюдать их за работой – пока. Рентгеноскопические анализы не показывают фильм о действии этих механизмов, они могут дать только отдельные кадры. Они запечатлевают механизм в одном конкретном состоянии, но не раскрывают его движение, то, как он функционирует. Однако хотя этот недостаток и препятствует полному пониманию того, как в точности действуют реакционные центры, мы уже прошли немалый путь к осознанию механизма использования световой энергии для расщепления воды и производства кислорода.
Реакционные центры – это нечто особенное: когда они работают, весь наномеханизм превращается в буквальном смысле в микроскопическое светомузыкальное представление. Вспомним, что энергия света проталкивает электрон, взятый у молекулы хлорофилла с донорской стороны белкового комплекса, на акцепторную сторону. В результате на миллиардную долю секунды положительно заряженная молекула и отрицательно заряженная молекула оказываются внутри белкового каркаса, и их разделяет всего лишь миллиардная доля метра. Положительный заряд притягивает отрицательный заряд. Под действием силы притяжения зарядов белковый каркас слегка проседает, и при этом возникает волна сжатия. Такая волна сжатия аналогична хлопку ладоней; каждый раз, когда реакционный центр передвигает электрон, он издает микроскопический хлопок – звук, который в буквальном смысле может быть услышан при помощи очень чувствительного микрофона. Этот феномен, называемый фотоакустическим эффектом, был обнаружен Александром Грэмом Беллом, изобретателем телефона. В 1880 году он использовал этот эффект для генерирования звуковых волн из света и построил специальный аппарат, фотофон, для передачи такого звука. Кто знал, что этот феномен может быть использован для того, чтобы слушать звуки механизмов фотосинтезирующих организмов, выталкивающих электроны? Вместе с моими коллегами и давними друзьями (Дэвидом Мозероллом из Рокфеллеровского университета, Цви Дубински из университета Бар-Илана и Максимом Горбуновым из моей лаборатории) мы разработали прибор для измерения звука, издаваемого фотосинтетическим аппаратом живой клетки. Проведенный нами анализ этих звуков показал, что приблизительно 50 % световой энергии преобразуется в реакционных центрах в электрическую.
Однако существует и другой сигнал, показывающий, как действуют фотосинтетические реакционные центры. Помимо прочего, эти реакционные центры меняют свои флюоресцентные характеристики. Под воздействием синего света хлорофилл испускает красное свечение в процессе флюоресценции. Мы можем наблюдать такое свечение в флюоресцентных красках, на собственных зубах или на модных сейчас футболках, когда нас освещают ультрафиолетовым светом. Однако в фотосинтезирующих организмах интенсивность флюоресцентного красного свечения возрастает, когда все большее число реакционных центров включаются в работу. Коротко говоря, когда водоросли или листья находятся в темноте и затем подвергаются освещению синим светом, интенсивность испускаемого красного флюоресцентного свечения возрастает с большой скоростью. Об этом феномене впервые сообщили в 1931 году двое немецких химиков, Ханс Каутский и А. Хирш, наблюдавшие этот эффект невооруженным глазом. На протяжении последующих семидесяти лет было показано, что этот феномен может использоваться как количественный показатель того, сколько работы производят реакционные центры. В связи с этим он на настоящий момент регулярно замеряется во всем мире при помощи чувствительной аппаратуры для изучения того, сколько солнечного света фотосинтезирующие организмы преобразуют в полезную энергию. Я также на протяжении многих лет своей научной деятельности применял этот метод для исследования эффективности фотосинтетического преобразования энергии в Мировом океане. Собственно говоря, инструменты именно такого типа – способные измерять флюоресцентное свечение – я и брал с собой на Черное море, чтобы изучать фотосинтетические реакции в океанах.
В природе существует множество других наномеханизмов, но в мои намерения не входит описывать их все. Будем надеяться, что этот короткий взгляд «под капот» позволил получить некоторое представление о ключевых компонентах, требующихся для того, чтобы клетки могли функционировать. Все клетки наделены аналогичными механизмами для синтеза белка. У всех клеток имеется некий базовый механизм преобразования энергии, основанный на синтезе АТФ посредством фактора сопряжения. Все клетки обладают неким механизмом для передачи электронов и протонов переносчику водорода и отъема их у него. Все клетки создают электрическое поле по разные стороны мембраны, которая либо производит, либо поглощает АТФ. И наконец, все клетки в конечном счете зависят от фотосинтезирующих организмов, преобразующих солнечную энергию для создания электрического поля, которое генерирует поток электронов и протонов, благодаря чему становится возможной вся жизнь на этой планете, включая и нас с вами.
Как мы видим, наномеханизмы, возникшие еще у первых микробов, обеспечивали функционирование клеток на протяжении всей истории жизни на Земле. Глядя на наследие древних микробиологических наномеханизмов в жизнедеятельности современных, живых клеток, можно поддаться впечатлению, будто микроорганизмы прошли через все эти геологические эпохи, ничуть не изменившись. Однако это совсем не так. Возвращаясь к микроорганизмам древнего мира, мы видим, что за прошедшее время они эволюционировали.
Первые фотосинтезирующие микроорганизмы были аноксигенными, то есть они не могли расщеплять воду. Должно было пройти несколько сотен миллионов лет, прежде чем микроорганизмы развили в себе эту способность. Вода – идеальный источник водорода на поверхности Земли, поскольку она распространена гораздо больше, нежели любой другой потенциальный донор электронов, однако на расщепление воды требуется много энергии. Ответственные за этот процесс наномеханизмы появились у прокариотов лишь единожды: у цианобактерий, или же сине-зеленых водорослей. Когда эти организмы в конце концов получили возможность расщеплять воду, они принялись производить новый газообразный продукт – кислород. И биологическая выработка кислорода навсегда изменила эволюционный путь жизни на Земле.
Назад: Глава 3. Мир до начала времен
Дальше: Глава 5. Суперзаряд двигателей

