Книга: 120 лет жизни – только начало. Как победить старение?
Назад: Так что такое старение?
Дальше: Пути к радикальному продлению жизни
7 критериев старения
У такого сложного явления, как старение, не может быть исчерпывающего определения. Тем не менее мы все же должны уметь отличать процессы старения от других изменений. Эта способность крайне необходима для того, чтобы осуществлять профилактику старения и связанной с ним нетрудоспособности, создавать и внедрять диагностику и терапию ранних стадий возраст-зависимых заболеваний. На помощь могут прийти критерии, по совокупности которых мы можем выявить старение уже на ранних стадиях. Критерии – не то же самое, что симптомы: когда проявляется симптом, это означает, что процесс уже зашел достаточно далеко. Нам же необходимо определять те сдвиги в физиологии, которые приводят к возникновению и развитию симптомов.
Каждый критерий старения в идеале должен обладать несколькими свойствами: (1) он должен проявляться на самых ранних этапах естественного старения; (2) его экспериментальное обострение должно ускорить старение; и (3) его предотвращение должно замедлить процесс старения и, следовательно, увеличить здоровый период жизни.
Критерий 1. Генетическая нестабильность
Основные функции нашего тела контролируются генами, находящимися в хромосомах ядра. В каждой клетке имеется всего две копии каждой хромосомы, да и те не являются идентичными – могут иметь разные варианты одного и того же гена (аллели). Поэтому повреждение молекул ДНК, из которых состоят хромосомы, может иметь печальные последствия для функций, выполняемых клеткой. Всплеск повреждений ДНК и мутаций, наблюдаемый при старении, носит название генетической нестабильности. Рассмотрим некоторые разновидности этой нестабильности.
Теломеры и теломераза
На концах каждой из хромосом имеются особые участки, называемые теломерами. Это важные области ДНК, за которые хромосомы прицепляются к внутренней оболочке клеточного ядра (рис. 22). На теломерах расположены особые белки, которые защищают хромосомы от атаки некоторых ферментов. Например, экзонуклеаз, в норме охраняющих наши клетки от вирусных ДНК, или лигаз, сращивающих обрывы нитей ДНК. Если бы не было теломер и связанных с ними защитных белков, экзонуклеазы отрезали бы от хромосом куски, а лигазы пришивали одни хромосомы к другим. Теломеры играют важную защитную роль, поэтому клетки с поврежденными хромосомами не способны поделиться или даже выжить, а иногда, напротив, начинают бесконтрольно делиться – становятся раковыми. Области хромосом, если они расположены близко от теломер, содержат большое количество метильной метки – это химическая модификация букв ДНК, способствующая более компактной упаковке нити ДНК и заставляющая молчать расположенные вблизи метилированного участка гены. Расположение теломер на самых концах хромосом приводит к тому, что с каждым клеточным делением они немного укорачиваются. Процесс укорочения хромосом при делении был предсказан советским иммунологом А. М. Оловниковым в 1971 году и экспериментально доказан нобелевскими лауреатами К. Грейдер и Э. Блекберн. Укорочение теломер не всегда связано с делением клетки. На концах хромосом могут возникать опасные разрывы, например при избытке свободных радикалов, что также провоцирует укорочение хромосом.
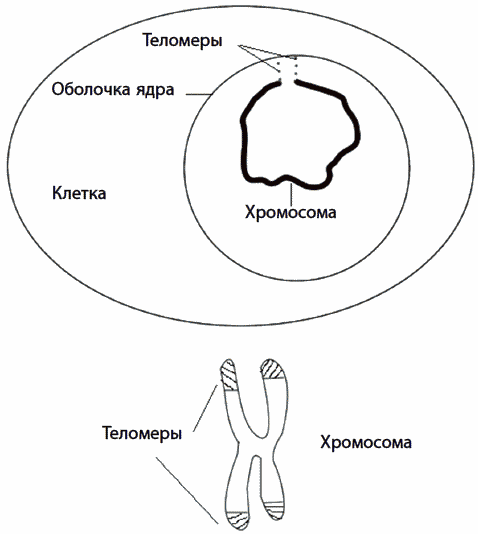
Рис. 22. Теломеры на концах хромосом в покоящемся ядре клетки (вверху) и на стадии клеточного деления (внизу)
В делящихся клетках с возрастом концы хромосом укорачиваются настолько, что они теряют защитный комплекс белков. В близко расположенных к укороченным теломерам генах также пропадает метильная метка, которая заставляла эти гены молчать. Прителомерные гены активизируются, что сеет хаос в сбалансированной системе клеточных белков. «Оголившиеся» концы воспринимаются клеткой как сигнал об обрыве. В отличие от обычного разрыва ДНК попытка клетки залечить такой «обрыв» по понятным причинам является безуспешной.
Далее возможны два варианта событий.
В одних клетках происходит необратимая остановка клеточных делений. Особенно неприятно, когда перестают делиться стволовые клетки – незрелые предшественники прочих типов клеток в каждой ткани. Это приводит к тому, что клеток нужной ткани определенного органа становится недостаточно, в результате чего нарушается функция этой ткани или органа. Например, от укорочения теломер с возрастом страдают клетки – основательницы клеток крови и клеток, выстилающих поверхность сосудов. Это является одной из причин анемий, иммунных расстройств и атеросклероза.
В других клетках при обнаружении псевдообрыва ДНК включается программа самоликвидации (апоптоза). Она также приводит к нарушениям в тканях.
О смертельной опасности укорочения концов хромосом говорит тот факт, что у лиц старше 60 лет чем короче теломеры, например в лимфоцитах крови, тем более высокими являются показатели смертности от инфекционных и сердечно-сосудистых заболеваний.
Для того чтобы теломеры не укорачивались в половых клетках и эмбриональных стволовых клетках, в них активен специальный фермент – теломераза. Он достраивает теломеры после каждого деления. Однако в клетках большинства тканей и органов человека ген одного из компонентов теломеразы отключен или работает очень слабо. Побочным следствием такого выключения является так называемое репликативное старение – прекращение способности к делению. Природа пошла на этот шаг, чтобы обезопасить развивающийся организм от смертельного заболевания – рака. Обычные клетки не могут делиться более определенного числа раз, что тормозит образование опухолей. Действительно, теломераза каким-то образом реактивируется в большинстве видов опухолевых клеток, делая их защищенными от клеточного старения, практически бессмертными. В то время как обычные фибробласты делятся в чашках Петри примерно 50 раз и погибают, претерпевшие злокачественное перерождение способны делиться в клеточной культуре десятилетиями. Искусственная индукция теломеразы в обычных фибробластах тоже вызывает их бесконечное деление. Научной группе под руководством Марии Бласко удалось с помощью генной терапии вернуть активность теломеразы тканям старых мышей, в результате чего они стали жить дольше и меньше болеть возраст-зависимыми заболеваниями.
Мутации
В 1958 году в статье «О природе процесса старения» Лео Сцилард, заложивший принципы создания атомной бомбы, выдвинул гипотезу о том, что элементарным событием старения является случайное повреждение хромосомы, инактивирующее ее гены. С возрастом накапливаются поломки хромосом не только в области теломер, но и по всей их длине. Это связано прежде всего с тем, что механизмы починки (репарации) ДНК перестают эффективно работать. Любое повреждение «букв» (нуклеотидов), из которых состоят наши гены, или разрыв цепочки ДНК на фоне недостатка репарации в стареющей клетке становится причиной мутации. Чем больше мутаций приобретает клетка, тем она менее жизнеспособна или выше риск, что она станет опухолевой.
Узнай больше
Ошибки в ДНК могут возникать также в процессе ее удвоения при делении клеток. Процесс этот сложный, он включает в себя несколько стадий. Сначала двойная спираль ДНК раскручивается и разделяется на две отдельные нити с образованием так называемой репликационной вилки. Легче всего вообразить этот процесс как расстегивание молнии на одежде. Затем специальные ферменты выполняют копирование каждой нити расплетенной двойной спирали ДНК. После этого происходит сплетение дочерних нитей с родительскими с образованием двух новых спиралей ДНК. В идеальном случае каждая дочерняя нить должна быть полностью идентичной материнской, но на практике в процесс могут закрадываться разнообразные ошибки. Это могут быть однобуквенные замены при неправильном копировании дочерней нити на материнской нити ДНК, а может быть запутывание нитей, ведущее к остановке репликационной вилки и разрывам ДНК (репликативный стресс). К репликативному стрессу ведут также межнитевые сшивки ДНК и сшивки ДНК с расположенными на ней белками. Эти неприятные явления вызываются уже знакомыми нам продуктами перекисного окисления липидов мембран и конечными продуктами гликирования, которых с возрастом возникает все больше.
Мобильные генетические элементы
Еще одной причиной генетической нестабильности при старении является активизация «прыгающих генов» (мобильных генетических элементов, ретротранспозонов). Это вирусоподобные фрагменты ДНК, затаившиеся в наших хромосомах.
Как правило, они инактивированы при помощи большого количества метильных меток. В местах возникновения случайных разрывов ДНК хромосомы менее доступны для ферментов, расставляющих метильные метки, необходимые для поддержания прыгающих генов в молчащем состоянии.
При такой активации ретротранспозоны начинают копироваться и перепрыгивать на другие участки хромосомы. Перепрыгивая с места на место, мобильные гены нередко прихватывают с собой фрагменты важных клеточных генов либо на новом месте встраиваются в другие гены, тем самым выключая их. Иногда, напротив, они включают гены, которые в норме должны молчать, предоставляя им свои системы активации. Происходит дестабилизация генома, приводящая к хаосу и клеточному старению.
Как показала Виктория Луняк, руководитель лаборатории Института старения Бака в Калифорнии, активность ретротранспозонов является ключевой причиной старения стволовых клеток костного мозга, а ее подавление приводит к восстановлению способности к регенерации данной ткани.
Примерно по тем же причинам, что и ретротранспозоны, в старых клетках активируются молчащие вирусные инфекции. В результате запускаются воспалительные реакции.
Синдромы ускоренного старения
Важным доказательством того, что генетическая нестабильность является критерием старения, служат синдромы ускоренного старения. Все они, так или иначе, связаны с врожденными мутациями в генах, управляющими починкой ДНК. Такие мутации приводят к тому, что молодые люди или даже дети начинают проявлять признаки старения и выглядеть как пожилые. Ускоренное старение проявляется и в результате экспериментально вызываемых мутаций в генах восстановления ДНК у мышей.
Эпимутации
Несмотря на регулярные поломки хромосом и снижение эффективности их починки с возрастом, мутации довольно редки и накапливаются с возрастом медленно. Частота образования раковых заболеваний и других возраст-зависимых патологий говорит о том, что изменения в активности генов при старении наступают гораздо быстрее. Как оказалось, другой тип изменений хромосом – эпимутации, то есть изменения активности генов без изменения последовательности ДНК – наступает во много раз чаще и вносит более значительный вклад в старение. Эпимутации связаны с деактивацией или активацией генов за счет изменения рисунка метильных меток, расставленных по геному. Наличие метильных групп в буквах генетического кода заставляет ген замолчать, в то время как убирание метилирования вновь активирует ген. Все это нужно организму для того, чтобы на основе одного и того же генотипа создавать клетки и ткани с разным набором активных генов и синтезируемых ими белков. Те белки и функции, которые нужны нейронам головного мозга, ни к чему клеткам печени, и наоборот. А в нашем теле более 200 разных типов клеток.
Как известно, однояйцевые близнецы являются клонами – точными генетическими копиями друг друга. Метильный профиль их хромосом в одних и тех же сравниваемых тканях в раннем детстве тоже практически совпадает. Однако к старости рисунок метильной разметки хромосом близнецов резко отличается, несмотря на генетическую идентичность и одновозрастность. Таким образом, в различных тканях с возрастом хаотично накапливаются эпимутации, приводящие к изменению активности многих (от 1 до 10 %) генов. Как теперь известно, эпимутации являются причинами разных видов рака, атеросклероза, ишемической болезни сердца, диабета, болезни Альцгеймера.
С возрастом происходит глобальное деметилирование генома, вызывающее активацию генов, которые в норме должны «молчать». Оно провоцируется поломками хромосом, возрастным снижением активности ферментов, расставляющих метильную метку, избытком аминокислоты гомоцистеина, недостаточным уровнем половых гормонов. На вероятность деметилирования существенно влияют образ жизни человека и окружающая среда, включая особенности питания. Например, недостаток потребления и усвоения в старости витаминов – фолиевой кислоты и B12, микроэлементов цинка и селена.
Напротив, ряд важных генов, например гены рецепторов половых гормонов, теломеразы, репарации ДНК в некоторых тканях испытывают избирательное гиперметилирование. Этот вид эпимутации приводит к отключению функции данного гена. Причины возрастного гиперметилирования пока не ясны. Но уже сегодня понятно, что управление процессом метилирования может дать один из подходов к управлению старением.
Критерий 2. Нарушение регуляции
Регуляция обмена веществ, постоянства внутренней среды (гомеостаза), а также осуществления системных функций (дыхание, выделение, пищеварение, кровообращение, иммунитет) жизненно важна. Ее нарушение приводит к различным заболеваниям и повышает вероятность смерти. В то же время все эти регуляторные процессы подвержены возраст-зависимым изменениям, большинство из которых неблагоприятно. Например, нередко утрачивается способность поддерживать постоянство концентрации сахара, липидов и электролитов в крови, pH крови, артериального давления, уровней гормонов. По нашему убеждению, нарушение регуляции – ключ к старению. Данный процесс проявляется на ранних этапах старения, его обострение ускоряет старение, противодействие ему замедляет старение. Рассмотрим его подробнее.
Нейроэндокринная регуляция
Физиологическая регуляция всех функций организма находится под контролем нервной и эндокринной систем, каждая из которых претерпевает существенные изменения при старении.
Наши эксперименты показали, что для того, чтобы существенно продлить жизнь подопытных животных, можно активировать определенные гены не во всем теле, а лишь в центральной нервной системе. Многочисленные исследования других авторов (группы Доншенг Каи из Колледжа Альберта Эйнштейна, коллектива под руководством Томаса Бартфаи из Института Скриппса в США) также подтвердили, что активация или подавление определенных генов в центральном нейроэндокринном регуляторе метаболизма – гипоталамусе – замедляет старение во всем теле.
Сосудистые изменения в головном мозге в результате артериальной гипертензии и атеросклероза, снижение метаболизма нейронов, падение уровня передатчиков нервного сигнала, накопление токсичных агрегатов амилоидных белков, хронический психологический стресс способствуют развитию старческой деменции, депрессии, нейродегенеративных патологий (болезнь Альцгеймера, болезнь Паркинсона). С возрастом нарушается функция таких отделов центральной нервной системы, как гипоталамус, гипофиз и эпифиз, что негативно влияет на работу периферических эндокринных желез (щитовидной, поджелудочной, надпочечников, половых желез) и диффузной эндокринной системы. В результате выходят за пределы нормы и суточной ритмики многие жизненно важные гормоны, что повышает риск десятков заболеваний (табл. 17).
Таблица 17. Гормональные нарушения при старении

Регуляторные пути клетки
Спустимся с организменного уровня на уровень клетки. Здесь тоже старение обусловлено нарушением регуляции. Примерно половина всех белков, принимающих участие как в развитии возраст-зависимых патологий, так и в обеспечении долголетия человека, – это регуляторные белки, требующиеся для восприятия и передачи сигналов между клетками и извне. Гормональные сдвиги, нарушения межклеточных коммуникаций и генетическая нестабильность обусловливают изменение регуляции активности сотен и тысяч генов, в зависимости от типа ткани, и прежде всего генов, необходимых для роста и деления клеток, а также для обеспечения стрессоустойчивости.
Регуляция иммунитета
Старение связано с нарушением естественной регуляции иммунитета. Иммуностарение затрагивает как врожденный, так и приобретенный иммунитет. Врожденный иммунитет – эволюционно наиболее древняя его форма, активная с рождения, до встречи с конкретным патогеном. Ее обеспечивают клетки-фагоциты, которые проникают из крови в очаг воспаления и убивают инфекцию, нередко повреждая и собственные клетки организма.
Приобретенный иммунитет – эволюционно молодая форма защиты, выражающаяся в производстве специфических антител, нейтрализующих патоген. Ее реализация требует предварительного контакта с данным вирусом или бактерией. В то время как адаптивный иммунитет с возрастом угнетается, врожденный, напротив, активизируется.
С возрастом происходит постепенная утрата тимуса – органа, в котором происходит созревание иммунных Т-клеток. У пожилых людей, как правило, нарушена активация и способность к делениям таких клеток иммунной системы, как Т– и В-лимфоциты и естественные киллеры. В результате этих нарушений регуляции при старении наблюдается реактивация латентных вирусных инфекций под действием затаившихся в геноме вирусов, увеличивается заболеваемость различными инфекциями, аутоиммунными патологиями, повышаются риски опухолевых процессов.
Ожирение ускоряет старение тимуса и понижает иммунитет
Группа американских ученых из Университета штата Луизианы в опытах на мышах установила, что ожирение нарушает формирование Т-лимфоцитов и вызывает преждевременное старение тимуса. Полученные на мышах результаты, видимо, применимы и к людям, поскольку у страдающих ожирением людей среднего возраста, независимо от того, есть ли у них диабет 2-го типа, также нарушена функция тимуса. Таким образом, можно сделать вывод, что ожирение ускоряет связанную со старением инволюцию тимуса, что в итоге снижает разнообразие Т-лимфоцитов, ограничивая иммунную защиту.
Напротив, происходит гиперактивация воспалительных функций – увеличивается образование медиаторов воспаления. Клетки соединительной ткани (фибробласты), которые состарились и перестали делиться, а также избыточные жировые клетки становятся для организма источником воспалительных гормоноподобных белков – цитокинов, что приводит к системным воспалительным процессам, способствующим новому витку нейродегенерации, ишемической болезни сердца, заболеваниям почек, желудочно-кишечного тракта.
Критерий 3. Нарушение обмена веществ
Водно-солевой баланс
Результаты исследований, выполненных на экспериментальных животных и человеке, указывают на то, что процесс старения сопровождается изменениями в способности тела регулировать баланс воды и электролитов, прежде всего натрия. Как правило, происходит дегидратация тканей, гипо– или гипернатриемия, наблюдается в целом негативный минеральный баланс. Кроме того, пожилые люди гораздо более восприимчивы к изменению этого баланса, чем молодые. Основные причины этих изменений отражены в таблице 18.
Таблица 18. Причины возрастных нарушений водно-солевого баланса

Пожилые люди зачастую страдают от дисбаланса натрия. Чаще речь идет о его недостатке в плазме крови и реже – об избытке. Недостаток натрия в крови (менее 130 ммоль/л) приводит к перераспределению воды из кровотока в ткани тела, что способствует возникновению отеков, наиболее опасный из которых отек головного мозга. Утрата натрия при старении вызывается повышенным мочеотделением, в том числе в связи с приемом диуретиков, гиперсекрецией антидиуретического гормона (вазопрессина), гипофункцией гормонов щитовидной железы, сердечной недостаточностью, болезнями печени и почек, сахарным диабетом, повышенной жаждой. Действенный способ избежать недостатка натрия – не превышать, но и не понижать суточную норму потребляемой жидкости.
Нарушение баланса других минералов, в частности кальция и магния при старении способствует остеопорозу. Оно связано с нарушением усвоения минералов и витамина D в кишечнике, изменением функции почек при старении. Недостаток магния может вызывать дополнительное снижение продукции мелатонина, ухудшая качество сна.
Как снизить риск остеопороза с помощью питания?
Необходимо позаботиться о балансе количества кальция в питании. Источниками кальция являются зеленые овощи (петрушка, салат листовой, лук), бобовые, орехи, рыба, цитрусовые, кунжутное масло (1 чайная ложка содержит суточную потребность организма в кальции). Для лучшего усвоения кальция организму необходимы магний, витамины B6, A и D.Надо помнить, что кальций полноценно усваивается только при условии нормального функционирования желудка и кишечника. Такие болезни, как гастрит, язвенная болезнь, панкреатит, холецистит могут снизить всасываемость кальция на 80–90 %.Кроме того, усвоению кальция мешают злоупотребление алкоголем, курение, кофеин и сладости в большом количестве, а также недостаток физической активности.
Энергетический метаболизм и митохондрии
Стареющие ткани страдают от упадка энергетического метаболизма, что во многом связано с нарушением структуры и функций митохондрий.
Митохондрии участвуют в реализации важнейших метаболических функций – клеточного дыхания (выработки АТФ) и «сжигания» (бета-окисления) жирных кислот.
Выполнение этих задач в пожилом возрасте нарушается, что связано как с дисфункцией самих митохондрий, так и с нарушением митофагии – процесса уничтожения клеткой поврежденных митохондрий.
Старение митохондрий связано с накоплением окислительных мутаций и выпадением кусков митохондриальной ДНК, нарушением структуры, агрегацией и утратой функций митохондриальными белками, перекисным окислением липидов мембран, снижением эффективности митохондриальной электрон-транспортной сети.
Выпадения фрагментов митохондриальной ДНК приводят к тому, что митохондрии теряют способность участвовать в клеточном дыхании – синтезировать АТФ. В то же время «облегченная» версия этой ДНК легче копируется, и поэтому дефектные митохондрии успешнее размножаются внутри стареющей клетки, заполняя ее практически целиком.
Клетка, наполненная дефектными митохондриями, испытывает острый энергетический голод. Страдают все энергозависимые процессы – биосинтез белков, восстановление повреждений, межклеточный обмен сигналами.
Нарушение функций митохондрий с возрастом сопровождается увеличением образования перекиси водорода, которая в присутствии ионов двухвалентного железа распадается до крайне токсичного гидроксил-радикала. Несмотря на позитивную сигнальную роль некоторых свободных радикалов в стресс-ответе, выход их из-под контроля при старении нарушает качество клеточных белков, целостность мембран и генетическую стабильность митохондрий.
Профессор Вашингтонского университета Мэтт Каберлейн относит сахарный диабет 2-го типа, сердечную недостаточность и болезнь Паркинсона к митохондриальным заболеваниям, поскольку в их патогенезе ключевую роль играет дисфункция именно этой энергетической структуры клетки.
Как известно, в эволюции митохондрии произошли от симбиотических бактерий, поселившихся в древних предках эукариотических клеток.
Молекулярные повреждения тканей при старении сопровождаются выходом в кровь связанных с повреждением молекул, вызывающих системное воспаление. Существенный вклад в этот процесс вносят именно митохондрии.
Повреждение митохондрий, в частности, сопровождается выбросом в тканевую жидкость определенных пептидов и фрагментов митохондриальных ДНК. Из-за схожести митохондрий с бактериями особые рецепторы на поверхности клеток распознаю́т их молекулы как сигнал о бактериальном заражении.
Активация данных рецепторов запускает реакции врожденного иммунитета и воспаления, так как продукты распада митохондрий схожи с факторами, сопровождающими бактериальное заражение.
Узнай больше
В процессе старения замедляется устранение поврежденных и нефункциональных митохондрий при помощи автофагии (а точнее, ее разновидности – митофагии), что провоцирует их накопление и хронический окислительный стресс, который нарушает баланс окислительно-восстановительных процессов в клетке. Как известно, процесс автофагии подавляется активностью киназы TOR, которая нарастает в стареющей клетке. Ингибиторы TOR (в частности, рапамицин) и снижение уровней аминокислоты метионина способны стимулировать митофагию.Проведенная в экспериментах на модельных организмах индукция повышенной активности митохондриальной протеазы LON, устраняющей поврежденные митохондриальные белки, и митофагии, устраняющей дефектные митохондрии, способствует увеличению продолжительности жизни.
Критерий 4. Нарушение регенерации тканей
Клеточное старение
В 1961 году американцы Хейфлик и Мурхэд показали, что клетки, полученные из соединительной ткани и содержащиеся в питательной среде вне организма, способны поделиться лишь определенное количество раз. Этим нормальные фибробласты отличаются от опухолевых клеток, способных делиться при культивировании неограниченное количество раз. Данное явление получило название клеточного старения.
Клеточное старение – это необратимая утрата способности клеток к делению в регенерирующихся тканях. Результатом клеточного старения является появление остановивших свой клеточный цикл сенесцентных клеток.
Процессы клеточного старения лежат в основе нейродегенерации, остеопороза, дистрофии сетчатки, потери слуха, сердечно-сосудистых заболеваний, саркопении, одряхления, диабета 2-го типа, метаболического синдрома, недостаточности функций легких и почек, канцерогенеза, поскольку в результате них прекращается обновление клеточного состава тканей и органов.
Явление клеточного старения – неслучайный процесс. По мнению Джуди Кампизи, профессора из Института старения Бака, оно запрограммировано и выработалось в процессе эволюции как одна из форм ответа клетки на значительное повреждение. Являясь позитивным в раннем периоде жизни (подавляя развитие опухолей, участвуя в заживлении ран), клеточное старение становится негативным в позднем периоде жизни, вызывая старение организма и связанные с ним патологии.
Клеточное старение – универсальное явление. Ученым удалось наблюдать накопление неспособных к делению клеток с возрастом в коже, сетчатке, печени, селезенке, аорте, почках, легких человека и различных животных (приматов, грызунов, рыб).
Клеточное старение распространено в участках тела, затронутых возраст-зависимыми патологиями – трофическими язвами, атеросклеротическими бляшками, артритом, хронической обструктивной болезнью легких, накоплением висцерального жира, доброкачественной гиперплазией предстательной железы, предопухолевыми поражениями, в головном мозге – при болезни Альцгеймера.
Узнай больше
В настоящее время активно изучаются причины клеточного старения. Выделяют, по крайней мере, три причины необратимой остановки клеточного деления (рис. 23). Первый вид – это онкоген-индуцированное клеточное старение, когда клетка перестает делиться в ответ на накопление опухолеродных белков, гиперстимуляцию деления, активацию ряда сигнальных путей, отвечающих за направление ресурсов клетки на рост и деление. Второй вид – стресс-индуцированное старение, которое реализуется в некоторых типах клеток при возникновении двухцепочечных разрывов ДНК. Третий вид – репликативное старение, возникающее в ответ на укорочение теломерных концов хромосом. Все три вида, так или иначе, способствуют предотвращению или остановке опухолевого роста. Однако в условиях генетической нестабильности, имеющей место в старости, частота возникновения сенесцентных клеток резко возрастает, что приводит к нарушению регенерации тканей.
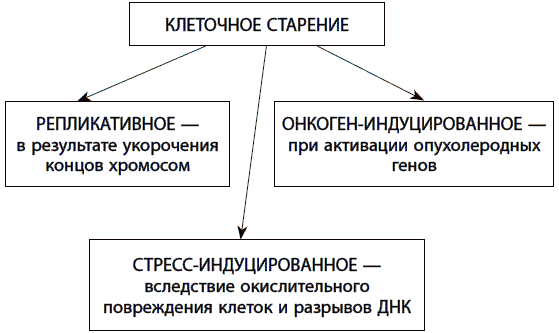
Рис. 23. Типы клеточного старения
Одна из причин, по которой клеточное старение выступает спусковым крючком возраст-зависимых патологий, заключается в его способности вызывать воспалительные процессы. Сенесцентные клетки секретируют воспалительные сигнальные белки – цитокины. Это так называемый старениезависимый секреторный фенотип стареющей клетки. Например, выделяемый сенесцентными клетками цитокин амфотерин активизирует сигнальные пути врожденного иммунитета, что приводит к усиленной секреции цитокинов воспаления макрофагами и последующей воспалительной реакции. В то же время хроническое воспаление ускоряет все основные возраст-зависимые патологии – от нейродегенерации до канцерогенеза. Старениезависимый секреторный фенотип эволюционно сформировался для того, чтобы сообщать сигнал о клеточном повреждении другим клеткам и стимулировать тканевую репарацию. Эта его роль проявляется, например, в процессе заживления ран. Кроме того, он является механизмом самоустранения сенесцентных клеток. Воспалительные цитокины привлекают иммунные клетки и вызывают атаку их источника. Однако возможности иммунитета с возрастом снижаются, и сенесцентные клетки перестают эффективно удаляться.Помимо цитокинов, сенесцентные клетки секретируют ферменты для разрушения внеклеточных белков – металлопротеиназы. Эти ферменты в том числе разрушают коллаген, гликозаминогликан и эластин, составляющие основу межклеточного вещества. Чтобы читателю было проще представить их влияние на здоровье, отметим, что разрушение коллагена и гликозаминогликанов проявляется, например, в нарушениях регенерации хрящевой ткани, что приводит к возраст-зависимым заболеваниям суставов. Но этим их влияние не ограничивается. Образующиеся фрагменты разрушенных металлопротеиназами белков – матри-криптины – обладают сигнальной активностью. Они ингибируют рост сосудов и могут вызывать гибель клеток. Таким образом, старениезависимый секреторный фенотип нарушает структуру и функцию нормальных тканей, подавляет способность к делению стволовых клеток, стимулирует озлокачествление (рис. 24).
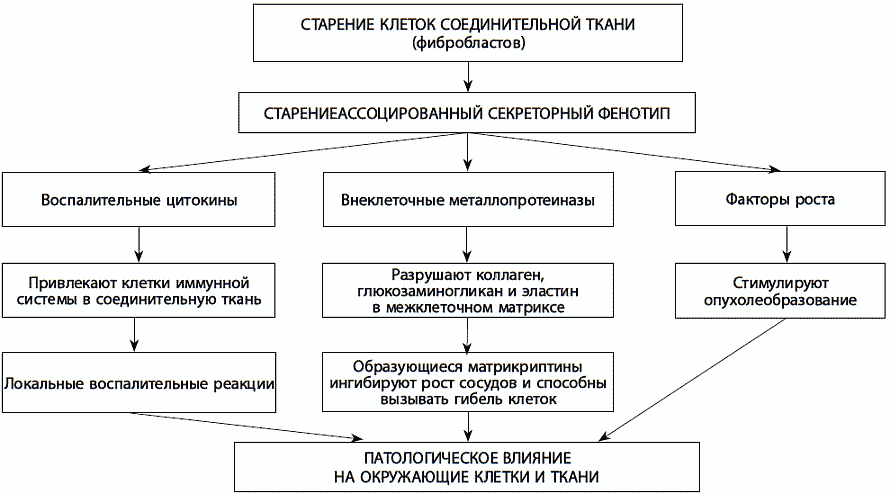
Рис. 24. Роль старениезависимого секреторного фенотипа в патологических процессах
Благодаря заметной роли в патогенезе старение-зависимых заболеваний, клеточное старение является потенциальной мишенью для терапевтических вмешательств. Среди стратегий борьбы с проявлениями клеточного старения научная группа Джуди Кампизи выделяет подавление секреторного фенотипа и индукцию избирательной гибели сенесцентных клеток. Генетически сконструированные мыши, у которых сенесцентные клетки самоликвидировались, отличались существенным замедлением в развитии возраст-зависимых заболеваний, в частности саркопении, катаракты, утраты жировой ткани.
Как снизить риск развития катаракты?
Необходимо правильное питание с достаточным количеством витаминов С, Е, В1, В12, а также каротиноидов лютеина и зеаксантина. Все проводившиеся в разное время, в разных странах исследования показывают, что у людей, потребляющих ежедневно три-пять порций овощей и фруктов, риск развития катаракты снижается в пять раз по сравнению с теми, чей рацион лишен этого количества овощей и фруктов. Отличные пищевые источники витамина С – апельсины, грейпфруты, клубника, папайя, а также зеленый перец и помидоры. Жирорастворимый витамин Е содержится в растительных маслах, миндале и других видах орехов, проросшем пшеничном зерне и семенах подсолнуха. Лютеин и зеаксантин присутствуют в овощах с темно-зелеными листьями и в несколько меньших количествах в цветных фруктах и овощах, таких как морковь, брокколи, желтый перец, кукуруза, горох, хурма и мандарины. Витамин В1 содержится в крупах, хлебе, красном мясе, яичном желтке, зеленых овощах, бобовых, коричневом рисе, ягодах, дрожжах, картофеле и орехах. Витамин В2 содержится в зерновых, молоке, мясе, яйцах, сыре и горохе.Имеются научно подтвержденные данные, что одним из факторов, способствующих возникновению катаракты, является диабет: у больных диабетом катаракта развивается в три-пять раз чаще. Как известно, развитие диабета ускоряется на фоне избыточного веса. Поэтому контроль за собственным весом в какой-то мере способствует и снижению риска катаракты.Курение – еще один из наиболее убедительно доказанных факторов риска развития катаракты. Это объясняется тем, что у курильщиков серьезно страдает обмен веществ.Значительный вред хрусталику наносит ультрафиолетовое излучение солнца. Периодическое воздействие ультрафиолетом повышает вероятность возникновения катаракты. Для защиты глаз от яркого солнечного света полезно носить темные очки или широкополую шляпу.Нужно избегать поднятия тяжестей, резких рывков, прыжков и падений.
Гибель клеток
Программируемая гибель клеток (апоптоз) – генетически регулируемый процесс самоликвидации клетки. При запуске апоптоза клетка активирует ферменты, разрушающие ее цитоскелет, в результате чего она распадается на фрагменты, которые близлежащие клетки используют в качестве строительных блоков. Одновременно активируются ферменты, уничтожающие ядерную ДНК ликвидируемой клетки.
Апоптоз играет важную роль в различных физиологических процессах, таких как дифференцировка органов и тканей в раннем эмбриональном развитии, надзор за вирусинфицированными клетками, иммунный ответ, удаление ненужных или поврежденных клеток в постнатальный период, подавление опухолевого роста. В то же время апоптоз побочно обусловливает процесс старения организма, поскольку приводит к гибели стволовых клеток или клеток в нервной и мышечной тканях, в которых клеточное деление прекратилось, вызывая в этих тканях дегенеративные изменения (рис. 25).
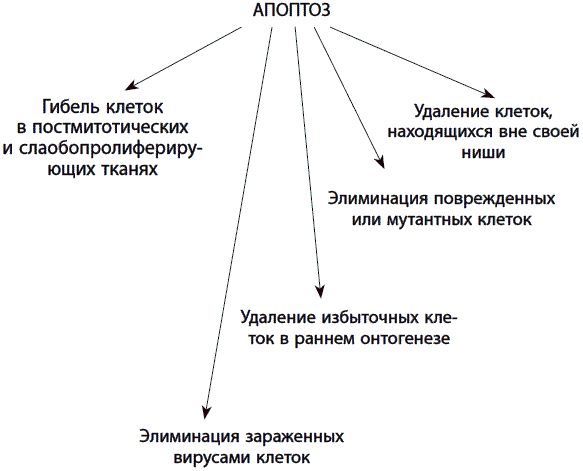
Рис. 25. Функции апоптоза в индивидуальном развитии и старении
Возможны несколько способов участия апоптоза в процессе старения. Во-первых, позитивный, через устранение опухолевых и поврежденных стареющих клеток (например, фибробластов и клеток печени), которые затем могут быть заменены путем деления; таким образом, сохраняется тканевый гомеостаз. Во-вторых, утрата постмитотических клеток (например, нервных клеток или клеток сердечной мышцы), которые не могут быть заменены, что ведет к патологии. В третьих, при старении отдельные типы клеток теряют способность подвергаться апоптозу, что может служить причиной избыточного накопления нефункциональных стареющих клеток, аутоиммунных заболеваний (таких, как ревматоидный артрит) или опухолевого процесса. Таким образом, частью феномена старения может являться как увеличение чувствительности клеток к апоптозу, так и снижение, то есть тканеспецифическая разрегулировка апоптоза.
Истощение количества стволовых клеток
Развитие каждого индивида начинается с эмбриональных стволовых клеток. Даже самые примитивные многоклеточные организмы обладают стволовыми клетками. На ранних стадиях развития эмбриона из имеющихся клеток могут сформироваться любые клетки и ткани организма (несколько сотен типов). После первых нескольких делений зародыша стволовые клетки могут давать начало только некоторым, но не всем, клеточным линиям, а еще позже они могут становиться родоначальниками всего лишь нескольких определенных клеточных типов. Последняя группа стволовых клеток присуща, в небольшом количестве, и взрослому организму. Они обычно пребывают в состоянии покоя либо делятся симметрично (самовоспроизводятся), но при необходимости могут приступить к асимметричному делению, образуя клетки, из которых далее развиваются зрелые клетки, необходимые для функционирования той или иной ткани.
Замена поврежденной клетки на новую в результате асимметричного деления стволовой клетки может обеспечить неограниченную устойчивость к дегенеративным изменениям любой ткани организма человека при условии, что сами стволовые клетки бессмертны. Однако этого не происходит. Почему стволовые клетки с возрастом реже самообновляются или неправильно созревают, а в других случаях, наоборот, начинают делиться бесконтрольно, превращаясь в раковые? На этот вопрос специалисты до сих пор не нашли однозначного ответа.
Действительно, с возрастом способность стволовых клеток делиться и восстанавливать ткани снижается. Например, поседение вызывается уменьшением в волосяных мешочках количества стволовых клеток, вырабатывающих пигмент. Получены свидетельства постепенного спада репликативной способности кроветворных, кишечных и мышечных стволовых клеток. Таким образом, изменение функциональных возможностей стволовых клеток при старении – установленный факт. Снижение активности стволовых клеток способствует прогрессивному ухудшению регенерации тканей.
Почему это происходит? Одни авторы считают, что стволовые клетки стареют «изнутри». Чем больше стволовые клетки взрослого организма делятся в течение жизни, тем больше они накапливают повреждений ДНК, в результате укорочения их теломер, стресса от «запутывания» при удвоении нитей ДНК, постепенного отказа систем починки ДНК, чрезмерного метилирования важных генов и активации «прыгающих» генов. Иногда при делении стволовой клетки даже теряются целые хромосомы.
Другие авторы, напротив, полагают, что стволовые клетки потенциально бессмертны. Например, когда стволовые клетки половой системы, из которых возникают новые сперматозоиды, от старых самцов мышей последовательно пересаживали молодым особям в течение трех лет, заметного снижения их функции не наблюдалось, что косвенно свидетельствует о незначительном вкладе внутренних причин в старение данного типа стволовых клеток. Кроме того, сателлитные стволовые клетки мышц стареющих мышей продолжают выполнять свою функцию без изменений при условии, если присутствуют определенные системные факторы, получаемые при переливании крови от молодой мыши.
Одной из причин повышенной жизнеспособности стволовых клеток по сравнению с другими типами клеток является активность особых транспортных белков, выбрасывающих из клеток поступающие в них токсины и избыточные гормоны. Кроме того, свойство бессмертия обеспечивается особой способностью перераспределять возникающие повреждения при асимметричном делении, когда одна дочерняя клетка остается стволовой, а вторая созревает в специализированную клетку данной ткани. Как было показано в специальных экспериментах, «клеточный мусор» – агрегаты окисленных и структурно неполноценных белков (агресомы), скапливающиеся в клетке, связаны только с одним из двух центров деления, вследствие чего при клеточном делении агресомы отходят лишь к одной из дочерних клеток. Как нетрудно догадаться, «клеточный мусор» достается созревающей клетке, а незрелая стволовая клетка за счет этого процесса очищается. По-видимому, при митозе стволовой клетки неслучайным образом распределяются не только поврежденные белки, но и родительская ДНК-матрица. Одним из следствий этого процесса может быть наблюдаемое снижение спонтанной частоты мутаций в стволовых клетках по сравнению с дифференцирующимися соматическими клетками, а также более медленное укорочение длины теломер. Теломеры могут укорачиваться и под действием окислительного стресса, поэтому некоторые стволовые клетки имеют активную теломеразу, при необходимости достраивающую концы хромосом. Правда, уровень активности теломеразы с возрастом падает даже в стволовых клетках, что, по мнению нобелевского лауреата Э. Блекберн, может служить маркером скорости старения у каждого конкретного человека. Таким образом, стволовая клетка «очищается» от внутриклеточного «мусора» и приобретенных в процессе репликации ДНК повреждений за счет образующейся созревающей клетки, что является менее энергозатратным и более надежным механизмом устранения повреждений, чем починка поломок, но обеспечивает более быстрое старение зрелых клеток.
Возникло и другое предположение, согласно которому старение стволовых клеток, утрата способности к делениям запускается извне – в результате изменения гормонального фона и локального микроокружения стволовой клетки.
Предположение о том, что стволовые клетки контролируются микроокружением, стимулирующим их самообновление и защищающим их от воздействий, вызывающих созревание, впервые было высказано в 1978 году и касалось кроветворных стволовых клеток. Экспериментально это предположение подтвердили значительно позже, когда было показано, что клетки костной ткани влияют на развитие кроветворных стволовых клеток, предоставляя им «инструкции» в виде сигнальных белков – факторов роста и цитокинов. Микроокружение стволовой клетки, необходимое для ее функционирования, получило название стволовой ниши. Помимо выполнения функции питания, стволовая ниша служит для стволовой клетки защитной и информационной средой. Она играет важную роль в обеспечении состояния покоя стволовой клетки и регулирует ее предрасположенность к вступлению на путь созревания в специализированную клетку. Структурно стволовая ниша представляет собой совокупность всех факторов, которые обеспечивают жизнеспособность и самовоспроизведение незрелых стволовых клеток, а также созревание дочерних специализированных клеток. К таким факторам относятся базальная мембрана, молекулы внеклеточного вещества, прочно закрепляющие стволовую клетку в нише, и определенные типы соседних клеток, продуцирующих факторы роста и различные регуляторные молекулы. В отличие от стволовых клеток, образующие стволовую нишу соседние клетки стареют с обычной скоростью. В свою очередь, клеточное старение, которому подвергаются клетки – соседи стволовой клетки, вызывает изменение спектра секретируемых ростовых факторов, провоцирует выделение цитокинов воспаления, мешающих состоянию покоя или самообновлению стволовых клеток, а также секрецию металлопротеиназ – ферментов, разрушающих внеклеточный матрикс.
Из данного механизма старения стволовых клеток (рис. 26) следуют два вывода: 1) инъекция стволовых клеток старому человеку будет малопродуктивной, поскольку молодая стволовая клетка имплантируется в старую нишу; 2) необходимо научиться модифицировать сигналы ниши, подавляя связанный со старением секреторный фенотип или внося в нее дополнительные количества необходимых ростовых факторов в нужной пропорции.
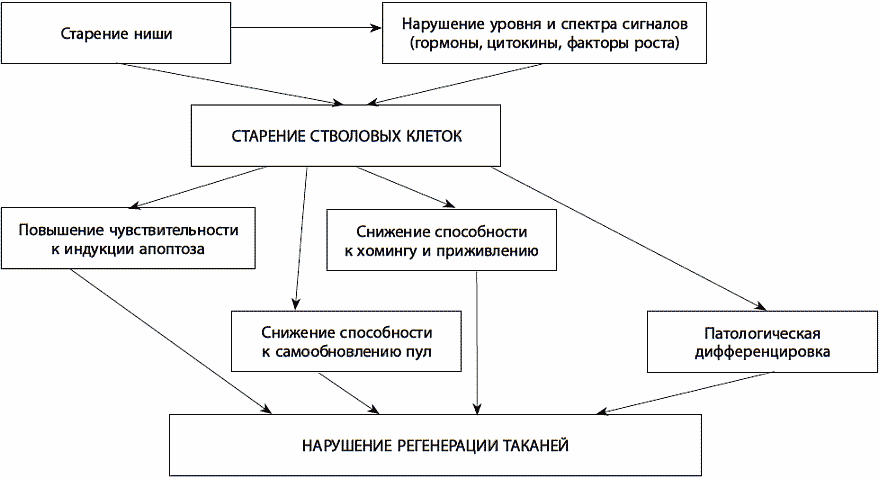
Рис. 26. Причины и следствия старения стволовых клеток
Роль гормональных изменений в организме при старении стволовой ниши показана на примере развития саркопении и истончения сердечной мышцы. С возрастом происходят существенные изменения в стволовой нише сателлитных клеток – стволовых клеток, из которых образуются новые мышечные волокна. В частности, наблюдается изменение спектра поддерживающих сигналов в результате атрофических изменений окружающих мышечных волокон, утолщается базальная мембрана, изменяется состав локальной среды за счет увеличения доли соединительной ткани (фибробластов и жировых клеток), что нарушает функционирование сателлитных клеток. Со стороны гормонального фона возрастает влияние отрицательных и снижается влияние положительных регуляторов сателлитных клеток. Например, наблюдается нехватка в циркулирующей крови ростовых сигналов, в частности GDF-11 и гормона окситоцина. При переливании крови от молодых мышей старым у последних происходят благоприятные изменения – утолщение миокарда и регенерация скелетных мышц.
В результате старения стволовой ниши стволовые клетки не обязательно погибают. Их количество уменьшается с возрастом в результате уменьшения доли симметричных делений, когда из одной образуются две одинаковые стволовые клетки. Напротив, вследствие увеличения потребности в регенерации в стареющих тканях все больше происходит асимметричное деление, в результате которого образуются зрелые клетки, восполняющие утраченные функциональные клетки данной ткани. Таким образом, происходит истощение количества стволовых клеток в ткани.
Однако в результате получения неправильных инструкций от стареющей стволовой ниши нередко происходит ошибочное созревание потомков стволовых клеток. Образуются не те клетки, что необходимы здоровой ткани. Например, воспалительные цитокины приводят к тому, что при старении кроветворные стволовые клетки дают все большее количество клеток врожденного иммунитета – воспалительного миелоидного ростка, например макрофагов, и все меньше эритроцитов и клеток приобретенного иммунитета – T– и B-лимфоцитов. Меланоцитные стволовые клетки в старом организме образуют атипично пигментированные меланоциты, что выражается в наличии старческих пятен на коже.
Критерий 5. Воспаление
Активация механизмов врожденного иммунитета
В настоящее время установлено, что хроническое воспаление является главным действующим фактором многих возрастных заболеваний, таких как атеросклероз, артрит, рак, диабет, остеопороз, старческое слабоумие, болезнь Альцгеймера, сердечно-сосудистые заболевания, ожирение и метаболический синдром. Воспаление угнетает способность клеток к делению, вызывает нечувствительность к инсулину, активизирует образование свободных радикалов, которые повреждают ДНК, мембраны и белки.
Процессы воспаления возникают в результате целого комплекса изменений. При старении происходит нарушение регуляции иммунной функции. В частности, происходит сбой в работе стволовых ниш кроветворных клеток и, как следствие, чрезмерное увеличение количества моноцитов и макрофагов, способных вызывать воспалительные процессы в стенках сосудов и даже в тканях головного мозга. В ответ на накопление повреждений в ДНК и дисфункциональных митохондрий происходит избыточная активация механизмов врожденного иммунитета – формируется старение-зависимый секреторный фенотип, сопровождающийся выбросом воспалительных сигнальных веществ. Секреция воспалительных цитокинов также связана с увеличением количества жировых клеток, которые, помимо функции запасания жиров, играют в организме роль распределенной эндокринной системы.
Центральным регулирующим органом всех физиологических функций в организме является гипоталамус – этот отдел головного мозга контролирует температуру тела, водно-солевой обмен, половое и пищевое поведение, эмоции и многое другое. Он осуществляет управление над телом посредством нейроэндокринной регуляции.
Концентрируя данные от всех органов чувств и сенсоров тела, гипоталамус запускает выработку гормонов гипофиза и периферических эндокринных желез, приводящих к адаптации организма к изменяющимся условиям окружающей среды. Нейроэндокринные клетки гипоталамуса находятся в тесном взаимодействии с другими клетками головного мозга – так называемой микроглией, которая в норме защищает мозг от инфекции. Микроглиальные клетки берут свое начало от иммунных клеток – моноцитов крови. Хронический стресс и системное воспаление во всем теле вызывают гиперактивацию микроглии, она начинает выделять свободные радикалы и воспалительные белки, которые вызывают реакции врожденного иммунитета и воспаления в клетках гипоталамуса, тем самым нарушая гипоталамические функции, ускоряя процессы старения и провоцируя различные патологии во всем теле.
При помощи генной терапии группе ученых под руководством доктора Доншенг Каи из Колледжа Альберта Эйнштейна в США удалось приглушить индукцию врожденного иммунитета в гипоталамусе старых мышей, что привело к увеличению их продолжительности жизни и замедлению развития возраст-зависимых патологий.
Несколькими годами раньше нам удалось увеличить продолжительность жизни дрозофил, воздействуя на них фармакологическим ингибитором тех же самых процессов врожденного иммунитета.
Оказалось, что большой спектр нестероидных противовоспалительных лекарственных препаратов (аспирин, ибупрофен) и веществ растительного происхождения (куркумин, ресвератрол, пектиновые полисахариды) обладают выраженными геропротекторными свойствами, увеличивая продолжительность жизни модельным животным и замедляя развитие возраст-зависимых патологий у человека.
Дисбаланс микробиоты
В кишечнике, ротовой полости, глотке, урогенитальном тракте и на коже обитают сотни триллионов бактерий, принадлежащих к различным группам доядерных организмов – прокариот. Поскольку большинство из них не может существовать в микробиологической культуре, изучение разнообразия видов микрофлоры стало возможным лишь в последнее время благодаря появлению метагеномного подхода, основанного на секвенировании ДНК микроорганизмов. В последнее время начала формироваться так называемая «третья генетика» долголетия, нацеленная на выяснение биоразнообразия микробиома человека для последующей терапевтической его коррекции. Отечественные и зарубежные компании по генетическим исследованиям уже включили исследование микробиома в перечень оказываемых услуг.
Здоровая микрофлора, обитающая в кишечнике, играет важные функции: защищает от патогенных микроорганизмов, стимулирует лимфоидную систему и иммунитет, вырабатывает необходимые нам витамины, короткоцепочечные жирные кислоты и утилизирует неперевариваемые собственными ферментами человека компоненты пищи, питает и стимулирует клетки слизистой кишечника.
Нарушение состава кишечной микрофлоры связано с воспалительными заболеваниями кишечника, ожирением, диабетом обоих типов, сердечно-сосудистыми заболеваниями, атопией кожи, аллергией, колоректальным раком. Известна также связь с расстройствами центральной нервной системы – депрессией, аутизмом, болезнью Альцгеймера, деменцией, рассеянным склерозом. Несмотря на кажущуюся неочевидность связи микробиоты с функционированием головного мозга, известно, что индуцируемое патогенной микрофлорой системное воспаление приводит к активации микроглиальных клеток мозга и воспалительным процессам в само́й нервной ткани, способствующим снижению когнитивных способностей.
Подводя итог, следует отметить, что воспаление соответствует признакам критерия старения: его можно отследить на любом этапе развития практически любого возраст-зависимого патологического процесса, индукция воспаления вызывает ускорение старения, в то время как противодействие ему с помощью, например, противовоспалительных препаратов позволяет продлить жизнь.
Критерий 6. Хронический стресс
Стрессом называется неспецифическая реакция организма на любое воздействие, вызывающее нарушение постоянства внутренней среды. Факторы, способствующие возникновению в организме стресса, довольно многочисленны. Они могут быть внешними (экзогенными): повышенная или пониженная температура окружающей среды, колебания концентрации кислорода в воздухе, травмы, гиподинамия, инфекции, избыток или недостаток питательных веществ, токсины и химические мутагены, ионизирующие излучения и жесткий ультрафиолет. Они также могут быть внутренними (эндогенными): психологический, нейрогормональный, оксидативный стресс, митохондриальный стресс и стресс эндоплазматической сети.
Старение с полным основанием можно назвать хроническим стрессом. С возрастом все большее количество физиологических констант нашего тела выходит за допустимые пределы.
Наиболее явно нарушение постоянства видно по отклонениям от нормы показателей крови – ее pH, уровня глюкозы и других питательных веществ, количества липопротеинов разных классов, концентрации витаминов, макро– и микроэлементов. Возникающие отклонения вызывают активизацию компенсаторных процессов, которые зачастую приводят к большему повреждению, чем сами отклонения.
Стресс-гормоны и старение
Говоря о причинах хронического физиологического стресса у пожилых людей, нельзя не упомянуть постоянное повышение, особенно в утренние часы, уровня стресс-гормона кортизола. Воспалительные процессы в гипоталамусе, возникающие при старении, провоцируют выработку избыточного адренокортикотропного гормона, который ускоряет образование кортизола корой надпочечников. Этот жизненно важный стероидный гормон необходим, чтобы при остром стрессе быстро мобилизовать поступление в кровь запасов глюкозы, аминокислот, липидов, подавить воспалительные процессы. Его роль также важна в процессе пробуждения – с первыми лучами солнца уровень кортизола повышается, затем он увеличивает уровень глюкозы, и наш мозг просыпается. В то же время, понижая выработку инсулина, высокая концентрация кортизола длительное время поддерживает повышенный уровень глюкозы в крови. Вызывая сужение сосудов, он может нарушать питание тканей и вызывать артериальную гипертензию. Кортизол подавляет функцию гиппокампа (отдела головного мозга, отвечающего за память) и способствует уменьшению его размеров. В результате нарушений в гиппокампе у пожилых людей снижена память, способность к обучению, повышена раздражительность и склонность к депрессиям.
Давно известно, что у пациентов, регулярно проходящих лечение кортизолом (обычно они получают в десятки раз большие дозы кортизола, чем физиологическая норма), появляются признаки ускоренного старения кожи и преждевременно развиваются возраст-зависимые патологии – остеопороз, ожирение, ослабление иммунной системы. Кстати, тихоокеанский лосось, приходя на нерест, активизирует программу самоубийства, очень похожую на ускоренное старение, в основе которой – выработка высоких доз все того же кортизола. Погибшие животные служат субстратом для размножения зоопланктона, который является источником пищи для молоди в холодных, обедненных питательными веществами северных ручьях. Очевидно, что в человеческом обществе такое «самопожертвование», заложенное природой, совсем не нужно.
Хотите похудеть? Снижайте уровень кортизола
Доказано, что хронически высокие показатели кортизола провоцируют набор веса, особенно в области живота и поясницы. А это означает, что неважно, как много вы упражняетесь и насколько правильно питаетесь – вы не потеряете вес, если уровень кортизола у вас в крови будет оставаться высоким, так как это делает организм нечувствительным к инсулину.В ходе одного исследования была проанализирована взаимосвязь между уровнем кортизола, чувствительностью к инсулину и количеством висцерального жира у мужчин. Мужчины с большим количеством висцерального жира имели повышенную выработку кортизола на протяжении всего дня, а также пониженную чувствительность к инсулину по сравнению с теми, у кого количество висцерального жира было меньше. Напротив, подкожный жир не обнаружил никакой связи с уровнем кортизола или инсулина.Чтобы понизить уровень кортизола, нужно соблюдать следующие простые правила: уменьшить потребление кофеина (его много в крепком чае или кофе), высыпаться, регулярно выполнять физические упражнения, заниматься медитацией и слушать релаксирующую музыку, не допускать резкого повышения уровня сахара в крови, сбалансировать диету по антистрессовым микронутриентам (витамины группы В, магний, цинк, хром III, альфа-липоевая кислота). В некоторых случаях полезно принимать противострессовые препараты из таких растений, как женьшень, лимонник, астрагал, родиола розовая.
Окислительный стресс
Окислительным стрессом можно назвать устойчивое превышение уровня окислителей в клетке над уровнем восстановителей. Под окислителями прежде всего понимаются активные формы кислорода и азота – так называемые свободные радикалы (рис. 27). Окислительный стресс могут вызывать как внешние стресс-факторы (радиация, тяжелые металлы, гипоксия, гипероксия), так и внутренние процессы, связанные со старением, – дефекты митохондрий, хроническое воспаление, снижение количества антиоксидантных ферментов и веществ – перехватчиков свободных радикалов.
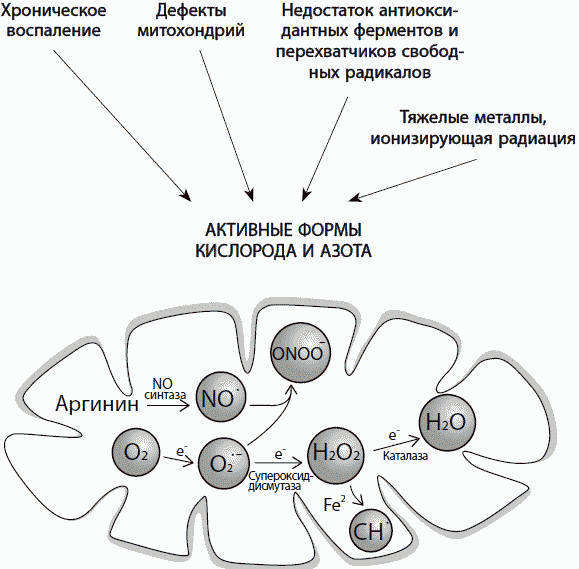
Рис. 27. Причины окислительного стресса
Узнай больше
В основном свободные радикалы в клетке образуются в процессе клеточного дыхания в митохондриях, однако некоторое их количество может возникнуть в цитоплазме, на поверхности клеток или в особых структурах клетки, таких как пероксисомы и микросомы.Свободные радикалы в определенном количестве необходимы – они помогают клеткам печени и почек окислить и нейтрализовать токсины, клеткам иммунной системы – атаковать инфекционные агенты, синтезировать стероидные гормоны и другие гормоноподобные вещества, стимулируют защитные реакции клетки – остановку клеточного цикла, необходимую для починки повреждений, образование ферментов репарации ДНК, белков теплового шока и антиоксидантных ферментов.Однако в случае хронического повышения уровня свободных радикалов, особенно в условиях избытка ионов железа и меди, повышающих их токсичность, возникает окислительный стресс, приводящий к повреждению клеточной ДНК, белков и мембран (рис. 28).
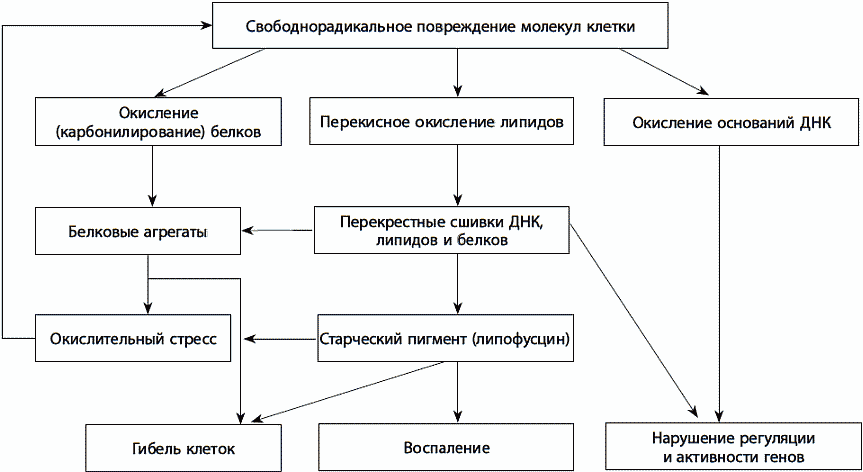
Рис. 28. Последствия окислительного стресса
Окислительный стресс приводит к накоплению повреждений и мутаций в митохондриальной и ядерной ДНК, к нарушению регуляции активности генов, укорочению концов хромосом, сшиванию между собой молекул белков, липидов и ДНК с образованием токсичных агрегатов – амилоида и липофусцина.На тканевом и системном уровне окислительный стресс вызывает гибель клеток (апоптоз и некроз), клеточное старение и хроническое воспаление.
Протеотоксический стресс
Любой белок в клетке и межклеточном матриксе имеет риск подвергнуться различным патологическим модификациям, нарушающим его структуру и функцию. Это может быть:
1) необратимое окисление (так называемое карбонилирование);
2) неферментативная реакция с глюкозой и продуктами ее окисления – гликирование и гликоксидация с образованием конечных продуктов гликирования;
3) сшивание белков с продуктами окисления жиров – липидными пероксидами, а также белков между собой и с ДНК.
Поврежденные таким образом белки в норме подвергаются утилизации при помощи специальной структуры клетки – протеасомы, которая нарезает ненужные белки на кусочки либо особыми цитоплазматическими и митохондриальными ферментами. Активность этих ферментов и структур клетки с возрастом падает. Еще один способ избавления от агрегатов поврежденных белков или целых клеточных органелл – автофагия. В результате нарушения регуляции определенных генов с возрастом снижается активность процессов утилизации белковых агрегатов (микроавтофагия) и поврежденных митохондрий (митофагия). Как следствие происходит накопление старческого пигмента липофусцина, запускающего каскад неблагоприятных для нашего долголетия изменений и способствующих окислительному стрессу избежавших утилизации поврежденных митохондрий.
Кроме уничтожения нарушенного белка, отдельные повреждения белков подлежат восстановлению предназначенными для этого ферментами. При клеточном старении отмечается снижение уровней как утилизирующих, так и восстанавливающих ферментов. Особенно выраженные снижения активности отмечаются в митохондриях. Искусственная активация генов этих ферментов в экспериментах на модельных организмах приводит к увеличению продолжительности жизни и повышению устойчивости к окислительному стрессу. Таких же результатов удается достичь, работая со старыми клетками человека в лабораторных условиях.
Стоит отметить, что восполнение запасов цинка в организме пожилых людей приводит к снижению накопления окисленных белков и к активации ферментов, восстанавливающих функцию поврежденных белков.
Белок с естественной пространственной укладкой, как правило, растворим в воде, поскольку он несет на своей поверхности заряженные аминокислотные группы, тогда как окисленные белки утрачивают заряд, становятся водоотталкивающими и слипаются в агрегаты. Накопление агрегатов в зависимости от места их образования вызывает:
1) стресс в эндоплазматической сети (особой структуре, имеющейся в каждой клетке и служащей для сортировки и транспортировки вновь образованных белков), который выливается в нечувствительность клетки к инсулину, системное воспаление, клеточное старение или гибель клетки;
2) митохондриальный стресс, приводящий к порочному кругу, в результате чего поврежденная митохондрия выделяет еще большее количество свободных радикалов.
При хроническом физиологическом стрессе тоже наличествуют все характеристики, присущие критерию старения.
Критерий 7. Сбой внутренних часов
В разделе про влияние режима сна и отдыха на долголетие мы уже говорили, что нарушение суточных (циркадных) ритмов создает предрасположенность к системному воспалению, раку, сердечно-сосудистым заболеваниям, метаболическому синдрому и диабету, нейродегенеративным и когнитивным расстройствам, нарушениям сна. Некоторые острые патологии, такие как гипертонический криз, инфаркт миокарда, приступ астмы и аллергии, иногда имеют привязку к определенному времени суток. Нарушение синхронизации между внутренними часами и сигналами из окружающей среды приводит к появлению симптомов усталости, дезориентации, бессоннице, ухудшению общего состояния здоровья. Все эти факты не вызывают удивления, поскольку центральные (в головном мозге) и периферические (в печени, легких, сердце, почках, коже) внутренние часы играют немаловажную роль в регуляции метаболизма, циклов сна – бодрствования, ритмичности секреции гормонов, физической активности, перистальтики кишечника, температуры тела и артериального давления, регуляции уровней метаболитов в крови. Напротив, остановка внутренних часов вызывает окислительный стресс, нарушение синтеза регуляторных и других белков, воспалительные процессы, нечувствительность к инсулину, гормональный дисбаланс.
Отклонение внутренних часов от 24-часового ритма в эксперименте приводило к уменьшению продолжительности жизни мышей. С возрастом снижается активность ключевых генов, контролирующих внутренние часы организма. Мыши, у которых снижение активности было вызвано мутацией в этих генах, живут значительно меньше нормальных животных. Установлено, что искусственная активация некоторых из этих генов в мышечной ткани мышей приводит к увеличению продолжительности жизни. Аналогичные результаты были получены и на дрозофиле. Таким образом, сбой внутренних часов тоже соответствует всем трем характеристикам критерия, подходящего для выявления старения: его проявления можно зарегистрировать на ранней стадии, наличие сбоя ускоряет старение, а предотвращение – замедляет старение.
Эволюция механизмов старения
Для того чтобы понять, что такое старение, важно иметь представление, как и когда оно могло возникнуть. Тот взгляд на эволюцию старения, который будет изложен далее, базируется на следующем представлении: одновременно с эволюционными усложнениями и появлением все более сложных видов живых существ добавлялись все новые механизмы старения, для противодействия которым возникали соответствующие механизмы «антистарения».
Молекулярный уровень старения появился еще на гипотетической доклеточной стадии существования – преджизни (прогеноты). Разрывы цепей и повреждение нуклеотидов ДНК, денатурация ферментов, образование перекрестных сшивок имели место уже на заре жизни. У современных одноклеточных безъядерных организмов существуют защитные белки, противостоящие износу (молекулярные шапероны, супероксиддисмутазы, каталазы, пероксидазы и ферменты репарации ДНК). Таким образом, наравне с молекулярным старением на заре жизни возникли первые противодействующие ему системы антистарения.
Несмотря на очевидность накопления поврежденных макромолекул, долгое время считали, что первые одноклеточные организмы, возникшие 3,8 миллиарда лет назад, не старели. К нестареющим относили и все современные доядерные (прокариотические) формы жизни. Предполагалось, что при делении бактериальных клеток повреждения равномерно разбавляются вновь образованными молекулами и структурами и распределяются между дочерними клетками. Подтверждением данного взгляда служило внешне симметричное деление бактериальных клеток, свойственное, например, кишечной палочке. Под симметричным делением клетки здесь понимается деление на две равноценные клетки, при асимметричном делении материнская и дочерняя клетка отличаются друг от друга.
Эволюционный биолог Том Кирквуд, директор Института старения и здоровья Университета Ньюкастла, предположил, что при бинарном делении клетки повреждения могут доставаться одной из дочерних клеток. Таким образом, деление бактерии, внешне выглядящее как симметричное, физиологически асимметрично. Совсем недавно данное явление было обнаружено и у бактерий, в том числе – у кишечной палочки.
Что собой представляет старение бактериальной клетки? Каждая делящаяся клетка бактерий имеет «старый» полюс и «молодой». Почти целиком «старые» структуры делящейся материнской клетки отходят к одному из потомков, тогда как дочерняя клетка синтезирует новые структуры, что «обнуляет» ее молекулярные часы. Наблюдение в микроскоп показало, что клетка кишечной палочки, наследующая «старые» структуры (прежде всего агрегаты окисленных белков), через несколько циклов деления теряет нормальные темпы роста и размножения. Увеличивается вероятность гибели потомков такой клетки. Данную клетку можно рассматривать как стареющую материнскую клетку, дающую молодое потомство. Возникает репродуктивная асимметрия, приводящая к появлению стареющего индивидуума и «омолаживающейся» за его счет дочерней клетки. Как следствие, популяция кишечной палочки состоит из двух различных субпопуляций: «репродуктивной», несущей мало повреждений, и насыщенной повреждениями, не способной образовывать потомство.
Таким образом, уже у доядерных одноклеточных существ эволюция создала второй способ омоложения – неравномерное распределение поврежденных структур. С точки зрения эволюции это оказалось более выгодным, чем колоссальные затраты на бесконечное поддержание и восстановление внутриклеточных структур. «Сегрегационное» старение, как я его называю, как ни парадоксально, явилось способом «омоложения» популяции одноклеточных ценой старения отдельных индивидуумов.
Неудивительно, что столь эффективный механизм был выявлен и у эволюционно более молодых ядерных одноклеточных существ, а также у всех многоклеточных, включая человека. Материнские клетки дрожжей, от которых отпочковываются молодые клетки, оставляют за собой бо́льшую часть поврежденных структур. В конечном итоге материнская дрожжевая клетка содержит в 4 раза больше неполноценных белков, чем ее потомки. Материнская клетка дрожжей не только удерживает повреждения, но и отдает дочерней часть своей защиты, в частности антиоксидантные ферменты.
В нашем теле также происходит физиологически асимметричное деление: это асимметричное деление стволовой клетки с образованием новой стволовой клетки и клетки, развивающейся в полноценную клетку определенной ткани. В этом случае весь «мусор» скапливается в определенном месте и прицепляется к одному из двух центров клеточного деления, вместе с которым отходит специализирующейся клетке, в результате чего незрелая стволовая клетка «омолаживается».
Новый виток эволюции – это появление 2,1 миллиарда лет назад одноклеточных организмов, имеющих ядро – командный центр, управляющий реализацией заложенной в хромосомах программы индивидуального развития. Появление ядерных форм жизни было сопряжено с приобретениями, принесшими с собой два новых механизма старения.
У доядерной клетки хромосомы являются кольцевыми молекулами ДНК. Поскольку «у кольца нет конца», при делении клеток они не подвергаются укорочению. Хромосомы ядерной клетки – линейные. С каждым делением они становятся все короче. Чтобы справиться с возникшей проблемой, на концах хромосом ядерных организмов возникли особые структуры – теломеры, а также фермент – теломераза, обеспечивающий их наращивание.
Большинство клеток тела человека (за исключением половых и эмбриональных стволовых клеток) имеет относительно короткие теломеры и слабый или нулевой уровень активности теломеразы, поэтому их хромосомы постепенно укорачиваются. Как показали эксперименты Марии Бласко на мышах, генная терапия, позволившая реактивировать теломеразу, привела к увеличению продолжительности жизни и отсрочке возраст-зависимых патологий.
Второй механизм старения связан с тем, что ядерные клетки несут митохондрии. Митохондрии – потомки поселившихся внутри клеток симбиотических альфа-протеобактерий. Получив «кров и стол» внутри ядерной клетки, симбионты оплачивали свое проживание энергетической валютой – АТФ, которую они образуют во много раз эффективнее, чем клетка-хозяин.
Митохондрии сегодня – это энергетические станции клетки, позволившие их носителям перейти на новый уровень развития, в том числе стать многоклеточными и приобрести энергозатратные физиологические системы – нервно-сенсорную, двигательную, сердечно-сосудистую, выделительную. Однако в процессе функционирования митохондрий неизбежно возникают свободные радикалы, которые, перемещаясь из митохондрий в цитоплазму и ядро, повреждают клеточные структуры.
Свободные радикалы в еще большей степени повреждают сами митохондрии, в том числе митохондриальные мембраны, ферменты и митохондриальные кольцевые ДНК. Кроме того, митохондриальные системы восстановления ДНК менее эффективны, чем ядерные. Таким образом, количество поврежденных митохондрий, неспособных к выполнению своих функций и относящихся к разряду токсичного клеточного «мусора», постепенно увеличивается с возрастом клетки.
В качестве механизма антистарения ядерная клетка изобрела механизм распознавания и утилизации поврежденных митохондрий – митофагию. Она является разновидностью процесса частичного самопереваривания клетки в момент голодания. Однако этот механизм оказался несовершенным. Митофагия с возрастом угасает по мере забивания клетки все большим количеством «мусора» – липофусцина.
Помимо митофагии, с повреждениями митохондрий борются антиоксидантные ферменты и вещества. В выработке антиоксидантной защиты особенно преуспели растения, которые несут в себе еще один мощный источник свободных радикалов, – хлоропласты, осуществляющие фотосинтез. Некоторые растения, например, креозотовый куст, способны образовывать клоны, существующие более 10 000 лет. В листьях этого растения содержится до 7 % мощнейшего антиоксиданта – нордигидрогваяретовой кислоты. Одна капля этого вещества способна останавливать прогоркание продуктов питания. Кстати, одновременно это и геропротектор, способный на 12 % увеличивать продолжительность жизни мышей.
Митохондрии принесли ядерным организмам явление запрограммированной гибели клеток – апоптоза. Постаревшие, зараженные вирусом, необратимо повредившие свою ДНК или просто лишние клетки самоликвидируются, и данный процесс осуществляется при непосредственном участии митохондрий. В то же время велика роль митохондрий в самоликвидации постаревших клеток нервно-мышечной системы. Поскольку в данных тканях процессы замещения клеток протекают медленно или отсутствуют, избыточный апоптоз с возрастом способствует дегенеративным процессам и старению. Именно с этим явлением отчасти связана потеря мышечной ткани пожилыми людьми и ее замещение фиброзной или жировой.
В определенном смысле, из поколения в поколение организмов передается не вещество и не структуры, а онтогенетическая программа, «идея развития», что и создает предпосылки для потенциального бессмертия популяции, несмотря на наличие старения индивидуумов.
Все «старое и косное» попросту остается родителю. Но у программы тоже есть материальный носитель. Поэтому поддержание целостности носителя «программы» – молекулы ДНК – имеет критическое значение.
Особый тип деления клетки, предшествующий образованию половых клеток, – мейоз – помогает поддерживать потенциальное бессмертие половых клеток, способствуя репарации ДНК, удалению мутаций ДНК, отбраковыванию поврежденных РНК, дефектных половых клеток.
Не менее важную роль играет естественный отбор стабильных, жизнеспособных геномов на разных стадиях репродуктивного цикла. Таким этапом является селекция половых продуктов, и прежде всего женских половых клеток, поскольку они являются тем звеном, которое передает митохондрии в следующее поколение.
У самок многих видов животных более половины яйцеклеток погибает в яичниках по механизму апоптоза еще на зародышевой стадии развития организма или непосредственно после рождения. Целостность митохондрий наравне со стабильностью генома играет определяющую роль в апоптозе яйцеклеток, обусловленном геномной нестабильностью и митохондриальными нарушениями.
Подтверждает определяющую роль митохондрий в селекции женских половых клеток и то, что инъекция небольшого количества здоровых митохондрий в яйцеклетку мыши предотвращает ее апоптоз. Возникшие в результате слияния мужской и женской половых клеток зародыши также проходят через этап селекции – дисфункция митохондрий ведет к их отмиранию. Таким образом, половой процесс мог возникнуть как эффективное средство омолаживания клона клеток ядерных организмов.
С приобретением многоклеточности многие клетки приобрели специализацию. Прежде всего произошло разделение на половые клетки, задача которых – передать гены в следующие поколения, и клетки тела (соматические клетки), которые способствуют осуществлению функции первых.
Половые клетки ранних многоклеточных наследовали потенциальную иммортальность от одноклеточного предка, тогда как клетки тела приобрели «смертность» в качестве новой функции. По крайней мере, представляется вероятным, что с появлением специализированных клеток, ответственных за первостепенную функцию – размножение, необходимость в бесконечном делении всех типов клеток отпала.
Во взрослых тканях присутствует небольшое количество стволовых клеток, не имеющих специализации, но способных при необходимости участвовать в регенерации ткани – образовании необходимых специализированных клеток. Остальные соматические клетки утратили теломеразу и способность к неограниченному делению, чтобы снизить вероятность развития опухолей.
Такое важное эволюционное приобретение, как специализация клеток, послужило основой возникновения еще одной формы старения организма. У высших многоклеточных живых существ в ряде тканей появились высокодифференцированные клетки, полностью утратившие способность к делению – постмитотические клетки. Они уже не способны к сегрегации или разбавлению повреждений, сохраняя при этом возможность выполнять свою функцию долгие десятилетия. У млекопитающих постмитотическое старение наблюдается в нервной, сердечно-мышечной системе и в сетчатке глаза.
Вместе с усложнением многоклеточного организма возникли мощные системы интеграции – нервная, эндокринная и иммунная, а одновременно с ними – системный уровень старения. Наиболее вероятная точка их интеграции в организме человека – гипоталамо-гипофизарная система. Процессы воспаления и врожденного иммунитета, которые изначально призваны защищать организм при ранении или инфекциях, сверхактивируются в ответ на накопление повреждений, сопутствующее процессу старения. Воспалительные процессы затрагивают и гипоталамус, в результате чего он утрачивает способность адекватно реагировать на изменения внешней и внутренней среды и осуществлять нервно-гормональную регуляцию постоянства внутренней среды организма.
Эволюция идей в биологии старения
Биология старения на протяжении всей своей истории была междисциплинарной наукой, развитие которой непосредственно связано с открытиями, идеями и методами, заимствованными у смежных наук. Зачастую первооткрыватели новых важнейших биологических законов и были теми первыми геронтологами, которые пытались применить свое открытие к феномену старения.
Например, открытие во второй половине XIX века законов эволюции позволило одному из ведущих эволюционистов того времени А. Вейсману сформулировать первую эволюционную теорию старения. Основные положения синтетической теории эволюции практически сразу были применены ее столпами Р. Фишером и П. Медаваром к эволюции старения.
Автор клеточной теории иммунитета И. И. Мечников был основателем научной геронтологии и изобретателем самого термина «геронтология». Существенный вклад в понимание механизмов старения внесли авторы целых направлений современной медицинской науки – гормонотерапии Ш. Броун-Секар, учения о высшей нервной деятельности – И. П. Павлов, учения об общем адаптационном синдроме (стрессе) – Г. Селье.
Ведущие открытия XX века практически сразу «примерялись» к общей теории старения: понятие гомеостаза, открытие индуцированного мутагенеза, двойной спирали ДНК, свободных радикалов, антиоксидантных ферментов, белков теплового шока, автофагии, теломер и теломеразы, апоптоза, стволовых клеток и их ниш, эпигенетического наследования и многого другого.
На мой взгляд, несмотря на многообразие точек зрения, не стоит говорить о множественности теорий старения. Правильнее вести речь о постепенном становлении общей теории старения, которая до сих пор не завершена, так как геронтология находится на этапе накопления знаний.
Эти знания еще недостаточно обобщены, чтобы создать непротиворечивую картину старения, которая будет положена в основу так необходимых нам количественных математических моделей. Разработка таких моделей важна для поиска и предсказания эффективности новых вмешательств, которые приведут к радикальному продлению здорового периода жизни каждого человека. Однако даже частичное понимание процессов старения уже дает возможность искать и разрабатывать действенные методы для управления здоровым долголетием.
Назад: Так что такое старение?
Дальше: Пути к радикальному продлению жизни

