Книга: Очаровательный кишечник. Как самый могущественный орган управляет нами
Назад: Человек как экосистема
Дальше: Формирование микрофлоры кишечника
Микрофлора и иммунитет
Ежедневно каждому из нас дается несколько шансов, чтобы умереть. У нас формируются раковые клетки, нас атакуют бактерии или вирусы. И несколько раз в день нас спасает наш иммунитет, который нейтрализует атипичные клетки, споры плесневых грибов, разрушает патогенные бактерии и вирусы. Процесс осуществляется с помощью специальных клеток, распознающих опасность, и клеток, направленных на ее уничтожение, – так называемых супрессоров, регулирующих излишнюю агрессивность, и медиаторов – биологически активных веществ. Все клетки работают слаженно в одной команде.
Дословно слово «иммунитет» переводится с латинского как невосприимчивость. Когда-то под этим термином понимали лишь невосприимчивость к инфекционным заболеваниям
Большая часть иммунной системы (около 80 %) представлена именно в кишечнике. И на это есть основания. Все наши бактерии также являются частью иммунной системы. Бактерии расположены в резервуаре под названием «слизистая» кишечника и не приближаются близко к клеткам других органов. Наша иммунная система может вступать с ними в игру, и она не представляет опасности для остального организма. Защитные клетки изучают на бактериях кишечника различные варианты чужеродных организмов.
Если вне полости кишечника иммунитет встречается с одной из знакомых кишечных бактерий, он реагирует очень быстро. Иммунная система в кишечнике должна быть особо внимательна к деталям – она должна постоянно подавлять в себе инстинкт защитника, чтобы не убить бактерии. Одновременно она должна вычленять и отсортировывать наиболее опасные микроорганизмы. Если бы мы приветствовали каждую бактерию и говорили ей «привет», на этот процесс у нас ушло бы три миллиона лет. А иммунная система успевает не только поприветствовать, но и сказать: «Так, ты мне нравишься, а вот ты – совсем нет!»
Оказалось, что в организме существует целая система, которая отвечает за «невосприимчивость» к возбудителям инфекционных заболеваний. Но занимается она не только этим. В ее функции входит защита организма и от любых вредных веществ, попавших в него извне, и от собственного брака – неполноценных белков и клеток, например раковых.
Задача усложняется тем, что иммунной системе необходимо отделить клетки тканей от бактерий, и это зачастую вызывает трудности. На поверхности некоторых бактерий имеются структуры, напоминающие поверхность наших клеток. Именно поэтому в случае со стрептококковой ангиной не стоит затягивать с приемом антибиотиков. Если возбудитель своевременно не будет нейтрализован медикаментозно, иммунная система начнет атаковать ткани собственных суставов или других органов. Иммунная система начинает путать наше колено с провокатором боли в горле. К счастью, такое встречается достаточно редко.
Похожий эффект был отмечен в случае заболевания диабетом в молодом возрасте, когда иммунная система начинает разрушать клетки, синтезирующие инсулин. Возможной причиной является нарушение взаимопонимания между иммунитетом и бактериями кишечника.
Вирус ведет себя хитро – он прячется. Внедряется в клетку и заставляет эту клетку работать на себя. Пораженная клетка начинает штамповать новые вирусы. Клетка-киллер такие клетки распознает и уничтожает. Значит, чтобы справиться с вирусами, пробравшимися в организм, зачастую приходится вместе с ними уничтожать собственные клетки. Если же таких пораженных клеток очень много, активная деятельность клеток-киллеров может привести к гибели всего организма. (Клетки-киллеры уничтожают и другие дефективные клетки, например раковые.)
Цель клетки-киллера – распознать предателей, переметнувшихся на сторону врага, в любом месте и уничтожить. Дело в том, что не все микробы циркулируют в организме сами по себе. Не всех их можно уничтожить описанными выше способами – съесть или обстрелять антителами. Такие способы годятся для борьбы с бактериями, а с вирусами это не проходит.
К счастью, наш организм предусмотрел возможность недопонимания и разработал свой механизм действия в таких случаях. Прежде чем иммунная клетка попадет в кровоток, она должна пройти масштабные полевые учения, а также близко познакомиться со всеми структурами организма и научиться отличать свое от чужого. Если бы иммунная клетка, не будучи уверенной в том, является ли клетка тканью организма или чужеродным объектом, притормаживала ее и крутилась рядом до момента окончательной идентификации, – это был бы путь в никуда. «Подозреваемая» клетка, возможно, так никогда бы и не вышла в кровоток. Если иммунная клетка имеет тенденцию покушаться на собственные ткани организма, то она «отчисляется» уже на этапе прохождения полевых учений. В процессе полевых учений клетки учатся проявлять толерантность там, где это нужно, и быть более подготовленными к борьбе с чужеродными агентами. В большинстве случаев иммунитет с этой задачей хорошо справляется.
Одно упражнение является особенно замысловатым. Что делать, если чужеродные компоненты ассоциируются у иммунитета с бактериями, несмотря на то что бактериями они не являются? Эритроциты, например, на своей поверхности несут сходные с клеточной мембраной бактерий протеиновые молекулы. По логике, наши иммунные клетки должны разрушать красные кровяные тельца, если на полевых учениях им не было объяснено, что это собственная кровь и трогать ее нельзя. Если на поверхности наших эритроцитов находятся белки группы А, то наш иммунитет не представляет особой опасности для донорской крови с белковым составом на поверхности эритроцитов, характерным для группы А. При кровопотерях в результате аварии и родов вливание донорской крови зачастую является единственным путем спасения человека.
А вот кровь другой группы и, соответственно, с другим набором белковых молекул на поверхности эритроцитов нашим организмом отторгается. Наш иммунитет вспоминает о бактериях, которым не место в кровотоке, и атакует чужие эритроциты. Если бы не тренировки на кишечных бактериях, иммунная система относилась бы толерантно к любой донорской крови вне зависимости от ее групповой принадлежности. Новорожденным, у которых микрофлора кишечника еще не сформирована в таком видовом разнообразии, гипотетически можно переливать кровь любой группы (но поскольку в организме новорожденного присутствуют антитела матери, в случае необходимости переливают материнскую кровь). На момент формирования кишечной микрофлоры и иммунитета допустимым является введение крови, идентичной по групповой принадлежности.
Взаимосвязь группы крови с видовым составом кишечной микрофлоры – это один из иммунологических феноменов. Скорее всего о большинстве из них мы даже не догадываемся.
Каждый вид бактерий может по-разному влиять на иммунную систему. Например, стимулировать синтез дружелюбных иммунных клеток-посредников или обусловливать действие на клетки кортизона или других противовоспалительных препаратов. В ходе такого взаимодействия с бактериями иммунная система становится более разборчивой и менее агрессивной, она не реагирует без веского повода. Это очень умный ход со стороны наших кишечных бактерий, таким образом повышается их шанс не быть разрушенными нашим иммунитетом.
В тонком кишечнике молодых особей позвоночных (в том числе человека) были выявлены бактерии, которые «подстрекают» иммунную систему, это дает простор для дальнейших размышлений. Возможно, что эти бактерии-задиры заботятся о том, чтобы плотность популяции бактерий тонкого кишечника была минимальной? Ведь вполне вероятно, что именно поэтому тонкий кишечник практически не населен и существует возможность переваривания в максимально спокойных условиях. Задиры не только дразнят иммунные клетки, но и крепятся на ворсинки, подобно болезнетворным агентам, например патогенной кишечной палочке. Поскольку эти места уже заняты, в случае появления патогенных организмов последним не остается места и они должны покинуть пространство.
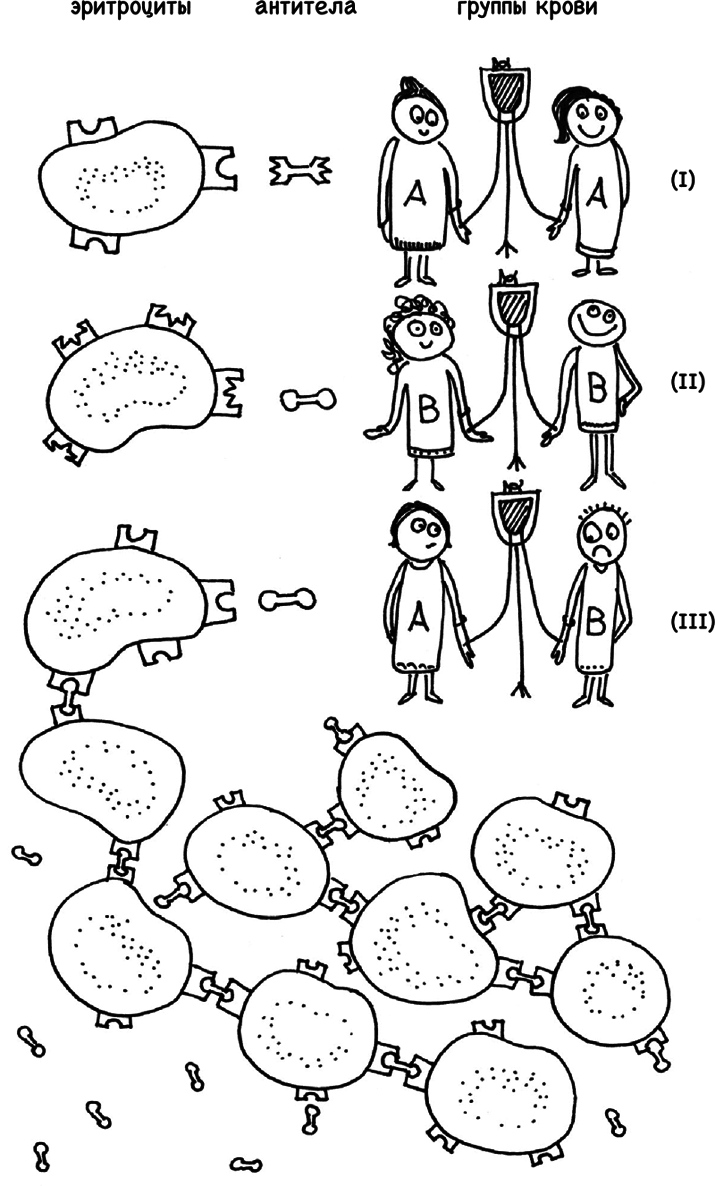
Антитела, связывающие чужеродные эритроциты
Это называется защитой от колонизации. Большинство бактерий кишечника также защищают территорию от патогенных микроорганизмов путем заселения свободных мест, не оставляя свободных регионов для обитания вредителей. Задиры, живущие в тонком кишечнике, нигде больше не встречаются. Возможно ли, что они наносят нам также и вред? Не исключено. Возможно, они вредят людям, у которых вызывают повышенное раздражение иммунных клеток и повышенную мобилизацию иммунной системы. Вопросов тут, как было сказано ранее, на порядок больше, чем ответов.
Для получения первых ответов в лаборатории Университета Нью-Йорка были выведены стерильные мыши. Это самые стерильные существа на планете. Мыши рождались на свет в результате кесарева сечения, их содержали в стерильных условиях, им давали полностью стерильную пищу. Полностью дезинфицированных существ, подобных этим мышам, в природе не бывает. При работе с мышами соблюдались строжайшие меры предосторожности, поскольку микроорганизмы могли попасть к мышам даже из воздуха, если тот не прошел предварительную очистку и фильтрацию. На примере этих мышей мы можем наблюдать, что происходит, если иммунная система полностью бездействует. Что происходит с кишечником, если в нем не живет ни одной бактерии? Как реагирует совсем необученная система на какой-либо возбудитель?
Каждый, кто работал с популяцией таких мышей, скажет вам, что стерильные мыши очень странные. Они гиперактивны и слишком смелы, что не свойственно нормальным мышам. Они потребляют больше пищи, и пищеварительные процессы у них происходят куда медленнее. Слепая кишка у них больших размеров, кишечная трубка с нетипичными перегибами, слизистая лишена ворсинок, бедно развита сосудистая сеть, у них очень мало иммунных клеток. Даже минимально опасный возбудитель способен убить такое животное.
При введении бактериального коктейля стерильным мышкам были отмечены удивительные вещи. Если стерильной мыши доставались бактерии организма, больного диабетом второго типа, через какое-то время у мыши наблюдались нарушения углеводного обмена. Если стерильной мыши вводили бактерии кишечника животного или человека, страдающего ожирением, мышка начинала набирать вес по сравнению с контрольной группой, которой вводились бактерии человека нормостенического телосложения. Некоторые бактерии самостоятельно могли исправлять дефекты, вызванные полной стерильностью: уровень иммунных тел повышался до нормального, слепая кишка принимала нормальные размеры, улучшалось пищевое поведение. Какие-то бактерии не вызывали никакого эффекта или эффект появлялся в результате совместной работы с коллегами-бактериями других разновидностей.
Иммунитет, или способность нашего организма сопротивляться неблагоприятным внешним и внутренним факторам, напрямую зависит от состояния микрофлоры нашего кишечника.
Исследование, проведенное на стерильных мышах, продвинуло ученых на шаг вперед в вопросах изучения микрофлоры кишечника. Мы можем предположить, что точно так же, как на нас влияет тот большой мир, в котором мы живем, на нас оказывают влияние и маленькие бактерии, живущие в нас. И их состав в каждом отдельном случае индивидуален, что делает ситуацию невероятно увлекательной.
Наш иммунитет зависит от самочувствия наших кишечных бактерий (как, кстати, и большинство происходящих в нашем организме процессов). Именно на них природой возложена «ответственность» за нашу защиту.
Назад: Человек как экосистема
Дальше: Формирование микрофлоры кишечника

