Рыжая смерть — ржавчина
Да, говоря о прочности металла, нельзя не остановиться на его долговечности.
Все в мире имеет свою продолжительность жизни. Родятся и умирают люди, планеты, галактики. Вечна только материя, всегда переменная, развивающаяся, никогда не повторяющая раз пройденного пути.
Люди борются — и успешно борются! — за продление своей жизни. И отступает костлявая, как ее раньше рисовали, с острой косой смерть. Почти вдвое выросла только за последние 40 лет средняя продолжительность жизни у нас в стране. А в будущем не до 69, а до 165 будет простираться человеческая зрелость, а может быть, и в 360 не будет приходить старость. Врачи и биологи, работающие над этой проблемой, не видят преград для практически неограниченного удлинения человеческой жизни.
Ну, а сколько же живет металл?
Это зависит от того, какую он жизнь ведет. Спокойную или бурную.
Академик И. П. Бардин сравнил жизнь металла с жизнью двух животных: огненного непоседы коня, вечно скачущего по долинам, и медлительной черепахи, никогда не ускоряющей своего размеренного движения. Говорят, что черепахи живут до 300 лет, в то время как лошади редко доживают до 30 лет. Так же и металл столового ножа может прожить 300 лет, в то время, как металл самолетного мотора вряд ли протянет и 30: слишком бурна и кипуча его жизнь! В его огненном сердце взрывается бензин, взвихриваются потоки газов, протекают тепловые и ударные волны… И ведь несравненно больше металла живет у нас кипучей жизнью деятелей, чем размеренной — созерцателей. «И то, что сегодняшний срок жизни получаемого в массовых количествах металла наших станков, моторов и машин достигает 35 лет— величайшее достижение металлургии», — считает академик.
Он убежден, что срок жизни металла будет многократно удлинен. Живут же по нескольку сотен лет булатные клинки, металл которых защищен тонкой пленкой шлаков-окислов! Да и сегодняшние легированные стали — вроде нержавеющих — значительно долговечнее, чем даже булат древних мастеров. Но речь идет о металле, который составляет основную массу производимого в нашей стране металла.
Металл умирает от разных причин. Он разрушается от усталости, выходит из строя из-за износа трущихся поверхностей. И огромные количества металла гибнут от ржавчины.
Рыжая смерть железа обладает неимоверным аппетитом. Если бы люди не защищали металл, наверное, за год или много за три она сгрызла бы его весь, добытый человечеством, до последней крошки. Рухнули бы, превратившись в ржавую труху, опоры мостов, рассыпались корпусы океанских пароходов, обрушились пролеты заводских цехов. Металл снова превратился бы в руду…
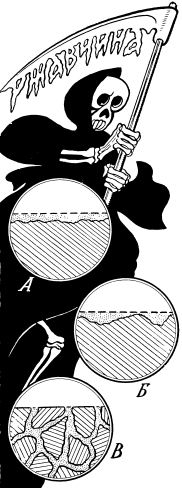
По-разному приходит смерть к металлу.
Но человек защищает металл. Защищает бесчисленными способами. Коррозия должна отступить! Но все же ее добыча еще велика.
Человечество добыло с 1890 по 1923 год 1766 млн. тонн черных металлов. Свыше трети этого металла — 718 млн. тонн — стало за эти же годы жертвой коррозии.
Считают, что и сегодня добыча ее составляет не менее 10 процентов выплавляемого за год металла.
Рыжую смерть железа видели все. Это она покрывает сверкающую ровную поверхность полированного металла струпьями, похожими на запекшуюся, смешанную с грязью кровь, делает ее ноздреватой, словно рябой. Это коррозия покрывает блестящую поверхность детали зеленым ядовитым налетом. Нет металла, включая золото и платину, который в той или иной степени не был бы покорен жестокой губящей власти.
Трудно представить себе весь вред, наносимый коррозией. Это из-за нее прерывается иногда подача воды водопроводом — она изгрызла металл труб. Это из-за нее приходится останавливать многие химические аппараты, заменяя сгоревшие части. Это из-за нее проводят тщательную диаэрацию — очистку от воздуха — воды, идущей на питание паровых котлов. Это на защиту от нее расходуются миллиарды рублей — на покраску, воронение, смазку металлических частей и деталей машин и механизмов. Борьба с коррозией — это непрерывная битва, которую, не жалея сил и средств, непрерывно ведет человечество. И, конечно, оно приложило все силы, чтобы изучить характер и повадки своего врага и выработать методы борьбы с ним.
Ученые различают два вида коррозии: химическую и электрохимическую. Химическая происходит в сухих газах и в жидкостях, не проводящих электрического тока. Она представляет собой прямое соединение металла с кислородом.
Наверное, все помнят, как на уроках химии учитель извлекал из стеклянной банки, наполненной керосином, кусочек удивительного металла— натрия. Перочинным ножом он отрезал от него крупинку, и в разрезе вдруг зеркалом сверкал чистый металл. А через пару минут тускнела поверхность металла — ее покрывала серая тусклая пелена. Вот это и есть химическая коррозия.
Особо выделяют газовую коррозию. Это те случаи, когда раскаленный металл соприкасается с газами. Обыкновенная окалина — вот результат такой коррозии.
Сложнее механизм электрохимической коррозии.
Вспомним простейшую химическую батарею — пластинки цинка и меди, опущенные в раствор электролита. Если теперь соединить эти пластинки проволочкой, по ней пойдет ток. Цинковая пластинка начнет окисляться, сгорать, ибо окисление и горение — это один и тот же процесс, только идущий с различной интенсивностью.
Вот такие же гальванические батареи возникают и на поверхности металла, разъедаемого электрохимической коррозией.
Трудно представить себе металл, абсолютно однородный по составу (кроме, конечно, специально получаемого сверхчистого металла). В нем всегда есть какие-нибудь посторонние включения, да и сами частицы металла различны между собой. В стали, например, всегда есть включения цементита, отличного от соседних кристаллов чистого железа. И вот между этими неоднородными микрочастицами происходит то же самое, что и между медью и цинком, опущенными в электролит. Нет электролита? Так он всегда найдется. Морская вода — это сильнейший электролит. Речная вода — тоже электролит: ведь в ней тоже содержатся какие-нибудь растворенные соли. Сконденсировавшаяся из воздуха пленка влаги, покрывшая металл, — тоже электролит: ведь в ней растворяются газы воздуха, а в нем всегда есть окислы углерода, серы и т. д.
Особенно много таких окислов, образующих при растворении в воде электролиты, в воздухе городов. И поэтому особенно быстро ржавеют в городах плохо покрашенные железные крыши.
Такова классификация коррозии по происхождению. Различны и проявления коррозии.
Бывает, что коррозия охватывает равномерно всю поверхность металла (А). Бывает, что ее разрушительные пятна сосредоточиваются лишь в отдельных местах (Б). И самое страшное — коррозия, прорвавшаяся внутрь металла (В). При этом разрушение его идет по самому слабому и неоднородному веществу — по границам зерен металла. Снаружи металл кажется прочным, нетронутым, а в действительности он уже весь во власти коррозии. Он рассыпается от удара, лопается при растяжении, не обеспечив и доли обычной прочности этой марки стали.
Мы говорили, что все металлы подвластны коррозии. А как же хром, алюминий, золото? Ведь они обладают удивительной способностью не окисляться!
Нет, окисляются и они. Хром сразу же при соприкосновении с воздухом начинает окисляться, на его поверхности образуется чрезвычайно тонкая, прозрачная ц прочная пленка окисла. Она-то и не дает проникнуть к поверхности металла кислороду воздуха, как броней защищает металл. Такая же пленка, но менее прозрачная, покрывает и поверхность алюминия. Это она делает его матовым, несколько ослабляя его металлический голубоватый блеск.
Вот эту способность некоторых металлов образовывать защитные пленки окислов и используют для защиты слабых, не способных сопротивляться ржавчине металлов.
Чаще всего эти металлы, например стали, покрывают пленкой такого металла. Всем известны никелированные и хромированные — покрытые никелем и хромом — детали машин, точный измерительный инструмент и т. д.
Интересен метод защиты металла от коррозии протекторами.
Вернемся ю нашему гальваническому элементу — пластинкам меди и цинка. В этой паре металлов сгорает цинк. А вот если опустить в электролит цинковую и магниевую пластинки, цинк останется нетронутым, сгорать будет магний. Он как бы берет на себя защиту цинка. И пока весь магний не сгорит, цинк в гальваническом элементе окисляться не будет. И так с любой парой металлов. Окисляется, отдавая энергию для образования электрического тока, только один из них.

Надежный щит.
Ученые расположили все элементы в один ряд в зависимости от их способности окисляться в гальваническом элементе. Вот некоторые металлы этого ряда: калий, натрий, барий, кальций, магний, алюминий, марганец, цинк, железо, никель, олово, свинец, медь, серебро, платина, золото. Какую бы пару элементов из этого ряда вы ни взяли, в гальваническом элементе будет сгорать тот металл, который ближе к началу этого списка.
И возникла идея: а почему бы, защищая особо важные детали машин и сооружений, не бросить на съедение ржавчине кусок другого металла, стоящего ближе защищаемого к началу списка? Конечно, это напоминает те жертвы, которые приносили критяне запертому в лабиринте минотавру — чудовищу с головой быка и телом человека. Ему на съедение отдавали ежегодно семь девушек и семь юношей, лишь бы он не наделал больших бед. Но в нашем случае с этим можно примириться: ведь речь идет о кусках цинка и марганца, которыми можно пожертвовать ради стальной нитки газопровода, металлического основания сооружения или корпуса океанского корабля.
Так и делают. К нити газопровода метров через пятьдесят подсоединяют протектор — сплав магния или цинка, закопанный в землю невдалеке. Образуется гальваническая пара, в которой сгорает протектор. Такая защита действует в течение нескольких лет. Но и по истечении этого срока значительно легче заменить протектор, чем целый газопровод.
Еще более активным методом защиты от коррозии является катодная защита. При этом методе к защищаемому металлу подсоединяется отрицательный полюс батареи, а положительный заземляется — его привязывают к старому рельсу, ржавому обломку трубы, которые и закапывают в землю. Таким образом создается ток, направление которого таково, что газопровод не ржавеет.
Теперь, зная химическую сущность ржавления, мы можем по-новому взглянуть и на роль защитных покрытий.
Цинк стоит ближе железа в нашем списке металлов. Значит, оцинкованное железо не будет ржаветь и в том случае, если часть покрытия исчезнет, окислится. Цинк будет самоотверженно, до последней молекулы неокисленного металла (чуть ли не до последней капли крови!), защищать своим телом железное ведро.
Совсем по-другому обстоит дело с никелевым покрытием. Ведь никель дальше железа в этом списке. Стоит прорваться этому покрытию— и в образовавшейся трещине заведется красная труха ржавчины. Недоглядишь — и она поползет под пленкой никеля, словно защищаясь им от посторонних взглядов.
Но ведь возможны случаи, когда нельзя применить для защиты от коррозии ни металлическое покрытие, ни покраску, ни метод протектора. Что ж, металл остается тогда беззащитным? Нет, в этих случаях применяют защиту ингибиторами.
Ингибиторы — это вещества, которые, оказываясь в растворенном виде в пленке покрывающей металл влаги, замедляют коррозию. Их можно добавить к серной или соляной кислоте — и перевозить ее в железной цистерне. На месте назначения можно будет извлечь из кислоты ингибитор, и она вновь приобретет свои разъедающие свойства.
Ингибиторы добавляют часто в состав лаков и красок. И пусть даже будет поцарапано такое покрытие. Просачивающаяся по царапине к металлу вода растворит по пути содержащийся в краске ингибитор, и он предохранит металл от коррозии.
Однажды сделали такой опыт. Несколько партий швейных игл, хранящихся на складе, смазали техническим вазелином и завернули в парафинированную бумагу. Это один из обычных методов хранения такого рода изделий. Точно такое же количество таких же игл завернули в бумагу, пропитанную раствором ингибитора.
Прошло несколько месяцев, и упаковку вскрыли. Те иглы, которые были завернуты в парафинированную бумагу, оказались довольно сильно затронуты коррозией. На иглах, завернутых в пропитанную ингибиторами бумагу, не оказалось ни одного пятнышка ржавчины.
Действие ингибиторов объясняется тем, что входящие в них вещества способны создавать на поверхности металла тончайшие пленки. Их молекулы как бы приклеиваются, адсорбируются, к поверхности металла, мешают тем самым его взаимодействию с агрессивной средой.
К сожалению, ингибиторы имеют избирательное действие. Одни из них защищают черные металлы, другие — цветные. Вероятно, можно будет применить и универсальные, комбинированные ингибиторы.
Борьбу с коррозией продолжает и конструктор. Однажды в США построили яхту для спортивного состязания. Это была прекрасная яхта: стройный узкий корпус, рассчитанный на стремительный полет по воде, медно-никелевая обшивка, стальной киль. Когда яхту спустили на воду, владелец не мог налюбоваться ею. Но она развалилась еще до начала состязания. Сталь киля и медно-никелевая обшивка корпуса составили отличную гальваническую пару— и киль съела ржавчина. Кто виноват? Конечно, тот, кто спроектировал яхту.
Поэтому проектировщики внимательно следят теперь за тем, как сопрягаются в конструкции различные материалы. Например, просто недопустим прямой контакт алюминиевых сплавов с деталями из меди, латуни и нержавеющей стали. Таких сопряжений вообще стремятся избежать. А если это невозможно, то между соприкасающимися металлами вставляют инертные прокладки. Следит конструктор и за тем, чтобы в нужных местах были поставлены протекторы, чтобы особо ответственные детали, соприкасающиеся с агрессивными жидкостями, были защищены стойкими покрытиями, и т. д.
Трудно перечислить все ухищрения, на которые пускаются люди, чтобы защитить свой металл от ржавчины. Точные приборы, малейшее пятнышко окисла на которых уже невозвратимо портит их, иногда заключают в герметические корпусы, причем воздух, находящийся в них, освобождают от влаги. Авиационные моторы упаковывают в мешки из полихлорвиниловой пленки. Влагу, которая содержится в мешке, поглощает специально для этой цели вводимое вещество. И так далее и так далее.
В борьбе с коррозией человек одержал много побед, но до решительной победы еще далеко. Немало еще придется поискать, прежде чем жизнь металла станет вечной.
А возможно ли это? Да!
В Индии, в одном из городов, на главной площади стоит железная колонна. В глубокой древности выковали ее из чистого железа кузнецы. Как они справились с этой работой, обладая лишь примитивными горнами и ручной технологией, это и сегодня непонятно. Но уже много сотен лет стоит она, и ни одного пятнышка ржавчины нет на ее поверхности, покрытой причудливой вязью письмен. Не в ней ли скрыта тайна борьбы с коррозией? Не знали ли ее древние металлурги, творцы этого чуда?
Чистый металл… Да, чистота металла играет роль, когда речь идет о коррозии. Магний, содержащий меньше 0,005 процента железа, оказывается в десятки раз более стойким против коррозии, чем обычный технический магний, содержание железа в котором достигает 0,2 процента. Чистый алюминий в 20–30 раз более стоек по отношению к коррозии, чем алюминий, содержащий около 1 процента железа. Да это и понятно: ведь примеси — лишняя возможность для создания гальванических пар. Но и без них металл все равно, хотя и значительно меньше, коррозирует. Случайная пылинка, севшая на его поверхность, уже может стать этой гальванической парой. Нет, не в чистоте металла разгадка тайны индийской колонны!..
Борьба с коррозией продолжается. Уже отступает, но еще уносит огромные жертвы рыжая смерть металла. Включайтесь и вы в эту борьбу! Защищайте металл! Ищите новые средства борьбы с ржавчиной! И, может быть, именно вам выпадет счастье открыть секрет древних индийских металлургов.
Назад: Конструктор продолжает борьбу
Дальше: Как птица Феникс

