Книга: Прямоходящие мыслители. Путь человека от обитания на деревьях до постижения миро устройства
Назад: Глава 7 Механическая вселенная
Дальше: Глава 9 Одушевленный мир
Глава 8
Из чего все сделано
Еще подростком я увлекся двумя отчетливо разными научными подходами к тайнам Вселенной. До меня постоянно долетали странные слухи о достижениях физиков, об их открытии квантовых законов, согласно которым я вроде как мог находиться в двух местах одновременно. Я сомневался, что в настоящей жизни такое и впрямь бывает, да и мест, где я бы хотел оказаться, было не так много. Но еще я слыхал и о более приземленных тайнах, которыми занимались химики, – устрашающих и опасных, но мало похожих на отмычку от Вселенной: они возбуждали во мне дух приключений и обещали наделить силами, каких дети обычно не имеют. Вскоре я уже смешивал аммиак с раствором йода, перхлорат калия с сахаром и цинковую пыль с нитратом и хлоридом аммония – и взрывал все подряд. Архимед говорил, дескать, дайте ему точку опоры, и он перевернет мир; я верил, что с помощью подходящей бытовой химии я его взорву. Вот она, сила постижения веществ вокруг нас.
Первые научные мыслители этого мира торили эти два пути изучения физического мира. Они задавались вопросом, что творит изменения, и разбирались, из чего все сделано и как состав предметов влияет на их свойства. Со временем Аристотель предложил план движения по обоим направлениям, но указанные им дороги оказались тупиковыми.
Ньютон и его предшественники прошли долгий путь к пониманию вопросов о переменах. Ньютон попытался понять и науку материи, но и близко не стал химиком столь же великим, каким был физиком. Загвоздка не в том, что ему не хватило интеллекта, и даже не в том, что он брел длинной тупиковой дорогой алхимии. Мешало ему вот что: хотя химия, наука о веществе, развивалась бок о бок с физикой, наукой о переменах, она совсем другого свойства. Она грязнее и сложнее, и заниматься ею настолько основательно, как Ньютон возился с изучением изменений, потребовало бы множества технических нововведений, большинство которых во времена Ньютона еще не были изобретены. И потому Ньютон оказался в безвыходном положении, а химии не хватало могучей фигуры, которая вывела бы эту дисциплину (а вместе с ней – и эту самую фигуру) к славе. Так что химия развивалась постепенно, а слава досталась нескольким первопроходцам разом.
История о том, как человечество разбиралось с составом всего, дорога моему сердцу, поскольку химия – моя первая любовь. Я вырос в маленькой двухэтажной квартире в Чикаго, где жили тесно, зато имелся большой подвал, в котором я, предоставленный сам себе, смог построить собственный Диснейленд – затейливую лабораторию, загроможденную полками со склянками, разноцветными порошками и бутылками с крепчайшими кислотами и щелочами.
Кое-какие реактивы приходилось покупать из-под полы или невольной помощью моих родителей («Вот был бы у меня галлон муравьиной кислоты, уж я б ту кошачью мочу от бетона-то оттер»). Нимало не чураясь хитрости, я понял, что, изучая химию, мог бы создавать клевые салюты, а попутно утолять любопытство, каким я пылал к окружающему миру. И, видимо, подобно Ньютону, я осознал, что у моего занятия есть масса преимуществ перед попытками обустраивать общение с людьми. Реактивы добывать проще, чем друзей, и когда мне хотелось играть с реактивами, они не говорили, что им нужно идти мыть голову или что-нибудь менее вежливое – типа, что не хотят водиться с чудиками. Впрочем, как это бывает со многими первыми любовями, мы с химией друг к другу охладели. Я начал флиртовать с другой дисциплиной – физикой. И вот тогда-то понял, что разница между разными отраслями науки – не только в том, что они отвечают на разные вопросы, но и в том, что вокруг них складываются разные культуры.
Разница между физикой и химией ярче всего проступала в совершаемых мною ошибках. Я довольно быстро понял, к примеру, что, если мои физические расчеты сводились в конце концов к уравнению «4 = 28», это означало, что я не открыл некую глубинную прежде не замеченную истину, а, скорее, сделал какую-то ошибку. Но ошибка эта безобидная, существовавшая только на бумаге. В физике подобные ляпы почти неизбежно приводили к безопасной, хоть и раздражающей математической белиберде. Химия – другое дело. Мои ошибки в химии венчались большими объемами дыма и огня, а также кислотным ожогам кожи, и оставляли рубцы, не сходившие десятилетиями.
Мой отец описывал разницу между физикой и химией по опыту своего общения со знакомцами, которые были ближе всего к практике этих дисциплин. «Физик» – точнее, математик – в концентрационном лагере, который объяснил отцу, как решить ту самую задачку, в обмен на хлеб. Человек, которого отец именовал «химиком», – из еврейского подполья, которого он встретил перед отправкой в Бухенвальд.
Мой отец состоял в группе, планировавшей подрыв железной дороги, шедшей через их город, Ченстохову. Химик, рассказывал отец, мог пустить под откос поезд, применив взрывчатку, хитро установленную на рельсы, но ему для этого нужно было выбраться из гетто и добыть кое-какие исходные материалы, которые, как он утверждал, можно приобрести взятками и воровством. На это потребовалось несколько ходок, но из последней он так и не вернулся, и больше о нем ничего не слыхали.
Физик, по словам отца, был изящный тихий человек, нашедший прибежище от ужасов лагеря, как умел: скрывшись в мире своего же ума. Химик же был ковбоем и мечтателем с горящими глазами, он бросался в гущу событий и сломя голову – в бой с хаосом. В этом и состояла, по мнению отца, разница между химией и физикой.
Что правда, то правда: в отличие от первых физиков, первым химикам требовалось немало чистой физической смелости, ибо случайные взрывы были неизбежным риском их работы, равно как и отравления: химики, чтобы определять вещества, частенько пробовали их на вкус. Быть может, самый знаменитый из давних экспериментаторов – Карл Шееле. Шееле выжил, хоть и был первым химиком, выделившим страшно едкий и ядовитый газ хлор, и каким-то чудом сумел подробно описать вкус цианистого водорода, чрезвычайно ядовитого газа, и при этом не умер. Но в 1786 году сорокатрехлетнего Шееле все же добила болезнь, подозрительно похожая на тяжелое отравление ртутью.
Если же говорить о личном, разница между химиком и физиком для меня самого походила на разницу между отцом и мной. После исчезновения химика отец и четверо других заговорщиков продолжили осуществлять план расшатать рельсы с применением только подручных инструментов – «всяких отверток», как он объяснил, – а не взрывчатки. Все пошло наперекосяк: один из подпольщиков запаниковал и привлек внимание оказавшихся неподалеку эсэсовцев. В итоге уцелеть удалось лишь моему отцу и еще одному диверсанту – они легли на рельсы и остались незамеченными: над ними прогромыхал длинный товарный состав. Я же, напротив, редко берусь за какое-нибудь значимое во внешнем мире дело, а только рассчитываю последствия событий при помощи уравнений и бумаги.
Пропасть между физикой и химией также отражают происхождение и культуры обеих дисциплин. Физика началась с умозрительного теоретизирования
Фалеса, Пифагора и Аристотеля, а химия родилась в кладовках торговцев и темных подвалах алхимиков. Хотя практики в обеих областях были движимы горним желанием познавать, химия еще и коренится в дольнем – иногда в стремлении облегчить жизнь человеческую, иногда в жажде наживы. Есть в химии благородство – благородство стремления постигать и приручать материю, но всегда есть и потенциал больших барышей.
* * *
Три закона движения, открытые Ньютоном, были в некотором смысле просты, хоть и прячутся от обычного взгляда во мгле трения, сопротивления воздуха и незримости силы тяготения. Химия, однако, не управляется набором постановлений, подобных Ньютоновой тройке универсальных законов движения. В химии все гораздо запутаннее: наш мир богат на ошарашивающее разнообразие веществ, и химии пришлось постепенно с ними всеми разбираться.
Первое открытие в химии было таким: некоторые вещества – «элементы» – базовые, а другие состоят из различных комбинаций элементов. Интуитивно это осознали еще греки. По Аристотелю, например, элемент есть «одно из тех тел, до которого можно разложить другие тела, а сам он разложен быть на составляющие не может». Называл он четыре элемента: земля, воздух, вода и огонь.
Очевидно, многие вещества состоят из других веществ. Соль плюс пресная вода равно соленая вода; железо плюс вода равно ржавчина; водка плюс вермут равно мартини. И наоборот: можно разложить многие вещества на составляющие путем нагревания. К примеру, если нагреть известняк, он разложится на негашеную известь и газ – диоксид углерода. Сахар разлагается на углерод и воду. Подобные простенькие наблюдения, впрочем, ведут недалеко, поскольку не существует единого описания того, что именно происходит. Допустим, если нагревать воду, она превращается в газ, но этот газ химически не отличается от жидкости, это просто другое ее физическое состояние. Ртуть при нагревании тоже не распадается на составляющие – напротив, соединяется с незримым кислородом воздуха и образуется вещество, именуемое ртутной окалиной.
А есть еще горение. Представьте горящую древесину. При сжигании дерева получаются огонь и зола, но было бы ошибкой предполагать, что дерево состоит из огня и золы. Более того, в пику Аристотелеву описанию, огонь – вообще не вещество, а, скорее, свет и тепло, выделяющиеся, когда вещества претерпевают химические превращения. На самом же деле при горении дерева выделяются невидимые газы – в основном, диоксид углерода и водяной пар, но вообще там более сотни разных газов, и у древних не было никаких приборов, которые позволили бы им эти газы собрать и уж тем более разделить или идентифицировать.
Такого рода трудности делали непосильным понимание, что именно сделано из двух или более веществ, а что – вещество простое. В результате этой путаницы многие ученые, подобно Аристотелю, ошибочно считали воду, огонь и другие фундаментальными элементами, но при этом не смогли опознать семь металлических простых веществ – ртуть, медь, железо, свинец, олово, золото и серебро, хотя те были ученым знакомы.
Так же, как рождение физики зависело от математических нововведений, рождение настоящей химии дожидалось определенных технических изобретений – оборудования для точного взвешивания веществ, для измерения тепла, поглощаемого или выделяемого в ходе реакций, для определения, кислота вещество или щелочь, для уловления, отделения и манипулирования газами, а также для определения температуры и давления. Лишь с разработкой этих приспособлений в XVII–XVIII веках химики смогли начать разбираться в запутанных прядях своего знания и развивать плодотворные методы представления химических реакций. Следует отдать должное человеческому упорству: даже и до всех этих технических усовершенствований люди, практиковавшие ремесла, зародившиеся в древних городах, собрали громадный массив знаний во множестве различных направлений этой области постижения – в окрашивании, парфюмерии, стекольном деле, металлургии и бальзамировании.
* * *
Бальзамирование возникло первым. В пространстве этого знания родословную химической науки можно отследить вплоть до Чатал-Гуюка, поскольку жители его хоть покойников и не бальзамировали, культуру отношения к смерти все же развили и за своими покойниками ухаживать начали. Во времена древнего Египта возросшее беспокойство о судьбе усопших привело к изобретению мумификации. Считалось, что успешная мумификация – залог счастливой загробной жизни; еще бы – ни единого недовольного клиента с жалобами. Следовательно, возник спрос на бальзамирующие вещества. Родилась новая индустрия, стремившаяся, перефразируя девиз компании «Дюпон», к лучшим вещам для лучшей загробной жизни – благодаря химии.
Миру всегда хватало мечтателей, и среди них были счастливые личности, воплотившие свою мечту, – или, по крайней мере, жившие стремлением к ней. Эти вторые необязательно признаны за талант или ученость, но неизбежно выделяются трудолюбием. Должно быть, египетские предприниматели и новаторы стремились разбогатеть, совершенствуя процесс бальзамирования, ибо вкладывали в эти попытки много времени и стараний. Со временем, путем многочисленных проб и ошибок, египетские бальзамировщики постепенно научились применять действенные сочетания солей натрия, смол ы, мирру и другие консерванты, с помощью которых можно было успешно предотвращать разложение трупов, и все эти открытия были сделаны без всякого знания происходящих химических процессов и причин распада человеческого тела.
Поскольку бальзамирование было ремеслом, а не наукой, с его открытиями обращались не как с теориями древних эйнштейнов, а, скорее, как с рецептами «Бейглы Братьев Айнстайн»: их тщательно стерегли. А поскольку бальзамирование связано с покойниками и загробным миром, практиковавшие это искусство считались колдунами и чародеями. Со временем развились и другие скрытные профессии, копившие знания о минералах, маслах, вытяжках из цветов, растительных плодов и кореньев, о стекле и металлах. Здесь, в прото-химии, практикуемой людьми торговыми, – истоки таинственной и мистической культуры алхимии.
Умельцы в этих областях вместе собрали обширный массив особого, но разрозненного опыта. Этот пестрый набор ноу-хау наконец начал объединяться, когда Александр Великий основал в 331 году до н. э. в устье Нила египетскую столицу Александрию.
Александрия была роскошным городом, с изящными зданиями и улицами в сотню футов шириной. Через несколько десятилетий после основания греческий царь Египта Птолемей II возвел культурную жемчужину города – Мусейон. Мусейон, в отличие от современных музеев, не выставлял экспонаты, а предоставлял убежище сотне ученых и книжников, получавших государственные стипендии, бесплатное жилье и питавшихся с кухни Мусейона. Этот храм науки был оборудован исполинской библиотекой на полмиллиона свитков, обсерваторией, анатомическими лабораториями, садами, зоопарком и другими исследовательскими удобствами. Здесь размещался достославный центр постижения, живой, действующий памятник человеческому стремлению знать. То был первый в мире исследовательский институт, сыгравший ту же роль, что и позднее – европейские университеты, хотя, как ни печально, ему суждено было погибнуть в огне, в III веке н. э.
Александрия вскоре стала культурной Меккой, а всего за пару столетий – величайшим и знаменитейшим городом на белом свете. Здесь разнообразные теории материи и перемен в ней пересеклись с египетским химическим знанием. Эта встреча идей все изменила.
До вторжения греков египетское знание о свойствах веществ веками было исключительно практическим. Однако греческая физика предложила египетскому знанию теоретическую базу и контекст. В особенности Аристотелева теория материи объясняла, как вещества меняются и взаимодействуют. Теория Аристотеля, конечно, была заблуждением, однако вдохновила объединенный подход к науке о веществе.
Особенно влиятельной оказалась одна сторона Аристотелевой теории – его представление о преобразовании веществ. Возьмем процесс кипения. Аристотель считал, что у элемента воды есть два ключевых свойства: она влажная и холодная. Элемент воздух же он охарактеризовал как влажный и горячий. Кипение, на его взгляд, – это процесс, в котором элемент огонь преобразует холод в тепло и таким образом превращает воду в воздух. Египтяне, унюхав возможность заработать на этом представлении, превзошли самих себя и предположили: если воду можно превратить в воздух, можно ли какой-нибудь не очень ценный материал превратить в золото? Примерно как моя дочь Оливия, которая в ответ на сообщение, что можно получить доллар от зубной феи, если оставить зуб под подушкой, тут же уточнила: «А сколько мне причтется за обрезки ногтей?»
Египтяне заметили, что золото, подобно Аристотелевым главным элементам, имеет некоторые ключевые свойства: это металл, мягкий, желтый. Золото само по себе всеми этими качествами располагает, однако они в разных сочетаниях встречаются у многих веществ. Можно ли найти способ, как передавать между веществами их свойства? В особенности, если кипение – процесс, в котором применение огня позволяет изменить физические свойства воды и превратить ее в воздух, вероятно, существует похожий процесс, посредством которого можно трансмутировать сочетание металлических, мягких и желтых веществ в золото.
В результате таких рассуждений к 200 году до н. э. из первых намеков на подлинное химическое знание, смешанных с представлениями из греческой философии и старой прото-химией бальзамирования, металлургии и других практических умений, родился объединенный подход к исследованию химических изменений. Так родилась алхимия, ее главной целью стало производство золота, а позднее – «эликсира жизни», дарующего вечную молодость.
Историки спорят, когда именно прорезалась наука химия, но химия – не люцерна, и потому дата ее прорезывания – скорее вопрос личного мнения, нежели точный факт. Одно, впрочем, бесспорно: алхимия служила полезному делу – и химия, когда бы ни достигла своего современного вида, есть наука, выросшая из искусств и мистицизма этого древнего предмета.
* * *
Первый рывок от алхимической волшбы к научным методам произошел благодаря одному из довольно странных персонажей в истории человеческой мысли. Родившегося в деревушке на территории современной Швейцарии двадцатиоднолетнего Теофраста Бомбаста фон Гогенгейма [Хоэнхайма] (1493–1541) отец отправил изучать металлургию и алхимию, но тот решил учиться медицине и занялся этой профессией. Тогда же, еще до тридцати, он взял себе имя Парацельс, что означает «превзошедший Цельса», римского врача I века н. э. Поскольку труды Цельса были в XVI веке очень популярны, Парацельс, сменив прозвище, сумел из человека по имени Бомбаст сделаться тем, кто это качество воплощает. Но дело не только в напыщенности: Парацельс шумно презирал бытовавший в те времена подход к медицине. Ученый продемонстрировал свое презрение довольно картинно: на традиционных студенческих посиделках летом у костра Парацельс швырнул в огонь, вместе с несколькими горстями серы, медицинские труды почтенного греческого врача Галена.
Неприязнь Парацельса к Галену была того же рода, что и у Галилея и Ньютона – к Аристотелю: его труды обесценились наблюдениями и опытом позднейших практиков. Парацельс, в частности, считал, что традиционное представление о болезни как о неравновесии загадочных телесных жидкостей под названием «гуморы» не выдерживает проверки временем. Сам он был убежден, что болезни возникают из-за внешних агентов, а с ними нужно разбираться, пользуя больного подобающими лекарствами.
Парацельс, изображенный на копии XVII века с утраченного оригинала фламандского художника Квинтена Матсейса (1466–1529)
Именно поиск этих самых «подобающих лекарств» и привел Парацельса к попытке трансформировать алхимию. Попытка принесла щедрые плоды, среди них – открытие новых веществ, в том числе солей металлов и минеральных кислот, но Парацельс желал оставить поиск золота и сосредоточиться на цели поважнее – создать вещества, какие есть в лаборатории человеческого тела и могут лечить те или иные заболевания. Что не менее важно, Парацельс стремился реформировать алхимические методы, в те времена – неточные и небрежные. Парацельс сам был не только книгочеем, но и знатоком торговли, и потому придумал для обновленной алхимии свежее название. Заместив арабский префикс «ал» (определенный артикль) на греческое слово, означающее «медицина» – иатро, он составил слово «иатрохимия». Не слишком удобное для произношения, вероятно, поэтому оно вскоре усохло до краткого «химия».
Соображения Парацельса позднее повлияют и на великого Исаака Ньютона, и на его соперника Лейбница, и оба они помогут двинуть алхимию к новому ее образу – науке химии. Но хотя Парацельс и был пылким борцом за собственный новый подход к науке, действенность его личных уговоров оказалась подпорчена качествами его характера. Он бывал изрядно неприятен – под словом «неприятен» я подразумеваю «вел себя, как буйнопомешанный».
Парацельс не носил бороды, был довольно женоподобен и не интересовался сексом, однако если бы в Олимпийских играх давали золотые медали в кутеже, Парацельс выиграл бы платину. Большую часть времени он пил, и один его современник отмечал, что жил Парацельс «как свинья». Продвижением себя самого он тоже занимался не слишком деликатно и склонен был бросаться заявлениями типа: «Все университеты и все старые писаки, вместе взятые, таланта имеют меньше, чем моя задница»1. А еще ему нравилось бесить влиятельные круги, временами – просто так. К примеру, когда его назначили лектором в Университете Базеля, он явился на первую лекцию в кожаном лабораторном фартуке, а не в положенной академической мантии, говорил на швейцарском немецком, а не на приличествующей латыни, а после объявления, что сейчас он продемонстрирует величайшую тайну медицины, показал всем судок с фекалиями.
Подобные выходки привели к тому же результату, какой случился бы и ныне: он оттолкнул своих врачебных и ученых коллег, однако стал популярен среди студентов. И все же, когда Парацельс говорил, люди слушали, поскольку многие его лекарства и впрямь помогали. Например, обнаружив, что опиаты гораздо лучше растворимы в спирте, чем в воде, он создал опийный раствор, который назвал «лауданумом», оказавшийся очень действенным против боли.
Однако лучшим двигателем идей Парацельса оказалась, похоже, экономика. Возможности новых химических снадобий от болезней увеличивали доход, общественное положение и популярность аптек, что создало спрос на знания в этой области. Расплодились учебники и медицинские занятия, и они, в полном согласии с желанием Парацельса, стали и точнее, и унифицированнее – благодаря переходу понятийного и методического аппарата алхимии на язык химии. К началу 1600-х годов, хоть многие по-прежнему и практиковали старую алхимию, новый Парацельсов стиль алхимии – химия – тоже набирал популярности.
Подобно мёртонцам-математикам, Парацельс стал переходной фигурой: он помог преобразовать свой предмет и заложил примитивный фундамент для тех, кто будет развивать эту практику вслед за ним. Масштабы влияния Парацельса и на старый, и на новый мир химии делаются ясны из его собственной жизни: он хоть и критиковал традиционную алхимию, сам же в ней и плескался. Всю свою жизнь он ставил эксперименты, нацеленные на создание золота, а однажды даже объявил, что получил и выпил эликсир жизни и дальше будет жить вечно.
Увы, в сентябре 1541 года, когда Парацельс находился в заведении под названием «Трактир Белая Лошадь» в венском Зальцбурге, Бог поймал его на блефе. Парацельс шел ночью по темной узкой улице к себе и либо неудачно упал, либо его избили головорезы, нанятые местными врачами, с которыми он ссорился, – выбирайте версию на свой вкус. Обе истории вели к одному концу: Парацельсову. Он скончался от увечий несколько дней спустя, в сорок семь лет. Говорят, при смерти выглядел гораздо дряхлее своих лет – из-за вечных загулов и пития. Проживи он еще полтора года, мог бы застать издание великой работы Коперника «De Revolutionibus Orbium Coelestium» («О вращениях небесных сфер»), которую часто считают началом научной революции, а такое развитие дел Парацельс почти наверняка бы одобрил.
* * *
Через полтора века после смерти Парацельса начался период, как мы убедились, в котором первопроходцы Кеплер, Галилей и Ньютон, развивая начатое в трудах постарше, создали новый подход к астрономии и физике. Со временем качественные теории мироздания, управляемого метафизическими принципами, уступили место представлениям об измеримой, подчиняющейся неизменным законам Вселенной, которую можно оценивать количественно. А подход к знанию, основанный на книжном авторитете и метафизических доводах, заменила убежденность, что нам необходимо постигать законы природы путем наблюдения и эксперимента и формулировать эти законы на языке математики.
Как и в физике, интеллектуальная трудность, с которой столкнулось новое поколение химиков, не сводилась к разработке методов строгого рассуждения и экспериментирования – нужно было отринуть философию и представления прошлого. Чтобы набраться зрелости, новой химии требовалось и учесть уроки Парацельса, и низвести с трона тупиковые теории Аристотеля – только не теории движения, которыми занимались Ньютон и другие физики и математики, а теории материи.
Прежде чем сложить головоломку, необходимо разобраться с ее фрагментами, а в головоломке природы фрагменты – это химические элементы. Пока люди верили, что все состоит из земли, воздуха, огня и воды – или в пределах какой-нибудь подобной схемы, – их понимание материальных тел основывалось на выдумках, а способность создавать новые полезные вещества по-прежнему ограничивалась методом проб и ошибок, без возможности какого-либо настоящего понимания. Так сложилось, что в новой интеллектуальной атмосфере XVII века, покуда Галилей и Ньютон окончательно изгоняли Аристотеля из физики и заменяли его представления на теорию, основанную на наблюдении и эксперименте, один из тех, чья работа по оптике помогла вдохновить Ньютона, взялся изгонять Аристотеля из химии. Речь об ирландце Роберте Бойле, сыне первого графа Коркского.
Один путь посвятить себя жизни в науке – добыть университетскую должность. Другой – быть непристойно богатым. В отличие от университетских про-фессоров-первопроходцев физики, многие герои юной химии были людьми со средствами, кои во времена, когда лаборатории оставались редкостью, могли себе позволить создать свою собственную. Роберт Бойль [Бойл] был сыном графа не просто богатого, а, возможно, богатейшего во всей Великобритании.
Про мать Бойля известно немногое – помимо того, что она вышла замуж в семнадцать лет и за последующие двадцать три года выносила пятнадцать детей, после чего упала замертво от чахотки, что к тому времени в ее судьбе, вероятно, было облегчением. Роберт был ее четырнадцатым ребенком и седьмым сыном. Граф, похоже, больше любил делать детей, чем их растить, а потому вскоре после рождения их всех отправляли под опеку нянь, затем – в пансионы и колледжи или же за рубеж, учиться у частных преподавателей.
Самые нежные свои лета Бойль провел в Женеве. В четырнадцать он как-то раз проснулся среди ночи в жуткую грозу и поклялся, что, если выживает, посвятит себя Богу. Если бы люди выполняли или даже просто помнили все клятвы, данные в трудных обстоятельствах, мы бы жили в лучшем мире, но Бойль своей клятве остался верен. Была та гроза подлинной причиной или же нет, но Бойль сделался глубоко религиозен и, невзирая на богатство, жил аскетом.
Через год после той судьбоносной грозы он навещал Флоренцию – как раз когда неподалеку в изгнании умер Галилей. Бойль ухитрился добыть книгу Галилея о системе Коперника – его «Диалог о двух главных системах». То была счастливая случайность, однако случайность, в истории мысли примечательная: по прочтении книги Бойль, в те поры пятнадцатилетний, влюбился в науку.
Ни из каких исторических документов не ясно, почему Бойль выбрал химию, но со дня своего обращения он искал, как бы послужить Богу, и решил, что химия – способ что надо. Подобно Ньютону и Парацельсу, он хранил безбрачие и сделался одержим работой; как и Ньютон, верил, что усилия понять устройство природы ведут к постижению путей Господних. Однако, в отличие от физика Ньютона, химик Бойль считал науку важной еще и потому, что она может облегчать страдания людей и улучшать их жизнь.
Бойль в некотором смысле был ученым из-за своей филантропии. В 1656 году в двадцать девять лет он переехал в Оксфорд, и, хотя в университете официально химию пока не преподавали, Бойль на свои деньги обустроил лабораторию и отдался исследованиям – преимущественно, пусть и не исключительно, в химии.
Оксфорд во времена Английской гражданской войны был оплотом короны и укрытием многим сбежавшим из парламентского Лондона. Бойль, похоже, не склонялся ни к той, ни к другой позиции, но примкнул к еженедельному собранию беженцев, на котором обсуждались общие интересы в экспериментальной науке. В 1662 году, незадолго до восстановления монархии, Карл II пожаловал этой группе особый статус, и она стала Королевским обществом (или, точнее, Лондонским Королевским обществом по развитию знаний о природе), сыгравшим столь важную роль в карьере Ньютона.
Королевское общество вскоре стало местом, где многие величайшие умы того времени, включая Ньютона, Гука и Галлея, собирались для обсуждений, дебатов и взаимной критики, а также чтобы поддерживать друг друга и добиваться, чтобы идеи проникали во внешний мир. Девиз Общества Nullus in verba приблизительно означает «Не верь на слово», но в частности это означало «Не верь на слово Аристотелю», поскольку члены Общества понимали, что движение вперед требует превзойти мировоззрение Аристотеля.
Бойль принял скептицизм как личную мантру, что нашло отражение в названии его книги 1661 года, «Химик-скептик» – по большей части сплошь разоблачение Аристотеля. Бойль, как и его коллеги, осознал, что научная строгость в понимании влекшего его к себе предмета требовала отказа от значительной части наследия прошлого. Химия, может, и уходила корнями в мастерские бальзамировщиков, стеклодувов, красильщиков, металлургов, алхимиков, а также, со времен Парацельса, аптекарей, однако Бойль воспринимал ее как единое поле знание, достойное изучения ради него самого как необходимого для фундаментального понимания естественного мира, подобно изучению астрономии и физики, и дисциплина эта имеет право на такой же интеллектуально строгий подход.
В своей книге Бойль предложил множество примеров химических процессов, противоречивших Аристотелевым представлениям об элементах. Он в подробностях рассмотрел, например, горение дерева до золы. Если жечь бревно, сообщал Бойль, вода, выкипающая с концов, «совсем не элементарная вода», а дым – «совсем не воздух»: если его перегнать, останутся масло и соли. Утверждение, будто огонь преобразует бревно в вещества-«элементы» – землю, воздух и воду, – не выдерживает проверки практикой. При этом другие вещества, например, золото и серебро, разложить на составляющие, похоже, не удается, а значит их, вероятно, следует считать «элементами».
Величайший вклад Бойля – развенчание представления о воздухе как об «элементе». Он подкрепил свои выводы экспериментами, в которых ему помогал ворчливый юный ассистент, оксфордский выпускник и пылкий роялист Роберт Гук. Бедняга Гук: позднее им пренебрег Ньютон, за эксперименты с Бойлем он тоже не слишком восхвален в веках, хотя, вероятно, собрал все оборудование и произвел почти всю работу сам.
В одной серии экспериментов они исследовали дыхание – пытались разобраться, как наши легкие взаимодействуют с поступающим в них воздухом. Они поняли, что происходит нечто очень важное. В конце концов, если там не протекает некое взаимодействие, тогда мы тратим на дыхание уйму времени впустую, просто чтоб легкие занять в паузах между сигарами. Разбираясь в этом, они ставили опыты на мышах и птицах. Увидели, что у животных, помещенных в закупоренный сосуд, дыхание постепенно затрудняется, а потом и вовсе прекращается.
Что показали эксперименты Бойля? Очевиднейший вывод: Роберту Бойлю не годится поручать приглядывать за вашим питомцем. Но помимо этого стало ясно, что, когда животные дышат, они либо поглощают некий компонент воздуха, который, если заканчивается, приводит к смерти, либо выделяют какой-то газ, который в достаточных концентрациях оказывается смертелен. Либо и то, и другое. Бойль считал, что верно первое, но, как бы то ни было, эти эксперименты показывали, что воздух – не «элемент», а состоит из разных компонентов.
Бойль разобрался и с ролью воздуха в горении, применив сильно усовершенствованную версию вакуумного насоса, изобретенного Гуком незадолго до этого. Бойль увидел, что, стоит откачать весь воздух из закупоренного сосуда с горящим предметом, огонь гаснет. Вывод: в горении, как и в дыхании, участвует некое неведомое вещество воздуха, необходимое для протекания этих процессов.
Попытка определить «элементы» – суть работы Бойля. Он знал, что Аристотель и его последователи заблуждаются, однако, с поправкой на ограничения доступных ресурсов, в замещении их представлений более точными он смог добиться лишь частичного успеха. И все же просто показать, что воздух состоит из разных газов, – столь же действенный удар по теориям Аристотеля, как и наблюдения холмов и кратеров на поверхности Луны, а также лун Юпитера Галилеем. Бойль своими трудами помог освободить нарождающуюся науку от опоры на привычную мудрость прошлого, заменив ее тщательным экспериментированием и наблюдением.
* * *
В химическом исследовании воздуха есть нечто глубоко значительное. Знания о селитре или же оксидах ртути про нас самих ничего нам не сообщает, а вот воздух дарует нам жизнь. И все же до Бойля воздух никто изучать не рвался. Исследование газов было задачей трудной и крайне ограниченной тогдашним состоянием техники. И ситуация не менялась вплоть до конца XVIII века, когда разработка нового лабораторного оборудования – например, пневматической ванны – позволила собирать образующиеся в химических реакциях газы.
К сожалению, поскольку незримые газы часто поглощаются или выделяются в химических реакциях, без понимания газообразного состояния веществ химики вынуждены были проводить неполный и зачастую ошибочный анализ многих химических процессов – в особенности горения. Химии, чтобы окончательно превзойти себя средневековую, требовалось изменить это – и понять природу огня.
Через сто лет после Бойля кислород, газ, необходимый для горения, был наконец открыт. Ирония истории: в 1791 году у человека, открывшего кислород, разъяренная толпа сожгла дом. Гнев толпы навлекла поддержка этим человеком Американской и Французской революций. Из-за этих противоречий Джозеф Пристли (1733–1804) покинул родную Англию и перебрался в 1794 году в Америку.
Пристли был унитарианцем, знаменитым – и пылким – сторонником религиозной свободы. Он начал свою карьеру священником, но в 1761 году сделался учителем современного языка в одной из нонконформистских академий, игравших роль университетов для тех, кто отпал от Церкви Англии. Тамошние лекции коллеги-преподавателя вдохновили его написать историю новой науки об электричестве. Его исследования в этой теме подтолкнули его к оригинальным экспериментам.
Яркий контраст между жизнями и происхождениями Пристли и Бойля отражают контраст их времен. Бойль умер в начале Эпохи Просвещения – периода в истории западной мысли и культуры примерно между 1685 и 1815 годами. Пристли же, напротив, трудился на пике той эры.
Эпоха Просвещения – время мощных революций, и в обществе, и в науке. Само понятие, по словам Эммануила Канта, представляет «выход человечества из самонаведенной незрелости». Девиз Канта для просвещения прост: Sapere aude – «Дерзай знать». И, конечно, Просвещение прославилось признанием развития науки, пылом в ниспровержении старых догм и принципом, что разум должен свергнуть слепую веру и может принести практическую пользу обществу.
Не менее важно и то, что во дни Бойля (и Ньютона) наука была вотчиной лишь немногих избранных мыслителей. Однако XVIII век увидел начало промышленной эры, непрерывное расширение среднего класса и закат владычества аристократии. И потому во второй половине века наука стала заботить относительно большой образованный класс, более разнородную группу людей, включавшую и середняков, а многие из них учились ради улучшения экономических условий своей жизни. От такого расширения рядов практикующих химия особенно выиграла: люди вроде Пристли привнесли в нее дух изобретательности и предприимчивости.
Книга Пристли об электричестве увидела свет в 1767 году, но в тот же год он переключился с физики на химию, и в особенности на химию газов. Область интересов он сменил не потому, что его посетило какое-то великое озарение в новой науке, и не потому, что она показалась ему более важной областью исследования. Он просто поселился рядом с пивоварней, где в деревянных бочках, где бродило их содержимое, обильно и яростно бурлил некий газ, и это разожгло в Пристли любопытство. Он постепенно собрал значительный объем этого газа и в экспериментах, подобных Бойлевым, определил, что горящие деревянные щепки, помещенные в закупоренный сосуд с этим газом, гасли, а мыши довольно быстро умирали. Он также заметил, что при растворении этого газа в воде получается беспокойная жидкость с приятным вкусом. Ныне нам известно, что этот газ – диоксид углерода. Пристли нечаянно изобрел способ производства газированных напитков, но, увы, поскольку человек он был со скромными средствами, коммерциализировать свое изобретение не смог. Это сделал через несколько лет Йоханн Якоб Швеппе, чья компания по производству газированных напитков работает и поныне.
Вполне логично, что Пристли оказался в химии благодаря интересу к побочному продукту коммерческой деятельности: с приходом промышленной революции в конце XVIII века наука и производство начали подвигать друг друга ко все более впечатляющим достижениям. В предыдущем веке от науки получилось очень немного непосредственного практического прока, однако ближе к концу XVIII века успехи науки полностью преобразили повседневность. Прямые результаты союза науки и промышленности – паровой двигатель, использование энергии воды на фабриках, развитие механизированных инструментов, а позднее и появление железных дорог, телеграфа и телефона, электричества и электрических лампочек.
Пусть на ранних этапах, около 1760-х годов, промышленная революция и опиралась на замыслы изобретателей-кустарей, а не на открытие новых научных принципов, она тем не менее подпитала склонность богатых людей поддерживать науку как способ развивать производство. Один такой увлеченный наукой состоятельный покровитель – Уильям Петти, граф Шелбёрнский. В 1773 году он устроил Пристли библиотекарем и учителем своим детям, а еще оплатил организацию лаборатории и выделил ученому много свободного времени для исследований.
Пристли был изобретательным и дотошным экспериментатором. У себя в новой лаборатории он взялся ставить опыты над ртутной окалиной, то есть «ржавчиной» ртути. Химики того времени знали, что при нагревании до получения окалины ртуть что-то забирает из воздуха, но не знали, что. Любопытно, что при дальнейшем нагревании окалина опять превращалась в ртуть, по-видимому, выбрасывая в воздух то, что поглотила из него вначале.
Пристли обнаружил, что газ, выделяемый из ртутной окалины, имеет удивительные качества. «Это воздух превосходного свойства, – писал он. – Свеча горит в нем с поразительной силой пламени… Но, чтобы полностью доказать высокое качество этого воздуха, я поместил в него мышь; в количестве его таком, что, будь это обыкновенный воздух, мышь умерла бы примерно через четверть часа. она провела целый час, и изъята была вполне бодрой». Пристли и сам попробовал «превосходный» воздух – то был, разумеется, кислород: «В легких у меня я не ощутил разницы между ним и обычным воздухом; но мне почудилось, что в груди у меня ненадолго стало примечательно легко и свободно». Быть может, рассуждал он, таинственный газ станет популярным новым баловством среди богатых бездельников.
Пристли не заделался поставщиком кислорода богатеям. Он продолжил изучать этот газ. Поместил в сосуд с ним темную свернувшуюся кровь и обнаружил, что та сделалась ярко-красной. Еще он заметил, что, если оставить темную кровь в маленьком закупоренном пространстве, она впитывала этот газ и краснела, а животные, помещенные в этот же сосуд после покраснения крови, задыхались насмерть.
Пристли сделал из этих наблюдений вывод: наши легкие взаимодействуют с воздухом, чтобы оживить в нас кровь. Он поставил опыты над мятой и шпинатом и обнаружил, что растения могут восстанавливать способность воздуха поддерживать и дыхание, и горение – иными словами, он первым заметил результаты процесса, который мы ныне зовем фотосинтезом.
Хотя Пристли многое узнал о свойствах кислорода, и часто говорят, что именно он открыл этот газ, его значения в процессах горения Пристли не понял. Напротив, он присоединился к расхожей, но затейливой теории того времени, что предметы горят не потому, что соединяются с чем-то в воздухе, а потому что выделяют нечто под названием «флогистон».
Пристли провел знаменательные эксперименты, но не смог понять, что же они знаменуют. Объяснить подлинное значение экспериментов Пристли выпало на долю француза по имени Антуан Лавуазье (1743–1794)1 – это он понял, что дыхание и горение суть процессы, при которых из воздуха поглощается нечто (кислород), а не высвобождается флогистон.
* * *
Что область знания, начавшаяся алхимией, дорастет до математической строгости Ньютоновой физики, казалось зряшной мечтой, однако многие химики XVIII века в нее верили. Бытовало даже суждение, что силы притяжения между атомами, составляющими вещества, в сути своей гравитационные по природе, и ими можно объяснять химические свойства. (Ныне мы знаем, что они были правы, вот только силы эти – электромагнитные.) Подобные соображения выдвинул Ньютон, утверждавший, что «действующие силы природы способны заставлять частицы тел [то есть атомы] объединяться очень сильным притяжением. Дело экспериментальной философии выяснить их». Такова была одна из забот химии – вопрос о том, насколько буквально взгляды Ньютона в физике можно распространять на другие науки.
Лавуазье был одним из тех химиков, на кого Ньютонова революция повлияла очень сильно. Он воспринимал химию в ее тогдашнем виде как «основанную на самой малости фактов… состоящую из совершенно бессвязных мыслей и неподтвержденных предположений. не тронутую логикой науки». И все же он пытался подтолкнуть химию к строгой количественной методологии экспериментальной физики, а не к чистым математическим системам физики теоретической. То был мудрый выбор, если учесть знания и технические возможности того времени. Позднее теоретическая физика смогла объяснить химию своими уравнениями, однако этого не случилось вплоть до возникновения квантовой теории или, что еще полезнее, высокоскоростных компьютеров.
Подход Лавуазье к химии отражал его любовь и к химии, и к физике. Он мог бы, в принципе, предпочесть вторую первой, однако вырос в семье состоятельного парижского поверенного, где тщательно оберегали общественное положение и привилегии, и потому счел физику слишком язвительной и противоречивой. Хотя родственники Лавуазье поддерживали его устремления, они хотели видеть его и общественно преуспевающим, и прилежным, а также предпочитали осторожность и сдержанность – качества, ему не очень-то свойственные.
Истинность любви Лавуазье к науке была, похоже, очевидна для всех, кто его знал. У него были сумасшедшие замыслы и великие планы. Еще подростком он пытался разобраться в воздействии диеты на здоровье, подолгу потребляя исключительно молоко, и предложил запереть его в темной комнате на полтора месяца – чтобы усилить свою способность распознавать небольшие различия в яркости света. (Его, похоже, отговорил кто-то из друзей.) Та же страсть к научному исследованию осталась с ним на всю жизнь и проявлялась в невероятной способности, присущей многим пионерам науки, во имя понимания по многу часов заниматься однообразной работой.
Лавуазье повезло: деньги для него никогда не были преградой – ему еще не исполнилось тридцати, а он уже получил авансом часть своего наследства, эквивалентного десяти с лишним миллионам долларов в современных деньгах. Он вложил их с прибылью, приобретя долю в учреждении под названием Генеральный откуп. Дольщики этой компании собирали кое-какие налоги, которые монархия решила отдать на откуп частным лицам.
Вложение Лавуазье требовало от него участия – и налагало ответственность следить за внедрением табачных акцизов. В обмен на старания откупщик получал, в современных деньгах, примерно два с половиной миллиона долларов ежегодно в виде своей доли дохода. Лавуазье применил заработанное на постройку лучшей частной лаборатории в мире, по слухам, набитой таким количество стекла, что, по-видимому, Лавуазье нравилось любоваться своей коллекцией мензурок в той же мере, в какой применять их. На гуманитарные цели деньги он тоже пускал.
Лавуазье прослышал про эксперименты Пристли осенью 1774 года от самого Пристли, который оказался в Париже, путешествуя с лордом Шелбёрном в качестве научного гида. Эти трое вместе с другими знаменитостями парижской науки вместе поужинали, а затем потолковали о цеховых делах.
Когда Пристли рассказал Лавуазье о своей работе, тот мгновенно понял, что эксперименты Пристли с горением имеют нечто общее с опытами, которые сам он ставил, изучая ржавление, и его это удивило и обрадовало. Но еще ему показалось, что Пристли не очень понимает теоретические принципы химии или даже следствия своих собственных экспериментов. Работа Пристли, писал Лавуазье, есть «ткань, сотканная из экспериментов, едва ли проникнутых каким-либо пониманием».
Преуспеть и в теоретической, и в экспериментальной науке – дело, разумеется, нешуточное, и я знаю лишь нескольких больших ученых, кто мог бы на такое претендовать. Во мне самом довольно рано опознали начинающего теоретика, и потому в колледже от меня требовалось пройти всего один лабораторный курс по физике. В рамках этого курса мне полагалось спроектировать и собрать радиоприемник с нуля, и этот проект занял целый семестр. Получившийся у меня приемник работал только в условиях «вверх тормашками и потрясти», но и в этом положении он ловил всего одну станцию – какую-то бостонскую, игравшую какофонию авангардной музыки. И потому я, как и большинство моих друзей, и теоретиков, и экспериментаторов, благодарен за разделение труда в физике.
Лавуазье был мастером и теоретической, и практической сторон своей науки. Отмахнувшись от Пристли как от интеллекта слабее своего, воодушевившись возможностями исследовать параллели между процессами ржавления и горения, он повторил работу Пристли с ртутью и ее оксидом, начав на следующий же день поутру. Лавуазье усовершенствовал эксперименты Пристли, все тщательно измерил и взвесил. И дал объяснение открытиям Пристли, какие сам Пристли и представить себе не мог: когда ртуть горит и образует окалину, она соединяется с газом, кой есть фундаментальный элемент природы и, как показали замеры, набирает в массе столько же, сколько впитывает газа.
Точные измерения, произведенные Лавуазье, показали и еще кое-что: когда происходит обратное, то есть когда окалина при нагревании вновь преобразуется в ртуть, она делается легче, судя по всему, отдавая тот же газ, какой поглотила до этого, и теряет массу, в точности равную массе, приросшей в процессе образования окалины из ртути. Хотя Пристли считают первооткрывателем газа, поглощаемого и выделяемого в этих экспериментах, именно Лавуазье объяснил суть этого процесса – и назвал газ «кислородом».
Позднее Лавуазье облек свои наблюдения в форму одного из знаменитейших законов науки – в закон сохранения массы: общая масса продуктов химической реакции всегда равна массе исходных реагентов. То была, вероятно, величайшая веха на пути от алхимии к современной химии: определение химического преобразования как перегруппировки составляющих компонентов веществ.
Участие Лавуазье в Откупе финансировало его важную научную работу. Но оно же, как оказалось, стало причиной его конца: он попался на глаза революционерам, свергнувшим французскую монархию. Во все времена и всюду сборщикам налогов рады примерно так же, как чахоточному больному с тяжким кашлем. Но откупщиков ненавидели особенно люто, поскольку многие налоги, в сборе которых их обвиняли, народ, в особенности – бедняки, считал неразумными и несправедливыми.
Сам Лавуазье, согласно любым источникам, выполнял свои обязанности честно и справедливо, однако Французская революция не славилась разборчивостью. А Лавуазье дал им массу поводов для нелюбви.
Наибольшая его провинность – мощная каменная стена, строительство которой он предложил, и она обошлась в несколько сот миллионов долларов в нынешних деньгах. Войти в город и покинуть его можно было лишь через ворота в этой стене, а их стерегли вооруженные стражники, ведшие учет всего товара, проходившего через ворота, и записи, по которым потом пересчитывались налоги. Таким образом Лавуазье привнес свою склонность к дотошным замерам из лаборатории в налоговое дело – к неудовольствию публики.
С началом Революции в 1789 году стена откупщиков первой приняла на себя удар повстанцев. Лавуазье вместе с другими откупщиками арестовали в 1793-м, в Эпоху Террора, и приговорили к смерти. Он попросил отсрочки своей казни – чтобы успеть довести исследования до конца. Судья якобы сказал ему: «Республике не нужны ученые». Может, и не нужны, однако химии – еще как, и, к счастью, за свои пятьдесят лет жизни Лавуазье все же успел преобразить эту дисциплину.
Ко времени казни Лавуазье идентифицировал тридцать пять простых веществ. Ошибся лишь в десяти из них. Он создал стандартную систему именования сложных веществ в соответствии с простыми, входящими в их состав, и так заменил путаный и невнятный язык химии, существовавший до него. Я много говорил о важности математики как языка физики, но дисциплинированный язык столь же важен и в химии. До Лавуазье, к примеру, одно и то же вещество носило два разных имени – окалина гидраргирума и окалина быстрого серебра. В терминологии Лавуазье это вещество стало окисью ртути.
До изобретения современного вида химических уравнений вроде «2Hg + O2 → 2HgO», описывающего образование оксида ртути, Лавуазье не добрался, однако основу такой записи заложил. Его открытия произвели революцию в химии и сильно оживили промышленность, коя в свою очередь начала снабжать будущих химиков новыми веществами – и новыми вопросами.
В 1789 году Лавуазье опубликовал «Начальный курс химии», в котором объединил свои соображения. Ныне его считают первым современным учебником, который прояснил понятие простого вещества как не разлагаемого на составляющие, отверг теорию четырех элементов и существование флогистона, сформулировал закон сохранения массы и представил новую рациональную номенклатуру. В пределах одного поколения книга стала классикой, по ней учились и ею вдохновлялись многочисленные позднейшие ученые. Сам Лавуазье к тому времени уже был казнен, а тело его сброшено в общую могилу.
Всю жизнь Лавуазье прослужил науке, но отчаянно желал и славы – и жалел, что сам так и не выделил ни одного нового химического элемента (хотя пытался приписать и себе заслугу в открытии кислорода). Наконец в 1900 году, век спустя после того как родина Лавуазье объявила о ненужности ученых, она же поставила ему в Париже памятник. Знаменитости, присутствовавшие на открытии, говорили, что Лавуазье «заслужил человеческое уважение» и был «великим благодетелем человечества», потому что «установил фундаментальные законы химических превращений». Один оратор объявил, что монумент запечатлел Лавуазье «в блеске его мощи и ума».

Памятник Лавуазье с головой Кондорсе
Похоже на то, чего Лавуазье алкал при жизни, однако церемония ему бы вряд ли понравилась. Как оказалось, лицо статуи – не великого французского химика, а философа и математика маркиза де Кондорсе, служившего секретарем Академии наук в последние годы Лавуазье. Скульптор Луи-Эрнест Барриас (1841–1905) скопировал голову со скульптуры, выполненной другим художником, и неправильно опознал ее хозяина. Это открытие французов, похоже, не смутило, и бронзовое заблуждение осталось быть – мемориалом гильотинированному человеку с чужой головой. Но статуя простояла примерно столько же, сколько прожил Лавуазье. Как и ее прототип, она пала жертвой политики войны – нацисты пустили металл на пули. Ну хоть взгляды Лавуазье выдержали проверку временем. Они перелицевали химию.
* * *
Часто говорят о «поступи науки», однако наука не своими ногами ходит – вперед ее двигают люди, а прогресс наш – скорее эстафета, нежели марш. Более того, эстафета эта довольно странная, поскольку тот, кто хватает палочку, частенько срывается с места в направлении, какого предыдущий бегун не ожидал – и не одобрил бы. В точности так случилось со следующим великим визионером химии, получившим эстафету после блестящего забега Лавуазье.
Лавуазье прояснил значение простых веществ в химических реакциях и поддерживал количественный подход в описании их. Ныне мы знаем: чтобы по-настоящему разуметь химию и в особенности количественно оценивать химические реакции, необходимо понимать атом. Но Лавуазье презрел понятие атома. Не потому что был зашорен или недальновиден. Скорее, он противился идее мыслить в понятиях атомов исключительно из практических соображений.
Ученые строили догадки об атомах со времен Древней Греции, хотя иногда именовали их иначе – «корпускулами», «частицами материи» и др. И все же, поскольку атомы так малы, за почти двадцать столетий никто не задумывался над тем, как связать их с физически возможными наблюдениями и измерениями.
Чтобы примерно понять, насколько мал атом, вообразите, что мировой океан состоит из шариков размером с марбл. Теперь представьте, что все они уменьшились до размеров атома. Сколько места они теперь будут занимать? Меньше чайной ложки. И как тут надеяться увидеть взаимодействия чего-то настолько маленького?
Оказывается, надеяться можно запросто: это чудесное достижение – наблюдать за такими взаимодействиями – стало первым прорывом школьного учителя-квакера Джона Дальтона [Дол тона] (1766–1844). Многие великие ученые в истории науки были людьми яркими, но Дальтон, сын бедного ткача, – не таков. Он был методичен во всем – от своих ученых занятий до ежедневных чаепитий в пять пополудни и последующих ужинов в девять, мясом с картошкой.
Дальтон известен своей книгой «Новая система химической философии» – подробнейшим трехчастным трактатом, который, что еще более ошеломительно, ученый экспериментально наполнил и написал исключительно в свое свободное время. Первая часть, изданная в 1810 году, когда ему было за сорок, – исполинский труд на 916 страниц. Из них лишь одна глава, страниц пять в лучшем случае, представляет эпохальную мысль, благодаря которой Дальтон известен нам и поныне: способ рассчитывать относительные массы атомов на основе измерений, которые можно произвести лабораторно. Такова интрига и сила научных идей – пять страниц могут отменить ошибочные представления двух тысячелетий.
Эта мысль, как часто бывает, пришла к Дальтону кружным путем, и, хотя дело было уже в XIX веке, она была вдохновлена человеком, рожденным в середине века XVII-го, – Ньютон дотянулся и до Дальтона.
Дальтону нравилось гулять, а в младые годы он жил в Камберленде, самой сырой части Англии, и там увлекся метеорологией. А еще он был юным гением и еще подростком изучал «Принципы» Ньютона. Это сочетание интересов оказалось поразительно плодотворным: оно привело Дальтона к изучению физических свойств газов – например, сырого воздуха камберлендской глубинки. Увлекшись Ньютоновой теорией корпускул, повторявшей, по сути, античные представления греков об атомах, но усовершенствованной Ньютоновыми представлениями о силе и движении, Дальтон постепенно заподозрил, что разная растворимость газов связана с различием в размерах их частиц, а это, в свою очередь, привело его к размышлениям о массах атомов.
Подход Дальтона основывался на представлении о том, что, если рассматривать только чистые вещества, они должны состоять из своих компонентов в точных и одинаковых пропорциях. К примеру, существует два разных оксида меди. Если изучить эти оксиды по отдельности, выяснится, что на каждый грамм поглощенного кислорода при получении одного оксида уходит четыре грамма меди, а на получение другого – восемь. Это означает, что во втором виде оксида с каждым атомом кислорода соединяется вдвое больше атомов меди.
Теперь допустим для простоты, что в первом случае каждый атом кислорода соединяется с одним атомом меди, а во втором – с двумя. Раз в первом случае оксид получается из четырех граммов меди на грамм кислорода, можно заключить, что атом меди в четыре раза больше по массе, чем атом кислорода. Это заключение, как выяснилось, верно, и такое рассуждение Дальтон применил для расчета относительных атомных масс всех известных элементов.
Поскольку Дальтон рассчитывал относительные массы, ему нужно было от чего-то отталкиваться, и он принял легчайший известный тогда элемент водород за единицу и массы всех остальных химических элементов рассчитывал в пропорции к нему.
К сожалению, его допущение, что все элементы соединяются друг с другом в простейших возможных пропорциях, оправдывалось не всегда. К примеру, согласно этому допущению формула воды – HO, а не более затейливая известная нам ныне H2O. Следовательно, когда он рассчитывал относительную массу атома кислорода к водороду, результат получился вполовину меньший, чем должен быть. Дальтон вполне понимал эту степень неопределенности и в отношении воды признавал и формулу HO2, и H2O как допустимые возможности. Рассчитать относительные массы было бы гораздо труднее, если б у обычных веществ были формулы вроде H37O22, но так, к счастью, дело не обстоит.
Дальтон знал, что оценки его приблизительны, и им необходима опора на данные о множестве веществ – тогда удастся выявить нестыковки, а они в свою очередь проявят ошибки в найденных формулах. Эта трудность мучила химиков еще лет пятьдесят, но то, что на прояснение деталей ушло время, не уменьшает значимости этой работы для химии, ибо Дальтонова версия атомизма наконец оказалась практически осмысленной: ее можно было увязать с лабораторными показателями. Более того, основываясь на работе Лавуазье, Дальтон применил свои соображения для разработки первого количественного языка химии – нового способа понимать проводимые химиками эксперименты в понятиях обмена атомами между молекулами. В современной версии, к примеру, описывая получение воды из кислорода и водорода, химик (или школьник) напишет: 2H2 + O2 → 2H2O.
Новый язык химии революционизировал способность химиков понимать наблюдаемое и измеряемое в химических реакциях и рассуждать о них, и представления Дальтона сделались с тех пор центральными в химической теории. Работа Дальтона принесла ему мировую славу, и, хотя он скрывался от публичных почестей, все же принимал их, включая и членство в Королевском обществе, коим его наделили невзирая на его яростные возражения. Когда в 1844 году он умер, погребение, которое, он надеялся, будет скромным, происходило в присутствии более сорока тысяч скорбящих.
Усилиями Дальтона человеческое мышление о природе вещества перешло от теорий, восходящих к древнему наследию мистики, к началам понимания материи на уровне далеко за пределами наших чувств. Но если атом каждого элемента имеет определенную массу, как это свойство связано с наблюдаемыми химическими и физическими особенностями веществ? Это следующий этап эстафеты и, разумеется, последний глубинный вопрос о химии, на который можно ответить, не выходя за пределы Ньютоновой науки. Будут и дальнейшие прозрения, но с ними придется подождать до квантовой революции в физике.
* * *
Стивен Хокинг, прожив не один десяток лет парализованным болезнью, которая должна была бы угробить его за считанные годы, однажды сказал мне, что считает упрямство своей величайшей добродетелью, – и, вероятно, он прав. Хоть это качество иногда затрудняет работу с ним, он знает, что именно его упрямство поддерживает в нем жизнь и дает силу продолжать исследования.
Готовые теории науки могут показаться самоочевидными – когда они уже сформулированы, но в борьбе за их создание обычно можно победить лишь потрясающей настойчивостью. Психологи называют это качество «выдержкой», свойством, связанным с упорством и упрямством, но и со страстью тоже, а такие качества мы на страницах этой книги уже встречали. «Склонность стремиться к достижению долгосрочных целей с устойчивым во времени интересом и усилием» – таково определение выдержки, и психологи, что не удивительно, обнаружили: она связана с успехом во всем – от супружеской жизни до службы в армейских подразделениях особого назначения. Быть может, поэтому персонажи, с которыми мы успели познакомиться, – своевольные, даже высокомерные. Таковы многие новаторы. Им приходится.
Наш следующий пионер науки, Дмитрий Иванович Менделеев (1834–1907), русский химик, который, говорят, был склонен к истерикам и припадкам ярости (и стриг волосы и бороду не чаще раза в год), вполне вписывается в пантеон упрямых ослов. Такова была сила его личности, что супруга Менделеева постепенно поняла: стоит жить подальше от него, в их загородном доме, – кроме тех случаев, когда он заявлялся туда, и тогда она брала детей и перебиралась в их городское жилье.
Менделеев, как и Хокинг, – выживший. Ближе к двадцати годам он попал в больницу с туберкулезом, но не просто выжил – он нашел поблизости лабораторию и, пока выздоравливал, проводил там целые дни за экспериментами. Он выучился на преподавателя, но по окончании Главного Педагогического института, по настоянию врача, отправился в Крым. Шел 1855 год, и Менделеев, прибыв в Симферополь и дожидаясь приема у великого Пирогова, устроился в местную гимназию, но та из-за войны почти не работала. Вернувшись с юга, Менделеев стал приват-доцентом Петербургского университета, а потом и профессором.

Дмитрий Иванович Менделеев
То, что Менделеев стал химиком и вообще получил образование, – заслуга его матери. Он родился в небогатой семье в Западной Сибири, младшим из четырнадцати или семнадцати детей – сведения разнятся. В школе учился неважно, но любил самопальные эксперименты. Мать Менделеева верила в силу его ума и, когда ему исполнилось пятнадцать и умер его отец, она отправилась с ним в путь – подобрать сыну университет.
То было странствие в тысячу четыреста миль, на перекладных, но в итоге Менделеев начал учебу в Главном Педагогическом институте в Петербурге, с небольшой стипендией – директор института был старым другом его покойного отца. Мать тоже вскоре скончалась, а Менделеев посвятил ее памяти научный труд, процитировав ее последние слова, которые он назвал «священными»: «избегать […] самообольщения, настаивать в труде, а не в словах, и терпеливо искать божескую или научную правду». Менделеев, как и многие великие ученые до него, прожил по этому завету всю жизнь.
В некотором смысле Менделееву повезло родиться тогда, когда он родился. Практически все великие открытия и изобретения возникли из сочетания интеллектуального прозрения и счастливых обстоятельств. Волею судеб научная работа Эйнштейна началась вскоре после того, как была сформулирована современная теория электромагнетизма, предполагавшая, что скорость света постоянна, а именно эта мысль стала сутью теории относительности. Стиву Джобсу [Джобзу] тоже повезло – его карьера стартовала, когда техническое развитие достигло точки, в которой можно было разработать удобный персональный компьютер. С другой стороны, армяноамериканскому изобретателю и предпринимателю Лютеру Симиджяну принадлежит множество патентов, однако лучшая мысль пришла ему в голову с опережением лет в десять: в 1960 году он придумал автоматическую банковскую машину, которую назвал банкографом. Убедил Банк Нью-Йорка установить несколько штук, но клиенты боялись класть через эти машины деньги, и пользовались ими только проститутки и аферисты, избегавшие личного общения с банковскими служащими. Через десятилетие ситуация изменилась, банкоматы прижились, но в другом техническом воплощении.
В случае Менделеева время оказалось на его стороне. Он достиг зрелости, когда химия была готова к рывку – представление о том, что химические элементы можно организовать в семейства, в 1860-х витало в воздухе по всей Европе. Классификация фтора, хлора и брома как «галогенов» Йенсом Якобом Берцелиусом в 1842 году, к примеру, не прошла незамеченной; эти элементы словно родственники: все три – чрезвычайно едкие газы, усмиряемые соединением с натрием, в результате которого образуются безобидные кристаллы, похожие на поваренную соль. (Поваренная соль – хлорид натрия.) Нетрудно было усмотреть общее и среди щелочных металлов лития, натрия и калия. Все три – блестящие, мягкие и очень активные. Члены семейства щелочных металлов до того похожи друг на друга, что, если заменить в поваренной соли натрий на калий, получится настолько похожее вещество, что его можно применять как заменитель поваренной соли.
Химики, вдохновленные схемой Карла Линнея, предложенной для биологических организмов, пытались разработать понятную систему родства и в своей дисциплине и объяснить с ее помощью взаимоотношения между элементами. Но не все элементы группировались очевидным манером, неизвестно было и то, как они соотносятся друг с другом и какие свойства атомов отвечают за фамильное сходство. Эти вопросы занимали мыслителей по всей Европе. В общее дело включился даже некий сахаровар – ну или, по крайней мере, работавший в сахароварне химик. Но хотя несколько ученых и стучали в дверь ответа, лишь один – Менделеев – в эту дверь вломился.
Вам может показаться, что, раз мысль об упорядочивании элементов «витала в воздухе», значит, человек, которому такая систематизация удается, достоин искреннего признания, однако есть вероятность, что в величайшие гении этого человека вы не запишете; Менделеев меж тем – именно величайший гений. Так что же ставит его в один ряд с исполинами вроде Бойля, Дальтона и Лавуазье?
«Периодическая таблица», составленная Менделеевым, – не химическая версия полевого путеводителя по птицам, а, скорее, ответ химиков законам Ньютона – или, во всяком случае, самое близкое к волшебству достижение, на какое химики могли надеяться. Это не просто список семейств элементов – это настоящая спиритическая доска, позволяющая химикам понимать и предсказывать свойства любого элемента, включая и еще не известные.
Оглядываясь на это открытие, легко приписать прорыв Менделеева его способности задавать правильные вопросы вовремя, или его трудовой этике, страсти, упрямству и крайней самоуверенности. Но, как это часто бывает с открытиями и нововведениями – и зачастую в нашей с вами жизни, – помимо интеллектуальных свойств имеет значение счастливая случайность или, по крайней мере, сторонние обстоятельства, позволившие этим качествам добиться успеха. В случае с Менделеевым эту роль сыграло его решение написать учебник по химии.
В 1866 году, после того, как Менделеева назначили профессором химии в Петербургском университете, в тридцать два года он решил составить учебник. Санкт-Петербург основал за полтора века до этого Петр Великий, и город к середине XIX века сделался одним из интеллектуальных центров Европы. Университет Петербурга был лучшим в России, но Россия отставала от остальной Европы, и Менделеев, изучив российскую химическую литературу, пришел к выводу, что приличного современного учебника, пригодного для преподавания, не имеется. И он взялся писать его. На эту работу ушли годы, но учебник в итоге был переведен на все основные мировые языки и применялся в университетах по всему свету многие десятилетия после его издания. Он был оригинальным, богатым на прибаутки, рассуждения и чудачества. То был труд любви, и стремление Менделеева написать наилучший учебник подтолкнуло его сосредоточиться на вопросах, которые и привели к его великому открытию.
Первая запинка на пути Менделеева к идеальному учебнику – как организовать материал. Менделеев решил поделить элементы и их соединения на группы, или семейства, согласно их свойствам. Выполнив сравнительно простую задачу – описав галогены и щелочные металлы, – он задался вопросом, о какой совокупности элементов писать дальше.
В случайном порядке? Или, может, сформулировать принцип, в согласии с которым установить порядок?
Менделеев сражался с этой задачей, вглядываясь в глубины обширного химического знания в поисках подсказок, как могут соотноситься друг с другом различные группы элементов. Однажды в субботу он настолько ушел в работу, что провел без сна всю ночь и утро. Так ничего и не добился, но что-то подтолкнуло его записать названия элементов из групп кислорода, азота и галогенов, итого двенадцать элементов, на обороте конверта – в порядке увеличения их атомных масс.
И тут вдруг он заметил поразительную закономерность: список начинался с азота, кислорода и фтора – легчайших членов своих групп, а затем продолжился вторыми по массе, тоже по порядку, и так далее. Список, иными словами, сложился повторяющимся, или «периодическим», узором. И лишь два элемента этой закономерности не поддерживали.
Менделеев сделал свое открытие еще отчетливее, разместив группы элементов в ряд, а ряды друг над другом, и получилась таблица. (Ныне мы записываем группы колонками.) Правда ли есть в этом что-то? А если эти двенадцать элементов и впрямь образуют осмысленную последовательность, впишутся ли в эту схему остальные известные в то время пятьдесят один?
Менделеев с друзьями любил раскладывать карточные пасьянсы – располагать игральные карты в определенном порядке. Из карт получалась таблица, которая, как он впоследствии вспоминал, выглядит очень похоже на ту, из двенадцати элементов, которую он в тот день изобразил. Решив записать названия и атомные массы всех известных элементов на карты и попытаться составить из них таблицу, он разложил, по его словам, «химический пасьянс». Принялся перекладывать карты так и эдак, пытаясь разместить их в осмысленном порядке.
В подходе Менделеева был серьезный изъян. Во-первых, было неясно, к каким группам некоторые элементы принадлежат. Свойства других к тому времени оставались непонятыми. Были и разногласия в отношении атомных масс одних элементов, а массы, присвоенные другим элементам, – попросту ошибочны. А во-вторых, что важнее, были и элементы, которые еще предстояло открыть, и из-за этого предположенная закономерность давала сбой.
Все эти трудности усложняли Менделееву задачу, но было и еще кое-что – нечто более тонкое: не хватало оснований считать, что схема, основанная на атомных массах, – непременно рабочая, поскольку никто в то время не понимал, какой аспект химических свойств связан с атомной массой. (Теперь-то мы знаем, что это число протонов и нейтронов в атомном ядре, и что масса, приходящаяся на нейтрон, никак на химические свойства вещества, состоящего из тех или иных атомов, не влияет.) И вот тут-то упрямство Менделеева поддержало его страсть достичь цели: он продолжил сражаться, основываясь исключительно на интуиции и вере.
Работа Менделеева куда буквальнее многих других показывает: научный процесс – решение головоломок. Но она еще и иллюстрирует важное отличие: в отличие от головоломки, купленной в магазине, кусочки мозаики, которую складывал Менделеев, не стыковались друг с дружкой. Частично в науке и полностью – в новаторстве временами бывает важно не обращать внимание на особенности дела, вроде бы подсказывающие, что ваш подход никак не может быть состоятельным, и верить, что какой-нибудь обходной путь все же найдется, или что эти особенности не будут иметь значения. Менделеев, благодаря поразительной одаренности и чрезвычайной настойчивости, собрал свою картинку, переделав одни части мозаики и выдумав с нуля другие.
Представлять достижение Менделеева в героическом свете задним-то числом просто – видимо, так оно и выглядит в моем описании. Пусть ваши взгляды отдают безумием, если они действенны – мы сотворим из вас героя. Но тут есть и оборотная сторона: за века накопилось множество безумных схем, оказавшихся в итоге ошибочными. Работающих систем гораздо меньше, чем неработающих. Ошибочные быстро забываются, а часы, дни и годы работы тех, кто в них верил, потрачены, как оказывается, впустую. И часто мы зовем поборников этих систем неудачниками и чокнутыми. Но героизм – это готовность рисковать, и потому героизм исследования, успешного или провального, – в риске, который берем на себя мы, ученые и новаторы, а это долгие часы и дни, месяцы или даже годы яростной интеллектуальной борьбы, коя может привести к плодотворному завершению и результату, а может и нет.
Менделееву уж точно пришлось покорпеть. Элементы не встали на свои места так, как ему хотелось, но он отказался смириться с недееспособностью своей системы. Напротив, он стоял на своем и заключил, что те, кто мерил атомные массы, ошиблись, – и он смело вычеркнул известные величины и вписал то значение, с которым элемент занимал правильное место в его системе.
Самый дерзкий его вывод возник в отношении пустых ячеек в таблице – элементов с отвечающими этому месту в системе свойствами не было известно. Менделеев не только не отказался от своих соображений и не попытался изменить организующий принцип, он упрямо настаивал, что пустые ячейки – это пока не открытые элементы. Он даже предсказал свойства этих новых элементов – атомную массу, физические свойства, с какими другими элементами они могут взаимодействовать и какие сложные вещества образовывать – исключительно на основании того, в какой части таблицы эта пустая ячейка возникла.
К примеру, существовал зазор рядом с алюминием. Менделеев вписал туда неведомый элемент экаалюминий и предсказал, что, когда химики откроют экаалюминий, это будет блестящий металл, хорошо проводящий тепло, с низкой температурой плавления и массой одного кубического сантиметра ровно 5,9 граммов. Через несколько лет французский химик по имени Поль-Эмиль Лекок де Буабодран открыл в образце руды элемент, в точности совпадавший с описанием, за исключением массы кубического сантиметра – 4,7 граммов. Менделеев тут же послал Лекоку письмо, в котором сообщил, что образец был явно неочищенный. Лекок повторил анализ с новым образцом и добился тщательной очистки. На сей раз все сошлось с предсказанием Менделеева – 5,9 граммов на кубический сантиметр. Лекок назвал элемент галлием, в честь латинского названия Франции – Галлия.
Менделеев обнародовал свою таблицу в 1869 году, сначала в «Журнале Русского химического общества», а затем – в почтенном немецком издании, под названием «Периодическая закономерность химических элементов». Помимо галлия, таблица включала в себя еще несколько на ту пору неизвестных элементов – ныне это скандий, германий и технеций. Технеций радиоактивен и до того редок, что его открыли лишь в 1937 году, синтезировав в циклотроне, разновидности ускорителя элементарных частиц, через тридцать лет после смерти Менделеева.

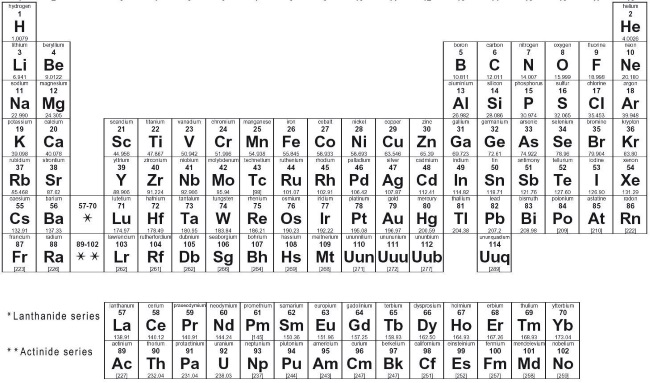
Оригинальная периодическая таблица Менделеева, опубликованная в 1869 году, и ее современный вид
Нобелевскую премию по химии впервые дали в 1901 году, за шесть лет до кончины Менделеева. Он не получил Нобелевскую премию, и это величайший промах Нобелевского комитета, поскольку Периодическая система – главный организующий принцип современной химии, открытие, сделавшее возможным наше освоение науки о веществе, это венец двухтысячелетней работы, начатой в лабораториях бальзамировщиков и алхимиков.
Но все же Менделеев стал членом еще более элитарного клуба. В 1955 году ученые в Беркли выделили всего десяток с чем-то атомов нового элемента, тоже в циклотроне, и в 1963 году назвали его менделевием, в честь автора великого открытия. Нобелевскую премию вручили более чем восьми сотням людей, но лишь шестнадцать ученых увековечены в Периодической таблице. И Менделеев – один из них, со своим личным местом в своей же таблице, под номером 101, совсем рядом с эйнштейнием и коперницием.
Назад: Глава 7 Механическая вселенная
Дальше: Глава 9 Одушевленный мир

