Книга: Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
Назад: Что почитать на эту тему в Интернете
Дальше: Частота мутаций под контролем
Глава 7. Управляемые мутации
Великие открытия 50-60-х годов XX века, такие как расшифровка структуры ДНК и генетического кода, произвели столь сильное впечатление на научное сообщество, что наспех оформившиеся вокруг этих открытий теории сразу же стали считаться «классическими». Дальнейшее развитие биологии показало, что не стоило так торопиться. Что ж, зато с тех пор молекулярные биологи не могут пожаловаться на недостаток сенсационности в своих открытиях. Стоит ученым обнаружить какой-нибудь новый молекулярный механизм, глядишь, одна-две «догмы» сразу же и рушатся. И тотчас падкие на сенсации журналисты привычной рукой строчат броские заголовки: «Теория эволюции под вопросом» и «Дарвин опровергнут». Хотя уж кто-кто, а Дарвин тут точно ни при чем. И факт эволюции никто из серьезных ученых под сомнение не ставит. Просто нужно честно признать, что в работе молекулярных систем, отвечающих за обработку генетической информации, очень много неизвестного и непонятного. И каждое новое открытие приближает нас к пониманию того, как на самом деле идет эволюция на молекулярном уровне.
Пожалуй, из всех скороспелых «абсолютных истин» синтетической теории эволюции с самым громким треском рухнула догма о полной случайности всех наследственных изменений.
Произошло это лишь в последние 10–20 лет, и многие биологи даже не успели еще вполне осознать этот факт. До сих пор и в популярных текстах, и даже в учебниках и научных статьях продолжают встречаться ссылки на «случайность всех мутаций» как на что-то общеизвестное и не подлежащее сомнению. Однако на сегодняшний день твердо установлено, что живая клетка располагает большим арсеналом средств, позволяющих ей контролировать изменения своего генома.
Вообще-то этого следовало ожидать. Ведь мутации — изменения нуклеотидной последовательности ДНК — являются важным фактором, влияющим на жизнеспособность организмов. И это влияние проявляется не когда-то в отдаленном будущем, а здесь и сейчас — у самого организма или его непосредственных потомков. Если организмы в ходе эволюции могут выработать приспособления, например, для защиты от хищников или болезнетворных микробов или для контроля температуры тела, то почему они не имеют права выработать также и приспособления, позволяющие им контролировать мутации? Никакого теоретического запрета на такие приспособления вроде бы нет, однако биологи-теоретики почему-то довольно долго считали их запрещенными.
Наверное, дело тут в том, что в большинстве ситуаций единственное, чего хочет добиться организм от мутационного процесса, — это чтобы он шел как можно медленнее или не шел вовсе. В стабильных благоприятных условиях это вполне разумно. Зачем менять свою наследственность, если все и так хорошо? Однако сама жизнь не позволяет долго существовать, совершенно не меняясь. Не идти вперед — значит идти назад.
Для начала вспомним, чему нас учили в школе на уроках биологии. Главный источник мутаций — ошибки, возникающие в ходе копирования ДНК.
ДНК в норме состоит из двух комплементарных цепочек нуклеотидов. Нуклеотид А всегда стоит напротив Т, Г — напротив Ц. Пары Г-Ц более прочные, они удерживаются вместе тремя водородными связями, а пары А-Т — только двумя.
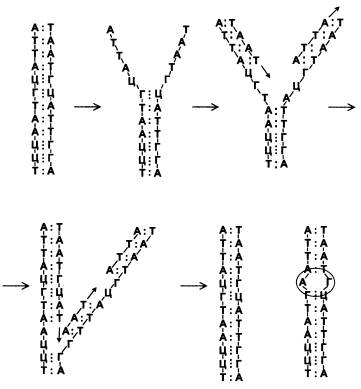
Во время репликации (копирования, удвоения) две цепочки разделяются, и на каждой по принципу комплементарности синтезируется новая цепочка, как показано на рисунке. Синтез осуществляется при помощи фермента ДНК-зависимой ДНК- полимеразы. Одна из двух новых цепей синтезируется подряд, без перерывов, потому что направление ее синтеза совпадает с направлением «расплетания» двойной спирали исходной молекулы ДНК. Вторая цепь синтезируется кусочками, задом наперед. Эти кусочки называются «фрагментами Оказаки» (в честь их первооткрывателя, японского молекулярного биолога Редзи Оказаки, пережившего бомбардировку Хиросимы и скончавшегося в 1975 году в 45-летнем возрасте от лейкемии). В итоге получаются две одинаковые молекулы, каждая из двух комплементарных цепей.
На приведенном рисунке возникла мутация — в правой молекуле напротив одного из гуанинов (Г) случайно встал аденин (А) вместо цитозина (Ц). Скорее всего, эта мутация будет замечена и исправлена специальными ферментами, функция которых как раз и состоит в исправлении подобных ошибок. Починку «неправильных» или поврежденных участков ДНК называют репарацией.
В нашем примере мутация возникла случайно. Впрочем, постойте. Случайно ли? Она ведь возникла на стыке двух фрагментов Оказаки, а процесс соединения этих фрагментов — некая особая операция, «технологически» отличающаяся от других этапов репликации, расплетания спирали и присоединения комплементарных нуклеотидов. Может быть, в нашей клетке забарахлила система соединения фрагментов Оказаки? А может, она забарахлила не случайно, а потому, что на нее оказал воздействие какой-то внешний или внутренний фактор? А если он внутренний, то клетка, наверное, может как-то контролировать его? А тогда, если хорошенько разобраться, не может ли в конечном счете оказаться так, что сама клетка «отдала команду» осуществить мутацию в данном месте ДНК? Если мы всерьез задумаемся над этими вопросами, то поймем, что было бы крайне удивительно, если бы живая клетка за 4 миллиарда лет эволюции так и не выработала никаких механизмов управления мутационным процессом. Ведь такие механизмы, во-первых, вполне возможны, во-вторых, могли бы оказаться очень полезными.
Впрочем, нет повода сомневаться в том, что значительная часть мутаций действительно возникает случайно — просто потому, что никакое копировальное устройство не может работать с абсолютной точностью. Кроме того, мутации могут происходить и без репликации, пока ДНК находится в двухцепочечном состоянии, — например, нуклеотиды могут претерпевать химические изменения под воздействием радиации, ультрафиолета или свободных радикалов, возникающих в ходе клеточного дыхания. Большинство ошибок в цепях ДНК будет замечено и исправлено, но какую-то небольшую их часть пропустит, не заметит даже самый строгий молекулярный «корректор».
Но мутации возникают не только потому, что невозможно копировать ДНК с абсолютной точностью. Мы привыкли думать, что мутации — это всегда некое нарушение, неправильность, ошибка, то есть что-то нежелательное, «мешающее нормально жить». В действительности это не всегда так. Изменение наследственной информации — неотъемлемая и необходимая часть жизни. Если бы геномы не менялись, на нашей планете, возможно, до сих пор жил бы только один вид очень примитивных микробов — тот самый Лука, общий предок всего живого (см. главу «Происхождение жизни»). Впрочем, и он бы давно вымер, не смог бы долго продержаться с неизменным геномом. А если бы молекулы РНК копировались с абсолютной точностью на этапе «преджизни», то и никакой Лука никогда бы не появился. Об этом, между прочим, свидетельствуют результаты экспериментов, проводимых исследователями РНК-мира. Для того чтобы в сообществе размножающихся молекул РНК зародилось что-то новое и полезное, совершенно необходимо, чтобы отдельные короткие молекулы, соединяясь в более длинные, могли обмениваться друг с другом своими участками (обмен участками между разными молекулами ДНК или РНК называется рекомбинацией). Рекомбинация — важнейший источник наследственной изменчивости наряду с «обычными» мутациями. В опытах с колониями РНК рекомбинация происходит сама собой, бесконтрольно, но в живой клетке она находится под контролем разнообразных и сложных регуляторных систем.
Очень важно понять, что изменения наследственной информации нужны всему живому не только в геологическом масштабе времени, чтобы постепенно совершенствоваться в течение миллионов лет. Естественный отбор не может «заглянуть» так далеко, поэтому и специальные механизмы для достижения столь отдаленных целей не могут развиться. Но наследственные изменения нужны здесь и сейчас, они необходимы нам постоянно. Особенно наглядно это видно на примере простейших живых систем — вирусов. Многие ученые, правда, не считают их живыми организмами, поскольку они не могут размножаться без помощи чужих клеток, но все же многие свойства живого у них есть. Да и кто в этом мире может похвастать абсолютной самодостаточностью? Разве что «отважный странник», подземный микроб, о котором рассказано во второй главе.
На примере вирусов хорошо видно, как они нарочно позволяют определенному количеству мутаций совершаться при каждой репликации. Таким способом они контролируют скорость мутирования и фактически превращают эволюцию в составную часть своего жизненного цикла, чуть ли не в основной компонент своего поведения.
—————Вирусы-мутанты помогают друг другу в борьбе за выживание. Большинство вирусов, вызывающих болезни человека, — РНК-содержащие. Их наследственный материал хранится в форме РНК, а не ДНК, как у всех других форм жизни. Среди немногочисленных белков, закодированных в геноме таких вирусов, присутствует фермент РНК-зависимая РНК-полимераза, синтезирующий новые копии вирусной РНК (см. главу 1).Популяции РНК-содержащих вирусов неоднородны: они состоят из целого набора генетически различающихся линий. Такие полиморфные популяции называют «квазивидами» — по аналогии с видами настоящих живых организмов, которые тоже всегда полиморфны. Процесс удвоения (репликации) вирусной РНК происходит с большим числом ошибок (мутаций), благодаря чему могут быстро возникать новые варианты вируса. У полиовируса — возбудителя полиомиелита — на каждый акт репликации приходится в среднем 1,9 мутаций. При этом, конечно, появляется много нежизнеспособных вариантов, однако эти потери оправданы. Высокая скорость мутирования помогает вирусам приспосабливаться к меняющимся условиям — к деятельности иммунной системы хозяина, новым лекарствам, переходам от одного хозяина к другому и из ткани в ткань.Марко Виньюцци из Калифорнийского университета в Сан-Франциско (США) и его коллеги, изучающие полиовирусов, предположили, что дело здесь не ограничивается поиском оптимального для данной ситуации варианта генома методом «случайного попадания». Возможно, возникающие в пределах квазивида вариации могут помогать друг другу за счет разделения функций. Например, в одной линии может возникнуть мутация, повышающая скорость репликации вирусной РНК, в другой линии — другая мутация, повышающая, например, эффективность самосборки белковых молекул в вирусную оболочку — капсид. Поскольку обе линии живут и размножаются в одной и той же хозяйской клетке, они могут пользоваться «достижениями» друг друга. Эффективная РНК-полимераза первой линии будет размножать и геномы второй, а более эффективные капсидные белки второй линии будут «упаковывать» и РНК первой. Кстати, не исключено, что совместить обе эти мутации в одном и том же геноме просто невозможно. Вирусный геном очень мал, и у него не так уж много степеней свободы, то есть вариантов мутаций, совместимых с «жизнью» вируса. Бывает даже, что у двух разных генов имеется общий кусок, настолько вирусы экономны в отношении наследственного материала. В этом случае изменения в одном белке неизбежно будут приводить к изменениям в другом.Возможность экспериментальной проверки гипотезы о взаимопомощи среди вирусов появилась благодаря тому, что Виньюцци и его коллегам удалось обнаружить и выделить мутантную форму полиовируса со «сверхточной» РНК-полимеразой, совершающей очень мало ошибок при копировании РНК. Эта мутация происходит из-за замены глицина (G) серином (S) в 64-й позиции РНК-полимеразы. В соответствии с этим мутация получила название G64S. Эта мутация ведет к тому, что вирусы начинают мутировать с аномально низкой частотой — 0,3 мутации на геном вместо положенных 1,9.Первым делом ученые проверили, действительно ли скорость мутирования важна для приспособляемости вирусов. Это подтвердилось: вирусы G64S приспосабливались к неблагоприятным условиям (лекарствам, ингибиторам) гораздо медленнее своих «диких» собратьев. Кроме того, вирусы G64S оказались неспособны проникать в спинной и головной мозг зараженных мышей, как это делают нормальные полиовирусы с высокой скоростью мутирования. Однако искусственное увеличение темпа мутагенеза привело к тому, что вирусы G64S стали проникать в мозг и размножаться там. При этом полиморфизм вирусной популяции вырос, но мутация G64S сохранилась у всех линий.Исследователи провели серию остроумных экспериментов, показывающих, что общая «эффективность» популяции вирусов зависит не от наличия в ней какой-то одной особо удачной линии, а от кооперативного взаимодействия нескольких разных линий, помогающих друг другу. Например, удалось показать, что вирусы G64S сами по себе не способны проникать в мозг, но успешно проникают туда в компании с другими вирусными популяциями — как «дикими», так и другими G64S, предварительно подвергавшимися действию искусственных стимуляторов мутагенеза. Следовательно, одни линии вирусов помогают другим преодолеть гематоэнцефалический барьер.Эксперименты блестяще подтвердили гипотезу о взаимовыгодной кооперации между разнообразными мутантами, составляющими вирусную популяцию — квазивид. Это означает, что эволюционирующей единицей является не отдельная линия и тем более не один вирус, а весь квазивид в целом, причем внутреннее разнообразие — залог успеха. Одна линия, даже самая совершенная, всегда будет проигрывать полиморфному квазивиду, включающему несколько взаимодополняющих линий.(Источник: Vignuzzi et al. Quasispecies diversity determines pathogenesis through cooperative interactions in a viral population // Nature. 2006. V. 439. P. 344–348.)—————

