24. Маленькая красная таблетка
Занимаясь проблемами памяти, нельзя не осознавать, как велика потребность в препаратах, улучшающих ее, нарушенную болезнью или ослабленную возрастом. Но прежде, чем новые препараты поступят в продажу, они должны пройти проверку на подопытных животных. Учитывая, что мы как раз занимались изучением имплицитной и эксплицитной памяти у животных, мы решили заняться поиском новых подходов к борьбе с нарушениями памяти. И снова время сыграло нам на руку. Как раз в начале девяностых, когда мы начали получать генетически модифицированных мышей для исследования природы памяти и ее нарушений, в разработке лекарственных препаратов возникало новое направление.
До 1976 года внедрение новых научных открытий в медицинскую практику в Соединенных Штатах шло медленно, а люди вроде меня, занимающиеся академической наукой, не особенно интересовались сотрудничеством с фармацевтической промышленностью для разработки лекарственных препаратов. Но в тот год ситуация радикально изменилась. Роберт Суонсон, двадцативосьмилетний рисковый инвестор, понял, какие возможности для фармацевтики открывает генная инженерия, и убедил Герберта Бойера, профессора Калифорнийского университета в Сан-Франциско и одного из новаторов в этой области, основать вместе с ним корпорацию Genentech (Genetic engineering technologies — «Генно-инженерные технологии»). Это была первая биотехнологическая компания, специализировавшаяся на внедрении в производство лекарственных препаратов на основе белков, полученных с помощью генной инженерии. Суонсон и Бойер вложили в это предприятие по пятьсот долларов и скрепили договор рукопожатием. После этого Суонсон добыл еще несколько сотен тысяч, и компания заработала. В настоящее время ее стоимость составляет около 20 млрд.
Незадолго до этого биологи научились быстро считывать последовательность нуклеотидов в ДНК и разработали ряд эффективных методов генной инженерии. Эти методы позволяли вырезать определенные последовательности хромосом, сшивать их друг с другом и вставлять в геном кишечной палочки, получая множество копий нового гена, которые могли экспрессироваться в бактериальной клетке и производить соответствующий белок. Бойер одним из первых понял, что гены многоклеточных животных, в том числе человеческие, можно экспрессировать в бактериальных клетках. Более того, он сыграл заметную роль в разработке методов, позволяющих это делать.
Основатели корпорации Genentech планировали использовать метод рекомбинантной ДНК, чтобы в большом количестве синтезировать два человеческих гормона, имеющих немалое медицинское значение: инсулин и гормон роста. Инсулин, выделяемый в кровь поджелудочной железой, позволяет регулировать уровень сахара в крови, а гормон роста, выделяемый гипофизом, регулирует процессы роста и развития. Чтобы доказать возможность широкомасштабного производства этих двух довольно сложных белков, корпорация Genentech начала с получения более простого белка соматостатина — гормона, выделяемого в кровь поджелудочной железой и подавляющего выделение инсулина.
До 1976 года количество соматостатина, инсулина и гормона роста, доступного для медицинского использования, было ограничено. Инсулина и соматостатина было мало, потому что их приходилось выделять из организмов свиней и коров. Поскольку последовательности аминокислот в соответствующих гормонах людей и этих животных немного отличаются, иногда гормоны животных вызывали у людей аллергические реакции. Гормон роста добывали из человеческих гипофизов, извлеченных из трупов. Помимо того что получаемого препарата тоже не хватало, иногда он оказывался зараженным прионами — инфекционными белками, вызывающими болезнь Кройцфельдта — Якоба — смертельное заболевание, вызывающее прогрессирующее слабоумие, от которого умер Ирвинг Купферман. Использование рекомбинантной ДНК открывало возможность синтезировать эти гормоны с помощью человеческих генов и производить их в неограниченных количествах намного более дешевым способом, не заботясь о безопасности. Бойер и Суонсон понимали, что, клонируя человеческие гены, можно будет получать для медицинских нужд эти и другие белки, а когда-нибудь и лечить наследственные заболевания, заменяя поврежденные гены пациентов клонированными нормальными генами.
В 1977 году через год после основания совместного предприятия с Суонсоном, Бойер разработал метод клонирования генов, позволяющий в больших количествах синтезировать соматостатин, тем самым продемонстрировав, что с помощью рекомбинантной ДНК можно наладить производство препаратов, обладающих большой медицинской и коммерческой ценностью. Три года спустя сотрудникам Genentech удалось клонировать ген человеческого инсулина.
Через два года после корпорации Genentech была основана компания Biogen — второе ведущее биотехнологическое предприятие. Но за эти два года произошли колоссальные изменения. Компания Biogen была создана не молодым предпринимателем, поначалу действовавшим в одиночку, а Кевином Лэндри и Дэниэлом Адамсом — двумя крупными инвесторами, представлявшими серьезные венчурные фирмы. Они начали не с тысячи долларов и рукопожатия, а с 750 тыс. долларов и пакета контрактов, позволивших собрать несравненную команду биотехнологов. Инвесторы обратились с предложениями к лучшим и способнейшим специалистам: вначале к Уолтеру Гилберту из Гарварда, а затем к Филлипу Шарпу из Массачусетского технологического института, Шарлю Вайсману из Цюрихского университета, Петеру Хансу Хофшнайдеру из мюнхенского Института биохимии Макса Планка и Кеннету Марри из Эдинбургского университета. После некоторых переговоров все они согласились работать на новое предприятие, а Гилберт даже возглавил научно-консультативный совет.
Вскоре из этих начинаний возникла отдельная отрасль. Биотехнологическая промышленность не только ввела в производство собственную новую продукцию, но и изменила всю фармацевтическую промышленность. В 1976 году большинству крупных фармацевтических компаний не хватало смелости и гибкости, чтобы самим организовать исследования, связанные с рекомбинантной ДНК, но, вкладывая в одни биотехнологические предприятия и покупая другие, они быстро вошли в курс дела.
Биотехнологические компании изменили и научное сообщество, особенно его отношение к коммерциализации науки. Американские ученые относились к участию в производстве отрицательно, в отличие от ученых из большинства европейских стран. Великий французский биолог Луи Пастер, заложивший в конце XIX века основы наших представлений о возбудителях инфекционных заболеваний, имел немало связей с производством. Он открыл биологические основы брожения, с помощью которого производят вино и пиво. Изобретенные им методы определения и уничтожения бактерий, заражающих гусениц тутового шелкопряда, вино и молоко, позволили спасти винную и молочную промышленность и внедрить пастеризацию молока, предотвращающую его заражение и порчу. Пастеру удалось впервые получить вакцину от бешенства, и Институт Пастера в Париже, учрежденный и названный в его честь еще при жизни ученого, получает немалую долю доходов от производства этой вакцины. Генри Дейл, английский ученый, сыгравший важную роль в открытии химических основ синаптической передачи, свободно перешел со своей должности в Кембриджском университете на работу в Физиологические исследовательские лаборатории Уэллкома, фармацевтическую компанию, а затем снова стал работать в научном учреждении — лондонском Национальном институте медицинских исследований.
В Америке дела обстояли иначе. Но Гилберт быстро понял, какие три условия могут заставить его и других биологов из университетской среды изменить отношение к совмещению научной работы и бизнеса. Во-первых, доказательства того, что компания сможет сделать что-то полезное. Во-вторых, гарантии того, что участие в работе компании не будет слишком сильно отвлекать их от фундаментальных научных исследований. И в-третьих, уверенность в том, что ничто не будет угрожать их научной независимости, которой так дорожат университетские профессора.
К 1980 году, когда компания Genentech наладила выпуск человеческого инсулина, первое условие (доказательство полезности) было выполнено. Все больше биологов налаживало связи с биотехнологической промышленностью. Совершив грехопадение, они с удивлением обнаружили, что им это нравится. Им нравилось, что наука позволяла получить ценные лекарственные препараты и что сами ученые могут преуспеть в финансовом отношении, принося пользу обществу — зарабатывая деньги на создании жизненно необходимых препаратов. До этого большинство университетских ученых старалось не связываться с промышленностью и презрительно относилось к коллегам, консультировавшим фармацевтические компании, но после 1980 года ситуация в корне изменилась. Более того, ученые поняли, что, приняв соответствующие меры, они могут ограничивать затрачиваемое время и сохранять независимость. Более того, большинство осознало, что они не только делятся своими знаниями, но и находят в процессе работы в промышленности новые пути научных исследований.
В результате университеты начали поощрять предпринимательскую деятельность своих сотрудников. Одним из первых такую политику стал проводить Колумбийский университет. В 1982 году Ричард Аксель и несколько его коллег разработали метод, позволяющий экспрессировать любой ген, в том числе человеческий, в клетке, выращиваемой в культуре. Поскольку Аксель был университетским сотрудником, Колумбийский университет запатентовал этот метод. Его сразу взяли на вооружение несколько ведущих фармацевтических компаний, которые начали производить с его помощью новые препараты, важные для медицины. За следующие двадцать лет (время действия патента) на одном этом патенте Колумбийский университет заработал пятьсот миллионов долларов. Эти средства позволили университету взять на работу новых сотрудников и вложить дополнительные деньги в научные исследования. Аксель и другие изобретатели тоже получили свою долю доходов.
Примерно в то же время в Англии Сезар Мильштейн из лаборатории Медицинского исследовательского совета в Кембридже изобрел способ получения моноклональных антител — высокоспециализированных молекул, связывающихся с определенными участками молекул белков. Этот способ тоже сразу оказался востребованным фармацевтической промышленностью и стал использоваться для получения новых препаратов. Но Медицинский исследовательский совет и Кембриджский университет продолжали мыслить по-старому. Они не запатентовали этот метод и лишились возможности получить по праву причитающиеся доходы, которые можно было бы использовать для финансирования важных исследований. Эти события не ускользнули от внимания других университетов, и в тех из них, где еще не было отделений, занимающихся интеллектуальной собственностью, стали организовывать такие отделения.
Вскоре большинство уважающих себя специалистов по молекулярной биологии вошло в состав консультативного совета какой-нибудь из новых биотехнологических компаний. На том раннем этапе компании занимались преимущественно гормональными и противовирусными препаратами, но к середине восьмидесятых предприниматели начали задумываться и о том, нельзя ли использовать для производства новых средств борьбы с неврологическими и психическими заболеваниями последние достижения нейробиологии. В 1985 году Ричард Аксель попросил меня выступить с докладом о болезни Альцгеймера на проходившем в Нью-Йорке заседании совета директоров израильской компании Biotechnology General, которую Аксель консультировал. В своем докладе я вкратце рассказал об этой болезни, подчеркнув, что в последнее время она приобретает характер эпидемии в связи с резким увеличением числа людей, которым перевалило за шестьдесят пять. Средство от этой болезни стало бы огромным достижением для здравоохранения.
Факты, которые я излагал, были вполне очевидны для нейробиологов, но не для рисковых инвесторов. После того заседания Фред Адлер, председатель совета директоров Biotechnology General, пригласил нас с Ричардом пообедать с ним на следующий день. За обедом он предложил основать новую биотехнологическую компанию, которая будет заниматься исключительно нервной системой и использовать достижения молекулярной биологии для борьбы с заболеваниями этой системы.
Поначалу я не хотел ввязываться в биотехнологию, потому что думал, что это занятие будет для меня неинтересным. Я разделял мнение, которого ранее придерживалась значительная часть научного сообщества, что биотехнологические и фармацевтические компании занимаются скучной наукой и что ввязываться в коммерческое предприятие — дело неблагодарное в интеллектуальном плане. Однако Ричард убеждал меня этим заняться и доказывал, что такая работа вполне может быть увлекательной. В 1987 году мы основали компанию Neurogenetics, впоследствии получившую название Synaptic Pharmaceuticals. Ричард и Адлер попросили меня возглавить научно-консультативный совет.
Я пригласил Уолтера Гилберта войти в состав этого совета. Мы познакомились с Уолли в 1984 году. Он замечательный человек и один из самых интеллектуально одаренных и разносторонних биологов второй половины XX века. Пойдя по стопам Жакоба и Моно, авторов теории регуляции генов, он впервые выделил вещество-регулятор и показал, что это, как и ожидалось, был белок, связывающийся с молекулами ДНК. После столь замечательного достижения Уолли продолжил молекулярно-биологические исследования и разработал метод считывания последовательности нуклеотидов в ДНК, за который в 1980 году получил Нобелевскую премию по химии. Кроме того, будучи одним из основателей компании Biogen, Уолли теперь разбирался и в бизнесе. Я подумал, что он был бы ценнейшим кадром для нас, принимая во внимание его научные достижения в сочетании с коммерческими навыками.
Уолли ушел из компании Biogen в 1984 году и вернулся в Гарвард, где обратился к нейробиологии, которой особенно заинтересовался в последнее время. Поскольку он был новичком в этой области, я подумал, что ему может понравиться идея присоединиться к нам и побольше узнать о ней. Он согласился и стал для нас очень ценным приобретением. У нас с Дениз возникла традиция, которой мы продолжаем следовать по сей день, ужинать с Уолли, обычно в каком-нибудь прекрасном ресторане, вечером перед заседанием нашего научно-консультативного совета.
Среди других ученых, приглашенных мной и Ричардом в консультативный совет новой компании, были Том Джееселл (наш коллега по Колумбийскому университету и талантливый специалист по нейробиологии развития). Пол Грингард (новатор в области исследования работы вторичных посредников в нервной системе, перешедший из Йеля в Рокфеллеровский университет), Льюис Роуланд (председатель отделения неврологии Колумбийского университета) и Пол Маркс (бывший декан Колледжа терапевтов и хирургов Колумбийского университета, а впоследствии — президент Мемориального онкологического центра Слоана — Кеттеринга). Это была необычайно сильная команда. Несколько месяцев мы посвятили изучению вопроса, какое направление стоит выбрать нашей компании.
Вначале мы обсуждали возможность специализироваться на боковом амиотрофическом склерозе (болезни, от которой умер Олден Спенсер), а затем на рассеянном склерозе, опухолях головного мозга или инсультах, но в итоге решили, что лучше всего будет, наверное, заняться чем-то имеющим отношение к рецепторам нейромедиатора серотонина. Многие важные препараты (например, почти все антидепрессанты) действуют на эти рецепторы, а Ричард недавно как раз впервые выделил и клонировал такой рецептор. Выяснение молекулярно-биологических основ работы этих рецепторов могло бы открыть новые возможности для исследования целого ряда заболеваний. Кроме того, клонированный Ричардом рецептор был лишь одним из большой группы метаботропных рецепторов, чувствительных к другим нейромедиаторам, действующим через вторичные посредники.
Обратиться к этой теме нас всячески убеждала Кэтлин Маллиникс, проректор Колумбийского университета, которую мы пригласили на должность главного исполнительного директора нашей компании. Хотя она и не разбиралась в нейробиологии, зато имела представление о том, что рецепторы можно использовать для поиска новых медикаментов. Наш совет проработал эту идею. Мы решили клонировать рецепторы серотонина и дофамина, выяснить, как они работают, а затем получить химические соединения, которые позволят управлять их работой. Пол Грингард и я составили документ, в котором все это было изложено, и мы приступили к изучению первого образца — успешно клонированного Ричардом Акселем рецептора серотонина.
Работа нашей компании началась, и началась успешно. Мы наняли прекрасных научных сотрудников, которым удалось клонировать ряд новых рецепторов, и наладили плодотворное сотрудничество с компаниями Eli Lilly и Merck. В 1992 году наша фирма была преобразована в открытую компанию, и ее незаурядный научно-консультативный совет был расформирован. Некоторое время я оставался ее научным консультантом, но через три года основал другую компанию, специализировавшуюся на моей собственной области исследований.
Идея организовать это новое предприятие возникла однажды вечером в 1995 году, когда мы с Дениз в очередной раз ужинали с Уолтером Гилбертом. Мы с Уолли обсуждали полученные мной незадолго до этого результаты, которые заставляли предположить, что потеря памяти у старых мышей обратима, и Дениз предложила нам организовать компанию, которая разработала бы «маленькую красную таблетку» для лечения возрастной потери памяти. Мы с Уолли согласились и объединили усилия с Джонатаном Флемингом, инвестором из объединения Oxford Partners, которое участвовало а финансировании компании Synaptic Pharmaceuticals. Джонатан помог нам привлечь в этот проект Акселя Унтербека из компании Bayer. В 1996 году мы вчетвером организовали новую компанию — Memory Pharmaceuticals.
Создавать компанию, деятельность которой была столь непосредственно связана с моей научной работой, посвященной памяти, было увлекательно, но руководство компанией, даже возникшей на базе собственных исследований, требует слишком больших затрат времени. Некоторые ученые для этого оставляют работу в университете. Но я не собирался уходить из Колумбийского университета и из Медицинского института Говарда Хьюза. Мне хотелось принять участие в создании компании, после чего работать на нее консультантом по совместительству. И в Колумбийском университете, и в Институте Говарда Хьюза были опытные юристы, которые помогли мне подготовить соответствующие договоры — вначале с Synaptic Pharmaceuticals, а затем с Memory Pharmaceuticals, — которые соответствовали как требованиям университета и института, так и моим собственным интересам.
Участие в работе этих двух биотехнологических компаний расширило мой кругозор. Работа в Memory Pharmaceuticals позволила мне на основе результатов моих собственных фундаментальных исследований принять участие в создании лекарственных средств, которые могли помочь людям. Кроме того, в ходе этой работы я познакомился с тем, как функционирует коммерческое предприятие. Младшие сотрудники научно-образовательного учреждения обычно независимы: предполагается, что на ранних этапах карьеры они будут не помогать старшим сотрудникам, а развивать собственные исследовательские проекты. Но в коммерческих организациях все должны совместно работать на благо компании, используя имеющиеся интеллектуальные и финансовые ресурсы, чтобы продвигать каждый возможный продукт в потенциально успешных направлениях. Хотя такое коллективное участие в производстве редко встречается в университетах, из этого правила есть важные исключения, например проект «Геном человека», который потребовал похожего объединения индивидуальных усилий множества людей в интересах общего дела.
В основу деятельности новой компании легла идея, что исследование памяти должно вылиться в прикладную науку и что однажды совершенствование наших представлений о механизмах работы памяти должно привести к изобретению средств, которые позволят лечить нарушения когнитивных функций. Как я отмечал в своем докладе на заседании совета директоров Biotechnology General, сегодня проблема нарушений памяти стала очевиднее, чем была пятьдесят лет назад, когда я начал работать врачом, и произошло это потому, что люди стали дольше жить. Даже в нормальной, здоровой человеческой популяции среди людей старше семидесяти лет лишь примерно у 40 % память не хуже, чем была лет тридцать пять назад. У остальных 60 % память в той или иной степени слабеет. На ранних этапах этот процесс не влияет на другие когнитивные функции, например на речь или способность решать различные задачи. У половины из этих 60 % наблюдается легкое нарушение памяти, иногда называемое доброкачественной старческой забывчивостью, которое развивается со временем и с возрастом довольно медленно, если вообще развивается. Однако у оставшейся половины (то есть у 30 % людей старше семидесяти лет) начинается болезнь Альцгеймера — прогрессирующее дегенеративное заболевание нервной системы.
На ранних этапах своего развития болезнь Альцгеймера характеризуется слабым нарушением когнитивных функций, неотличимым от симптомов доброкачественной старческой забывчивости. Но на более поздних этапах развития этой болезни наблюдаются сильные и прогрессирующие нарушения памяти и других когнитивных функций. Подавляющее большинство симптомов этой поздней, дегенеративной стадии болезни, по-видимому, связано с утратой синаптических связей и гибелью нервных клеток. Это разрушение нервной ткани во многом вызывается накоплением аномального вещества, так называемого амилоида, в форме нерастворимых бляшек в промежутках между клетками мозга.
Доброкачественная старческая забывчивость впервые привлекла мое внимание в 1993 году. Этот термин смягчен и не совсем точен, потому что данное расстройство может начинаться и не в старости, а также потому, что оно не вполне доброкачественно. Первые его проявления наблюдаются у некоторых людей уже на пятом десятке и обычно слегка усиливаются со временем. Я надеялся, что непрекращающееся накопление знаний о механизмах формирования памяти у аплизии может позволить нам разобраться в нарушениях, лежащих в основе этого печального проявления старости, а затем и разработать лечение.
Читая литературу, посвященную доброкачественной старческой забывчивости, я убедился, что по своим симптомам, если не по тяжести, это расстройство напоминает одно нарушение памяти, связанное с повреждениями гиппокампа, а именно неспособность к формированию долговременной памяти. Люди, страдающие доброкачественной старческой забывчивостью, подобно пациенту Г. М., могут нормально поддерживать разговор и сохранять мысли в кратковременной памяти, но с трудом переводят кратковременную память в долговременную. Например, пожилой человек, которого знакомят на званом ужине с каким-то новым гостем, может запомнить его имя на непродолжительное время, но забудет его на следующее утро. Это сходство дало мне основания предположить, что в возрастной потере памяти тоже может быть задействован гиппокамп. Последующие опыты с людьми и животными показали, что это действительно так. Еще одним основанием для такого вывода стало открытие того, что с возрастом в гиппокампе исчезают синапсы, выделяющие дофамин. Ранее мы уже выяснили, что дофамин играет важную роль в поддержании долговременного усиления синаптических связей и в регуляции внимания, задействованной в формировании пространственной памяти.
Чтобы лучше разобраться в этой форме потери памяти, я и мои коллеги воспользовались природной моделью этого явления, наблюдаемой у мышей. Лабораторные мыши доживают до двухлетнего возраста. Таким образом, в возрасте от трех до шести месяцев мыши могут считаться молодыми, начиная с двенадцати месяцев — среднего возраста, а с восемнадцати — пожилыми. Мы использовали для своих экспериментов плоский лабиринт, похожий на тот, который служил нам ранее для изучения роли генов в работе пространственной памяти. Мышей помещали в центр большой круглой площадки с сорока отверстиями по краю, после чего они учились находить то единственное, которое вело в убежище, ориентируясь по положению этого отверстия в пространстве относительно узоров на стенах. Мы установили, что большинство молодых мышей быстро проходит этапы случайной и последовательной стратегий поиска отверстия и скоро обучается использовать более эффективную пространственную стратегию. Однако у многих пожилых мышей были трудности с обучением пространственной стратегии (рис. 24–1).
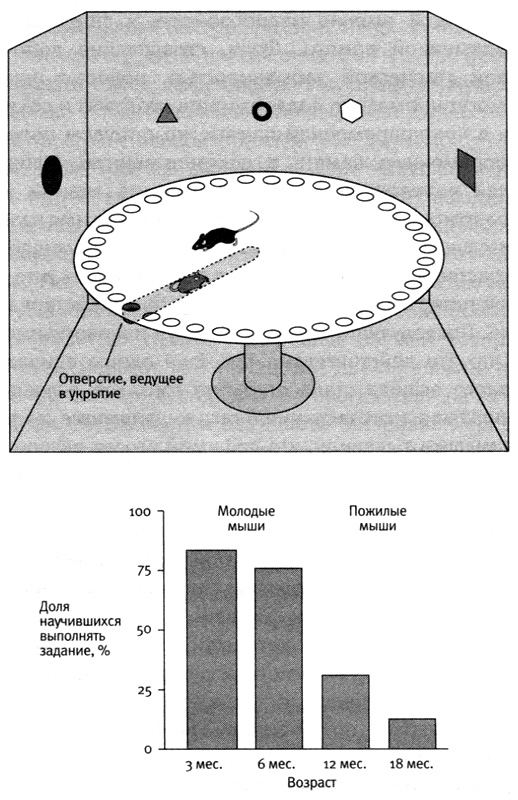
24–1. Возрастная потеря памяти у мышей, демонстрируемая при выполнении задания на пространственную память. В лабиринте Барнса (вверху) мышь может найти единственное отверстие, ведущее с площадки в укрытие, ориентируясь по меткам на стенах. Старые мыши с трудом запоминают, как метки пространственно соотносятся с отверстием (внизу). Этому нарушению памяти сопутствует нарушение работы гиппокампа.
При этом, как мы выяснили, такое нарушение наблюдалось не у всех старых мышей: у некоторых память была не хуже, чем у молодых. Кроме того, у мышей, обладавших этим нарушением, оно затрагивало только эксплицитную память. Мы провели ряд проверок характера их поведения и установили, что у этих мышей была вполне нормальная имплицитная память на простые навыки восприятия и моторные навыки. И наконец, нарушения памяти наблюдались не только в старости — иногда они начинались в среднем возрасте. Эти результаты заставляли предположить: то, что относится к людям, относится и к мышам.
Если у мыши нарушена пространственная память, значит, у нее что-то не так с гиппокампом. Мы исследовали коллатерали Шаффера в мозгу более старых мышей с возрастной потерей памяти и установили, что у них нарушена поздняя фаза долговременной потенциации, которая, по нашим данным и данным других авторов, связана с долговременной эксплицитной памятью. Более того, у тех из более старых мышей, у кого не было нарушений памяти, долговременная потенциация работала нормально, как и у молодых мышей с нормальной пространственной памятью.
Ранее мы установили, что поздняя фаза долговременной потенциации осуществляется с помощью циклического АМФ и протеинкиназы А и что этот сигнальный путь активируется дофамином. Когда дофамин связывается со своим рецептором а пирамидальных клетках гиппокампа, в них повышается концентрация циклического АМФ. Оказалось, что препараты, которые активируют дофаминовые рецепторы и тем самым повышают концентрацию циклического АМФ, исправляют нарушения поздней фазы долговременной потенциации, а также связанные с работой гиппокампа нарушения памяти.
Постдок Марк Барад и я решили узнать, можно ли с помощью каких-то других манипуляций с сигнальным путем циклического АМФ улучшить нарушенную память у более старых мышей. В норме циклический АМФ расщепляется особым ферментом, не позволяющим сигналу действовать неограниченно долго. Препарат ролипрам подавляет работу этого фермента, продлевая жизнь молекулам циклического АМФ и усиливая сигнал. Мы с Барадом выяснили, что ролипрам существенно улучшает связанные с гиппокампом способности к обучению у более старых мышей: после приема этого препарата старые мыши решали задание на проверку памяти не хуже молодых. Даже у молодых мышей ролипрам усиливал долговременную потенциацию и улучшал связанную с работой гиппокампа память.
Эти результаты подтверждали идею, что возрастное снижение связанных с гиппокампом способностей к обучению обусловлено, по крайней мере отчасти, нарушениями в работе поздней фазы долговременной потенциации. Должно быть, еще важнее было то, что эти результаты заставляли предположить: доброкачественная старческая забывчивость обратима. Если так, то в ближайшем будущем пожилые люди смогут улучшать память, принимая препараты, разработанные с помощью подобных экспериментов на мышах.
Перспективы лечения доброкачественной старческой забывчивости заставили руководство Memory Pharmaceuticals задуматься о том, сможем ли мы лечить и другие формы нарушений памяти, если больше узнаем о молекулярных механизмах, лежащих в основе ее формирования. Чтобы это выяснить, мы обратились к изучению ранней фазы развития болезни Альцгеймера.
Одно из интересных свойств болезни Альцгеймера состоит в том, что формированию амилоидных бляшек в гиппокампе предшествует слабое нарушение памяти. Поскольку ранние нарушения когнитивных функций при болезни Альцгеймера очень похожи на возрастную потерю памяти, Майкл Шелански, сотрудник нашего университета, задался вопросом, не нарушаются ли при этом одни и те же сигнальные пути. Чтобы это выяснить, он занялся изучением работы мышиного гиппокампа.
Он подвергал гиппокамп мышей воздействию самого токсичного из компонентов амилоидных бляшек, так называемого бета-амилоида, и выяснил, что это вызывает нарушения долговременной потенциации задолго до гибели нейронов и формирования бляшек. Кроме того, у животных, служащих модельными объектами для изучения ранних этапов развития болезни Альцгеймера, нарушения памяти наблюдались до того, как удавалось выявить образование бляшек или гибель нейронов. Изучая экспрессию генов в клетках гиппокампа, подвергнутых воздействию бета-амилоида, Шелански обнаружил, что это вещество вызывает снижение активности циклического АМФ и протеинкиназы А. Результат заставлял предположить, что бета-амилоид может вызывать нарушения работы системы циклического АМФ и протеинкиназы А на ранних этапах развития болезни. Более того, Шелански выяснил, что, активируя работу циклического АМФ с помощью ролипрама, можно сделать бета-амилоид нетоксичным для нейронов мышей.
Тот же препарат, который предотвращал у мышей возрастную потерю памяти, предотвращал у них и нарушения памяти на ранних этапах развития болезни Альцгеймера. После этого другой сотрудник нашего университета, Оттавио Аранчио, обнаружил, что ролипрам защищает нейроны от некоторых повреждений, сопровождающих болезнь Альцгеймера. Это заставляло предположить, что циклический АМФ не только усиливает работу ослабленных проводящих путей, но и помогает защищать нейроны от повреждений, а возможно, даже восстанавливать утраченные связи у мышей, служащих модельными объектами для изучения болезни Альцгеймера.
В настоящее время Memory Pharmaceuticals и другие компании, занимающиеся созданием препаратов против потери памяти, ищут способы лечения обеих болезней. Кроме того, большинство компаний с момента основания расширило свою деятельность и теперь разрабатывает препараты для лечения не только возрастной потери памяти и болезни Альцгеймера, но и ряда других нарушений памяти, сопровождающих иные неврологические и психические расстройства. Одно из таких расстройств — депрессия, которая в наиболее тяжелых формах связана с сильной потерей памяти, другое — шизофрения, для которой характерны нарушения рабочей памяти и организующих функций, таких как определение порядка событий или приоритетов внимания.
Memory Pharmaceuticals теперь переместилась в Монтвейл (штат Нью-Джерси). В 2004 году она стала открытой компанией. В ней были разработаны новые семейства препаратов для лечения возрастной потери памяти, существенно превосходящие те вещества, которые были доступны в то время, когда мы с коллегами проводили с такими препаратами свои эксперименты. Некоторые из этих новых веществ позволяют улучшать крысиную память о способе выполнения нового задания на многие месяцы!
Эпоха биотехнологий сулит огромные успехи в разработке новых препаратов для лечения людей, страдающих психическими заболеваниями. Возможно, не пройдет и десяти лет, как наши исследования молекулярных механизмов, лежащих в основе формирования памяти, позволят внедрить новые методы лечения, которые в девяностые годы сложно было даже представить. Медицинское значение таких препаратов очевидно. Не столь очевидно влияние развития биотехнологической промышленности на новую науку о психике и жизнь ученых. Теперь университетские ученые не только работают в научно-консультативных советах, некоторые из лучших уходят с прекрасной работы в университетах в биотехнологические компании, работа в которых, по их мнению, приоритетнее. Ричард Шеллер, замечательный специалист по молекулярной биологии, работавший постдоком у Ричарда Акселя и у меня в те времена, когда мы только начали применять молекулярно-биологические методы для изучения нервной системы, ушел из Стэнфордского университета и Медицинского института Говарда Хьюза на должность вице-президента по науке корпорации Genentech. Вскоре после этого к нему присоединился Марк Тессье-Лавинь — выдающийся специалист по нейробиологии развития из Стэнфорда. Кори Гудман, признанный ведущий исследователь развития нервной системы дрозофилы, ушел из Калифорнийского университета в Беркли, чтобы руководить работой собственной компании Renovts. Этот список можно продолжать и продолжать.
Биотехнологическая промышленность теперь дает как зрелым, тем и молодым ученым дополнительный возможный путь научной карьеры. Качество исследований проводимых в лучших биотехнологических компаниях очень высоко, поэтому вполне вероятно, что ученые будут свободно переходить из научно-образовательных учреждений в биотехнологические компании и обратно.
Появление Memory Pharmaceuticals и других биотехнологических компаний питает наш у надежду найти средства от потери памяти и дает возможность альтернативной карьеры ученым, занимающимся исследованиями мозга, но также поднимает этическую проблему, связанную с усилением когнитивных функций. Стоит ли стремиться к улучшению памяти у здоровых людей? Давать ли молодым людям, имеющим на это средства, возможность покупать препараты, усиливающие память, и принимать их при подготовке к поступлению в колледж? Мнения по этому вопросу сильно расходятся, но мое состоит в том, что здоровые молодые люди способны учиться (самостоятельно и в учебных заведениях) и без помощи химических средств усиления памяти (проблему молодежи с нарушениями когнитивных способностей можно рассматривать отдельно). Лучший усилитель когнитивных функций для людей, способных к обучению, несомненно, состоит в том, чтобы хорошо учиться.
В целом это направление поднимает этические проблемы, у которых есть нечто общее с проблемами, связанными с клонированием генов и изучением стволовых клеток. Работа биологов затрагивает некоторые области, в которых честные и хорошо информированные люди расходятся во взглядах на этическую сторону плодов научных исследований.
Как добиться непредвзятого и последовательного обсуждения этической стороны научных достижений? Здесь сходятся две проблемы. Первая касается научной работы. Свобода научных исследований подобна свободе слова, и мы как представители демократического общества должны защищать право ученых заниматься широкомасштабным исследованием всего, что им заблагорассудится. Если мы в Соединенных Штатах запретим научные исследования в какой-то области, то можно не сомневаться, что это сделают и в других странах, возможно, и там, где человеческую жизнь ценят не так высоко, как у нас, и меньше о ней задумываются. Вторая проблема касается оценки того, как использовать те или иные научные открытия и стоит ли их вообще использовать. Решение этой проблемы нельзя отдать на откуп ученым, потому что оно влияет на все общество. Ученые могут участвовать в обсуждении того, как использовать плоды научных исследований, но окончательные решения по таким вопросам должны приниматься при участии не только ученых, но и специалистов по этике, юристов, групп защиты прав пациентов и священнослужителей.
Этика, один из разделов философии, с давних времен занимается стоящими перед людьми проблемами морали. Развитие биотехнологии привело к возникновению специальной области этой дисциплины — биоэтики, которая занимается социальными и моральными аспектами биологических и медицинских исследований. Уильям Сэфайр, журналист из New York Times и председатель благотворительного фонда Dana, деятельность которого направлена на ознакомление общественности с достижениями нейробиологии, для решения этических проблем, поднимаемых новой наукой о психике, в 2002 году организовал поддержку фондом исследований в области нейроэтики. Чтобы запустить проект. Сэфайр профинансировал организацию симпозиума на тему «Нейроэтика: картирование области». На этот симпозиум собрались ученые, философы, юристы и священнослужители для обсуждения того, как новые представления о психике влияют на широкий круг проблем, от ответственности за свои поступки и свободы воли до подсудности психически больных и значения новых фармакологических методов лечения для общества и отдельных людей.
Чтобы участвовать в обсуждении проблем, связанных с препаратами, усиливающими когнитивные функции в 2004 году я присоединился к группе, в состав которой вошли Марта Фара из Пенсильванского университета, Джуди Иллес из центра биомедицинской этики при Стэнфордском университете, Робин Кук-Диган из центра этических, юридических и политических аспектов геномных исследований при Университете Дьюка и ряд других ученых. Мы подготовили совместную декларацию и опубликовали ее в журнале Nature Reviews Neuroscience в качестве обзорной статьи, озаглавленной «Нейрокогнитивное усиление: что можно сделать и что следует делать?»
Фонд Dana продолжает курировать открытую дискуссию, посвященную проблемам нейроэтики. Как заметил недавно в опубликованной этим фондом статье проректор Гарвардского университета Стивен Хайман, различные вопросы, «от неприкосновенности сферы мозга до препаратов, улучшающих настроение и память, следует активно обсуждать, и, в идеале, эти обсуждения достигнут зрелости раньше, чем непрерывное развитие науки потребует неотложной реакции общества».
Назад: Часть пятая
Дальше: 25. О мышах, людях и психических заболеваниях

