Книга: Пуговицы Наполеона. Семнадцать молекул, которые изменили мир
Назад: Порох
Дальше: Динамит Нобеля
Химия взрыва
Движущей силой взрыва является образование газов и их быстрое расширение под действием реакционного тепла. Газы занимают гораздо больший объем, чем аналогичное количество твердого вещества или жидкости. Разрушительное действие взрыва связано с ударной волной, вызванной очень быстрым изменением объема вещества при образовании газов. Ударная волна, образующаяся при взрыве пороха, распространяется со скоростью несколько сотен метров в секунду, однако в случае более мощной взрывчатки (такой как тринитротолуол или нитроглицерин) скорость ударной волны может достигать шести тысяч метров в секунду.
При любом взрыве выделяется большое количество тепла. Реакции, сопровождающиеся выделением тепла, называют экзотермическими. Большое количество тепла способствует активному расширению газов: чем выше температура, тем больше объем газовой смеси. Выделение тепла связано с различием между молекулами, расположенными в двух частях уравнения реакции. Образующиеся молекулы (находящиеся в правой части уравнения) обладают меньшей энергией, запасенной в их химических связях, чем исходные молекулы (находящиеся слева). Образующиеся вещества более устойчивы. В частности, в реакциях взрыва нитросоединений образуется чрезвычайно устойчивая молекула азота N2. Стабильность этой молекулы связана с прочностью тройной связи, соединяющей два атома азота.
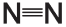
Структура молекулы азота
Прочность тройной связи означает, что для ее разрыва требуется много энергии. Напротив, при образовании тройной связи высвобождается большое количество энергии, что и происходит при взрыве.
Кроме образования газов и выделения тепла, третьим важным свойством реакций взрыва является их высокая скорость. Если бы реакция протекала медленно, выделяющееся тепло успевало бы рассеяться, а газ диффундировал в окружающую среду, не оказывая значительного давления и не вызывая разрушительной ударной волны. Требующийся для реакции кислород должен содержаться в самой взрывчатке. Атмосферный кислород нельзя использовать по той причине, что он не может поступать в реакцию достаточно быстро. Именно по этой причине нитросоединения, в которых азот и кислород соединены между собой, часто бывают взрывоопасными, а другие соединения, содержащие не связанные между собой азот и кислород, таковыми не являются.
Сказанное можно проиллюстрировать на примере изомеров. Как мы уже знаем, изомеры — это вещества с одинаковой химической формулой, но разной структурой. Лоро-нитротолуол и пара-аминобензойная кислота с одинаковой химической формулой C7H7NO2 имеют по семь атомов углерода, семь атомов водорода, одному атому азота и два атома кислорода, но атомы в этих двух молекулах расположены в разной последовательности.
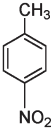
n-нитротолуол
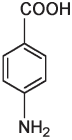
n-аминобензойная кислота
Пора- или n-нитротолуол (приставка пора означает, что группы CH3 и NO3 располагаются в противоположных позициях в кольце) может взрываться, тогда как n-аминобензойная кислота ничуть не взрывоопасна. Возможно, вы даже втирали это вещество себе в кожу летом: n-аминобензойная кислота, или ПАБА, является активным ингредиентом многих солнцезащитных кремов. Такие вещества, как ПАБА, поглощают ультрафиолетовый свет как раз с такой длиной волны, которая является наиболее опасной для клеток кожи. Поглощение света с определенной длиной волны связано с присутствием в молекуле чередующихся одинарных и двойных связей, а также атомов кислорода и азота. Изменение числа связей или атомов в таких структурах изменяет длину волны поглощаемого света. Существуют и другие вещества, поглощающие свет со специфической длиной волны, которые можно использовать в составе кремов от солнца, — при условии, что они не очень быстро смываются водой, нетоксичны, не вызывают аллергии, не имеют неприятного вкуса или запаха и не разлагаются на солнце.
Взрывоопасность соединений, содержащих нитрогруппы, зависит от количества этих групп. Нитротолуол имеет только одну нитрогруппу. Дальнейшее нитрование может привести к добавлению еще одной или двух нитрогрупп с образованием соответственно ди— или тринитротолуола. Хотя нитротолуол и динитротолуол могут взрываться, они не вызывают взрыва такой силы, как тринитротолуол (ТНТ, тротил).
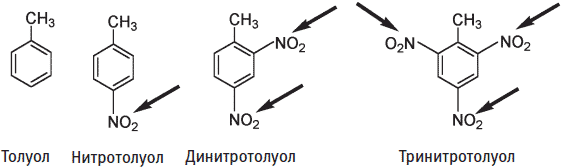
Нитрогруппы показаны стрелками
Новые взрывчатые вещества начали появляться в XIX веке, когда химики занялись изучением взаимодействия азотной кислоты с органическими соединениями. Спустя несколько лет после того, как Фридрих Шенбейн испортил фартук своей жены, итальянский химик Асканьо Собреро, работавший в Турине, синтезировал новое взрывчатое нитросоединение. Собреро изучал влияние азотной кислоты на некоторые органические вещества. Он поместил глицерин, который легко выделить из животного жира, в охлажденную смесь серной и азотной кислот, а затем вылил полученную смесь в воду. Образовался слой масляной жидкости, которую теперь называют нитроглицерином. Далее он выполнил традиционную в те времена и немыслимую сегодня манипуляцию: попробовал новое вещество на вкус и записал, что “следовое количество вещества, помещенное на язык, но не проглоченное, вызывает множественные пульсации, сильную головную боль и слабость в конечностях”.
Позднее изучение причин сильной головной боли у рабочих, занятых в производстве взрывчатых веществ, показало, что головная боль связана с расширением кровеносных сосудов под действием нитроглицерина. В результате нитроглицерин стали применять как лекарство от стенокардии.
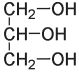
Глицерин
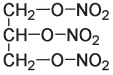
Нитроглицерин
Расширение суженных сосудов, снабжающих кровью сердечную мышцу, обеспечивает нормальную подачу крови и снимает боль. Теперь известно, что в организме от нитроглицерина отщепляется молекула окиси азота NO, которая и вызывает расширение сосудов. Исследования действия окиси азота привели к созданию лекарства от импотенции, виагры, действие которого также основано на сосудорасширяющих свойствах NO.
Кроме того, в организме окись азота участвует в поддержании кровяного давления, передаче межклеточных сигналов, формировании долгосрочной памяти, а также в пищеварении. На основании этих исследований были созданы лекарства для нормализации кровяного давления у новорожденных и для лечения больных после перенесенного инсульта. В 1998 году Нобелевскую премию в области медицины получили Роберт Ферчготт, Луис Игнарро и Ферид Мурад за открытие роли окиси азота в организме. По иронии судьбы, сам Альфред Нобель, сделавший состояние на производстве динамита из нитроглицерина, что позволило ему учредить Нобелевскую премию, отказался лечиться нитроглицерином. Он умер от стенокардии, так и не поверив, что нитроглицерин способен врачевать. Он считал, что это вещество способно лишь вызвать головную боль.
Нитроглицерин — очень неустойчивая молекула. Он взрывается при нагревании или сильном ударе.
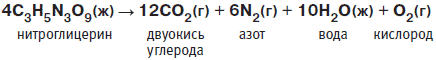
В результате взрыва образуются облака быстро расширяющихся газов и большое количество тепла. В отличие от пороха, при взрыве которого давление в шесть тысяч атмосфер возникает за тысячную долю секунды, при взрыве эквивалентного количества нитроглицерина за миллионную долю секунды создается давление в двести семьдесят тысяч атмосфер. Порох сравнительно безопасен в обращении, а вот нитроглицерин ведет себя чрезвычайно непредсказуемо. Он способен взрываться спонтанно при встряхивании или нагревании. Вот почему людям пришлось найти надежный и безопасный способ обращения с этим строптивым веществом, а также способ его детонации.
Назад: Порох
Дальше: Динамит Нобеля

