Ближайшее время
(с настоящего момента до 2030 г.)
Геномная медицина
Движущей силой сегодняшнего взрывного развития медицины являются, в частности, квантовая теория и компьютерная революция. Квантовая теория дала человеку поразительно подробные модели молекулярной структуры — например, структуры белков и молекулы ДНК. Мы знаем, как построить молекулу жизни, атом за атомом. А секвенирование генов, которое прежде было долгой, нудной и дорогой процедурой, теперь полностью автоматизировано и производится роботами. Первоначально секвенирование всех генов в теле одного человека стоило несколько миллионов долларов. Эта процедура была настолько дорогой и длительной, что лишь горстка людей в мире (включая ученых, которые занимались совершенствованием и отладкой этой технологии) могла позволить себе обзавестись собственной геномной картой. Однако всего через несколько лет эта экзотическая технология, по всей видимости, станет доступна каждому.
(Прекрасно помню свое выступление на конференции во Франкфурте в конце 1990-х гг., где говорилось о будущем медицины. Я предсказывал, что к 2020 г. личная карта генома будет вполне доступна и каждый желающий сможет обзавестись диском или чипом с полным описанием своих генов. Мое заявление вызвало раздражение одного из участников; он поднялся и сказал, что это несбыточая мечта. Генов в человеческом организме попросту слишком много, и составление персональной геномной карты для любого человека будет стоить слишком дорого. Проект «Геном человека» обошелся в 3 млрд долларов, и стоимость секвенирования генов каждого отдельного человека никогда не снизится слишком сильно. Позже мы с ним еще поговорили на эту тему, и я понял, в чем заключается проблема. Этот человек мыслил линейно. Однако за короткое время закон Мура многократно снизил цены и дал возможность секвенировать ДНК с использованием роботов, компьютеров и автоматических установок. Тот человек просто не понял, какое глубокое значение приобрел в биологической науке закон Мура. Сегодня, оглядываясь назад, я понимаю, что если и ошибся в оценке, то в большую сторону. На самом деле возможность получить личную генную карту появится еще раньше.)
К примеру, инженер из Стэнфордского университета Стивен Квейк (Stephen R. Quake) разработал на основе последних достижений очередную роботизированную систему. Он сумел снизить стоимость полного секвенирования до 50 000 долларов и уверен, что через несколько лет она упадет до 1000 долларов. Ученые предполагают, что падение стоимости секвенирования генов до 1000 долларов может послужить сигналом к началу массового обращения за генными картами, так что эта технология станет доступна значительной части человечества. Может быть, через несколько десятков лет процедура полного секвенирования генов будет стоить меньше 100 долларов, не дороже стандартного анализа крови.
(Ключ к последним достижениям в этой области — рационализация процедуры секвенирования. Квейк сравнивает цепочки исследуемой ДНК с аналогичными цепочками, которые были уже прочитаны у других пациентов. Он разбивает геном на кусочки, содержащие по 32 бита информации, затем компьютерная программа сравнивает эти фрагменты с уже прочитанными геномами других людей. Известно, что ДНК всех людей почти идентична, различия составляют в среднем менее 0,1%. Это означает, что компьютер может быстро найти среди 32-битных фрагментов соответствующие.)
Квейк стал восьмым человеком в мире, чей геном был полностью прочитан. В этом проекте у него был и личный интерес, поскольку он хотел проверить свой геном на признаки сердечно-сосудистых заболеваний. К несчастью, его геном свидетельствует о том, что он действительно унаследовал не самый удачный вариант одного из генов, связанный с сердечным заболеванием. «Чтобы рассматривать собственный геном, нужно обладать крепкими нервами», — пожаловался Квейк.
Мне знакомо это жутковатое чувство. Мой геном тоже был частично секвенирован и записан на лазерный диск для передачи канала BBC-TV/Discovery, которую я должен был вести. Врач взял у меня из руки немного крови и отправил ее в лабораторию Университета Вандербильта; через две недели оттуда почтой прислали CD-ROM, где были записаны тысячи моих генов. Даже держать этот диск в руках было как-то странно — ведь на нем была записана часть «чертежей», по которым построено мое тело. В принципе, на базе информации с этого диска можно было бы создать мою точную копию.
Надо сказать, что любопытство мое тоже было затронуто — ведь на этом диске были записаны многие тайны моего тела. К примеру, я получил возможность проверить, есть ли у меня один конкретный ген, который увеличивает вероятность болезни Альцгеймера. Это меня всегда беспокоило, поскольку моя мама умерла именно от этой болезни. (К счастью, у меня этого гена нет.)
Кроме того, четыре моих гена были сопоставлены с соответствующими генами тысяч других людей по всему миру, у которых также были взяты образцы для анализа. Затем на карте земного шара обозначили места проживания всех тех людей, которые обладают точно такими же, как я, копиями этих четырех генов. Точки на карте образовали длинный след, начинающийся у Тибета и затем протянувшийся через весь Китай в Японию. Я был поражен. Оказалось, что точки на карте показывают след древних миграций предков моей матери, протянувшийся в прошлое на тысячи лет. Мои предки не оставили записей о своих перемещениях в эти древние времена, но карта их передвижений, как ни странно, оказалась прочно вписана в мою кровь и ДНК. (Можно проследить и происхождение отца. Если митохондриальные гены передаются в неизменном виде от матери к дочери, то Y-хромосома, наоборот, передается от отца к сыну. Так что, анализируя эти гены, можно проследить за предками человека по материнской и отцовской линии.)
Мне представляется, что в недалеком будущем многие люди испытают такое же странное чувство, как и я, взяв в руки диск с «чертежами» своего тела и прочитав самые сокровенные его тайны, включая скрытые в геноме опасные болезни и древние миграционные маршруты предков.
Но для ученых все это — первые шаги новой области науки, получившей название биоинформатики. Ее основа — сканирование и анализ геномов тысяч живых организмов при помощи компьютеров. К примеру, если ввести в компьютер данные о геноме нескольких сотен человек, страдающих определенной болезнью, может быть, получится вычислить точное расположение поврежденного участка ДНК. В настоящее время многие мощные компьютеры в мире задействованы именно в биоинформационных исследованиях и заняты анализом миллионов генов, содержащихся в растениях и животных, а также поиском среди них определенных ключевых генов.
При помощи биоинформатики можно было бы, к примеру, внести свежую струю в детективные телешоу, такие как «C.S.J.: место преступления». По крошечным кусочкам содержащих ДНК веществ (к примеру, волосяным луковицам, слюне или крови) можно было бы определять не только цвет волос, глаз, этническую принадлежность, рост и медицинскую историю конкретного человека, но, возможно, и его лицо. Сегодня полицейские художники могут воссоздать приблизительный скульптурный портрет жертвы преступления по черепу. Не исключено, что в будущем компьютер сможет реконструировать черты лица человека по каплям его крови или частицам перхоти. (Тот факт, что однояйцевые близнецы очень похожи внешне, означает, что черты лица человека в значительной степени определяются генетическими, а не внешними факторами.)
Визит к врачу
Как мы уже говорили, визит к врачу в будущем радикально поменяется. Общаясь с доктором посредством настенного интернет-экрана, вы, вероятно, будете иметь дело с компьютерной программой. В вашей ванной комнате будет установлено больше датчиков, чем в современной больнице, и они смогут без труда и шума обнаружить раковые клетки за несколько лет до возникновения опухоли. К примеру, около половины всех случаев обычного рака связаны с мутацией гена p53, которую можно без труда обнаружить при помощи таких датчиков.
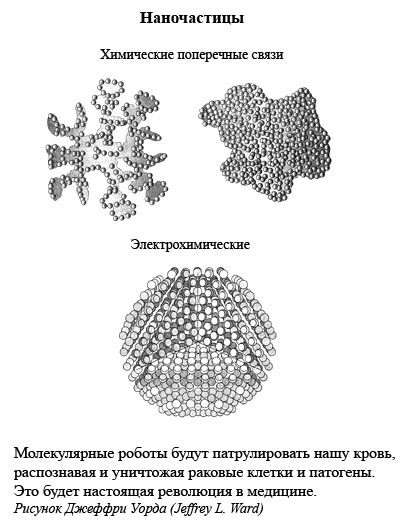
При появлении первых признаков рака вам будет сделана инъекция специальных наночастиц, которые попадут в кровь и подобно умным бомбам, доставят противораковые лекарства непосредственно к месту расположения раковых клеток. Сегодняшняя химиотерапия покажется нам такой же примитивной, какими сейчас кажутся медицинские пиявки прошлого и позапрошлого веков. (Подробнее о нанотехнологии, ДНК-чипах, наночастицах и наноботах мы поговорим в следующей главе.)
Если «врач» на вашем настенном экране не сможет вылечить болезнь или травму какого-то органа, вы сможете вырастить для себя новый орган. На сегодняшний день только в США в очереди на пересадку различных органов «стоит» 91 000 человек. Все они ждут одного — чтобы нашелся донорский орган на замену. Каждый день 18 человек из этой очереди умирает, так и не дождавшись спасения.
В будущем, если виртуальный врач обнаружит какое-то нарушение в одном из ваших органов, он сможет заказать новый орган, который будет выращен на специальной фабрике непосредственно из ваших собственных клеток.
Одной из самых «горячих» областей медицины на сегодня является так называемая «тканевая инженерия», цель которой — сделать возможной «мастерскую» по изготовлению запасных частей для человеческого тела.
Уже сейчас ученые умеют выращивать в лаборатории кожу, кровь, кровеносные сосуды, сердечные клапаны, хрящи, кости, носы и уши из собственных клеток человека. Первый серьезный орган — мочевой пузырь — был выращен в 2007-м, а первая трахея — в 2009 г. До сих пор получается выращивать только относительно простые органы, содержащие лишь несколько типов тканей и почти не структурированные. Можно предположить, что лет через пять удастся вырастить первую печень и поджелудочную железу, что будет иметь громадное значение для всей системы здравоохранения. Нобелевский лауреат Уолтер Гилберт в разговоре со мной сказал, что предвидит в недалеком будущем — всего через несколько десятилетий — такое время, когда можно будет вырастить из клеток практически любой орган.
Чтобы вырастить новый орган для конкретного человека методом тканевой инженерии, сначала необходимо получить некоторое количество клеток этого человека. Затем эти клетки вводят в пластиковую матрицу, которая по внешнему виду напоминает губку в форме нужного органа. Матрица изготавливается из биорассасывающегося полимера гликолевой кислоты. Кроме того, клетки обрабатывают определенными факторами роста, что стимулирует их развитие и рост внутри матрицы. Со временем матрица рассасывается, оставляя вместо себя желаемый орган.
Мне довелось побывать в лаборатории Энтони Аталы (Anthony Atala) в Университете Уэйк-Форест в Северной Каролине и лично стать свидетелем применения этой технологии. Проходя по лаборатории Аталы, я видел бутыли с живыми человеческими органами. Я видел кровеносные сосуды и мочевые пузыри; я видел сердечные клапаны, которые непрерывно открывались и закрывались, потому что через них прокачивали различные жидкости. Вид живых органов, функционирующих в сосудах, вызывал ассоциации с лабораторией доктора Франкенштейна. Однако были и принципиальные различия. Тогда, в XIX в., медики не подозревали о существовании механизмов отторжения чужеродных тканей, которые так затрудняют пересадку органов. Кроме того, врачи не умели останавливать инфицирование, которое было неизбежным следствием любой хирургической операции. Поэтому Атала, вместо того чтобы создавать чудовищ, разрабатывает новую жизнесберегающую медицинскую технологию, которая когда-нибудь, возможно, полностью изменит сущность медицины.
Одна из целей его лаборатории — выращивание человеческой печени — может быть реализована в течение пяти лет. Вообще говоря, печень не так уж сложна и содержит в себе ткани лишь нескольких типов. Выращенная в лаборатории печень могла бы спасти тысячи жизней, в первую очередь тех, кто остро нуждается в пересадке этого органа. Она могла бы спасать и алкоголиков, страдающих циррозом. (К несчастью, эта технология может также побудить людей прочнее держаться за свои дурные привычки, ведь они будут знать, что смогут получить новый орган взамен поврежденного.)
Если некоторые органы человеческого тела, такие как трахея и мочевой пузырь, выращивать уже научились, то что мешает ученым вырастить все без исключения органы? Проблема, с одной стороны, заключается в выращивании крохотных капилляров, которые обеспечивают кровью клетки тканей, ведь кровь должна поступать к каждой клетке тела. Кроме того, существует проблема выращивания сложных структур. К примеру, почка, очищающая нашу кровь от токсинов, состоит из миллионов мельчайших фильтров, и матрицу для этих фильтров создать будет очень нелегко.
Но наибольшие сложности при выращивании представляет другой человеческий орган — мозг. Хотя воссоздание или наращивание мозга — дело не ближайших десятилетий, не исключено, что, если ввести молодые клетки непосредственно в мозг, он подхватит их и включит в свою нейронную сеть. Такая инъекция, конечно, будет случайной, поэтому пациенту придется многие базовые функции осваивать заново. Но поскольку мозг «пластичен» — т.е. он постоянно, с каждой новой задачей, обновляет свою структуру и связи, — не исключено, что он действительно сможет безболезненно интегрировать новые нейроны и добиться, чтобы они правильно срабатывали.
Стволовые клетки
Следующий шаг — применение технологии стволовых клеток. На данный момент все человеческие органы выращиваются не из стволовых клеток, а из обычных, только специальным образом обработанных, чтобы они могли размножаться внутри матрицы. В ближайшем будущем, вероятно, можно будет непосредственно использовать здесь технологию стволовых клеток.
Стволовые клетки — это «мать всех клеток», они способны менять свою структуру и превращаться в клетки любого типа. Каждая клетка в нашем теле несет в себе полный генетический код, необходимый для строительства тела целиком. Однако по мере созревания клетки специализируются, так что многие гены в них становятся неактивными, как бы выключаются. В клетке кожи, к примеру, имеются все гены, необходимые для превращения в кровь, но они выключены; ненужные гены отключились в тот момент, когда зародышевая клетка стала взрослой клеткой кожи.
Зародышевые стволовые клетки всю свою жизнь сохраняют способность превращения в клетки любого типа. Ученые ценят их выше, но одновременно вопрос работы с ними куда более противоречив, поскольку для извлечения таких клеток зародышем приходится жертвовать, а здесь, естественно, возникают этические вопросы. (Однако Ланца и его коллеги нашли новые способы, при помощи которых можно взять взрослые стволовые клетки, уже превратившиеся в клетки какого-то конкретного типа, и превратить их снова в зародышевые стволовые клетки.)
Потенциально при помощи стволовых клеток можно излечивать множество болезней, таких как диабет, сердечные заболевания, болезни Альцгеймера и Паркинсона и даже рак. Более того, трудно придумать болезнь, в лечении которой стволовые клетки не могли бы сыграть существенную роль. В частности, активные исследования в настоящее время идут в области лечения травм позвоночника и спинного мозга, которые когда-то считались совершенно неизлечимыми. В 1995 г., когда актер Кристофер Рив (Christopher Reeve) серьезно повредил позвоночник и остался парализованным, методов лечения таких травм не существовало. Однако в опытах на животных уже сегодня достигнуты огромные успехи в восстановлении спинного мозга при помощи стволовых клеток.
К примеру, Стивен Дэвис (Stephen Davies) из Университета Колорадо добился впечатляющих успехов в лечении травм спинного мозга у крыс. Он говорит: «Я провел несколько экспериментов, в которых мы пересаживали взрослые нейроны непосредственно во взрослую центральную нервную систему. Почти как у Франкенштейна. К нашему великому удивлению, мы обнаружили, что взрослые нейроны всего за неделю способны протянуть новые нервные волокна от одного конца мозга до другого». Ранее в лечении спинномозговых травм считалось, что любая попытка восстановления нервов вызовет сильнейшую боль и страдание. Однако Дэвис обнаружил, что ключевой тип нервных клеток, известный как астроцит, существует в двух вариантах, и их применение вызывает разные результаты.
Дэвис говорит: «Если использовать при восстановлении поврежденного спинного мозга правильные астроциты, мы получим результат без боли, тогда как клетки другого типа дадут боль без результата». Более того, он уверен, что та же техника применения стволовых клеток, которую он разрабатывает, будет полезна в лечении инсульта, а также болезней Альцгеймера и Паркинсона.
Поскольку из зародышевой стволовой клетки можно получить практически любую клетку тела, возможности здесь открываются безграничные. Однако Дорис Тейлор (Doris Taylor), директор Центра сердечно-сосудистых заболеваний при Университете Миннесоты, предостерегает от излишнего оптимизма и говорит, что работы впереди еще очень много. «Зародышевые стволовые клетки могут нести и добро, и зло, и уродство. Если они хорошие, их можно выращивать в больших количествах в лаборатории и использовать для создания тканей, органов или частей тела. Если они плохие, они не могут вовремя прекратить рост и образуют опухоли. Что касается уродства, то мы понимаем далеко не все и не можем контролировать результат, и мы не готовы использовать их без дополнительных лабораторных исследований», — замечает она.
Действительно, это одна из главных проблем, стоящих перед исследователями стволовых клеток: эти клетки, без внешних химических сигналов, иногда продолжают бешено размножаться и в конце концов перерождаются в раковые. Ученые уже понимают, что тонкие химические сигналы, курсирующие между клетками и сообщающие им, когда надо расти и когда пора прекратить рост, не менее важны, чем сами клетки. Тем не менее можно говорить о медленном, но стабильном прогрессе в этой области, особенно в опытах на животных. В 2008 г. имя Тейлор попало в заголовки газет: ее команда впервые в истории вырастила работающее мышиное сердце почти с нуля.
Эксперимент начался с того, что ученые взяли мышиное сердце и растворили все клетки внутри его, оставив только каркас, белковую матрицу в форме сердца. Затем они поместили в эту матрицу смесь сердечных стволовых клеток. После этого осталось только наблюдать, как стволовые клетки размножаются внутри каркаса. Ученым и раньше удавалось вырастить отдельные сердечные клетки в чашке Петри, но впервые удалось вырастить в лаборатории живое бьющееся сердце.
Выращивание сердца стало для Тейлор и значимым личным событием. Она сказала: «Это великолепно. Можно увидеть все сосудистое дерево, от артерий до крошечных вен, снабжающих кровью все без исключения клетки сердца».
Одно из подразделений правительства США остро заинтересовано в скорейшем развитии тканевой инженерии, и это подразделение — Вооруженные силы США. В прежних войнах боевые потери армии были ужасающими, списочный состав целых полков и батальонов уменьшался разом на порядок, многие умирали от ран. Теперь медицинские эвакоотряды быстрого реагирования перевозят раненых из Ирака и Афганистана в Европу или Соединенные Штаты, где солдаты получают высококвалифицированную медицинскую помощь. Коэффициент выживания среди солдат резко вырос — и одновременно с этим резко выросло число солдат, потерявших руки или ноги. Вследствие этого приоритетной задачей армии США стал поиск способа выращивания частей тела на замену утраченным.
В Институте регенеративной медицины Вооруженных сил было сделано серьезное открытие, связанное с использованием совершенно нового метода выращивания органов. Ученые давно знали, что саламандры обладают замечательными способностями к регенерации и могут отращивать новые конечности взамен утраченных. Конечности отрастают заново, потому что стволовые клетки саламандры получают соответствующую команду. Исследованием одной из плодотворных теорий на сей счет занимается Стивен Бадилак (Stephen Badylak) из Университета Питтсбурга, которому удался эксперимент по отращиванию утраченных кончиков пальцев. Его команда разработала «эльфийский порошок», обладающий чудесной силой стимулировать рост тканей. Порошок этот изготавливается не из клеток, а из внеклеточной матрицы, существующей между клетками. Эта матрица играет решающую роль, поскольку в ней содержатся сигналы, которые доносят до стволовых клеток команду расти определенным образом. Если этим порошком посыпать отрезанный кончик пальца, он простимулирует восстановление не только самого пальца, но и ногтя, и в результате получится почти идеальная копия первоначального пальца. Таким образом, Бадилаку и его команде удалось нарастить на пальце до трети дюйма мягких тканей и ногтя. Следующая цель — продолжать этот процесс и посмотреть, отрастет ли под действием порошка целая человеческая конечность, как у саламандры.
Клонирование
Если можно выращивать отдельные органы человеческого тела, то нельзя ли вырастить целого человека — создать точную генетическую копию, клона? Ответ: да, в принципе можно, но пока этого никто не делал, несмотря на многочисленные сообщения.
Клоны — любимая тема голливудских фильмов, но там, как правило, о науке особенно не беспокоятся. В фильме «Шестой день» герой Арнольда Шварценеггера сражается с плохими парнями, которые каким-то образом овладели искусством клонирования человека. Что еще важнее, они придумали способ копировать личность вместе с памятью и вставлять все это в готового клона. Когда Шварценеггеру удается устранить одного плохого парня, на его место тут же встает другой, с той же личностью и теми же воспоминаниями. Ситуация еще больше усложняется, когда герой узнает, что без его ведома был создан его собственный клон. (На самом деле при клонировании животного память не клонируется.)
Тема клонирования попала в заголовки мировых газет в 1997 г., когда Ян Вилмут из Рослинского института при Университете Эдинбурга сумел клонировать овечку Долли. Он взял клетку взрослой овцы, извлек из нее ядро с содержащейся в нем ДНК и поместил это ядро в пустую яйцеклетку. Вилмут добился главного: создал генетическую копию оригинала. Я однажды спросил, думал ли он о том, какая медийная буря поднимется вокруг его исторического достижения. Он ответил: нет. Он ясно представлял медицинское значение своей работы, но серьезно недооценивал интерес публики к подобным событиям.
Вскоре научные группы по всему миру начали повторять эксперимент Вилмута. Было клонировано немало самых разных животных, включая мышей, коз, кошек, свиней, собак, лошадей и крупный рогатый скот. Я ездил со съемочной группой ВВС на ферму Рона Маркесса (Ron Marquess) под Далласом (Техас). Там находится одно из крупнейших в стране хозяйств, где разводят клонированный скот. На ранчо Маркеса я с изумлением увидел клонированных животных первого, второго и даже третьего поколения — клонов клонов клонов. Маркес рассказал, что для обозначения разных поколений клонированного скота им придется придумывать новый словарь.
Одна группа животных привлекла мое внимание. В ней было около восьми совершенно одинаковых животных. Они ходили, бегали, ели и спали совершенно одинаково. Конечно, телята не знали, что являются клонами друг друга, но инстинктивно собирались вместе и во всем подражали друг другу.
Маркес рассказал мне, что клонирование скота — потенциально очень выгодный бизнес. Если у вас есть бык с великолепными физическими характеристиками, он может принести вам неплохой доход как производитель. Но когда бык умирает, его генетическая линия пропадает вместе с ним, если только вы не озаботились заранее собрать и заморозить сперму. Клонирование позволяет сохранять генетическую линию призового быка вечно.
Хотя клонирование, очевидно, найдет коммерческое применение в разведении самых разных животных, с применением его к человеку все гораздо сложнее. Уже прозвучало несколько сенсационных сообщений об успешном клонировании человека, но, по всей видимости, все они пока безосновательны. До сих пор никому не удалось клонировать даже примата, не говоря уж о человеке. Даже клонирование животных пока представляет собой сложную операцию, и на каждый зародыш, которому удается достичь зрелости, приходятся сотни дефектных.
Но даже если считать, что клонирование человека станет возможным, против него имеются серьезные социальные возражения. Во-первых, многие религии восстанут против клонирования человека, точно так же как в 1978 г., когда Луиза Браун стала первым в истории ребенком, зачатым в пробирке, католическая церковь восстала против внематочного оплодотворения. Это означает, что будут приняты законы, запрещающие клонирование человека или по крайней мере жестко его регулирующие. Во-вторых, коммерческий спрос на клонирование человека будет очень невелик. Как максимум, даже если эта операция станет законной, клоны составят совсем небольшую долю человечества. В конце концов, среди нас уже есть клоны в форме однояйцевых близнецов (и тройняшек), так что новизна этого явления будет весьма относительной и нездоровый интерес к нему со временем спадет.
Первоначальный спрос на детей из пробирки был огромен — ведь бесплодных пар очень много. Но кто захочет клонировать человека? Может быть, родители, оплакивающие смерть ребенка. Или, еще вероятнее, пожилой богач на смертном одре, не имеющий наследников — по крайней мере таких наследников, которым он захочет что-то оставить, — и мечтающий завещать все свои деньги возрожденному себе самому, чтобы начать все заново.
Так что в будущем, несмотря на возможные запрещающие законы, человеческие клоны, вероятно, появятся. Однако они составят лишь ничтожную долю человечества, и социальные последствия клонирования будут невелики.
Генная терапия
Фрэнсис Коллинз (Francis Collins), директор Национального института здравоохранения и человек, руководивший историческим правительственным проектом «Геном человека», рассказал мне, что «у каждого из нас имеется с полдюжины искореженных генов». В далеком прошлом человеку приходилось безмолвно страдать от этих часто смертельных генетических дефектов. В будущем, сказал он, мы сможем устранять многие из них при помощи генной терапии.
Генетические заболевания преследовали человечество с незапамятных времен, а в ключевые моменты истории, возможно, даже оказывали влияние на ее ход. Так, близкородственные браки среди царствующих фамилий Европы привели к тому, что наследственными генетическими болезнями страдали целые поколения знати. К примеру, Георг III Английский, скорее всего, страдал острой перемежающейся порфирией, которая вызывает временные приступы безумия. Некоторые историки считают, что это осложнило его отношения с североамериканскими колониями, подтолкнув их к объявлению в 1776 г. независимости от Англии.
Королева Виктория была носительницей гена гемофилии, вызывающего неконтролируемые кровотечения. У нее было девять детей, многие из которых вступили в брак с представителями других правящих домов Европы, таким образом эта «королевская болезнь» распространилась по всему континенту. В России правнук королевы Виктории Алексей, сын царя Николая II, страдал от гемофилии, которую, согласно легенде, умел временно облегчать загадочный Распутин. Этот «безумный монах» получил достаточно власти, чтобы парализовать русскую аристократию и задержать нужные стране реформы; как предполагают некоторые ученые, большевистская революция 1917 г. — отчасти его вина.
Однако в будущем генная терапия сможет излечить многие из 5000 известных генетических заболеваний, такие какфиброзно-кистозная дегенерация (поражающая уроженцев Северной Европы), болезнь Тея-Сакса (поражающая восточноевропейских евреев) или серповидно-клеточная анемия (которой страдают афроамериканцы). Уже в ближайшем будущем можно будет излечивать многие генетические болезни из тех, что вызываются мутацией одного гена.
Генная терапия бывает двух типов: соматическая и генеративная.
Соматическая генотерапия предусматривает исправление поврежденных генов у одного конкретного человека. Со смертью пациента терапевтический эффект заканчивается. Более противоречива генотерапия второго типа — генеративная, где исправляются поврежденные гены, в том числе и половых клеток, так чтобы исправленный ген мог быть передан следующему поколению и сохранился надолго, почти навсегда.
Лечение генетического заболевания следует по долгому, но хорошо отработанному пути. Сначала необходимо найти людей, ставших жертвами определенного генетического заболевания, и тщательно проследить их родословные на много поколений назад. Анализируя гены пациентов, надо попытаться определить точное положение гена, который мог оказаться поврежденным.
Затем следует взять здоровую версию этого же гена и вживить ее в «вектор» (обычно это безвредный вирус), после чего ввести его пациенту. Вирус быстро вставляет «правильный ген» в клетки пациента и — потенциально — излечивает болезнь.
К 2001 г. начались или планировались испытания более чем 500 вариантов генной терапии. Но дело продвигается медленно, а испытания дают противоречивые результаты. Одна проблема состоит в том, что тело часто путает безвредный вирус, содержащий «правильный ген», с вирусом опасным и начинает атаку. При этом возникают побочные эффекты, которые могут свести на нет действие правильного гена. Другая проблема заключается в том, что далеко не всем вирусам удается корректно встроить нужный ген в клетки человеческого тела, и клетки не могут производить нужный белок в необходимом количестве.
Несмотря на эти трудности, французские ученые объявили в 2000 г., что им удалось вылечить детей с тяжелым комбинированным иммунодефицитным синдромом (ТКИД) — детей, родившихся с неработоспособной иммунной системой. Некоторые из таких детей, подобно «Дэвиду, мальчику из пузыря», вынуждены всю жизнь провести в стерильном пластиковом пузыре. Любая инфекция может оказаться для них фатальной. Генетический анализ пациентов, подвергнутых генотерапии, показал, что в их иммунных клетках действительно появился новый ген, как и планировалось, в результате чего иммунная система детей заработала.
Но были и неудачи. В 1999 г. в Университете Пенсильвании пациент умер при испытании одного из методов генотерапии, и медицинскому сообществу пришлось переосмыслить свое отношение к подобным экспериментам. Эта смерть стала первой среди 1100 пациентов, участвующих в испытаниях генной терапии этого типа. А к 2007 г. выяснилось, что у четырех из десяти пациентов, вылеченных от одной конкретной формы ТКИД, развился серьезный побочный эффект — лейкемия. Теперь исследования в области генной терапии ТКИД сосредоточены на том, как вылечить болезнь и не активировать при этом случайно ген, способный вызвать рак. На сегодняшний день все семнадцать пациентов, страдавших другой разновидностью ТКИД и вылеченных средствами генной терапии, здоровы и не страдают ни ТКИД, ни раком. Это один из немногих бесспорно успешных результатов в этой области.
Рак и сам по себе является одной из главных мишеней генной терапии. Почти половина всех случаев обычного рака связана с повреждением одного гена, p53. Это длинный и сложный ген, что повышает вероятность его повреждения под воздействием окружающей среды или химических факторов. Проводится множество экспериментов, цель которых — ввести пациентам здоровый ген p53. К примеру, известно, что табачный дым вызывает характерные мутации в трех хорошо известных зонах этого гена. Таким образом, если мы научимся заменять поврежденный ген здоровым, то однажды мы, скорее всего, сможем излечивать определенные формы рака легких.
Прогресс в области генной терапии рака идет медленно, но верно. В 2006 г. ученые Национального института здравоохранения в Мэриленде сумели вылечить метастатическую меланому — форму рака кожи — при помощи генетически измененных Т-лимфоцитов (Т-киллеров), нацеленных специально на раковые клетки. Это первое исследование, доказывающее, что генную терапию можно использовать против некоторых форм рака. А в 2007 г. врачи Юниверсити-колледжа и глазной больницы Мурфилдс в Лондоне смогли посредством генной терапии вылечить одну из форм наследственного заболевания сетчатки (вызываемого мутациями гена RPE65).
Тем временем некоторые супружеские пары не ждут появления методов генной терапии на рынке, а берут свою судьбу и свое генетическое наследие в собственные руки. При оплодотворении в пробирке пара может получить сразу несколько оплодотворенных зародышей. После этого каждый из зародышей можно проверить на конкретное генетическое заболевание, а затем выбрать и подсадить матери тот из них, который достоверно от него свободен. Таким образом, даже не используя дорогостоящих технологий и методов генной терапии, можно постепенно избавиться от значительного числа генетических заболеваний. Это уже делают некоторые ортодоксальные евреи в Бруклине, среди которых очень высок риск болезни Тея-Сакса.
Но можно сказать почти наверняка, что одна болезнь — рак — останется смертельно опасной на протяжении всего XXI в.
Сосуществование с раком
Еще в 1971 г. президент Ричард Никсон под фанфары, с большим шумом в прессе, торжественно объявил раку войну. Он считал, что, если выделить на исследования достаточно денег, метод лечения быстро отыщется. Однако сорок лет (и 200 млрд долларов) спустя рак продолжает оставаться в США второй ведущей причиной смертности; именно это заболевание является причиной четверти всех смертей.
Смертность от рака за 55 лет, с 1950 по 2005 г., снизилась (с поправкой на возраст и другие факторы) всего лишь на 5%. Ожидается, что только в этом году рак унесет жизни 562 000 американцев — по полторы тысячи человек в день. По некоторым типам рака смертность снизилась, по другим упрямо держится на прежнем уровне. А методы лечения рака, при которых организм человека травят, кромсают и жгут, заставляют несчастных пациентов сомневаться в том, что в конечном итоге хуже — болезнь или ее лечение.
Задним числом мы, конечно, можем сказать, что именно было сделано неверно. Тогда, в 1971 г., до революции в генной инженерии, причина рака оставалась совершенной загадкой.
Теперь ученые понимают, что рак — это в первую очередь болезнь генов. Что бы ее ни вызывало — вирус, химические вещества, излучение или просто случайность, — в основе рака лежат мутации четырех или более наших генов, при которых нормальная клетка «разучивается умирать». Клетка теряет контроль над собственным воспроизведением и начинает беспредельно размножаться, со временем убивая пациента. Тот факт, что для запуска раковых процессов требуется последовательность из четырех или более дефектных генов, вероятно, объясняет, почему эта болезнь нередко убивает человека через несколько десятилетий после события, послужившего причиной ее возникновения. К примеру, человек может, будучи ребенком, сильно обгореть на солнце. Через много лет на этом самом месте у него может развиться рак кожи. Это означает, что за прошедшее время в клетке возникли дополнительные мутации, и их стало достаточно много, чтобы переключить клетку в раковый режим.
Существует по крайней мере два основных типа генов, имеющих отношение к раку, — это онкогены и гены — супрессоры опухолей. Онкоген действует как педаль газа в автомобиле, застрявшая в нижнем положении; машина при этом несется на полной скорости. Онкоген позволяет клетке размножаться без всяких ограничений. Ген-супрессор в нормальных условиях действует как тормоз в автомобиле; если он поврежден, клетка становится похожа на машину без тормозов.
Проект «Геном рака» нацелен на выявление последовательностей генов, критичных для разных видов рака. Если учесть, что каждый вид заболевания требует полного секвенирования человеческого генома, получится, что проект «Геном рака» в сотни раз амбициознее, чем первоначальный проект «Геном человека».
Кое-какие первые результаты этого долгожданного проекта, относящиеся к раку кожи и легких, были опубликованы в 2009 г. Результаты поразительны. Майк Страттон (Mike Stratton) из Института Сенгера сказал: «То, что мы наблюдаем сегодня, полностью изменит наши представления о раке. Мы никогда не видели рак в таком обнаженном виде».
В клетках легочной раковой опухоли было обнаружено поразительное количество — 23 000 — отдельных мутаций, а в раковой клетке меланомы — 33 000 мутаций. Это означает, что у среднего курильщика возникает одна мутация на каждые пятнадцать выкуренных сигарет. (Рак легких убивает ежегодно миллион человек по всему миру, в основном курильщиков.)
Цель проекта — провести генетический анализ всех типов рака, которых насчитывается больше 100. В теле человека множество типов тканей, любая из которых может обернуться раковой; более того, на каждый тип ткани приходится множество типов рака; при этом каждый тип рака — это десятки тысяч мутаций. Поскольку речь в каждом случае идет о десятках тысяч мутаций, ученым понадобится не одно десятилетие, чтобы определить в точности, какие из них вызывают сбой в клеточном механизме. Скорее всего, будут разработаны методы лечения отдельных видов рака, но не будет одного общего подхода к лечению рака в целом, — ведь и сам рак представляет собой совокупность множества разных заболеваний.
На рынке будут появляться новые лекарства и методы лечения, разработанные для поражения молекулярных и генетических корней рака. Среди самых многообещающих методов:
• антиангиогенез, или перекрытие кровоснабжения опухоли, в результате которого ее рост прекращается;
• наночастицы, напоминающие «умные бомбы» и направленные непосредственно на раковые клетки;
• генная терапия, особенно в отношении гена p53;
• новые лекарственные препараты, нацеленные на раковые клетки;
• новые вакцины против вирусов, способных вызывать рак, таких как вирус папилломы человека (HPV).
К несчастью, нам вряд ли удастся отыскать волшебную пилюлю от рака. Более вероятно, что нам придется проходить путь к лечению этого заболевания постепенно, шаг за шагом. Скорее всего, серьезное снижение смертности произойдет тогда, когда вся обстановка вокруг нас будет насыщена чипами, постоянно ведущими наблюдение и выявляющими раковые клетки задолго до того, как образуется настоящая опухоль.
Как отмечает нобелевский лауреат Дэвид Балтимор, «рак — это армия клеток, которые сражаются с любыми нашими способами лечения так, что, я уверен, мы никогда не сможем выйти из боя».
Назад: Три этапа развития медицины
Дальше: Середина века (2030–2070 гг.)

