5.3. Кальций
Кальций – элемент 4-го периода и IIA-группы Периодической системы, порядковый номер 2O. Электронная формула атома [18Ar]4s2, степени окисления +II и 0. Относится к щелочноземельным металлам.
Имеет низкую электроотрицательность (1,04), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Многие соли кальция малорастворимы в воде.
В природе – шестой по химической распространенности элемент (третий среди металлов), находится в связанном виде. Жизненно важный элемент для всех организмов.
Недостаток кальция в почве восполняется внесением известковых удобрений (СаСO3, СаО, цианамид кальция CaCN2 и др.).
Кальций, катион кальция и его соединения окрашивают пламя газовой горелки в темно-оранжевый цвет (качественное обнаружение).
Кальций Са. Серебристо-белый металл, мягкий, пластичный. Во влажном воздухе тускнеет и покрывается пленкой из СаО и Са(ОН)2.
Весьма реакционноспособный; воспламеняется при нагревании на воздухе, реагирует с водородом, хлором, серой и графитом:
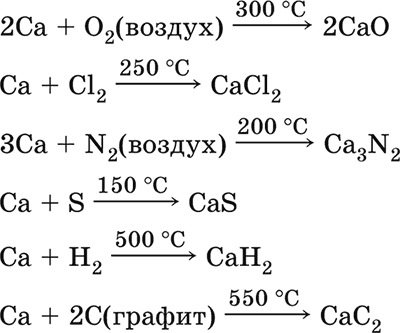
Восстанавливает другие металлы из их оксидов (промышленно важный метод — кальцийтержия):
ЗСа + Cr2O3 = ЗСаО + 2Cr (700–800 °C)
5Са + V2O5 = 5СаО + 2V (950 °C)
Энергично реагирует с водой (с высоким экзо-эффектом):
Са + 2Н2O = Са(ОН)2 + Н2↑ + 413 кДж
В ряду напряжений стоит значительно левее водорода, из разбавленных кислот НCl и H2SO4 вытесняет водород (за счет Н2O и Н+):
Ca + 2H+ = Са2+ + Н2↑
Получение кальция в промышленности:
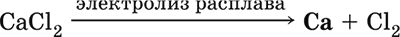
Кальций применяется для удаления примесей неметаллов из металлических сплавов, как компонент легких и антифрикционных сплавов, для выделения редких металлов из их оксидов.
Оксид кальция СаО. Основный оксид. Техническое название негашёная известь. Белый, весьма гигроскопичный. Имеет ионное строение Са2+O2-. Тугоплавкий, термически устойчивый, летучий при прокаливании. Поглощает влагу и углекислый газ из воздуха. Энергично реагирует с водой (с высоким экзо-эффектом), образует сильно щелочной раствор (возможен осадок гидроксида), процесс называется гашение извести. Реагирует с кислотами, оксидами металлов и неметаллов. Применяется для синтеза других соединений кальция, в производстве Са(ОН)2, СаС2 и минеральных удобрений, как флюс в металлургии, катализатор в органическом синтезе, компонент вяжущих материалов в строительстве.
Уравнения важнейших реакций:
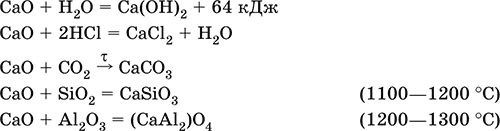
Получение СаО в промышленности – обжиг известняка (900—1200 °C):
СаСO3 = СаО + СO2
Гидроксид кальция Са(ОН)2. Основный гидроксид. Техническое название гашёная известь. Белый, гигроскопичный. Имеет ионное строение Са2+(ОН-)2. Разлагается при умеренном нагревании. Поглощает влагу и углекислый газ из воздуха. Малорастворим в холодной воде (образуется щелочной раствор), еще меньше – в кипящей воде. Прозрачный раствор (известковая вода) быстро мутнеет из-за выпадения осадка гидроксида (суспензию называют известковое молоко). Качественная реакция на ион Са2+ – пропускание углекислого газа через известковую воду с появлением осадка СаСO3 и переходом его в раствор. Реагирует с кислотами и кислотными оксидами, вступает в реакции ионного обмена.
Применяется в производстве стекла, белильной извести, известковых минеральных удобрений, для каустификации соды и умягчения пресной воды, а также для приготовления известковых строительных растворов – тестообразных смесей (песок + гашёная известь + вода), служащих связующим материалом для каменной и кирпичной кладки, отделки (оштукатуривания) стен и других строительных целей. Отвердевание («схватывание») таких растворов обусловлено поглощением углекислого газа из воздуха.
Уравнения важнейших реакций:
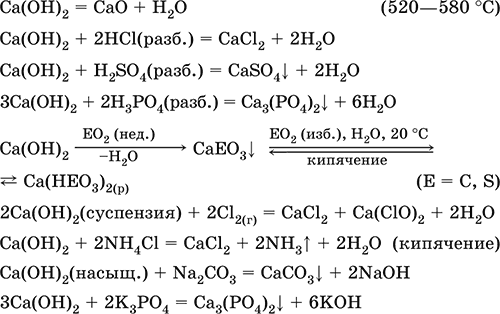
Получение Са(ОН)2 в промышленности – гашение извести СаО (см. выше).
Назад: 5.2. Калий
Дальше: 5.4. Жёсткость воды

