Книга: Химия. Полный справочник для подготовки к ЕГЭ
Назад: 4. Классификация и взаимосвязь неорганических веществ
Дальше: 5.2. Калий
5. Металлы главных подгрупп I–III групп
5.1. Натрий
Натрий – элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе – пятый по химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
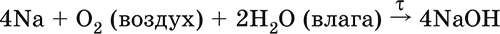
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + Cl2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород (за счет Н2O и Н+).
Получение натрия в промышленности:
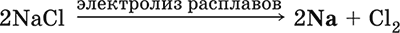
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na+)2O2-. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
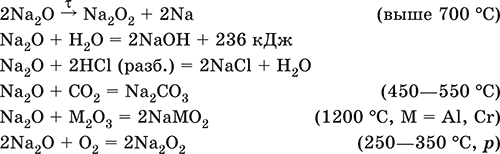
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaaO + H2 (600 °C)
2Na + Na2O2 = 2NaaO (130–200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na+)2O22-. При нагревании разлагается, плавится под избыточным давлением O2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O2 при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
Na2O2 + 2Н2O = Н2O2 + 2NaOH (на холоду)
2Na2O2 + 2Н2O = O2↑ + 4NaOH (кипячение)
Na2O2 + 2НCl (разб.) = 2NaCl + Н2O2 (на холоду)
2Na2O2 + 4НCl (разб.) = 4НCl + 2Н2O + O2↑ (кипячение)
2Na2O2 + 2CO2 = Na2CO3 + O2
Na2O2 + CO = Na2CO3
Na2O2 + 4H+ + 2I- = I2↓ + 2H2O + 2Na+
5Na2O2 + 16H+ + 2MnO4- = 5O2↑ + 2Mn2+ + 8H2O + 10Na+
3Na2O2 + 2[Cr(OH)6]3- = 2CrO24- + 8OH- + 2H2O + 6Na+ (80 °C)
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na+)(OH-). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
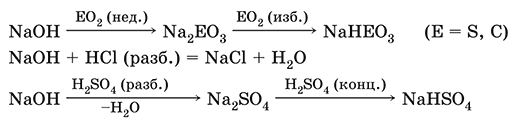
NaOH (разб.) + H3PO4 (конц.) = NaH2PO4 + H2O
2NaOH (разб.) + H3PO4 (разб.) = Na2HPO4 + 2H2O
3NaOH (конц.) + H3PO4 (разб.) = Na3PO4 + 3H2O
2NaOH(T) + M2O3 = 2NaMO2 + H2O (1000 °C, M = Al, Cr)
2NaOH (конц.) + 3H2O + AI2O3 = 2Na[Al(OH)4] (кипячение)
2NaOH(T) + M(OH)2 = Na2MO2 + 2H2O (500 °C, M = Be, Zn)
2NaOH (конц.) + Zn(OH)2 = Na2[Zn(OH)4]
Осаждает нерастворимые гидроксиды:
2NaOH + MCl2 = 2NaCl + M(OH)2↓ (M = Mg, Cu)
Подвергает дисмутации галогены и серу:
2NaOH (конц., хол.) + Е2 = NaE + NaEO + H2O (Е = Cl, Br)
6NaOH (разб., гор.) + 3S = 2Na2S + Na2SO3 + 3H2O
Подвергается электролизу в расплаве:
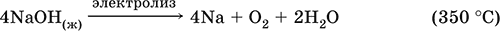
Раствор NaOH разъедает стекло (образуется NaSiO3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде:
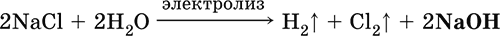
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
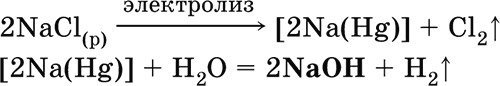
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Назад: 4. Классификация и взаимосвязь неорганических веществ
Дальше: 5.2. Калий

